Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кинетика ферментативных реакций
Содержание
- 1. Кинетика ферментативных реакций
- 2. План :ВВЕДЕНИЕОСНОВНАЯ ЧАСТЬСПИСОК ЛИТЕРАТУРЫ
- 3. ввЕДЕНИЕФерментати́вная кине́тика — зависимость скорости химической реакции
- 4. Кинетика ферментативных реакций – наука о скоростях
- 5. Слайд 5
- 6. Слайд 6
- 7. Слайд 7
- 8. Слайд 8
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ1. Грин Н., Статут У.,
- 13. Скачать презентанцию
План :ВВЕДЕНИЕОСНОВНАЯ ЧАСТЬСПИСОК ЛИТЕРАТУРЫ
Слайды и текст этой презентации
Слайд 1Министерство образования и науки РК
Алматинский технологический Университет
Кинетика ферментативных реакций.
Подготовила: Акимжан
Сумбат
Слайд 3ввЕДЕНИЕ
Ферментати́вная кине́тика — зависимость скорости химической реакции от её условий[1] —
раздел биохимии, предметом которого являются химические реакции, катализируемые ферментами, изучающий
закономерности течения во времени и механизм ферментативных реакций[2]. Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагентов (субстратов, ферментов), количественным изучением эффектов варьирования условий (кинетики) той или иной химической реакции (концентрация, pH среды, температура, присутствие активаторов или ингибиторов), а также измеряет её скорость[3]. Изучение ферментов позволяет выявить каталитический механизм действия определённого фермента и контролировать его роль в процессе обмена веществ, способного замедлять (ингибировать) или ускорять (активировать) ход химической реакции. Таким образом, кинетические исследования позволяют не только определить сродство и специфичность связывания субстратов и ингибиторов к ферментам, но и найти максимальную скорость процесса, катализируемого специфическим ферментом, а также попутно решить многие другие задачи и возникающие проблемы. При этом, основная часть проблем ферментативной кинетики сводится канализу предполагаемых схем ферментативных реакций,
выводу уравнений скорости, соответствующих этим схемам,
сопоставлению полученных зависимостей с данными эксперимента.
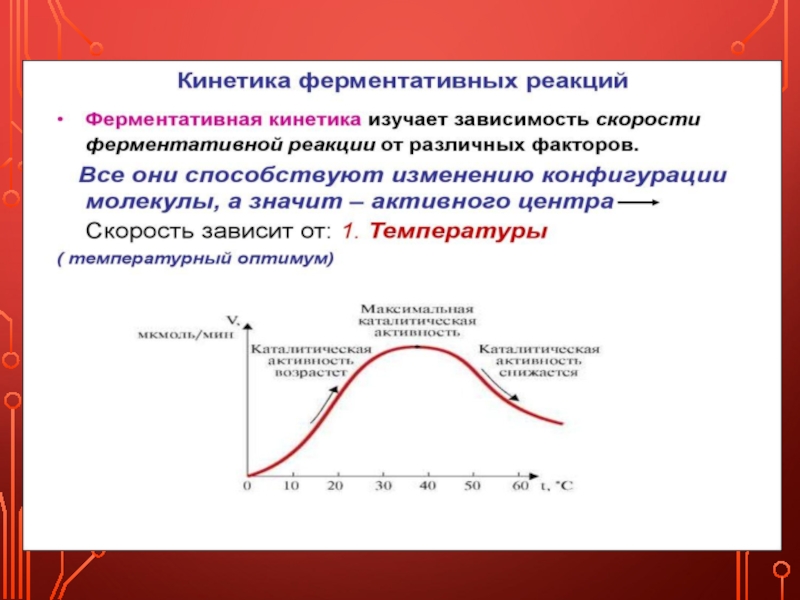
Слайд 4Кинетика ферментативных реакций – наука о скоростях ферментативных реакций, их
зависимости от различных факторов. Скорость ферментативной реакции определяется химическим количеством
прореагировавшего субстрата или образовавшегося продукта реакции в единицу времени в единице объема при определенных условиях:,
где v – скорость ферментативной реакции, – изменение концентрации субстрата или продукта реакции, t – время.
Скорость ферментативной реакции зависит от природы фермента, которая определяет его активность. Чем выше активность фермента, тем выше скорость реакции. Активность фермента определяют по скорости реакции, катализируемой ферментом. Мерой активности фермента является одна стандартная единица активности фермента. Одна стандартная единица активности фермента – это такое количество фермента, которое катализирует превращение 1 мкмоль субстрата за 1 минуту.
В процессе ферментативной реакции фермент (Е) взаимодействует с субстратом (S), в результате образуется фермент-субстратный комплекс, который затем распадается с высвобождением фермента и продукта (Р) реакции:
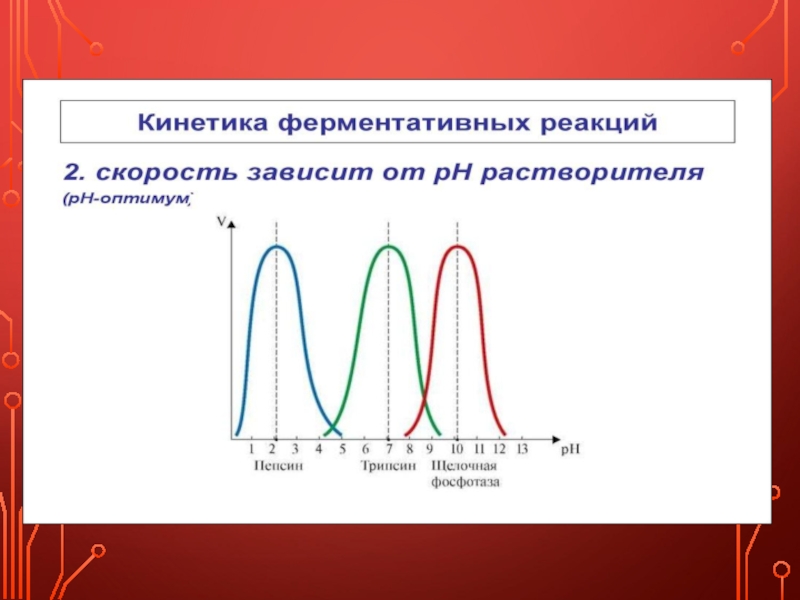
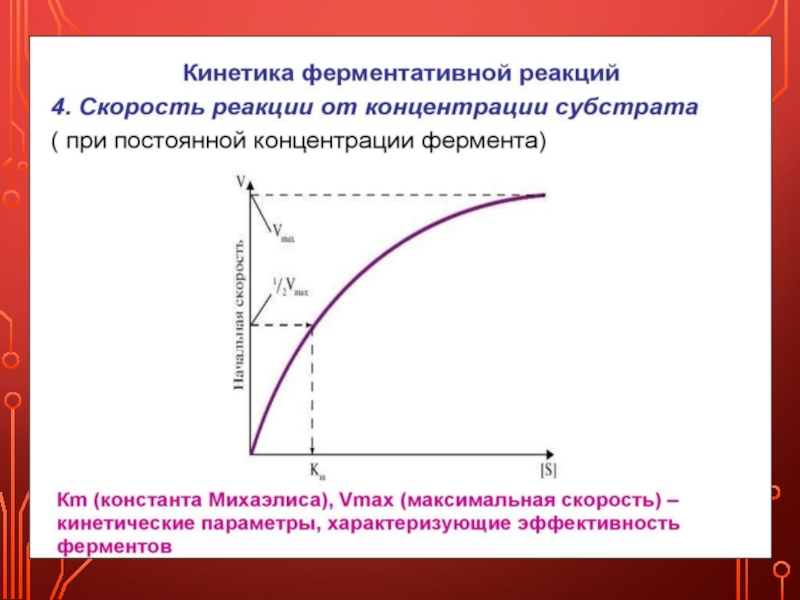
Скорость ферментативной реакции зависит от многих факторов: от концентрации субстрата и фермента, температуры, рН среды, наличия различных регуляторных веществ, способных увеличивать или снижать активность ферментов.
Слайд 12СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
1. Грин Н., Статут У., Тейлор Д. Биология:
В 3 т. – Т. 1. – Пер с англ.
/ Под ред. Р. Сопера. – М.: Мир, 1996. – 368 с.2. Камилов Ф.Х., Давлетов Э.Г. Биохимия гормонов и механизм гормональной регуляции обмена веществ. – Уфа: Гилем, 1998. – 268 с.
3. Киршенблат Я.Д. Общая эндокринология: Учеб. пособие для ун-тов. – М.: Высшая школа, 1971. – 384 с.
4. Красильникова Л.А., Авксентьева О.А., Жмурков В.В., Садовниченко Ю.А. Биохимия растений / Под. ред. Л.А. Красильниковой. – Ростов н/Д.: Феникс; Харьков: Торсинг, 2004. – 224 с.
5. Плакунов В.К. Основы энзимологии. – М.: Логос, 2001. – 128 с.
6. Степанов В.М. Молекулярная биология. Структура и функции белков.– М.: Высшая школа, 1996. – 335 с.


![Кинетика ферментативных реакций ввЕДЕНИЕФерментати́вная кине́тика — зависимость скорости химической реакции от её условий[1] — раздел ввЕДЕНИЕФерментати́вная кине́тика — зависимость скорости химической реакции от её условий[1] — раздел биохимии, предметом которого являются химические реакции,](/img/thumbs/29c593812fac0e8aa4a7d8ad14cef78a-800x.jpg)