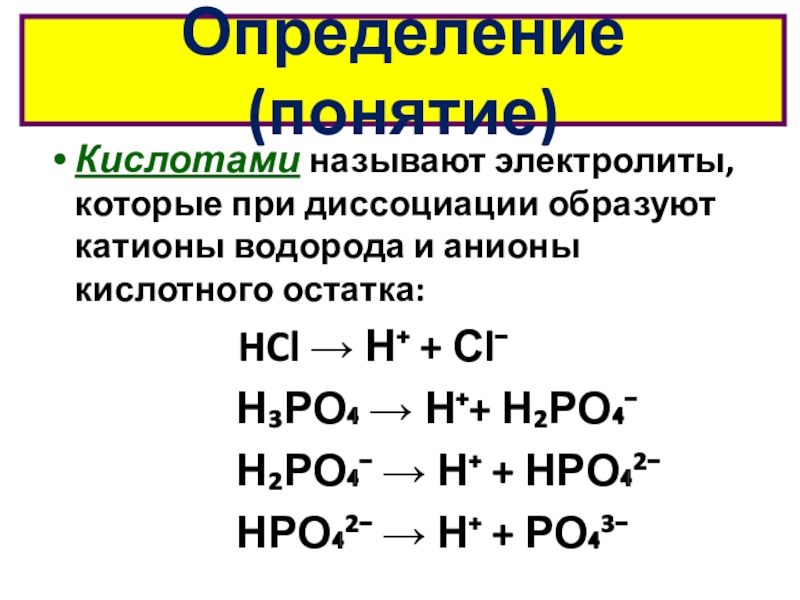
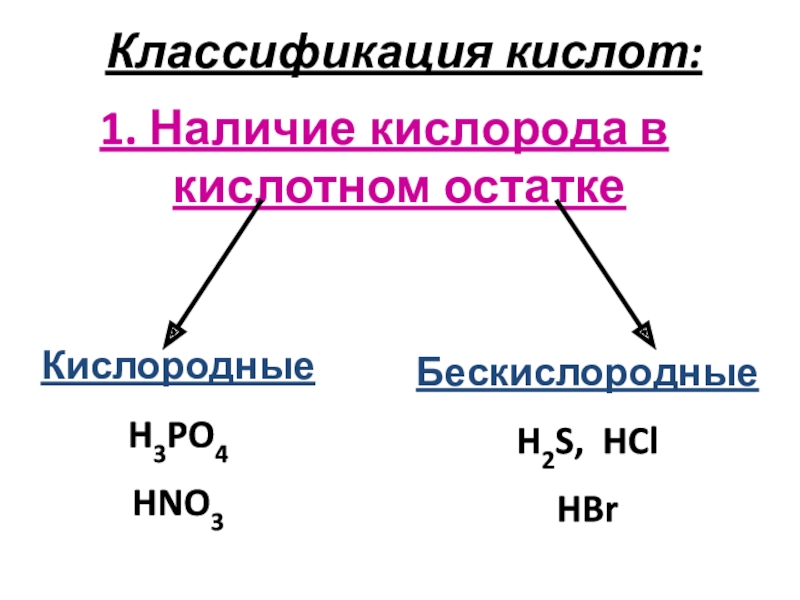
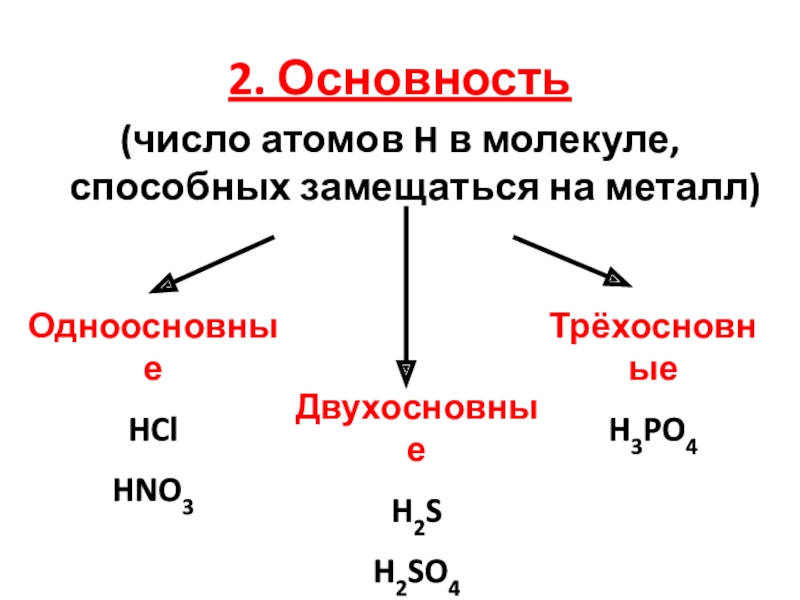
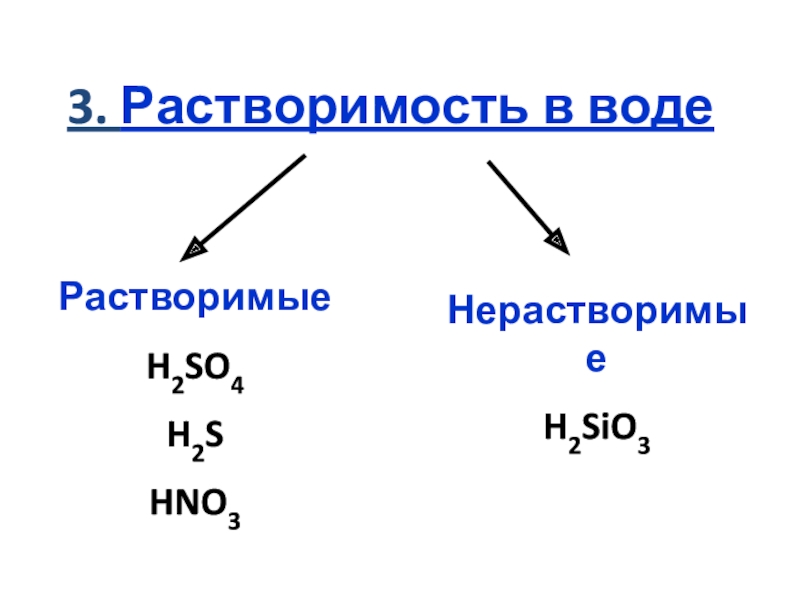
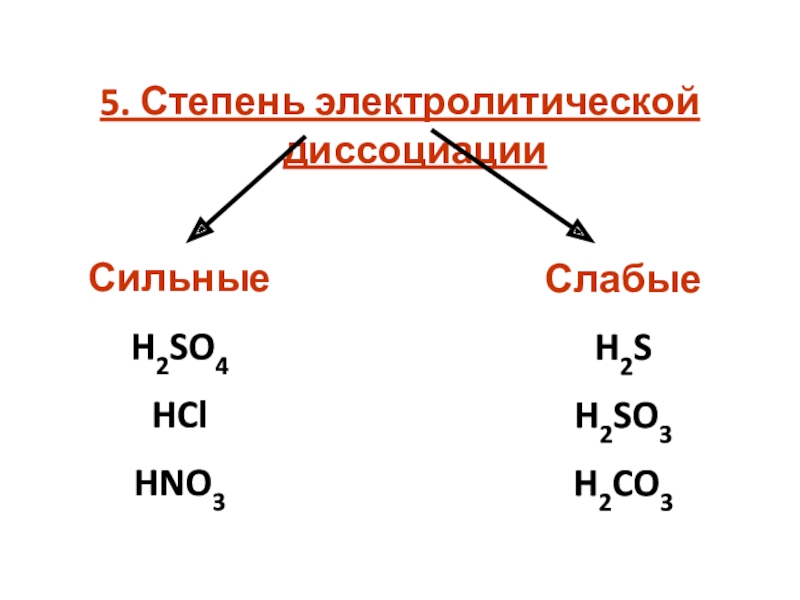
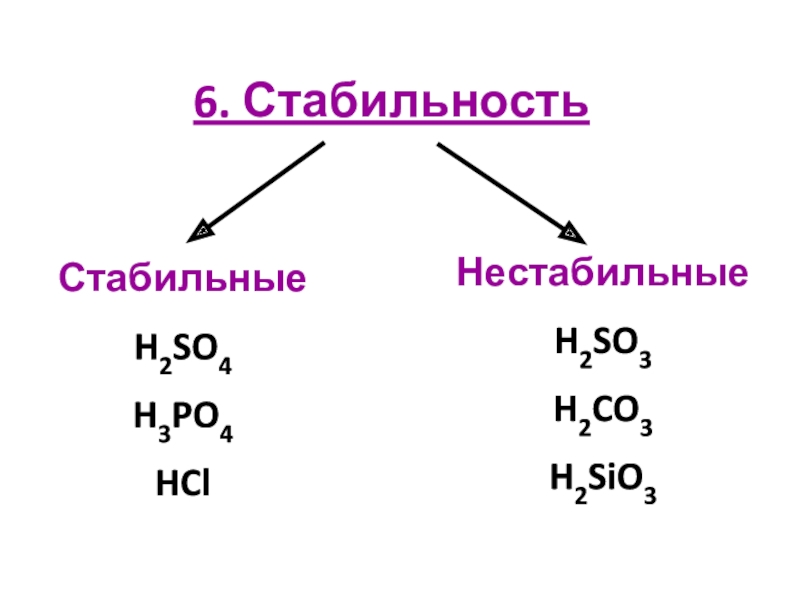
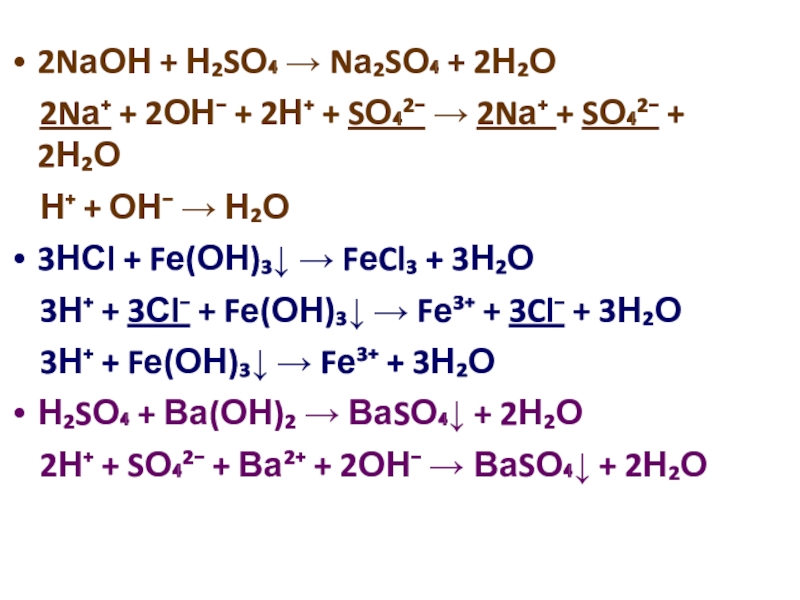
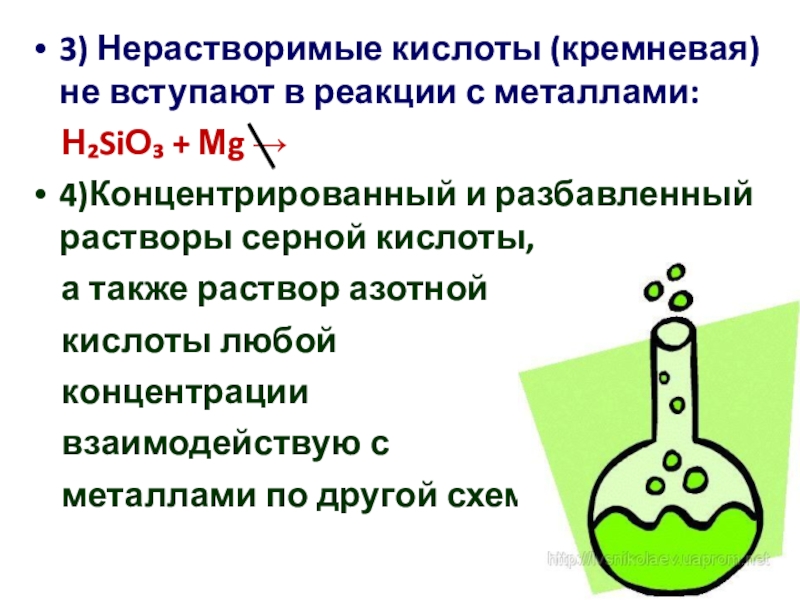
кислот по различным признакам;
Охарактеризовать общие свойства кислот в свете ионных
представлений;Научиться пользоваться электрохимическим рядом напряжений металлов и таблицей
растворимости для
прогнозирования возможных
химических реакций;