Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Классификация химических реакций. Катализаторы. Скорость химической реакции
Содержание
- 1. Классификация химических реакций. Катализаторы. Скорость химической реакции
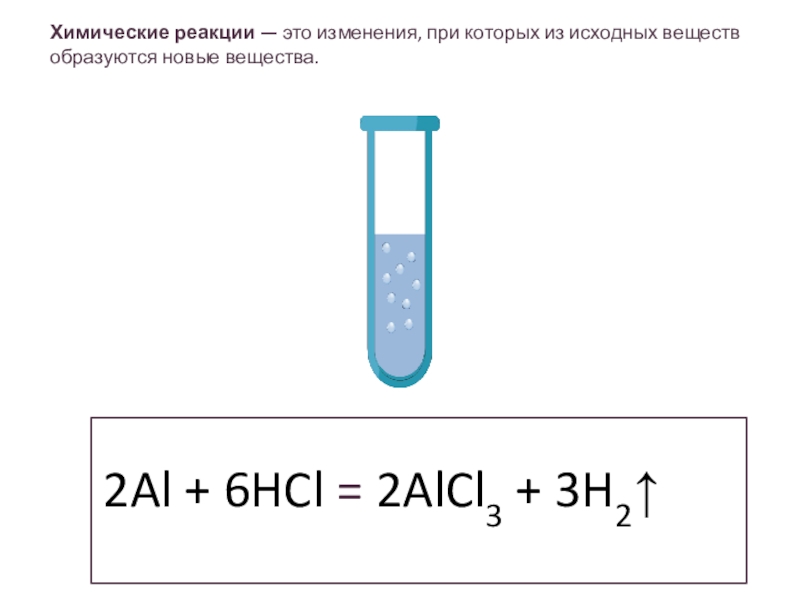
- 2. Химические реакции — это изменения, при которых из исходных веществ образуются новые вещества.
- 3. Классификация реакции на основании различных признаков1. Число
- 4. Для того чтобы вещества начали взаимодействовать, их
- 5. Скорость химической реакции — это изменение концентрации
- 6. 1. Природа реагирующих веществ.2. Концентрация реагирующих веществ.3.
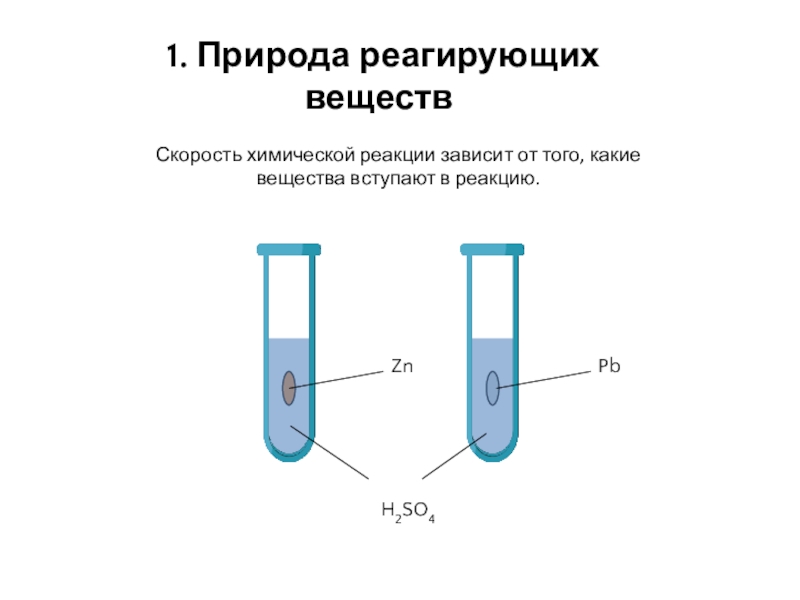
- 7. 1. Природа реагирующих веществ. Скорость химической реакции зависит от того, какие вещества вступают в реакцию. ZnPbH2SO4
- 8. 1. Природа реагирующих веществ. Pb + H2SO4
- 9. 2. Концентрация реагирующих веществ.Чем выше концентрация реагирующих веществ, тем выше и скорость взаимодействия между ними. ZnHCl10%HCl20%HCl30%
- 10. 2. Концентрация реагирующих веществ.Zn + 2HCl =
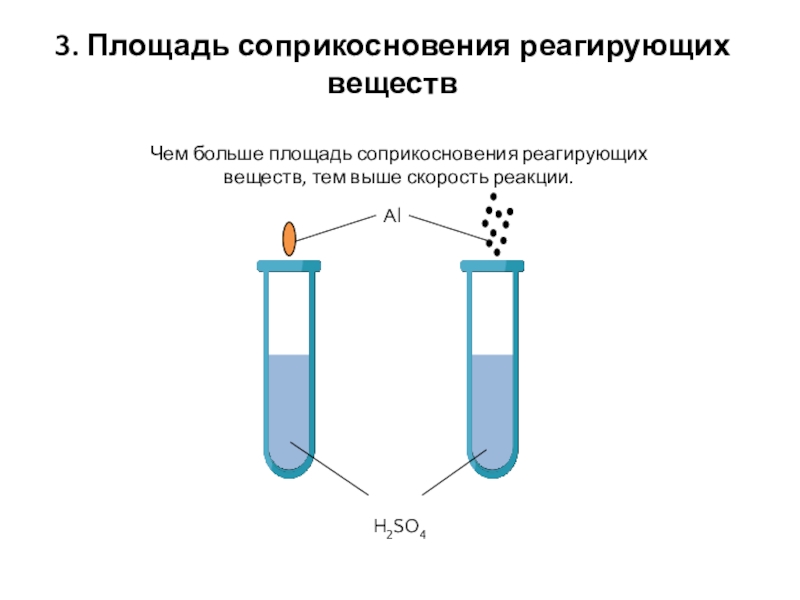
- 11. 3. Площадь соприкосновения реагирующих веществЧем больше площадь соприкосновения реагирующих веществ, тем выше скорость реакции.AlH2SO4
- 12. 3. Площадь соприкосновения реагирующих веществЧем выше температура,
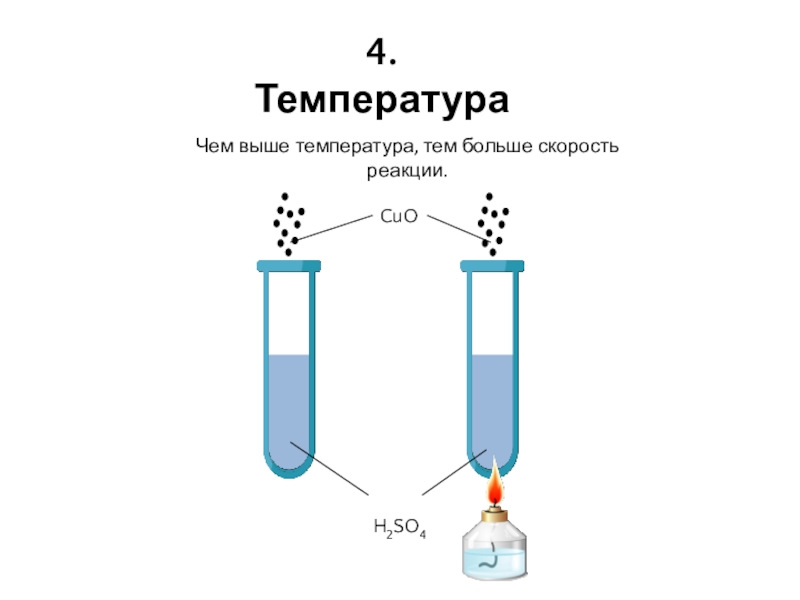
- 13. 4. ТемператураCuOH2SO4Чем выше температура, тем больше скорость реакции.
- 14. 4. ТемператураЧем выше температура, тем больше скорость реакции.CuO + H2SO4 = CuSO4 + H2O
- 15. Якоб Хендрик Вант-Гофф1852–1911 гг. Голландский учёный. Сформулировал
- 16. 5. КатализаторыH2O2O2Катализаторы — это вещества, изменяющие скорость
- 17. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Химические реакции — это изменения, при которых из исходных веществ
образуются новые вещества.
Слайд 3Классификация реакции на основании различных признаков
1. Число и состав исходных
веществ и продуктов реакции.
2. Обратимость реакции.
3. Тепловой эффект.
4. Изменение
степеней окисления элементов, образующих вещества, участвующие в реакции. 5. Агрегатное состояние реагирующих веществ.
6. Участие катализатора.
Слайд 4Для того чтобы вещества начали взаимодействовать, их частицам нужно сообщить
определённую энергию, называемую энергией активации.
Катализаторы — это вещества, изменяющие
скорость химической реакции или путь, по которому она протекает, но остающиеся неизменёнными качественно и количественно по окончании реакцииФерменты — катализаторы белковой природы
Если нужная реакция протекает очень медленно и её необходимо ускорить, то катализаторы используют для понижения энергии активации, то есть указания правильного расположения частицы с первого раза и ускорения, таким образом, реакции.
Катализ — процесс изменения скорости химической реакции или пути, по которому она протекает.
Ингибиторы — вещества, замедляющие протекание биологических процессов и увеличивающие срок годности продуктов.
Используя катализаторы и ингибиторы возможно изменить скорость химической реакции в соответствии с потребностями человека.
Слайд 5Скорость химической реакции — это изменение концентрации реагирующих веществ в
единицу времени.
Формула концентрации химических веществ,
где С- концентрация, n –
количество вещества, V – объем реактора
Формула скорости химической реакции
Химическая кинетика — раздел химии, изучающий скорость химических реакций.
Слайд 61. Природа реагирующих веществ.
2. Концентрация реагирующих веществ.
3. Площадь соприкосновения реагирующих
веществ.
4. Температура.
5. Катализаторы.
Факторы, влияющие на скорость химической реакции
Слайд 71. Природа реагирующих веществ.
Скорость химической реакции зависит от того,
какие вещества вступают в реакцию.
Zn
Pb
H2SO4
Слайд 8
1. Природа реагирующих веществ.
Pb + H2SO4 = PbSO4 +
H2↑
Скорость химической реакции зависит от того, какие вещества вступают
в реакцию. Слайд 92. Концентрация реагирующих веществ.
Чем выше концентрация реагирующих веществ,
тем выше
и скорость взаимодействия между ними.
Zn
HCl
10%
HCl
20%
HCl
30%
Слайд 102. Концентрация реагирующих веществ.
Zn + 2HCl = ZnCl2 + H2↑
Чем
больше площадь соприкосновения реагирующих веществ, тем выше скорость реакции.
Слайд 113. Площадь соприкосновения реагирующих веществ
Чем больше площадь соприкосновения реагирующих веществ,
тем выше скорость реакции.
Al
H2SO4
Слайд 123. Площадь соприкосновения
реагирующих веществ
Чем выше температура, тем больше скорость
реакции. Проведем следующий опыт.
2Al + 3H2SO4 = Al2(SO4)3 +
3H2↑ Слайд 15Якоб Хендрик Вант-Гофф
1852–1911 гг.
Голландский учёный. Сформулировал основное правило возрастания
скорости реакции при повышении температуры.
При повышении температуры на каждые 10
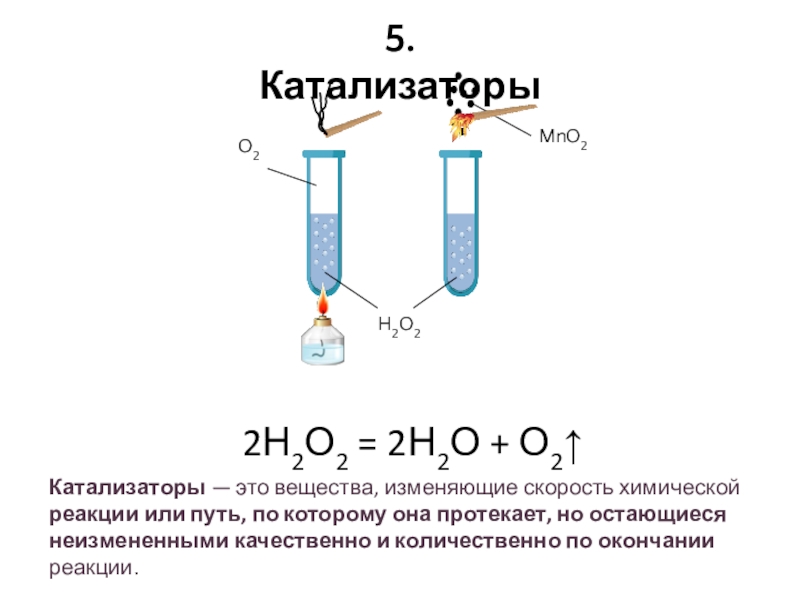
̊ С скорость химической реакции возрастает в 2 – 4 раза. Слайд 165. Катализаторы
H2O2
O2
Катализаторы — это вещества, изменяющие скорость химической реакции или
путь, по которому она протекает, но остающиеся неизмененными качественно и
количественно по окончании реакции.2Н2О2 = 2Н2О + О2↑