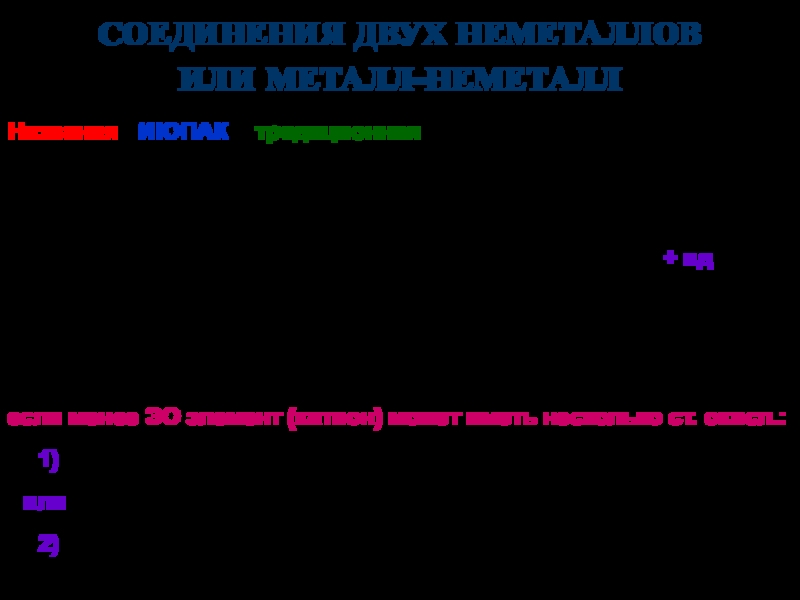
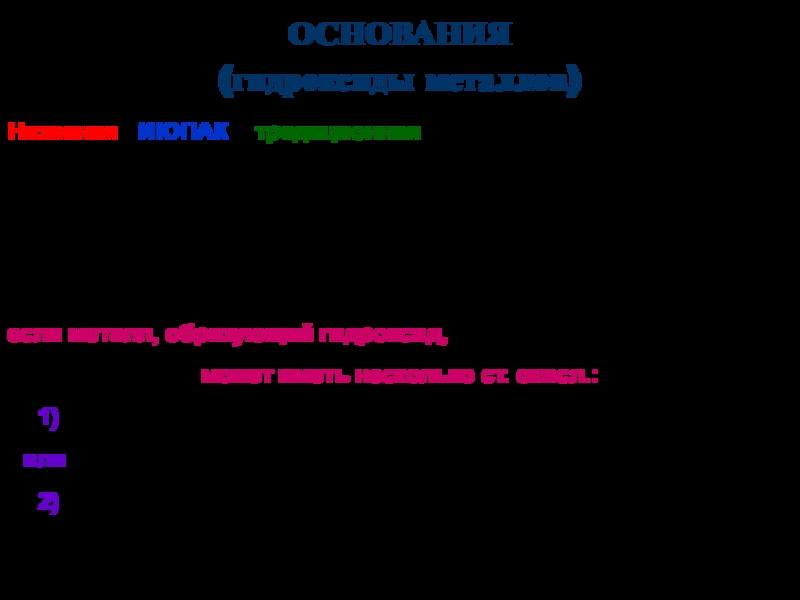
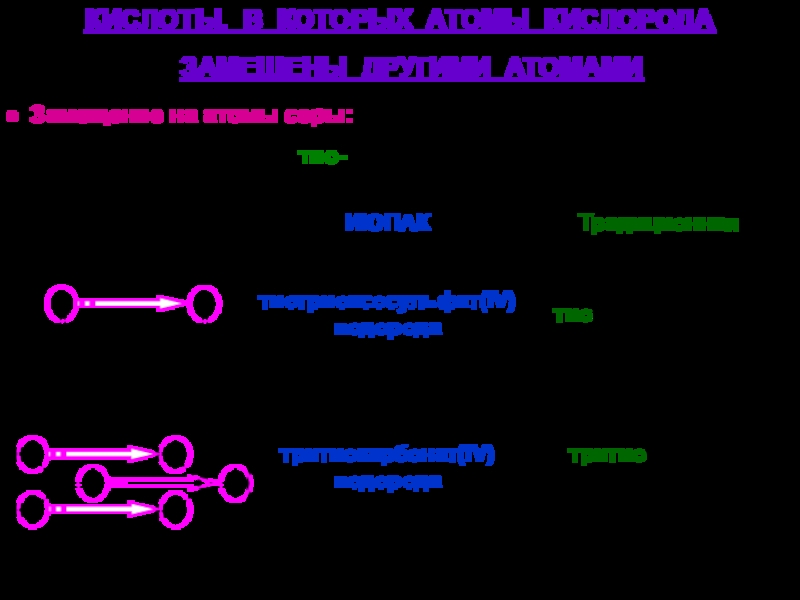
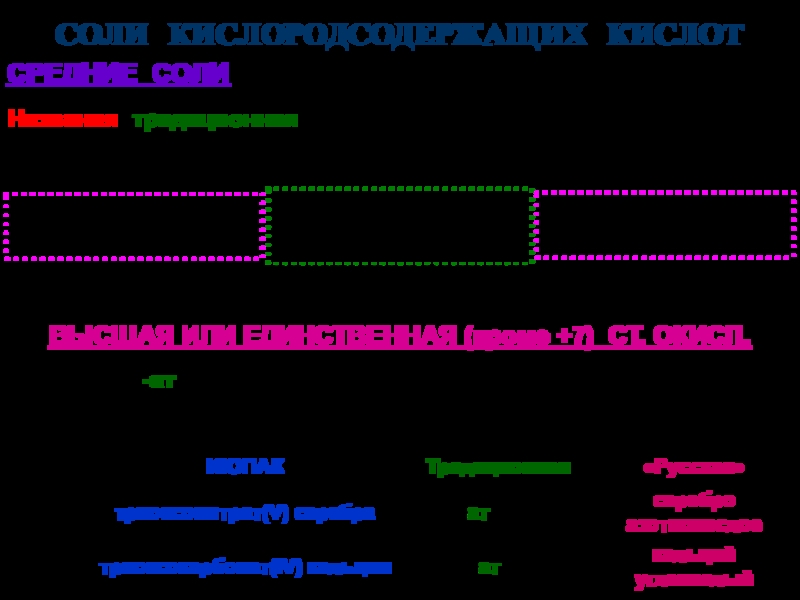
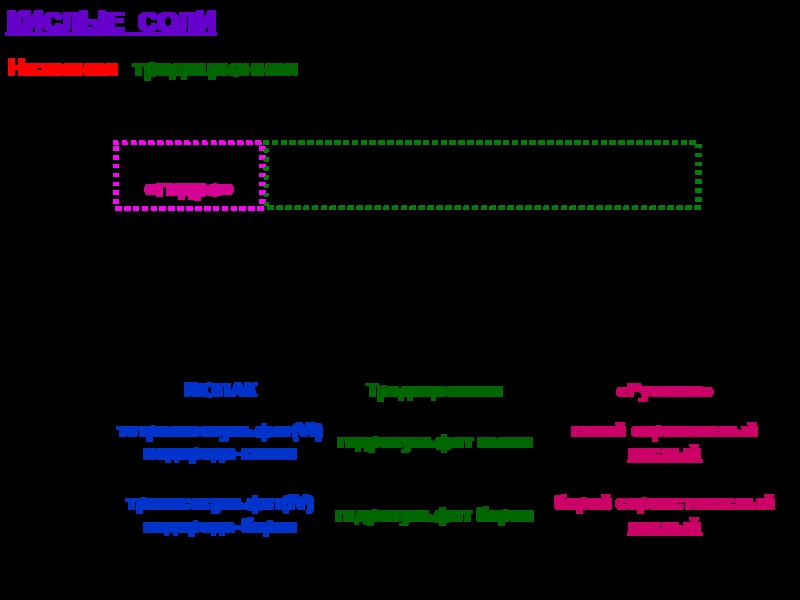
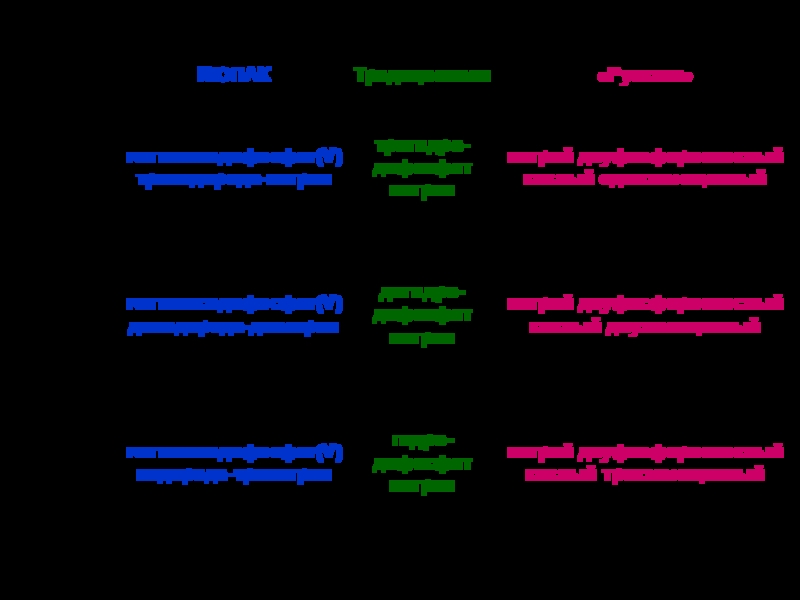
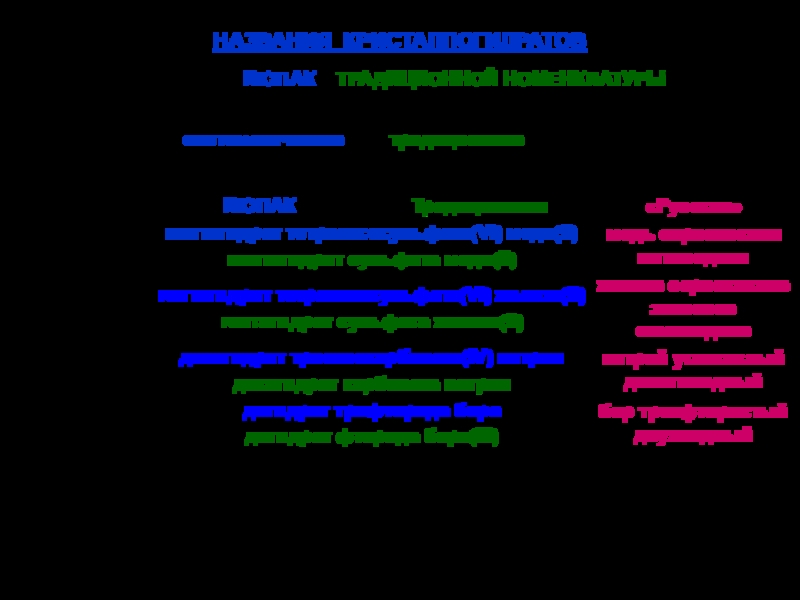
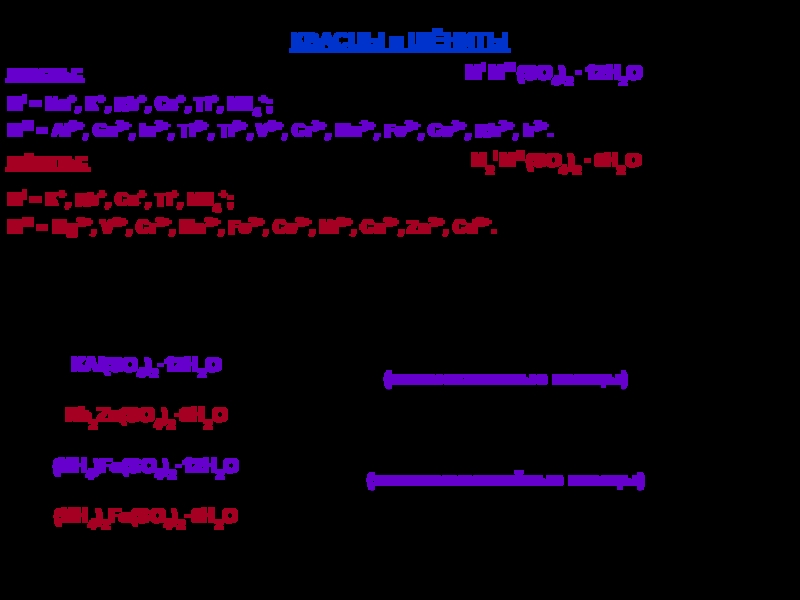
твердых аллотропных модификаций:
-, -, - (начиная с -низкотемпературной),
например:-Sn – -олово (серое олово) -Sn – -олово (белое олово)
специальные (устоявшиеся) названия, например:
графит, алмаз, фуллерен, карбин