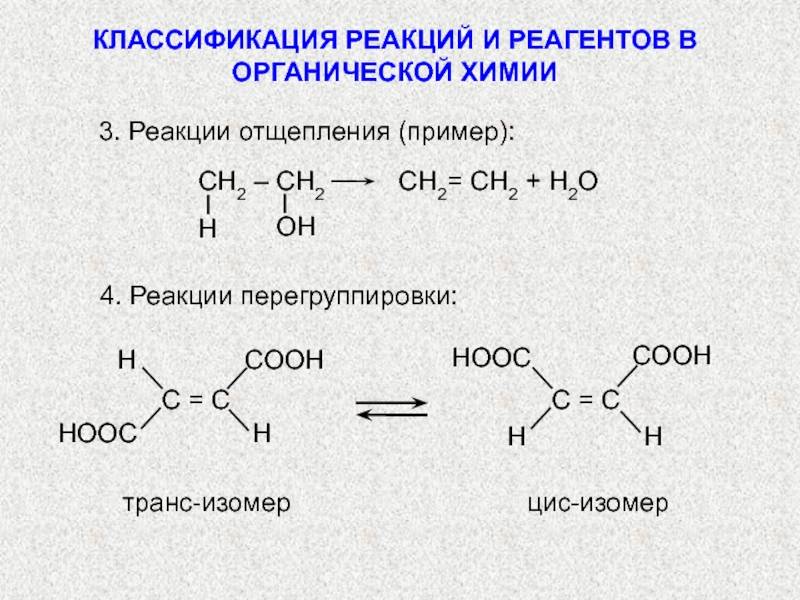
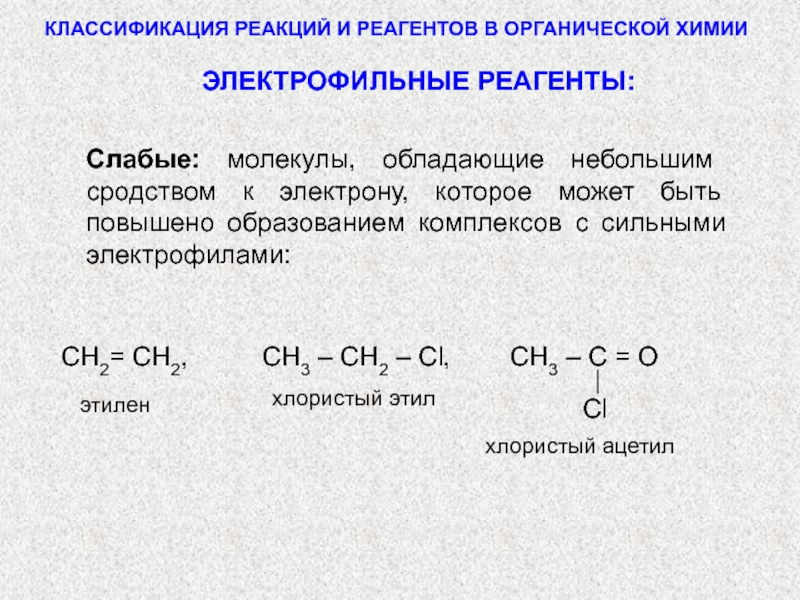
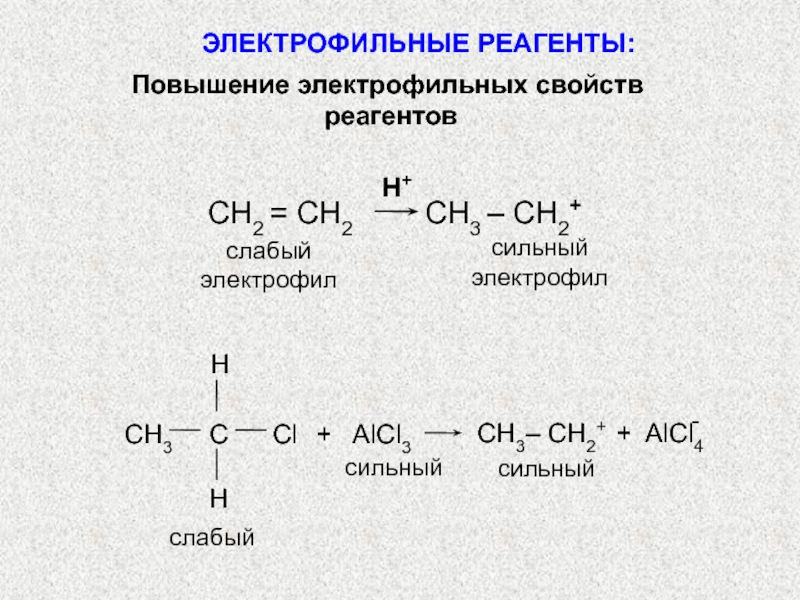
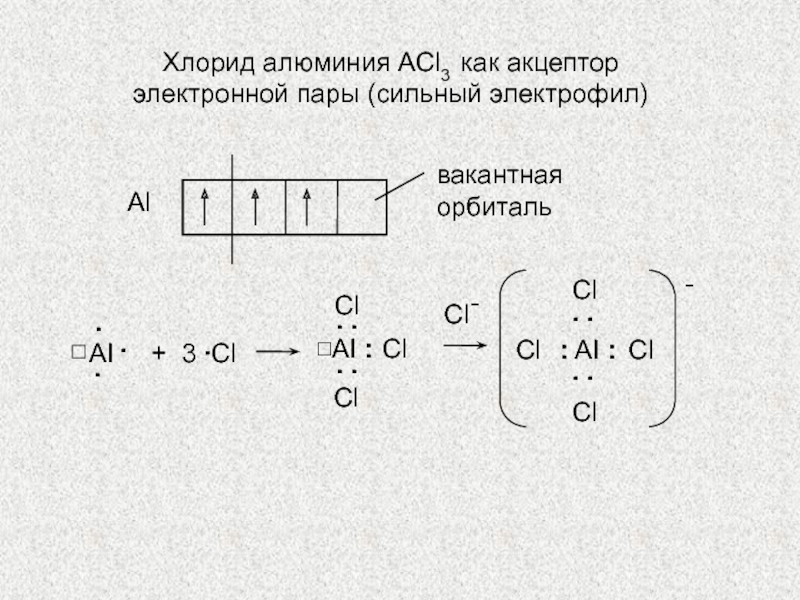
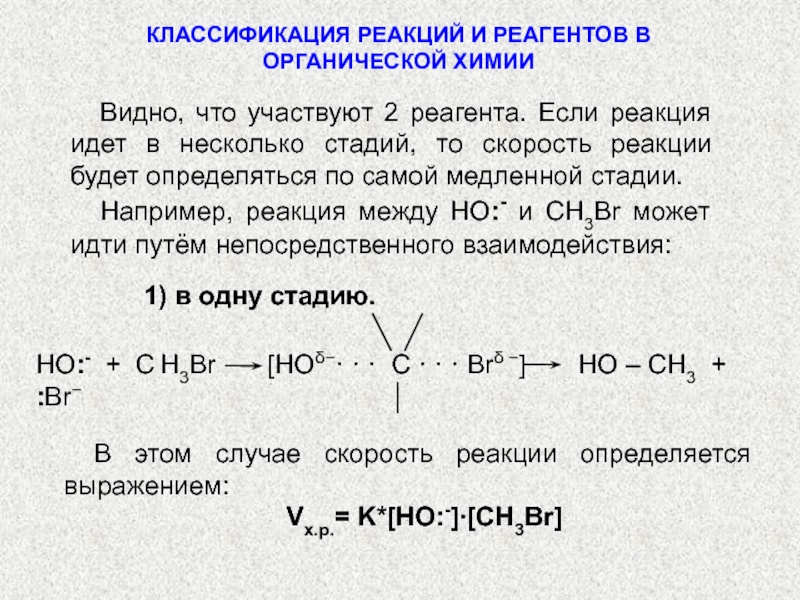
по разным принципам. Для многих органических реакций наиболее важная классификация
по следующим признакам:I. По изменению числа частиц в ходе реакций (т.е. по результатам проведения). В соответствии с этим признаком различают:
Общая схема:
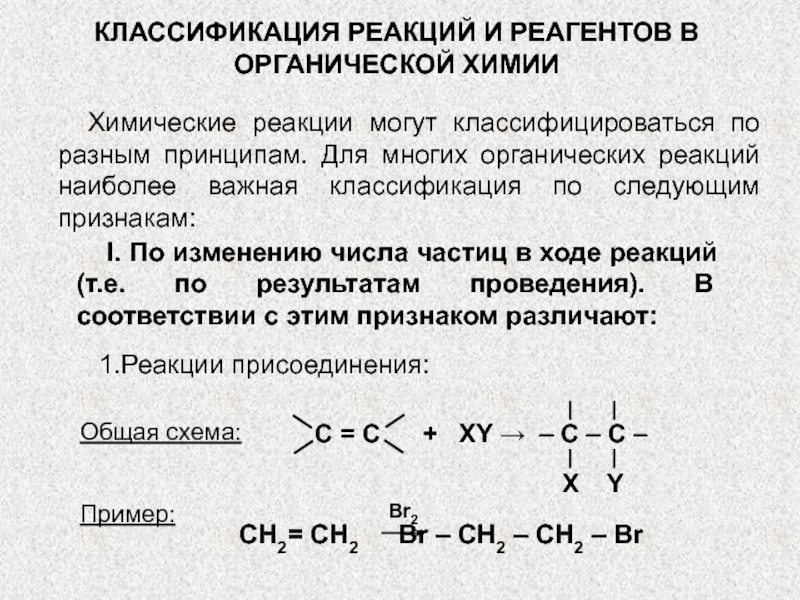
1.Реакции присоединения:
C = C + XY → – C – C –
X Y
Пример:
Br2