Слайд 1Клеточная мембрана – ключевой элемент интеграции метаболизма
ЛЕКЦИЯ 2
Слайд 2 Цитоплазматическая мембрана - физический полупроницаемый барьер, отграничивающий внутриклеточное пространство
от внеклеточ-ной среды. Мембрана обеспечивает сохране-ние различий между клеточным содержимым
и окружающей средой, поддерживает разницу концентраций ионов и молекул по обе её сто-роны.
В 1950 году был сконструирован ультрамик-ротом, позволивший изучать ультраструктуру клеток с помощью электронного микроскопа и установить толщину мембраны клеток живот-ных: 5 – 10 нм (в среднем – 8 нм).
Слайд 3 Функции цитоплазматической мембраны
1. Барьерная функция;
2. Структурная функция -
придание опреде-
ленной формы клеткам;
3. Регуляторная: контроль обмена молекула-
ми между внутри- и внеклеточным про-
странствами;
4. Передача внеклеточных сигналов внутрь
клетки посредством рецепторов и активная
роль в межклеточной коммуникации;
5. Участие в обмене за счет локализованных
в мембране ферментов;
6. Электрогенная – формирование электри-
ческого потенциала (перераспределение
ионов К+ и Na+);
Слайд 47. Обозначение генетической идентичности
данной клетки данному организму (поверх-
ностные гликопротеины и полисахариды).
Согласованная работа всех
систем мем-браны (рецепторов, ферментов, молекул – переносчиков и др.) – активное участие в интеграции обмена и сохранении клеточного гомеостаза.
Слайд 5 Биомембрана - фосфолипидный бислой.
Её основные составляющие: липиды
и белки (% соотношение липиды : белки плазматиче-ской мембраны =
47 : 53).
Липиды и белки взаимно удерживаются за счет нековалентных взаимодействий, коопе-ративных по своему характеру. Благодаря этому, липиды и белки мембраны способны совершать движения в пределах бислоя. Это позволяет биомембранам (в определенных пределах) изменять свою форму, без потери целостности – быть пластичными.
Слайд 6Липидный компонент плазматических мембран
Слайд 7
Три главных типа липидов плазматических
мембран
1. ФОСФОЛИПИДЫ
1.А. ГЛИЦЕРОФОСФОЛИПИДЫ:
Главные: ФХ, ФС, ФЭА
Минорный: ФИ (фосфатидилинозитол). Расположен
во
внутреннем монослое плазматической мембраны.
Баланс между производными ФИ:
Фосфатидилинозитол (ФИ) – 80%;
Фосфатидилинозитол-4-фосфат (ФИФ) – 15%;
Фосфатидилинозитол-4,5-бисфосфат (ФИФ2) – 5%.
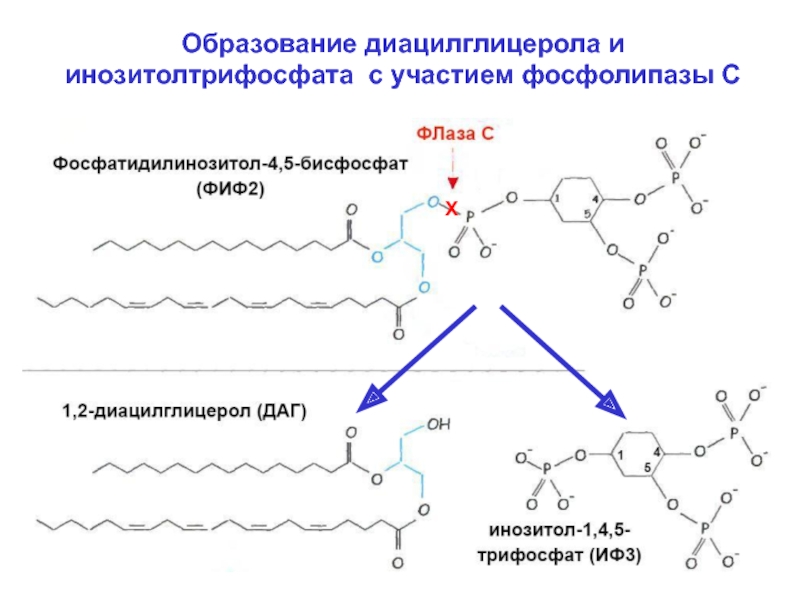
Из ФИФ2 под действием фосфолипазы С образуются
два продукта – вторичных мессенджера липидной
природы: 1,2-диацилглицерол (ДАГ) и инозитол-1,4,5-
трифосфат (ИФ3).
1. ФОСФОЛИПИДЫ
Слайд 8Образование диацилглицерола и инозитолтрифосфата с участием фосфолипазы С
Х
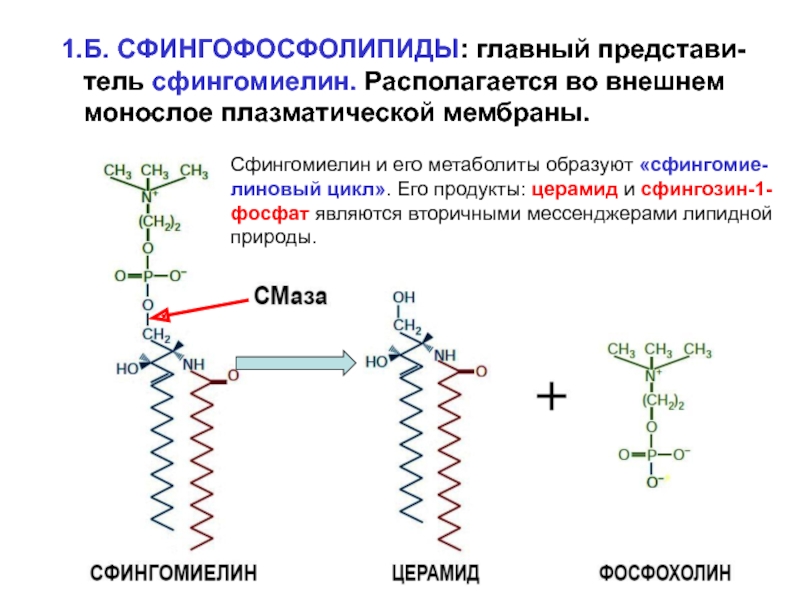
Слайд 91.Б. СФИНГОФОСФОЛИПИДЫ: главный представи-
тель сфингомиелин. Располагается во внешнем
монослое плазматической мембраны.
Сфингомиелин и его метаболиты образуют «сфингомие-
линовый цикл».
Его продукты: церамид и сфингозин-1-фосфат являются вторичными мессенджерами липидной
природы.
Слайд 102. ГЛИКОЛИПИДЫ
ЦЕРЕБРОЗИДЫ = гидрофобная часть молекулы: цера-
мид + углеводная часть молекулы:
моно- или олиго-сахаридный остаток.
ГАНГЛИОЗИДЫ = гидрофобная часть молекулы: цера-
мид + углеводная часть молекулы:
разветвленный олигосахарид, содер-
жащий N–ацетилнейраминовую кис-
лоту.
3. ХОЛЕСТЕРОЛ
Молекула имеет жесткое гидрофобное ядро и единст-венный гидроксил, который является его «полярной головкой». В цитоплазматической мембране соотно-шение ХС : ФЛ = 0,8-0,9.
Слайд 11 Холестерол распределен между листками бислоя сравнительно равномерно. Его
моле-кулы располагаются между остатками жир-ных кислот фосфолипидов.
Холестерол, сам
по себе, не формирует структуру бислоя. Но, в зависимости от темпе-ратуры, холестерол влияет на текучесть би-слоя: при повышение температуры его теку-честь снижается и проницаемость бислоя для малых молекул уменьшается. При снижении температуры – текучесть усиливается.
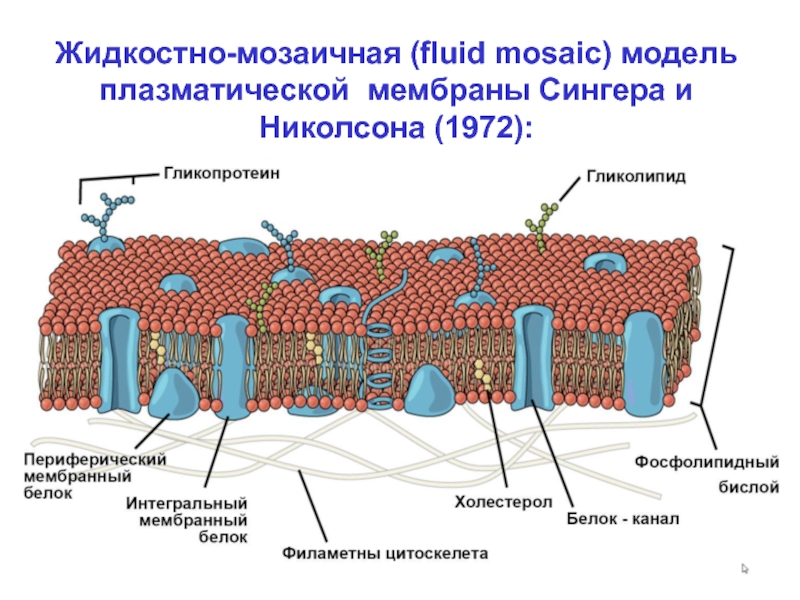
Слайд 12Жидкостно-мозаичная (fluid mosaic) модель
плазматической мембраны Сингера и
Николсона (1972):
Слайд 13
По Сингеру и Николсону, мембрана это:
- Фосфолипидный
бислой, образующий
замкнутую сферу. В бислое «плавают» или
«растворены» белковые молекулы;
Липиды составляют жидкокристаллический
каркас, а белки мозаично встроены в него и
могут менять свое положение;
Латеральная диффузия (движение вдоль
бислоя) белков и липидов происходит
сравнительно свободно. Их перемещение
между внешним и внутренним слоями (вер-
тикальная диффузия) – ограничено, особен-
но для белков.
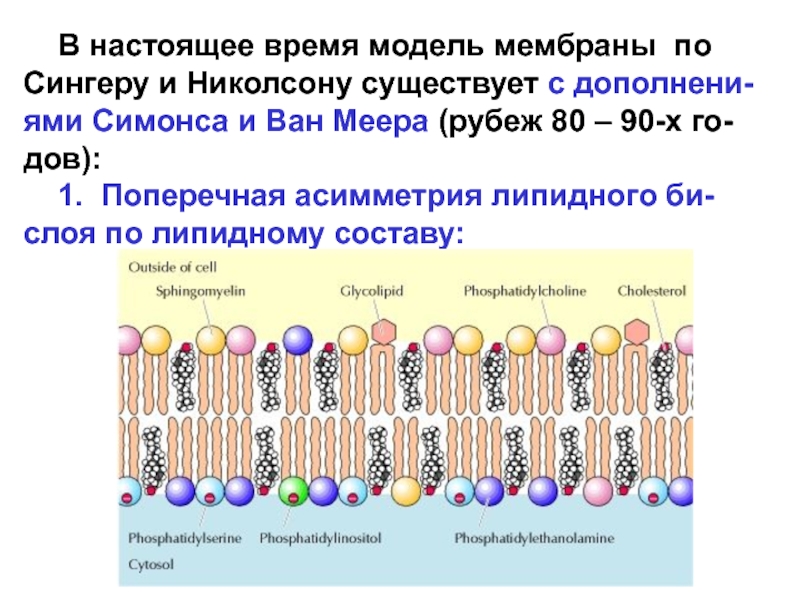
Слайд 14 В настоящее время модель мембраны по Сингеру и
Николсону существует с дополнени-ями Симонса и Ван Меера (рубеж 80
– 90-х го-дов):
1. Поперечная асимметрия липидного би-слоя по липидному составу:
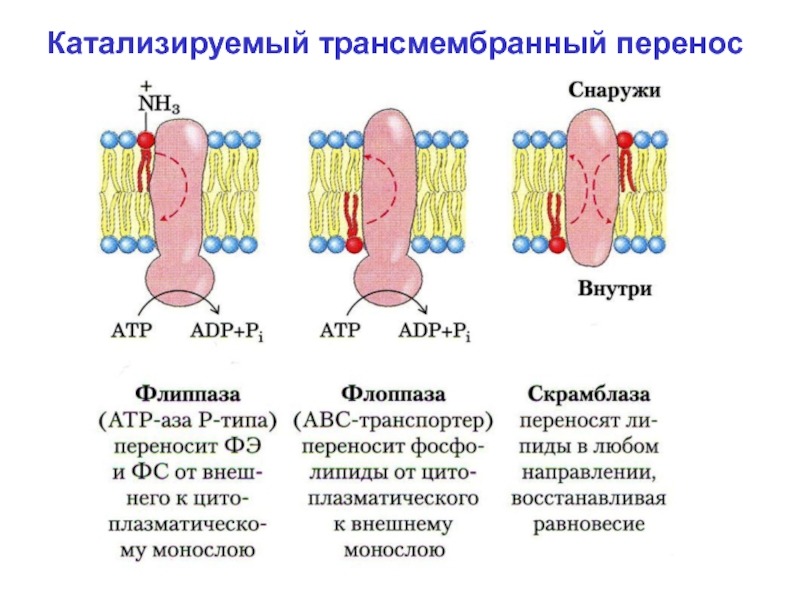
Слайд 15 Поперечная асимметрия липидного бислоя возможна благодаря селективным энергоза-висимым
переносчикам липидов. К их числу относится семейство белков (флоппазы, флиппазы
и скрэмблазы), которые облегчают перемещение молекул липидов поперёк бисля мембраны (катализируемый трансмембран-ный перенос):
А. Флиппазы. Катализируют перенос ФЭА и ФС из внешнего монослоя во внутенний. Пе-ренос 1 молекулы ФЛ требует затраты 1 моле-кулы АТФ. По структуре флиппазы родствен-ны транспорным АТФазам.
Слайд 16 Б. Флоппазы. Перемещают ФЛ в обратном направлении –
из внутреннего монослоя во внешний.
В. Скрэмблазы. Переносят через
липидный бислой любые ФЛ вдоль градиента концент-рации, не требуют АТФ, но активируются в присутствии ионов Са2+.
Слайд 17Катализируемый трансмембранный перенос
Слайд 18
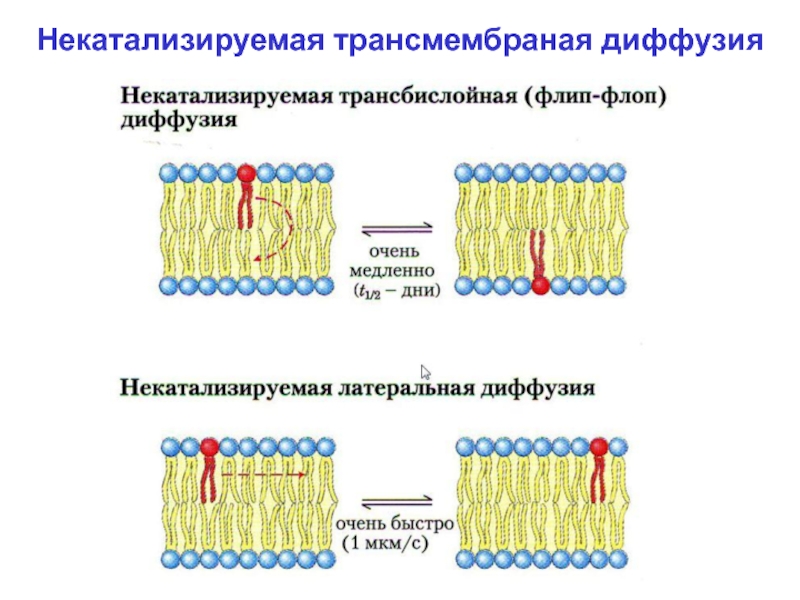
При физиологической То диффузия молекул липидов
из одного монослоя в другой («флип-флоп»), посредством некатализируемой диф-фузии –
происходит крайне редко и очень медленно (сутки).
Латеральная некатализируемая диффузия происходит постоянно и очень быстро (до 1 мкм/с).
Некатализируемая трансмембраная диффузия
Слайд 19Некатализируемая трансмембраная диффузия
Слайд 20 2. Рафты и сигнальные платформы.
Представления
о рафтах в липидной фазе цитоплаз-матических мембран были сформированы Симонсом,
Ван Меером и Айконеном на рубеже 80-90-х годов про-шлого столетия.
Рафты - (10 – 200 нм) небольшие микродомены цито-плазматической мембраны, содержащие холестерол, гликолипиды и сфингомиелин. Сохраняя свой липид-ный состав в течение определенного времени, рафты «плавают» в глицеро-фосфолипидном «озере» (лате-ральная диффузия), подобно плотам (от англ. «raft» - плот).
Рафты четко отграничены от их глицеро-фосфолипид-ного окружения в пределах мембранного бислоя и не смешиваются с ним, имеют большую степень упорядо-ченности.
Слайд 21 В составе рафтов типично присутствие рецепторов, обладающих собственной
тирозин-киназной активно-стью и других белков, участвующих в передаче внеш-него сигнала
внутрь клетки (10 – 15 различных мемб-ранных белков).
В зависимости от типа клеток, рафты могут занимать 20% - 50% поверхности плазматической мембраны.
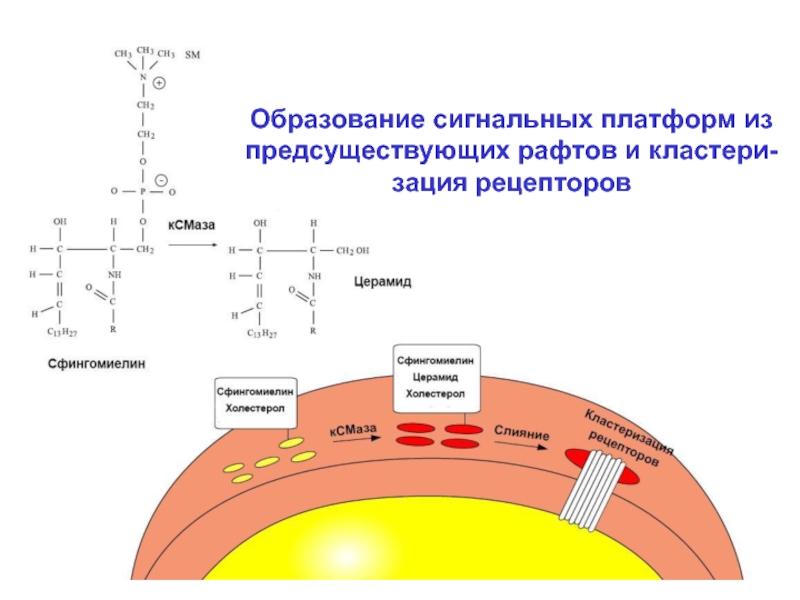
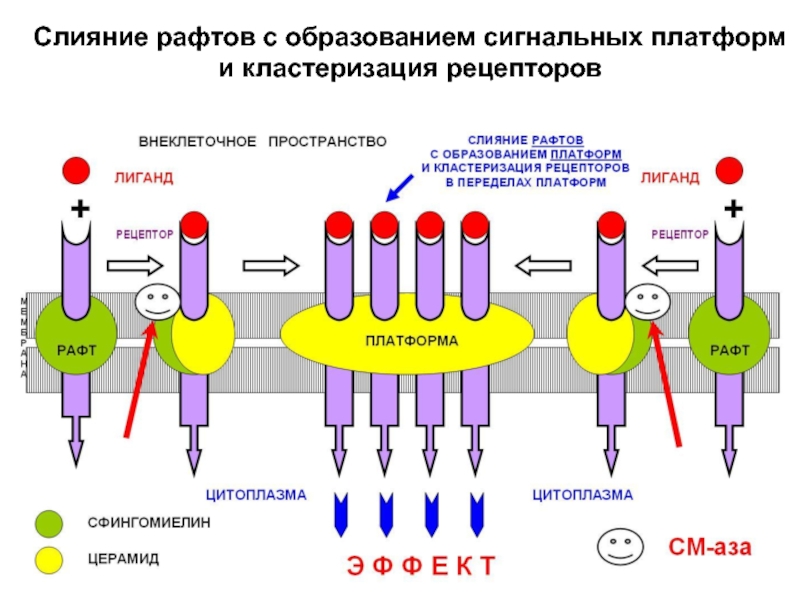
При воздействии на клетку биологических (гормон) и физических факторов происходит слияние рафтов в более крупные липидные макродомены – сигнальные «платформы». Активация рецептора сопряжено с акти-вацией кислой СМазы. Мембранный сфингомиелин превращается в церамид. Резкое увеличение содержа-ния церамида в составе рафта заставляет их сливать-ся, образуя платформу.
Слайд 22 В пределах образующейся сигнальной платформы в течение нескольких
секунд происходит кластеризация рецепторов, что является эффективным способом усиления внешнего
регуляторного сигнала и облегче-ния его проведения внутрь клетки.
В состав платформы могут входить: адренорецеп-тор, G-белок, аденилатциклаза, протеинкиназа А и протеинфосфатаза PP2 и др.
В составе платформы содержатся молекулы, образу-ющие высокоинтегрированную сигнальную единицу. Платформа способна инициировать и завершить ответ клетки на внешний сигнал.
Слайд 23Образование сигнальных платформ из
предсуществующих рафтов и кластери-
зация рецепторов
Слайд 24Слияние рафтов с образованием сигнальных платформ
и кластеризация рецепторов
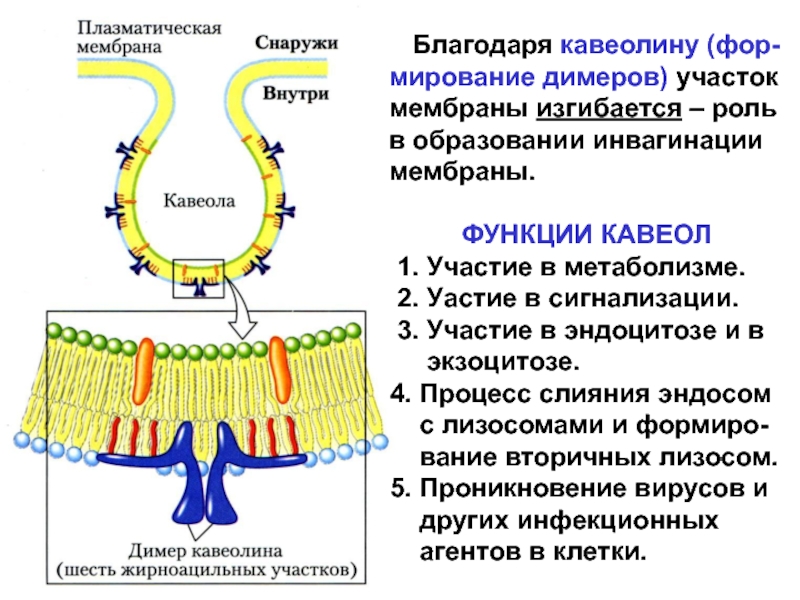
Слайд 25КАВЕОЛЫ – разновидность рафтов
Кавеола описана в 1955 г.
- «сaveolae intracellulare» или просто «сaveolae». Это колбообразная инвагина-ция поверхности
цитоплазматической мембраны, раз-мером 50-100 нм.
Принципиальное отличие состава кавеол от рафтов: в кавеолах обязательно содержаться белки – кавеоли-ны (кавеолин-1 и -2). Кавеолины играют важную роль, как в образовании, так и в функционировании кавеол.
Кавеолами богата плазматическая мембрана адипо-цитов (участие в регуляции потока жирных кислот через мембрану). Инсулин для адипоцитов - главный гормон, регулирующий метаболизм. Рецепторы к инсулину расположены в кавеолах мембран адипоци-тов.
Слайд 26 Благодаря кавеолину (фор-мирование димеров) участок мембраны изгибается –
роль в образовании инвагинации мембраны.
ФУНКЦИИ КАВЕОЛ
1. Участие в метаболизме.
2. Уастие в сигнализации.
3. Участие в эндоцитозе и в
экзоцитозе.
4. Процесс слияния эндосом
с лизосомами и формиро-
вание вторичных лизосом.
5. Проникновение вирусов и
других инфекционных
агентов в клетки.
Слайд 27Белковый компонент плазматических мембран
Слайд 28 В большинстве цитоплазматических мембран на долю липидов и
белков приходится около 50% по массе. На долю углеводных компонентов
в составе гликолипидов и гликопротеинов мембраны - 5 – 10% массы.
Молекулярная масса белков больше, чем у липидов. Таким образом, в среднем, на 1 молекулу белка при-ходится 50 – 100 молекул липидов.
Липиды плазматической мембраны, в основном, выполняют роль структурного элемента.
Мембранные белки ответственны за выполнение самых разнообразных функций. Функции белков цитоплазматической мембраны:
1. Структурная: в составе цитоскелета участвуют в поддержании формы клетки;
Слайд 292. Транспортная: формируют различные каналы (для диффузии молекул через мембрану),
ионные насосы и специфические переносчики;
3. Рецепторная: образуют рецепторы для различных
лигандов: гормонов, цитокинов, факторов роста и др. сигнальных молекул;
4. Ферментативная: связанные с мембраной фер-менты;
5. Антигенная функция: гликопротеины клеточной поверхности;
6. Адгезивная функция.
Слайд 30 Согласно Сингеру и Николсону, белки цитоплазмати-ческой мембраны делят
на периферические, интег-ральные и амфитропные.
1. Периферические (поверхностные) белки.
Расположены
на внешнем или внутреннем листах ФЛ-бислоя, внутрь мембраны не проникают. Связь с мембраной за счет электростатики или Н-связи между гидрофильными доменами белка и полярны-ми головками ФЛ.
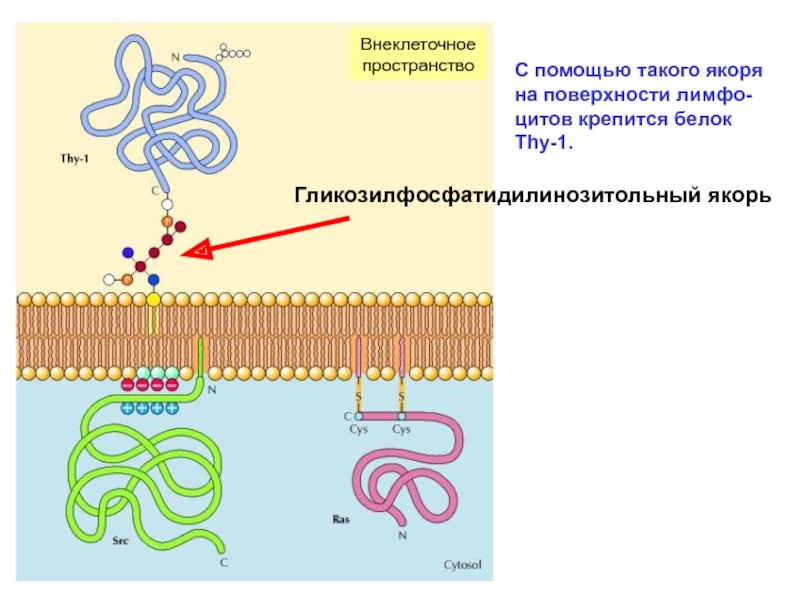
а). Белки внешней стороны мембраны – рецеп-торы. Есть белки, которые связаны с внешним монослоем мембраны с помощью гликозилфосфа-тидилинозитольного якоря (ГФИ-якоря). ГФИ-якорь связан с С-концевой частью белка – схема:
Слайд 31С помощью такого якоря на поверхности лимфо-цитов крепится белок Thy-1.
Внеклеточное
пространство
Гликозилфосфатидилинозитольный якорь
Слайд 32б). Белки внутренней стороны мембраны:
- ассоциированы с цитоскелетом, участвуют в
форми-
ровании силуэта клетки;
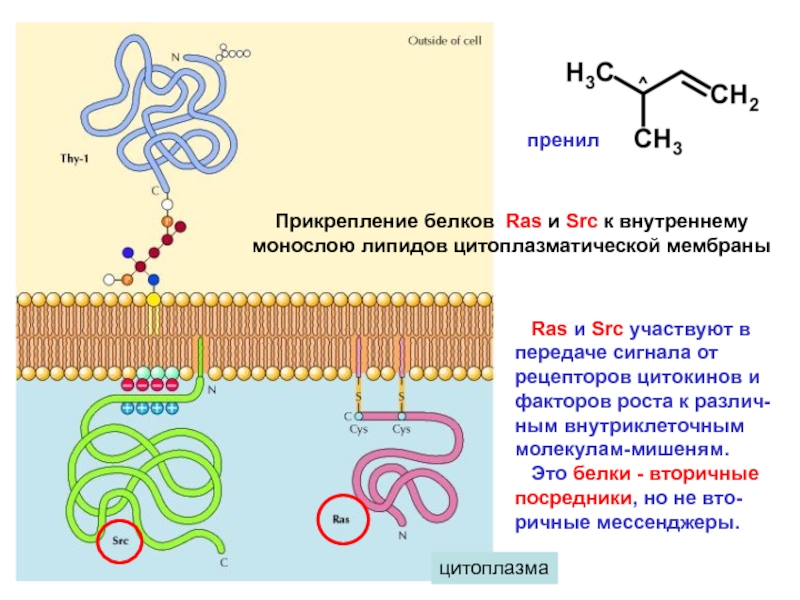
Белок Ras (малый G-белок). В составе С-конца цепи,
к остаткам цистеина присоединены прениловые груп-
пы. Эти групы «втискиваются» между остатками
пальмитиновой кислоты в составе ФЛ. Ras активиру-
ет киназу Raf – первую киназу в каскаде киназ сигналь-
ного пути МАРК.
- Белок Src (не связанная с рецептором внутриклеточ-
ная ПК). В составе N-конца цепи содержатся группы
миристоила (С14 - ЖК), имеют «+», который притягива-
ется головками ФЛ, которые заряжены «-». Участвует в
сигнализации через рецепторные тирозиновые киназы
и через рецепторы, сопряженные с G-белком. Содер-
жат SH2-домены. Сигнализация, обеспечивающая
рост, развитие и регенера цию клеток.
Слайд 33цитоплазма
Прикрепление белков Ras и Src к внутреннему
монослою липидов цитоплазматической мембраны
Ras и Src участвуют в передаче сигнала от рецепторов
цитокинов и факторов роста к различ-ным внутриклеточным молекулам-мишеням.
Это белки - вторичные посредники, но не вто-ричные мессенджеры.
пренил
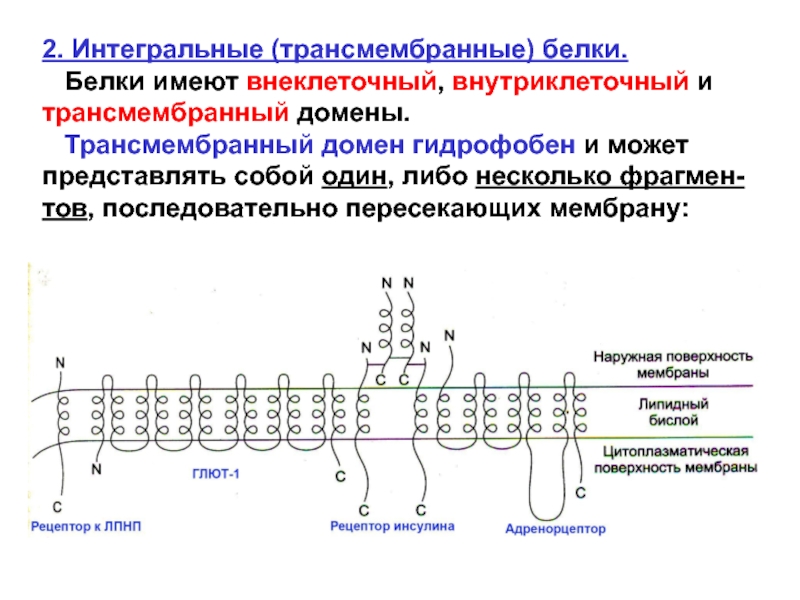
Слайд 342. Интегральные (трансмембранные) белки.
Белки имеют внеклеточный, внутриклеточный и
трансмембранный домены.
Трансмембранный домен гидрофобен и может представлять
собой один, либо несколько фрагмен-тов, последовательно пересекающих мембрану:
Слайд 35 Трансмембранный гидрофобный домен интеграль-ного белка часто является α-спиралью.
α-спиральные последовательности, каждая из кото-рых образует
трансмебранный сегмент, связаны между собой неспиральными петлями на внешней и внутренней сторонах мембраны.
Известно, что цепочка гидрофобных/неполярных аминокислот из 20-25 остатков, формирует α-спи-ральную структуру длиной, достаточной для пересе-чения цитоплазматической мембраны.
Слайд 363. Амфитропные белки.
Могут находится в цитоплазме и обратимо
связы-ваться с мембраной.
Способы связывания с мембраной:
нековалентные
взаимодействия с мембранными
липидами или белками (ПКС);
ковалентная вязь между амфитропным белком и
липидами мембраны.
Механимзы образования связи:
фосфорилирование – дефосфорилирование;
лиганд амфитропного белка (после образования
комплекса лиганд-белок) изменяет конформацию
белка, что «открывает» в нём участок связывания с
мембраной.
Слайд 37О латеральной диффузии мембранных белков
Латеральная диффузия мембранных белков
открыта L. Frye и M. Edidin в 1970 г и
послужила одним из под-тверждений жидкостно - мозаичной модели мембраны Сингера и Николсона.
Поперечная диффузия белков (аналогично «флип-флоп» для липидов) – науке не известна.
Белки могут свободно диффундировать только вдоль плоскости мембраны (латеральная диффузия белков). Исключение – белки, связанные с цитоске-летом.
Например: фосфолипаза А2, связавшись с цитоплаз-матической поверхностью мембраны и перемещаясь вдоль неё, способна гидролизовать неск. тыс. молекул восфолипидов в минуту.
Слайд 38Трансмембранная передача сигналов
Слайд 39 Основополагающее свойство клетки, обеспечиваю-щее её полноценное функционирование –
способ-ность получать сигналы из окружающей её среды (за пределами плазматической
мембраны), распознавать их и преобразовывать в адекватный клеточный ответ.
С помощью рецепторов клетка воспринимает сигна-лы из внешней среды, носителями которых являются первичные мессенджеры: гормоны, цитокины, нейро-медиаторы, факторы роста.
Рецептор - посредник, который преобразует внекле-точный химический сигнал (полученный с первичным мессенджером), во внутриклеточный сигнал (предава-емый вторичным мессенджером). Итог действия вторичного мессенджера - специфический клеточный ответ.
Слайд 40Сигнальная молекула (лиганд любой природы), связывается с рецептором слабой нековалентной
связью: водородные связи, гидрофобные и электро-статические взаимодействия. [Аналогия со связыва-нием
субстрата в активном центре фермента].
Позже комплекс лиганд-рецептор диссоциирует (обратимость связывания).
Биохимические процессы, которые инициирует образование комплекса гормон-рецептор, продолжа-ются в течение некоторого времени после диссоци-ации комплекса.
Молекулы первичных мессенджеров не метаболизи-руют, не дают биоактивных интермедиатов, не обла-дают каталитической активностью.
Слайд 41Основные свойства систем, передающих внешний
сигнал
Специфичность передачи сигналов.
Обеспечивается молекулярной комплементарно-
стью сигнальной молекулы (первичного мессенд-
жера) и рецептора, принадлежащего
клетке-мишени.
Большинство клеток функционально специализиро-
ваны. Каждый тип клеток имеет определенный набор
рецепторов, что и позволяет ей реагировать на
предназначенный для неё сигнал и реализовать спе-
цифическую функцию.
Слайд 422. Высокая чувствительность молекул-посредников в
передаче (трансдукции) сигнала.
Она
обеспечивается:
а). Высоким сродством рецепторов к сигнальным молекулам (лигандам).
Сродство характеризуется Kd (константа диссоциации), величина которой говорит о том, что рецептор обнаруживает пикомолярные концентрации лиганда (1Х10-12 моль/л).
б). Кооперативностью лиганд-рецепторных взаимо-действий. Малые изменении концентрации лиганда приводят к значительной активации рецептора.
в). Усилением сигнала (с помощью различных каска-дов). Каждый активированный лигандом рецептор активирует несколько ферментов «вниз по течению». Каскады реакций способны в течение миллисекунд обеспечить усиление первичного сигнала на несколь-ко порядков.
Слайд 43 Особо о десенситизации рецептора.
Это снижение
(потеря) чувствительности рецептора к продолжительно действующей сигнальной молеку-ле. Чувствительность восстанавливается,
когда сти-мул ослабевает ниже порогового значения.
3. Интеграция при передаче сигнала.
Живая система получает извне множество различных сигналов, но даёт единый (интегрированный) ответ, в четком соответствии с нуждами клетки, органа, организма.
Различные сигнальные пути «перекрещиваются» на разных уровнях, порождают множество взаимодейст-вий, которые поддерживают гомеостаз в клетке и организме.
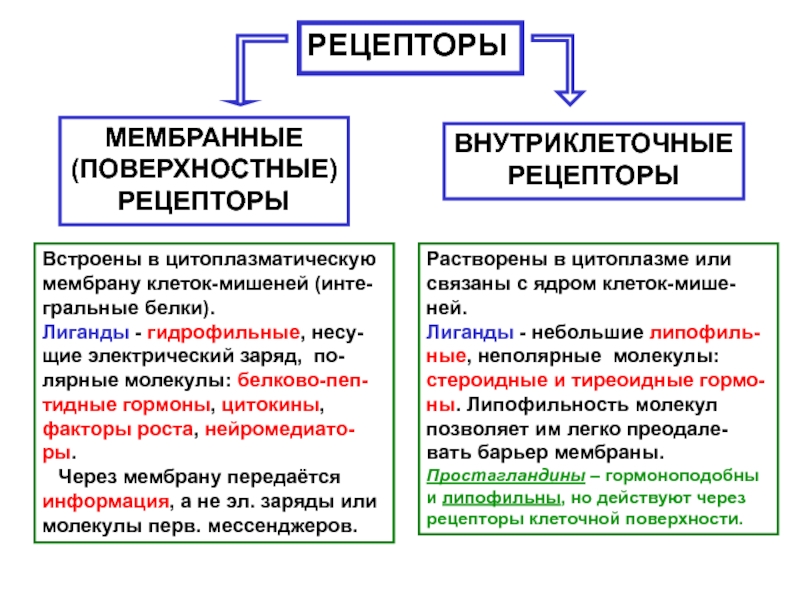
Слайд 44РЕЦЕПТОРЫ
МЕМБРАННЫЕ
(ПОВЕРХНОСТНЫЕ)
РЕЦЕПТОРЫ
ВНУТРИКЛЕТОЧНЫЕ
РЕЦЕПТОРЫ
Встроены в цитоплазматическую мембрану клеток-мишеней (инте-гральные белки).
Лиганды -
гидрофильные, несу-щие электрический заряд, по-лярные молекулы: белково-пеп-тидные гормоны, цитокины, факторы
роста, нейромедиато-ры.
Через мембрану передаётся информация, а не эл. заряды или молекулы перв. мессенджеров.
Растворены в цитоплазме или связаны с ядром клеток-мише-ней.
Лиганды - небольшие липофиль-ные, неполярные молекулы: стероидные и тиреоидные гормо-ны. Липофильность молекул позволяет им легко преодале-вать барьер мембраны.
Простагландины – гормоноподобны и липофильны, но действуют через рецепторы клеточной поверхности.