Слайд 1С.М.Судариков
Гидрогеохимия
Характеристика основных ионов, содержащихся в природных растворах
Коллоидные вещества
Слайд 2Роль коллоидов в самоочищении природных вод и формировании рудных месторождений.
В
природных водах происходит постоянный обмен металлами между растворенной формой, частицами
коллоидов и вмещающими породами или донными отложениями. Коллоиды способны активно сорбировать тяжелые металлы. Со временем коллоидные растворы коагулируют, в результате чего сорбированные элементы переходят в твердую фазу. Вода самоочищается.
Если поступление тяжелых металлов в поверхностных водоемах прекращается, поверх загрязненного ила образуется свежий слой "чистых" донных отложений. В результате тяжелые металлы изолируются и выводятся из экосистемы. Именно так водоемы справляются с последствиями антропогенных аварий.
Слайд 3Коллоиды активно участвуют в формировании некоторых типов месторождений: железорудных формаций,
полей металлоносных осадков (гидротермальный плюм на фото), Fe-Mn конкреций на
дне Океана, скоплений бокситов.
Слайд 4Оксид кремния SiО2
В большинстве случаев SiО2 поступает в воды в
результате гидролиза полевых шпатов при выветривании горных пород.
В воде
аморфный кремнезем малорастворим, при комнатной температуре его растворимость составляет 120 мг/л, а растворимость стабильного кварца более чем на порядок ниже.
Тем не менее кремнекислоты содержатся во всех природных водах, соотношение определяется щелочно-кислотными равновесиями. H2SiO3 – метакремневая кислота; Н4SiO4 – ортокремневая; часто даются в виде суммы SiO2.
При температурах около 100°С растворимость аморфного кремнезема достигает 400 мг/л. Высокие содержания кремнекислоты известны в глубинных кислых (рН < 4) водах.
Слайд 5В ультрапресных водах SiО2 является главным компонентом химического состава.
Содержание
его возрастает и в щелочных водах, но обычно в подземных
водах оно не превышает первых десятков миллиграммов на литр. В воде SiО2 чаще присутствует в молекулярно-диспергированном (H4SiО4, H2SiО3), реже коллоидальном (xSiO2×yН2O) состоянии.
Кремнезем способен отлагаться из вод термальных источников, особенно щелочных азотных терм, образуя специфические осадки — гейзериты. В гейзеритах Долины Гейзеров SiO2 > 90-95 %.
Слайд 6Гейзер Малахитовый, Камчатка
Слайд 7Гейзериты в районе проявления терм. Сиена, Италия
Слайд 8Термальные воды, насыщенные коллоидами кремния
Слайд 9Оксид кремния малотоксичен для человека, животных, микроорганизмов и растений.
Для
орошения почвы в США рекомендуется использовать воды с предельно допустимой
концентрацией (ПДК) кремния в пределах 10—50 мг/л.
В связи с образованием труднорастворимых осадков в паровых котлах, бойлерах и турбинах ПДК кремния составляет 1—40 мг/л (в зависимости от давления).
Слайд 10Кремнекислота добавляется в мягкие воды как средство защиты металлических трубопроводов
от коррозии.
В бальнеологии кремнекислота состава H2SiО3+HSiО3≥50 мг/л используется в
качестве лечебного компонента.
Практикуется использование "кремней" для улучшения качества питьевых вод.
Слайд 11Гидроксиды железа.
Пределы растворимости ПРFе(OH)2 – 4,8.10-16; Fe(OH)3 – 4.10-38.
При окислении (Fe2+→Fe3+) и гидролизе образуется коллоидный осадок гидроксида железа
(III), ухудшающий органолептические показатели воды.
Ограниченная миграционная способность этого компонента обусловлена наличием окислительного и сульфидного геохимических барьеров на путях миграции.
Слайд 12Окислительный и сульфидный барьеры. Гидротермальное поле Снейк Пит, Атлантика
Слайд 13Во многом поэтому железо относительно широко распространено в горных породах
и минералах (кларк 4,2 %) (железорудные формации, магнетит, гематит, сидерит,
гётит, железистые силикаты и пр.).
При высоких концентрациях Fe2+ осадки гидроксидов забивают трубопроводы и водозаборную арматуру.
В подземных водах оно содержится в относительно небольших количествах (единицы, десятки миллиграммов на литр), изредка достигая сотен и в исключительных случаях (в резко восстановительной обстановке) тысяч миллиграммов на литр
Слайд 14Гидроксиды марганца.
Предел растворимости ПРMn(OH)2 – 4.10-14.
Марганец Мn2+ содержится
в водах в концентрациях на порядок меньших, чем железо. Имеются
отличия и в миграционных способностях. Это обусловлено большей устойчивостью Мn2+ в окислительных условиях.
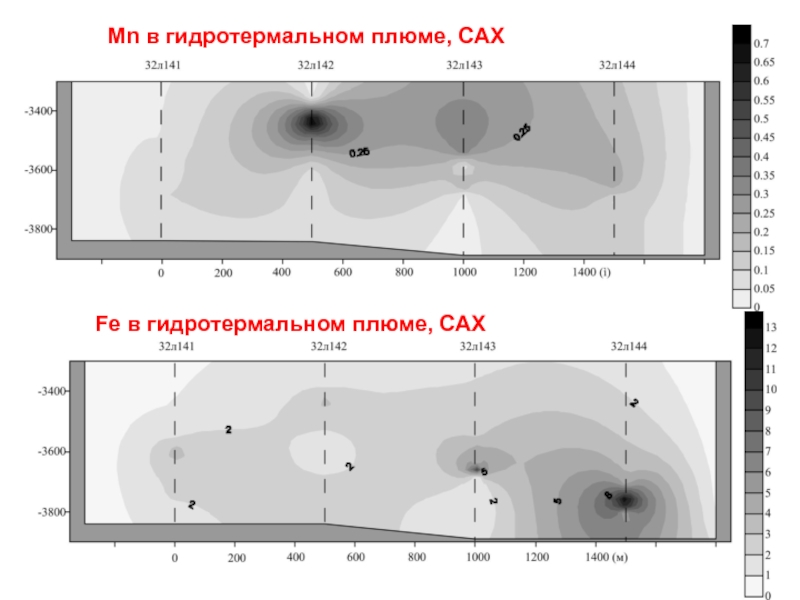
В особенности это проявляется при разгрузке субмаринных гидротерм. Железо переходит во взвешенное (коллоидальное) состояние вблизи источника, а марганец – на заметном удалении, иногда до нескольких километров.
Слайд 15Fe в гидротермальном плюме, САХ
Mn в гидротермальном плюме, САХ
Слайд 16Установлено, что наиболее эффективно Мn2+ переводится во взвешенное состояние с
участием бактерий.
В концентрациях больше 0,1 мг/л марганец делает воду мутной,
а при концентрациях 0,5 мг/л появляется металлический привкус.
Предположительно оказывает мутагенное действие на теплокровных животных и токсичен для растений в концентрациях свыше 0,5 мг/л.
ПДК этого элемента в питьевой воде составляет в России 0,1 мг/л, в других странах колеблется от 0,05 до 0,1 мг/л.
Слайд 17Образование железомарганцевых конкреций (дно Океана; Финский залив).
Первые сведения о рудных
образованиях на дне Океана были получены в ходе первой в
истории мировой науки комплексной океанологической экспедиции на английском судне “Челленджер”, продолжавшейся почти четыре года (1872-1876).
18 февраля 1873 г. при проведении драгировки в 160 милях к юго-западу от Канарских о-вов со дна были подняты черные округлые желваки - железомарганцевые конкреции, содержащие, как показали уже первые анализы, значительное количество никеля, меди и кобальта.
Слайд 19Другой тип образований – Fe-Mn корки, которые, в отличие от
конкреций, образуют относительно тонкие покровы на твердых породах, в основном
на подводных поднятиях. Они были открыты и впервые описаны совместно с конкрециями в результате той же экспедиции на “Челленджере”
Главное геохимическое различие между Mn и Fe в океане сводится к многообразию минеральных форм, в которых Fe выводится в осадочную толщу как в окислительных, так и в восстановительных условиях, в то время как Mn может находиться в твердофазной форме только в окисленных условиях.
Слайд 20Из восстановленных осадков растворенный Mn мигрирует к поверхности дна и
в благоприятных фациальных условиях (высокие содержания растворенного кислорода в морской
воде и низкие скорости седиментации) формирует рудные отложения в двух основных формах: железо-марганцевые конкреции (ЖМК) и корки.
Казалось бы, что само название этих стяжений свидетельствует о геохимической близости свойств главных рудообразующих металлов - Fe и Mn. Но это не совсем так. Еще В. И. Вернадский отмечал, что в природе в зоне гипергенеза нет ни одного железо-марганцевого минерала.
Слайд 22Кроме того железистые и марганцеворудные формации на суше хотя и
сопутствуют друг другу, но всегда разделены во времени и пространстве.
Это связано с разницей в стандартных потенциалах окисления - более низком у Fe и высоком у Mn. Поэтому Fe окисляется легче Mn и соответственно раньше образует окисные твердофазные соединения.
Слайд 23Гидроксиды алюминия.
Предел растворимости алюминия гидроксида
ПР Al(OH)3 1,9.10-33.
Другие формулы: H3AlO
, H3AlO , HAlO2,
[Al2O3 H2О]. nH2О. Белое студенистое вещество,
плохо растворимое в воде
Источники поступления алюминия в природные воды:
частичное растворение глин и алюмосиликатов;
атмосферные осадки;
сточные воды различных производств.
Слайд 24В природных водах алюминий присутствует в ионной, коллоидной и взвешенной
формах.
Миграционная способность невысокая. Образует довольно устойчивые комплексы, в том
числе органоминеральные, находящиеся в воде в растворенном или коллоидном состоянии.
Концентрация алюминия в поверхностных водах обычно колеблется в пределах n.10-2 — n.10-1 мг/дм3, в некоторых кислых водах иногда достигает нескольких граммов в 1 дм3.
Слайд 25Используется для очистки питьевых вод
Наиболее часто на водопроводах в качестве
коагулянта применяют неочищенный алюминия сульфат (сернокислый глинозем), который содержит 33%
безводного алюминия сульфата и до 23% нерастворимых примесей.
При добавлении к воде Al2(SO4)3 вступает в реакцию с гидрокарбонатами кальция и магния , которые всегда содержатся в природной воде и обусловливают ее устранимую жесткость и щелочность:
Слайд 26Al2(SO4)3 + ЗСа(НСO3)2 = 2Аl(ОН)3 + 3CaSO4 + 6СO2
Al2(SO4)3 +
ЗMg(НСO3)2 = 2Аl(ОН)3 + 3MgSO4 + 6СO2
Основным для процесса коагуляции
является образование Аl(ОН)3 в виде коллоидного раствора. Аl(ОН)3 придает ей опалесценцию и быстро коагулирует, образуя хлопья во всей толще воды.
Они имеют заряд, противоположный заряду коллоидных частиц гуминовых веществ, которые содержатся в природной воде. Благодаря этому коллоидные частицы коагулянта нейтрализуют заряд коллоидных гуминовых частиц воды.
Слайд 27Хлопья же самого коагулянта адсорбируют коллоидные и мелкие взвешенные частицы
и выпадают на дно, механически захватывая с собой крупную взвесь.
Обесцвечивание,
которого невозможно добиться другими способами очистки, происходит вследствие адсорбции гуминовых веществ на поверхности хлопьев коагулянта и дальнейшего выпадения в осадок. Уменьшение количества взвеси способствует также значительному уменьшению количества бактерий и вирусов, содержащихся в воде.
Слайд 28Образование бокситов
В 1821 г. французский химик Вернье впервые исследовал и
описал встречающуюся близ города Ле Бо (Les Baux), на юге
Франции, горную породу, содержащую 52% Аl2О3, 27,6% F2О3 и 20,4 % Н2О, причем назвал ее по месту нахождения бокситом (bauxite).
В настоящее время бокситы являются важнейшей алюминиевой рудой, на которой, за немногими исключениями, базируется почти вся мировая алюминиевая промышленность.
Слайд 29По внешнему виду
бокситы представляют глиноподобную, а часто каменистую породу, иногда
плотного, иногда пористого сложения. Для них характерна большая дисперсность составных
частей, нередко приближающаяся к дисперсности коллоидов.
Цвет бокситов весьма разнообразен, но чаще всего красный различных оттенков.
Слайд 31По одной из гипотез, бокситы являются продуктом выветривания древней коры
с последующим механическим перемещением и переотложением остаточного продукта, находящегося в
коллоидном состоянии.
По другой - бокситы являются химическим осадком, образовавшимся при разложении растворов алюминиевых, железных и титановых солей (получавшихся за счет выщелачивания природными водами изверженных пород) в момент поступления их в водоемы — моря и озера.
Слайд 32Схема Акад. А. Е. Ферсмана осаждения гидратов окиси алюминия из
растворов алюминиевых солей при разных значениях рН, иллюстрирующая возможность гидрохимического
образования скоплений алюминия (в виде гидратов)
рН ниже 4; Алюминий растворяется (Алюминий, как катион)
рН = 4—7; Алюминий осаждается
рН =7-11; Алюминий остается в осадке
рН = 13—14; Алюминий растворяется (Алюминий, как анион)
Слайд 33Из этой схемы видно, что алюминий растворяется лишь при очень
высоких и при очень низких рН.
Первое редко осуществляется в земной
коре; гораздо важнее вторая группа растворов — кислых, в виде которых алюминий очень легко мигрирует (выносится).
К таким растворам относятся и некоторые типы гидротерм, характеризующиеся повышенными концентрациями алюминия.
Слайд 35Ионы алюминия обладают токсичностью по отношению к многим видам водных
живых организмов и человеку
ПДК составляет 0.5 мг/дм3





















![Коллоидные вещества Гидроксиды алюминия. Предел растворимости алюминия гидроксидаПР Al(OH)3 1,9.10-33.Другие формулы: H3AlO , Гидроксиды алюминия. Предел растворимости алюминия гидроксидаПР Al(OH)3 1,9.10-33.Другие формулы: H3AlO , H3AlO , HAlO2, [Al2O3 H2О].](/img/thumbs/15a1fa59ec82defddd0d8d6e6777f577-800x.jpg)































