Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Содержание
- 1. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- 2. Соединения,имеющие в своем составе комплексные ионы, относят к комплексным соединениям.
- 3. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙNH4ClКОМПЛЕКСНЫЙ ИОНКООРДИНАЦИОННОЕ ЧИСЛО - 4
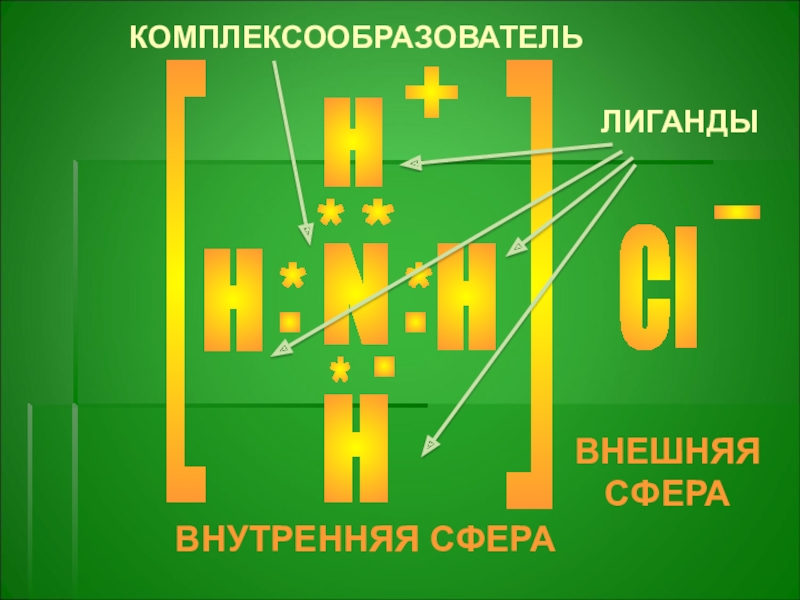
- 4. NHHHCl+-[[*****...HКОМПЛЕКСООБРАЗОВАТЕЛЬЛИГАНДЫВНУТРЕННЯЯ СФЕРАВНЕШНЯЯ СФЕРА
- 5. [N-3H+14]Cl-1КОМПЛЕКСНЫЙ ИОН[NH4]+ВНУТРЕННЯЯ СФЕРА:КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3ЛИГАНДЫH+ВНЕШНЯЯ СФЕРААНИОНCl-
- 6. (OH)-4[Zn+xNa+(+1)+ x+ (-1)]2·2·4 = 0x = 0-2+4x = +2Na+[Zn+2(OH)-4]
- 7. РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:Na3[AlF6]K[MgCl3]Na[Al(OH)4]Na4[Fe(CN)6]Na3[Al(OH)6][Cu(NH3)4]Cl2
- 8. РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:Na3[AlF6]Ответ: Na+3[Al+3F-6]K[MgCl3]Na[Al(OH)4]Na4[Fe(CN)6]Na3[Al(OH)6][Cu(NH3)4]Cl2Ответ: Na+[Al+3(OH)-4]Ответ: K+[Mg+2Cl-3]Ответ:Na+4[Fe+2(CN)-6]Ответ:Na+3[Al+3(OH)-6]Ответ:[Cu+2(NH3)04]Cl-2
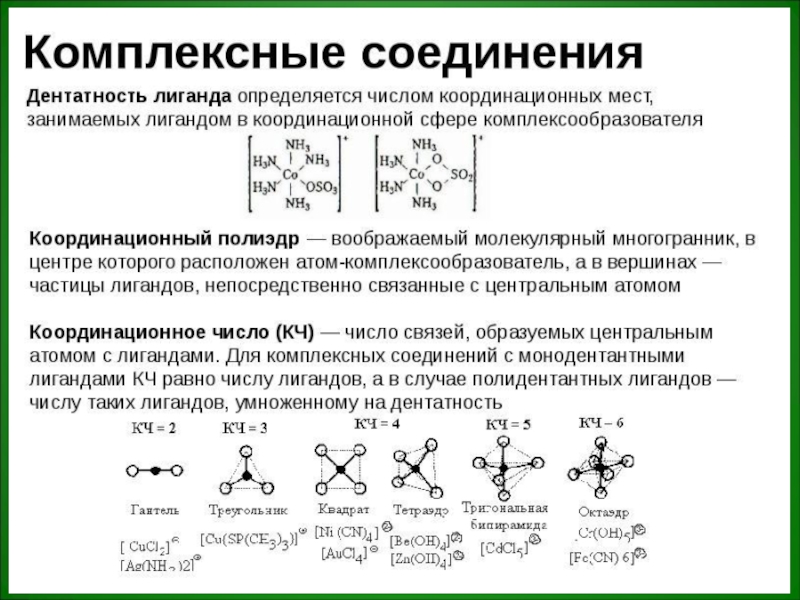
- 9. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ2-4-3-5-6-ди-три-тетра-пента-гекса-ЧИСЛИТЕЛЬНЫЕ:НАЗВАНИЯ ЛИГАНДОВ:H2O - акваNH3 -
- 10. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙНАЗВАНИЯ АНИОНОВ:Fe - ферратCu -
- 11. тетрагидроксоцинкатНОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙNa+24](OH)-[Zn+2натрия[Cr+3(H2O)06]Cl-3хлоридаквагексаxрома (III)K+2[Hg+2I-4]тетрайодомеркурат (II)калия
- 12. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]Na[Al(OH)4]K4[Fe(CN)6]
- 13. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]Na[Al(OH)4]K4[Fe(CN)6]Гексафтороалюминат натрияТетрагидроксоалюминат натрияГексационоферрат (II) калия
- 14. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4[Ag(NH3)2]Cl[Cr(H2O)6]Cl3
- 15. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4Сульфат тетраамминмеди (II)[Ag(NH3)2]ClХлорид диамминсеребраХлорид гексааквахрома (III)[Cr(H2O)6]Cl3
- 16. Гексахлороплатинат (IV) калияНитрат хлоронитротетраамминкобальта (III)Гексагидроксохромат (III) натрияСОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВНитрат гексаамминникеля (II)
- 17. Ответ: K2[PtCl6]Гексахлороплатинат (IV) калияНитрат хлоронитротетраамминкобальта (III)Гексагидроксохромат (III) натрияСОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВОтвет: [Co(NH3)4(NO3)Cl]NO3Ответ: Na3[Cr(OH)6]Нитрат гексаамминникеля (II)Ответ: [Ni(NH3)6](NO3)2
- 18. ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙЛабораторный опыт. Получение тетрагидроксоалюмината натрияAlCl3+3NaOH
- 19. ХИМИЧЕСКИЕ СВОЙСТВА1. Диссоциация[Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42-
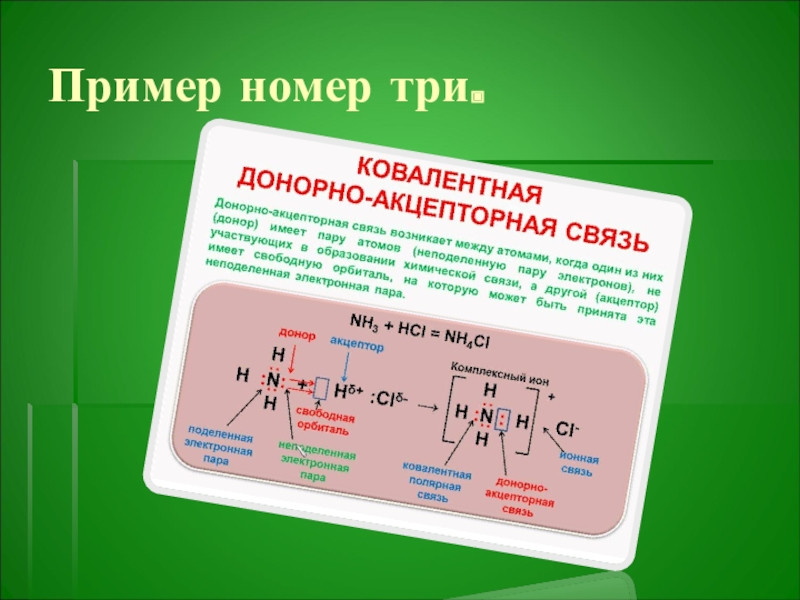
- 20. Механизм образования комплексных соединений. Донорно-акцепторноя связь.
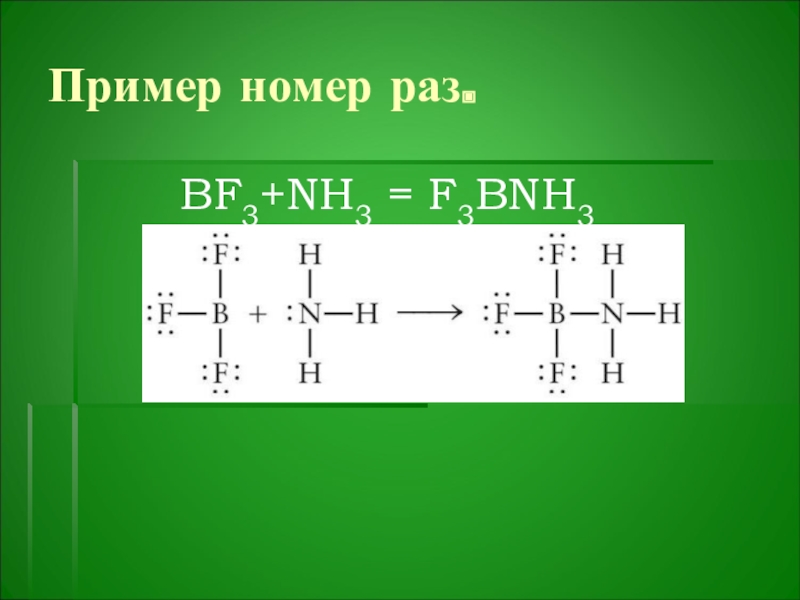
- 21. Пример номер раз.BF3+NH3 = F3BNH3
- 22. Пример номер два.
- 23. Пример номер три.
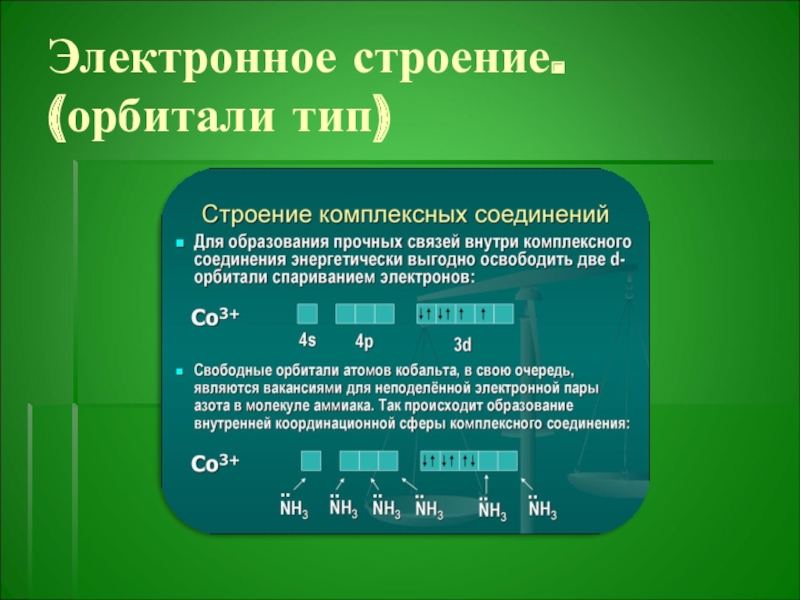
- 24. Электронное строение. (орбитали тип)
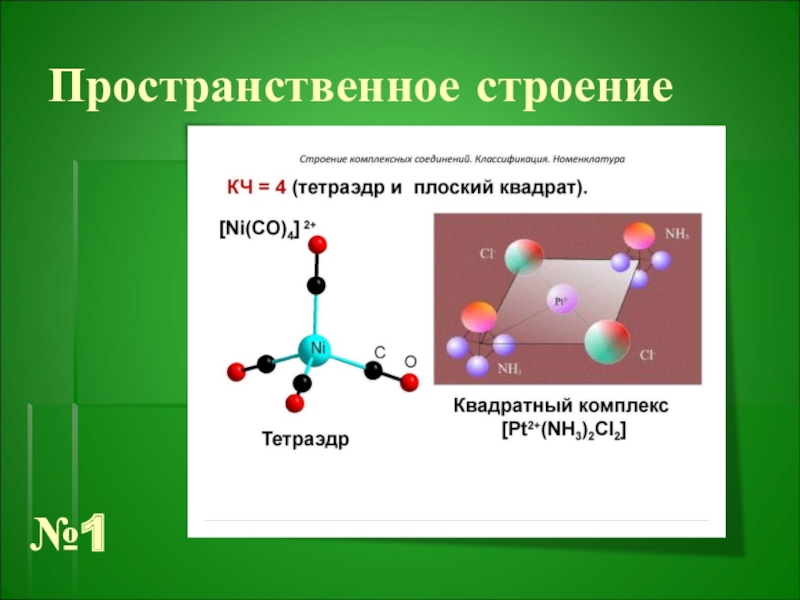
- 25. Пространственное строение№1
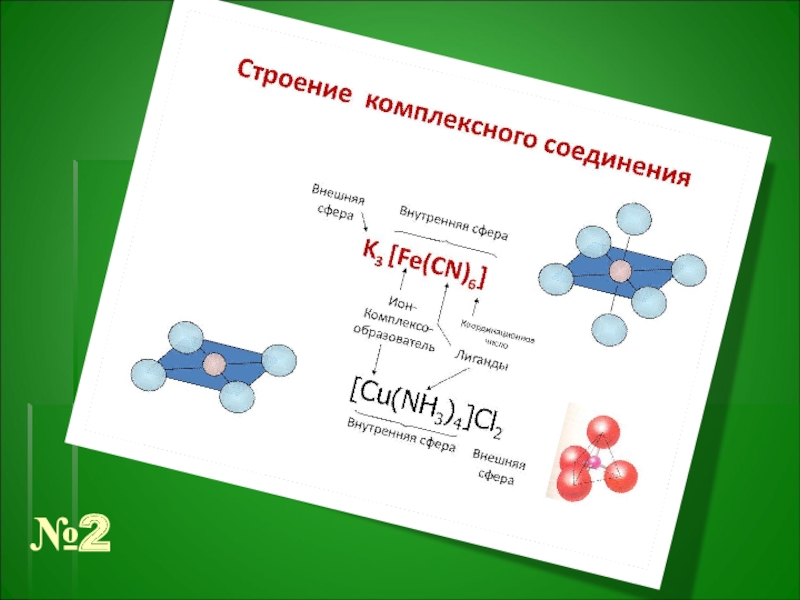
- 26. №2
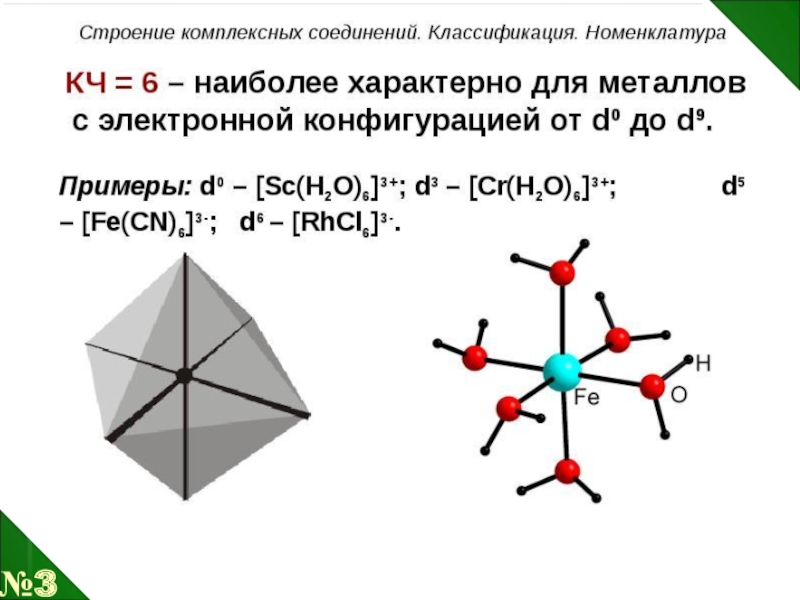
- 27. №3
- 28. Время какой-то дичи…
- 29. Слайд 29
- 30. Слайд 30
- 31. Практическая частьНапишите уравнения реакций и осуществите возможные
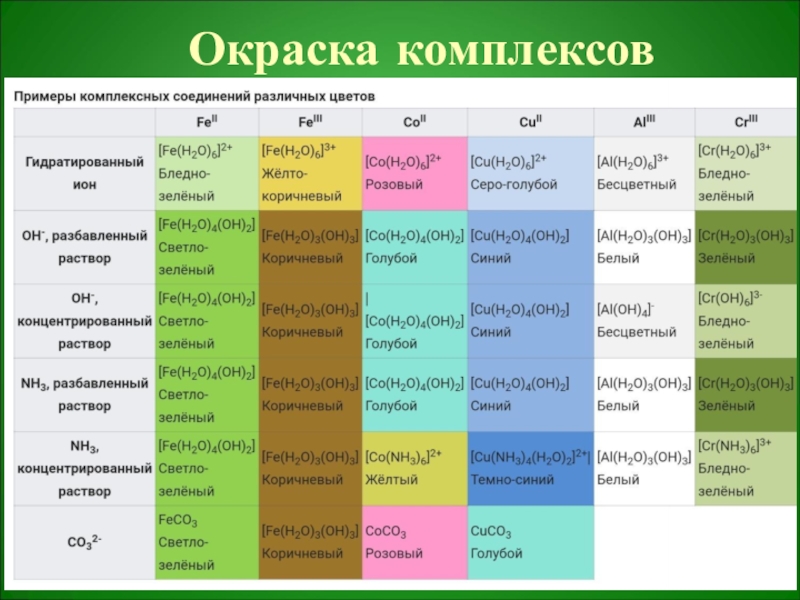
- 32. Окраска комплексов
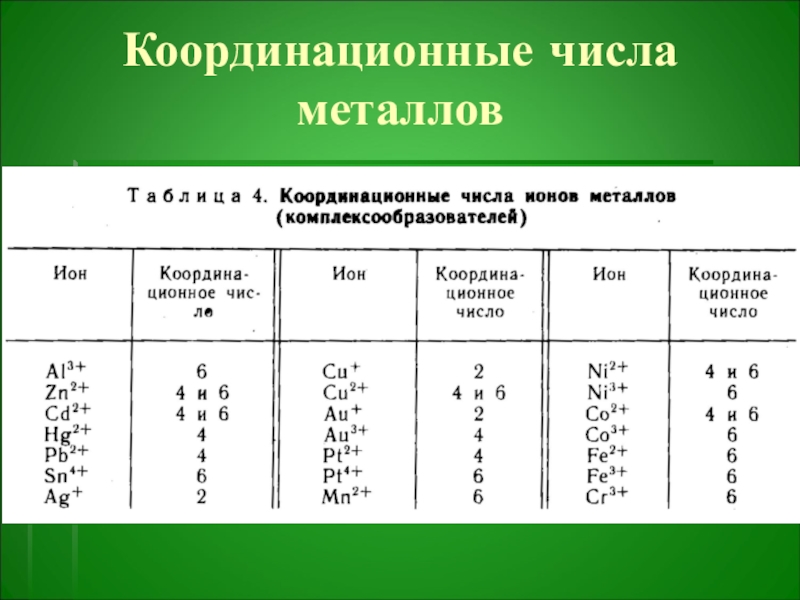
- 33. Координационные числа металлов
- 34. Гидролиз- По катиону:2FeSO4 + 2H2O = [FeOH]2SO4
- 35. Практическая частьПредположите и подтвердите экспериментально среду следующих растворов:- хлорид железа (3)- нитрит натрия- сульфит натрия
- 36. Скачать презентанцию
Соединения,имеющие в своем составе комплексные ионы, относят к комплексным соединениям.
Слайды и текст этой презентации
Слайд 1КОМПЛЕКСНЫЕ
СОЕДИНЕНИЯ
Сборная лицейчика 1502
Женя, Никита, Саша, Ксюша, Илья*2, Люба, Лена,
Катя и пр.
Слайд 5[N-3H+14]Cl-1
КОМПЛЕКСНЫЙ ИОН
[NH4]+
ВНУТРЕННЯЯ СФЕРА:
КОМПЛЕКСООБРАЗОВАТЕЛЬ
N-3
ЛИГАНДЫ
H+
ВНЕШНЯЯ СФЕРА
АНИОН
Cl-
Слайд 7РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:
Na3[AlF6]
K[MgCl3]
Na[Al(OH)4]
Na4[Fe(CN)6]
Na3[Al(OH)6]
[Cu(NH3)4]Cl2
Слайд 8РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:
Na3[AlF6]
Ответ: Na+3[Al+3F-6]
K[MgCl3]
Na[Al(OH)4]
Na4[Fe(CN)6]
Na3[Al(OH)6]
[Cu(NH3)4]Cl2
Ответ: Na+[Al+3(OH)-4]
Ответ: K+[Mg+2Cl-3]
Ответ:Na+4[Fe+2(CN)-6]
Ответ:Na+3[Al+3(OH)-6]
Ответ:[Cu+2(NH3)04]Cl-2
Слайд 9НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
2-
4-
3-
5-
6-
ди-
три-
тетра-
пента-
гекса-
ЧИСЛИТЕЛЬНЫЕ:
НАЗВАНИЯ ЛИГАНДОВ:
H2O - аква
NH3 - амин
СO - карбонил
OН-
- гидроксо-
(СN)- - циано
F-, Cl-, Br-, I- - фторо-, хлоро-,
бромо-, йодо-(NO3)- - нитро
Слайд 10НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
НАЗВАНИЯ АНИОНОВ:
Fe - феррат
Cu - купрат
Ag - аргентат
Au
- аурат
Hg - меркурат
Al - алюминат
Zn - цинкат
Слайд 11тетра
гидроксо
цинкат
НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Na+2
4]
(OH)-
[Zn+2
натрия
[Cr+3
(H2O)0
6]
Cl-3
хлорид
аква
гекса
xрома (III)
K+2
[Hg+2
I-
4]
тетра
йодо
меркурат (II)
калия
Слайд 13НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Na3[AlF6]
Na[Al(OH)4]
K4[Fe(CN)6]
Гексафтороалюминат натрия
Тетрагидроксоалюминат натрия
Гексационоферрат (II) калия
Слайд 15НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
[Cu(NH3)4]SO4
Сульфат тетраамминмеди (II)
[Ag(NH3)2]Cl
Хлорид диамминсеребра
Хлорид гексааквахрома (III)
[Cr(H2O)6]Cl3
Слайд 16Гексахлороплатинат (IV) калия
Нитрат хлоронитротетраамминкобальта (III)
Гексагидроксохромат (III) натрия
СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ
Нитрат гексаамминникеля
(II)
Слайд 17Ответ: K2[PtCl6]
Гексахлороплатинат (IV) калия
Нитрат хлоронитротетраамминкобальта (III)
Гексагидроксохромат (III) натрия
СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ
Ответ:
[Co(NH3)4(NO3)Cl]NO3
Ответ: Na3[Cr(OH)6]
Нитрат гексаамминникеля (II)
Ответ: [Ni(NH3)6](NO3)2
Слайд 18ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Лабораторный опыт.
Получение тетрагидроксоалюмината натрия
AlCl3+3NaOH = Al(OH)3↓+3NaCl
Al(OH)3 +
NaOH = Na[Al(OH)4]
Лабораторный опыт.
Получение гидроксида тетраамминмеди (II)
CuCl2+2NH3 +2H2O =
Cu(OH)2↓+NH4ClCu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
Слайд 19ХИМИЧЕСКИЕ СВОЙСТВА
1. Диссоциация
[Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42-
2. Реакции по
внешней сфере
FeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl
[Cu(NH3)4]SO4+BaCl2→[Cu(NH3)4]Cl2+BaSO4↓
3. Реакции с участием лигандов
[Cu(NH3)4]SO4+4HCl→4NH4Cl+CuSO4
4. Реакции по центральному
ионуОбменные:[Ag(NH3)2Cl + KI → AgI↓ + KCl + 2NH3
Окислительно-восстановительные:
2[Ag(NH3)2OH+R-C=O →2Ag↓+RCOONH4+H2O+3NH3
H
Слайд 31Практическая часть
Напишите уравнения реакций и осуществите возможные превращения:
- Гидроксид цинка
+ гидроксид калия (изб)
- Гидроксид железа (3) + гидроксид калия
(изб)- Гексааквахлорид кобальта (2) + конц. соляная кислота = ?
- Гексацианоферрат (2) калия + диакватетрахлороферрат (3) водорода = ?
- Гексацианоферрат (3) калия + гексааквахлорид железа (2) = ?
- Гексааквахлорид железа (2) + тиоцианат (родонид) натрия
Слайд 34Гидролиз
- По катиону:
2FeSO4 + 2H2O = [FeOH]2SO4 + H2SO4
Fe2+ +
OH- = FeOH-
Кислая среда в растворе
По аниону:
KHCO3 + H2O =
KOH + CO2 + H2OHCO3- + H+ = CO2 + H2O
Щелочная среда в растворе



![КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [N-3H+14]Cl-1КОМПЛЕКСНЫЙ ИОН[NH4]+ВНУТРЕННЯЯ СФЕРА:КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3ЛИГАНДЫH+ВНЕШНЯЯ СФЕРААНИОНCl- [N-3H+14]Cl-1КОМПЛЕКСНЫЙ ИОН[NH4]+ВНУТРЕННЯЯ СФЕРА:КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3ЛИГАНДЫH+ВНЕШНЯЯ СФЕРААНИОНCl-](/img/tmb/7/627442/335fcf9b21b68ee0f28968bef1cf9e07-800x.jpg)
![КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ (OH)-4[Zn+xNa+(+1)+ x+ (-1)]2·2·4 = 0x = 0-2+4x = +2Na+[Zn+2(OH)-4] (OH)-4[Zn+xNa+(+1)+ x+ (-1)]2·2·4 = 0x = 0-2+4x = +2Na+[Zn+2(OH)-4]](/img/tmb/7/627442/3a880a5df411c3154fcc98b9839877d1-800x.jpg)
![КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:Na3[AlF6]K[MgCl3]Na[Al(OH)4]Na4[Fe(CN)6]Na3[Al(OH)6][Cu(NH3)4]Cl2 РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:Na3[AlF6]K[MgCl3]Na[Al(OH)4]Na4[Fe(CN)6]Na3[Al(OH)6][Cu(NH3)4]Cl2](/img/tmb/7/627442/7fbc237835c601867f890fab42c3c16c-800x.jpg)
![КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:Na3[AlF6]Ответ: Na+3[Al+3F-6]K[MgCl3]Na[Al(OH)4]Na4[Fe(CN)6]Na3[Al(OH)6][Cu(NH3)4]Cl2Ответ: Na+[Al+3(OH)-4]Ответ: K+[Mg+2Cl-3]Ответ:Na+4[Fe+2(CN)-6]Ответ:Na+3[Al+3(OH)-6]Ответ:[Cu+2(NH3)04]Cl-2 РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ:Na3[AlF6]Ответ: Na+3[Al+3F-6]K[MgCl3]Na[Al(OH)4]Na4[Fe(CN)6]Na3[Al(OH)6][Cu(NH3)4]Cl2Ответ: Na+[Al+3(OH)-4]Ответ: K+[Mg+2Cl-3]Ответ:Na+4[Fe+2(CN)-6]Ответ:Na+3[Al+3(OH)-6]Ответ:[Cu+2(NH3)04]Cl-2](/img/tmb/7/627442/d11e0a1c90df6f725a15c714b4107776-800x.jpg)


-[Zn+2натрия[Cr+3(H2O)06]Cl-3хлоридаквагексаxрома (III)K+2[Hg+2I-4]тетрайодомеркурат (II)калия тетрагидроксоцинкатНОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙNa+24](OH)-[Zn+2натрия[Cr+3(H2O)06]Cl-3хлоридаквагексаxрома (III)K+2[Hg+2I-4]тетрайодомеркурат (II)калия](/img/tmb/7/627442/9ccee8f103767cdd536f59d11d8bf65c-800x.jpg)
![КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]Na[Al(OH)4]K4[Fe(CN)6] НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]Na[Al(OH)4]K4[Fe(CN)6]](/img/tmb/7/627442/6822406d330d7c77785476d43c0c1c65-800x.jpg)
![КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]Na[Al(OH)4]K4[Fe(CN)6]Гексафтороалюминат натрияТетрагидроксоалюминат натрияГексационоферрат (II) калия НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯNa3[AlF6]Na[Al(OH)4]K4[Fe(CN)6]Гексафтороалюминат натрияТетрагидроксоалюминат натрияГексационоферрат (II) калия](/img/tmb/7/627442/5a6093915414ac25b3ac6032375d22d8-800x.jpg)
![КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4[Ag(NH3)2]Cl[Cr(H2O)6]Cl3 НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4[Ag(NH3)2]Cl[Cr(H2O)6]Cl3](/img/tmb/7/627442/24c5c3bb1c4442970453b41afe88d9bf-800x.jpg)
![КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4Сульфат тетраамминмеди (II)[Ag(NH3)2]ClХлорид диамминсеребраХлорид гексааквахрома (III)[Cr(H2O)6]Cl3 НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ[Cu(NH3)4]SO4Сульфат тетраамминмеди (II)[Ag(NH3)2]ClХлорид диамминсеребраХлорид гексааквахрома (III)[Cr(H2O)6]Cl3](/img/tmb/7/627442/63c5937c54e006ff806aee0bca085d34-800x.jpg)

![КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Ответ: K2[PtCl6]Гексахлороплатинат (IV) калияНитрат хлоронитротетраамминкобальта (III)Гексагидроксохромат (III) натрияСОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВОтвет: [Co(NH3)4(NO3)Cl]NO3Ответ: Na3[Cr(OH)6]Нитрат гексаамминникеля (II)Ответ: [Ni(NH3)6](NO3)2 Ответ: K2[PtCl6]Гексахлороплатинат (IV) калияНитрат хлоронитротетраамминкобальта (III)Гексагидроксохромат (III) натрияСОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВОтвет: [Co(NH3)4(NO3)Cl]NO3Ответ: Na3[Cr(OH)6]Нитрат гексаамминникеля (II)Ответ: [Ni(NH3)6](NO3)2](/img/tmb/7/627442/270f7dcff90fede3d1ef5cb7abfc9c5f-800x.jpg)
![КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙЛабораторный опыт. Получение тетрагидроксоалюмината натрияAlCl3+3NaOH = Al(OH)3↓+3NaClAl(OH)3 + NaOH ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙЛабораторный опыт. Получение тетрагидроксоалюмината натрияAlCl3+3NaOH = Al(OH)3↓+3NaClAl(OH)3 + NaOH = Na[Al(OH)4]Лабораторный опыт. Получение гидроксида тетраамминмеди](/img/tmb/7/627442/22b8c10cec6d3d951166ae6a591db71f-800x.jpg)
![КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ ХИМИЧЕСКИЕ СВОЙСТВА1. Диссоциация[Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42- 2. Реакции по внешней ХИМИЧЕСКИЕ СВОЙСТВА1. Диссоциация[Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42- 2. Реакции по внешней сфереFeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl[Cu(NH3)4]SO4+BaCl2→[Cu(NH3)4]Cl2+BaSO4↓ 3. Реакции с участием лигандов[Cu(NH3)4]SO4+4HCl→4NH4Cl+CuSO44.](/img/tmb/7/627442/295840f4236b9dbd9b44a5c981160352-800x.jpg)




![КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Гидролиз- По катиону:2FeSO4 + 2H2O = [FeOH]2SO4 + H2SO4Fe2+ + OH- Гидролиз- По катиону:2FeSO4 + 2H2O = [FeOH]2SO4 + H2SO4Fe2+ + OH- = FeOH-Кислая среда в раствореПо аниону:KHCO3](/img/tmb/7/627442/c9298680c0764316f6a70bf50eea7f7d-800x.jpg)