Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Контекстные задачи как способ формирования у школьников навыков решения
Содержание
- 1. Контекстные задачи как способ формирования у школьников навыков решения
- 2. Перечень умений и навыков школьников в развитии
- 3. Перечень умений и навыков школьников в развитии
- 4. Основные этапы формирования любого умения: Первый этап:
- 5. Мне нравится использовать контекстные задачи на
- 6. Контекстные задачи, которые я использую
- 7. Контекстные задачи открывают широкие возможности
- 8. Принципы разработки контекстных задач1.Принцип доступности. 2.Принцип актуальности. 3.Принцип учёта возрастных особенностей учащихся.
- 9. Занятие элективного курса в 11 классе по теме: «Применение производных карбоновых кислот»
- 10. Разминка 1.Какая карбоновая кислота находится в
- 11. Слайд 11
- 12. 2.Назовите карбоновую кислоту, которая содержится в жире козьего молока.
- 13. Это капроновая кислота!CH3-(CH2)4-COOH Название «капроновая» эта кислота
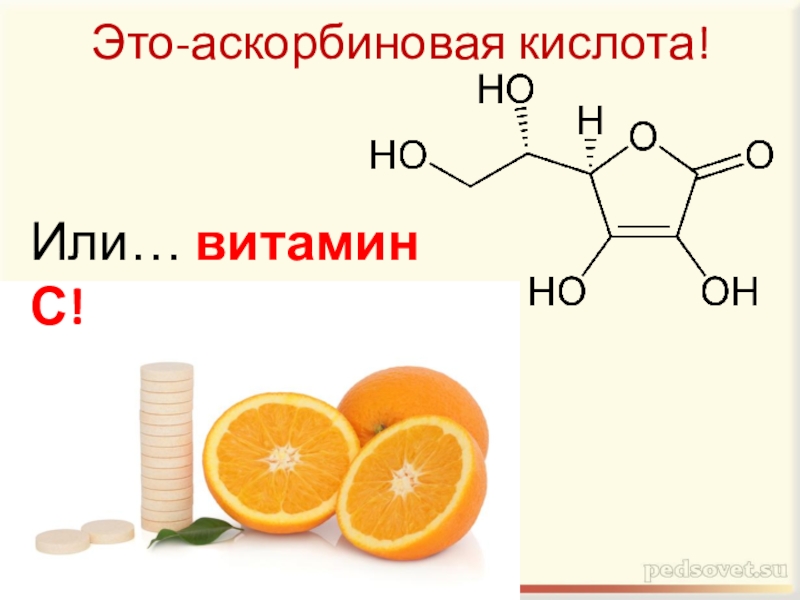
- 14. 3.Какая кислота имеет формулу C6H8O6 и
- 15. Это-аскорбиновая кислота!Или… витамин С!
- 16. 4. В 1714г по указу Петра I
- 17. Это крапива! Кислота-муравьиная (метановая). Используют её:1. как
- 18. 5.Какие функциональные производные карбоновых кислот
- 19. Это- ангидриды карбоновых кислот!КАУЧУКИЛЕКАРСТВАСИНТЕТИЧЕСКИЕ КРАСИТЕЛИ
- 20. Исследование продолжается!Ребята, вы разделены на две группы:
- 21. 3. Решить задачу, выполнив все
- 22. Индивидуальные задания Для группы №1: найти
- 23. Задача №1.Из целлюлозы - основного вещества древесины
- 24. Задания:1. Запишите уравнения реакции получения ангидрида уксусной
- 25. 4. Исследуйте ацетатное волокно на устойчивость к
- 26. 2 часа назад ваш учитель поместила несколько
- 27. Задача №2. Ежедневно миллионы людей пользуются
- 28. По видам мыло
- 29. Задания:Объясните, почему у женщин, изображённых на картине
- 30. 4.Проведите опыт: «Получение нерастворимых солей жирных кислот»4.1.
- 31. ОТВЕТЫ К ЗАДАЧЕ №1.1.Получение уксусного ангидрида:2. Получение
- 32. Ацетатное волокно горит желтым пламенем,
- 33. Ответ 1 группы на индивидуальное задание
- 34. Слайд 34
- 35. Слайд 35
- 36. ОТВЕТЫ К ЗАДАЧЕ №2.1. В горячей воде
- 37. 4. Образуются стеараты кальция (осадок белого цвета)
- 38. Ответ 2 группы на индивидуальное задание
- 39. Слайд 39
- 40. Слайд 40
- 41. Слайд 41
- 42. Слайд 42
- 43. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Контекстные задачи как способ формирования у школьников навыков решения практических
проблем и функциональных умений
Русакова Е.В.
Слайд 2Перечень умений и навыков школьников в развитии естественнонаучной функциональной грамотности
1. Использовать естественнонаучные знания в жизненных ситуациях.
2. Делать выводы, формулировать
ответ в понятной форме.3. Уметь описывать, объяснять и прогнозировать естественнонаучные явления.
4. Уметь интерпретировать научную аргументацию и выводы.
5. Понимать методы научных исследований.
6.Перечислять явления, факты, события.
Слайд 3Перечень умений и навыков школьников в развитии естественнонаучной функциональной грамотности
7.
Сравнивать объекты, события, факты.
8. Объяснять явления, события, факты, анализировать их
и характеризовать.9. Составлять конспект, план и т. д….
Слайд 4Основные этапы формирования любого умения:
Первый этап: ученику предлагается попробовать
сделать то, что он никогда раньше не делал. При этом
приобретается первичный опыт выполнения какого-либо нового действия.Второй этап: формируется новое знание (способ действия) и осуществляется тренировка его в применении.
Третий этап: контролируется правильность применения нового знания и устанавливается его связь с имеющимися знаниями.
Слайд 5 Мне нравится использовать контекстные задачи на уроках и внеурочной
деятельности, которые формируют у школьников навыки решения реальных практических проблем
и функциональных умений, открывают возможности для оценивания уровня развития творческого потенциала личности. Такие задачи отражают реальные ситуации из бытовой, производственной, общественной жизни; при этом основной единицей их содержания является проблемаСлайд 6 Контекстные задачи, которые я использую в своей деятельности,
способствуют формированию у школьников навыков решения практических проблем и функциональных
умений.Слайд 7 Контекстные задачи открывают широкие возможности для оценивания уровня
развития творческого потенциала личности, учат генерировать мысли, работать в команде,
связывать теоретические знания и практическое применение этих знанийСлайд 8Принципы разработки контекстных задач
1.Принцип доступности.
2.Принцип актуальности.
3.Принцип
учёта возрастных особенностей учащихся.
Слайд 10Разминка
1.Какая карбоновая кислота находится в сливочном масле в
виде сложного эфира с глицерином, выделяется в свободном виде при
«прогоркании» масла, обладает резким запахом и неприятна на вкус?Слайд 11 Это масляная
кислота!
CH3-(CH2)2-COOH
Название по международной систематической номенклатуре - бутановая кислота.
Слайд 13Это капроновая кислота!
CH3-(CH2)4-COOH Название «капроновая» эта кислота получила от латинского
слова «Capra» – коза. Название по международной систематической номенклатуре -
гексановая кислота.Слайд 14 3.Какая кислота имеет формулу C6H8O6 и является водорастворимым витамином,
участвующим в биохимических окислительно-восстановительных процессах человеческого организма? Что это за
витамин?Слайд 164. В 1714г по указу Петра I в Петербурге был
заложен аптекарский сад. Там выращивали лекарственные растения. Листья одного из
таких растений, помещённые в молоко, предохраняют его от скисания. Из его корней можно получить жёлтый краситель, а из волокон-сети, не гниющие в воде. Листья используются для приготовления здоровой и полезной пищи. Личный опыт с этим растением способен довести до слёз. Кислоту, содержащуюся в этом растении, также входит состав жгучих выделений муравьёв, пчёл, медуз. Что это за растение? Что это за кислота? Где её используют?Слайд 17Это крапива! Кислота-муравьиная (метановая). Используют её:
1. как пищевая добавка-консервант E236;
2.как
антиобледенитель;
3. при дублении/выделке
натуральных кож и изделий из них;
4.как протравливающий
агент при финишном окрашивании тканей в текстильной промышленности;6. в техпроцессах производства различных резин в качестве коагулянта.
HCOOH
Слайд 18 5.Какие функциональные производные карбоновых кислот являются ацилирующими агентами
и применяются для получения ацетил-целлюлозы, винилацетата, красителей, лекарств, синтетических полимеров,
карбоксилатных каучуков?Слайд 20Исследование продолжается!
Ребята, вы разделены на две группы: группа №1 и
группа №2. Вам необходимо:
Выбрать руководителя группы (у вас 10 секунд).
Выбрать
представителя группы, который будет искать информацию в Интернете для всей группы согласно индивидуальному заданию (у вас 10 секунд). 3. Распределить обязанности в группе: кто будет записывать уравнения химических
реакций на доске, кто будет отвечать на
вопросы задачи перед всеми участниками
и кто будет проводить эксперимент и демонстрировать его результаты ( у вас 30 секунд).
Слайд 21 3. Решить задачу, выполнив все задания к ней.
(у вас на это будет 10 минут).
4. Записать
уравнения соответствующих реакций на доске.5. Продемонстрировать результаты эксперимента и прокомментировать их.
6. Ответить на все вопросы задачи.
7. Заслушать информацию по индиви-
дуальным заданиям.
5. Проанализировать правильность
своих ответов и оценить свою работу.
Слайд 22Индивидуальные задания
Для группы №1: найти в сети Интернет
информацию «История возникновения химических волокон. Полиэфирные волокна»
Для группы
№2: найти в сети Интернет информацию о применении нитрилов
и амидов как производных
карбоновых кислот.
Ответы запишите в программе
Microsoft Word. (используйте картинки)
Слайд 23Задача №1.
Из целлюлозы - основного вещества древесины - получают бумагу,
пироксилин(взрывчатое вещество для производства бездымного пороха), негорючую плёнку, органическое стекло,
пластики, красители и ацетатные волокона, из которых ткут мягкую, эластичную ткань – искусственный шёлк. Он мало сминается и пропускает ультрафиолетовые лучи. Ацетатные волокна – сложные эфиры уксусной кислоты и целлюлозы – трёхатомного спирта:C6H7O2
ОН
ОН
ОН
n
Остатки β - глюкозы
Слайд 24Задания:
1. Запишите уравнения реакции получения ангидрида уксусной кислоты.
2. Запишите
уравнения реакции взаимодействия целлюлозы с уксусным ангидридом с образованием диацетилцеллюлозы
для производства ацетатного волокна и негорючей кино- и рентген - пленок )3. Запишите уравнения реакции взаимодействия целлюлозы с уксусным ангидридом с образованием триацетилцеллюлозы ( для получения прочных пластмасс, красителей, электроизоляционных пленок лаков и т.д.)
Слайд 254. Исследуйте ацетатное волокно на устойчивость к растворам кислот и
щелочей и характер горения:
4.1. Повторите правила безопасной работы в кабинете
химии (см. таблицу на столе)4.2. Закрепите в держателе пробирок несколько ацетатных волокон и исследуйте а) скорость горения, запах продуктов горения, какой характер имеет остаток после сгорания.
4.2. Проанализируйте действие конц. растворов кислот и щелочей на волокно:
Слайд 262 часа назад ваш учитель поместила несколько волокон в пробирку
№1 с концентрированным раствором серной кислоты и несколько волокон в
пробирку №2 с концентрированным раствором щёлочи. Отметьте наличие(отсутствие) изменений. Соблюдайте технику безопасности!Запишите уравнения реакций на доске.
Слайд 27Задача №2.
Ежедневно миллионы людей пользуются мылом, ставшим необходимым
атрибутом жизни современного человека. Мыло было «изобретено» в Вавилоне приблизительно
шесть тысяч лет назад, но кем и когда – точно неизвестно.Слайд 28 По видам мыло бывает глицериновое, детское,
жидкое туалетное, кусковое, лечебно-косметическое, прозрачное, твердое туалетное, хозяйственное. Считается, что
лучший антисептик – это хозяйственное мыло. Мыла- смеси растворимых (натриевых, калиевых, аммонийных) солей высших карбоновых кислот. Пример состава мыла:C17H35COONa
(СТЕАРАТ НАТРИЯ)
Слайд 29Задания:
Объясните, почему у женщин, изображённых на картине французского художника Жана
Франсуа Милле «Прачки», - красные руки?
Напишите уравнение реакции гидролиза
мыла, предположив, что прачки пользовались твёрдым, натриевым, мылом.3. Ответить на вопрос:
в чем преимущества
использования
синтетических
моющих средств
по сравнению с мылом?
Слайд 304.Проведите опыт: «Получение нерастворимых солей жирных кислот»
4.1. Повторите правила безопасной
работы в кабинете химии (см. таблицу на столе)
4.2. В пробирку
поместите кусочек твердого мыла, прилейте к нему 8–10 мл дистиллированной воды, взболтайте и подогрейте полученный раствор. Разделите раствор по двум пробиркам, добавьте в первую – раствор хлорида кальция, во вторую – раствор сульфата меди.4.3. Объясните изменения, происходящие в каждой пробирке.
Соблюдайте технику безопасности!
Запишите уравнения реакций на доске.
Слайд 31ОТВЕТЫ К ЗАДАЧЕ №1.
1.Получение
уксусного ангидрида:
2. Получение
диацетилцеллюлозы:
3. Получение
триацетилцеллюлозы:
4. Ацетатное волокно растворяется в концентрированном
растворе серной кислоты и
плохо растворяется в растворе щёлочи. Здесь оно омыляется, приобретая
жёлтый оттенок.
Слайд 32 Ацетатное волокно горит желтым пламенем, распространяя специфический кисловатый
запах и образуя наплыв темного цвета, который после охлаждения легко
раздавливается пальцами. Если пламя погасить, то волокно медленно тлеет с выделением струйки дыма.Слайд 34
Полиэфирные волокна
Полиэфи́ры (или полиэ́стеры) — высокомолекулярные соединения, получаемые поликонденсацией многоосновных кислот или их ангидридов с многоатомными спиртами. Известны природные (янтарь, древесная смола, шеллак и др.) и искусственные полиэфиры. Практическое применение получили глифталевые смолы, полиэтилентерефталат, полиэфирмалеинаты и полиэфиракрилаты.
полиэфирные волокна - синтетические волокна, формуемые из расплава полиэтилентерефталата. К полиэфирным волокнам относится лавсан. Превосходят по термостойкости большинство натуральных и химических волокон: при 180°С они сохраняют прочность на 50%. Полиэфирные волокна сравнительно атмосферостойки. Полиэфирные волокна устойчивы к действию ацетона, четырёххлористого углерода, дихлорэтана и др. растворителей, микроорганизмов, моли, плесени, коврового жучка.
Слайд 36ОТВЕТЫ К ЗАДАЧЕ №2.
1. В горячей воде происходит гидролиз солей
карбоновых кислот с образованием щёлочи, которая и раздражает руки.
2. Гидролиз
стеарата натрия:Преимущества синтетически моющих средств:
они не теряют своей моющей способности
даже в жесткой и морской водах, так как их
кальциевые и магниевые соли растворимы.
Также, среда их водных растворов-нейтральна
(в отличие от растворов мыла - щелочной)
3.
Слайд 374. Образуются стеараты кальция (осадок белого цвета) и меди (бирюзово-зелёного
цвета):
2С17Н35COONa+CaCl2 (С17Н35COO)2Са+2NaCl
2С17Н35COONa+CuCl2
(С17Н35COO)2Cu+2NaClСТЕАРАТ КАЛЬЦИЯ
СТЕАРАТ МЕДИ