Слайд 1Л-5-Адд. Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры)
Дополнительная
Дрюк, В. Г.
Курс органической химии / В.Г. Дрюк, М.С. Малиновский.— К.: Вища
шк. Головное изд-во, 1987.— 400 с.
Травень, В.Ф. Органическая химия: Учебник для вузов: В 2 т. / В.Ф. Травень. — М.: ИКЦ «Академкнига», 2004. - Т. 1. - 2004. - 727 с.
Литература
Основная
1. Тюкавкина, Н.А. Биоорганическая химия: Учебник для вузов / Н.А. Тю-кавкина, Ю.И. Бауков. — М: Дрофа, 2004. — 544 с.
2. Травень В.Ф. Органическая химия: Учебник для вузов: В 2 т. / В.Ф. Травень. - М: ИКЦ «Академкнига», 2006. - Т. 2. - 2006. - 582 с.
Вопросы
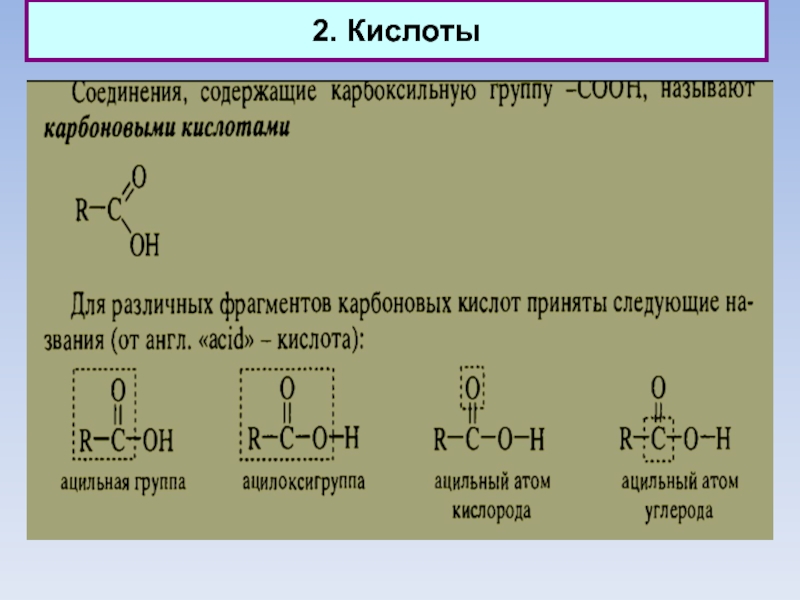
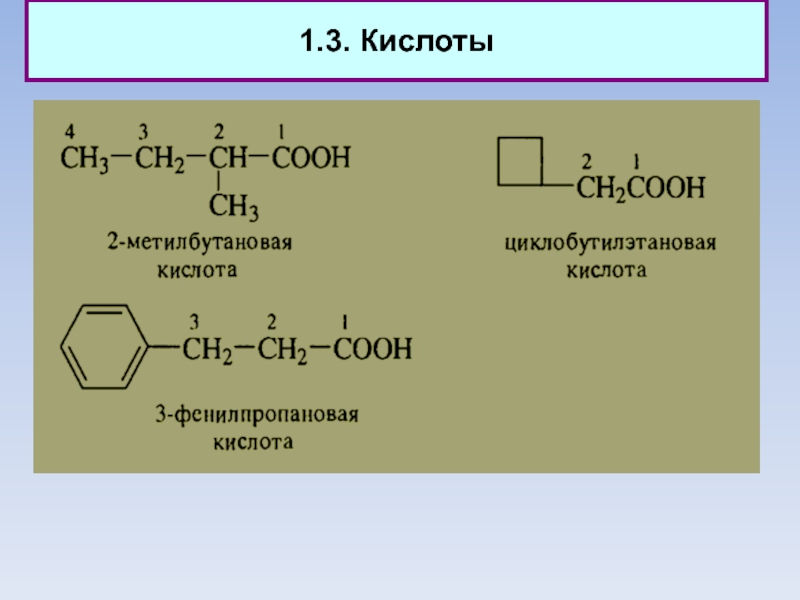
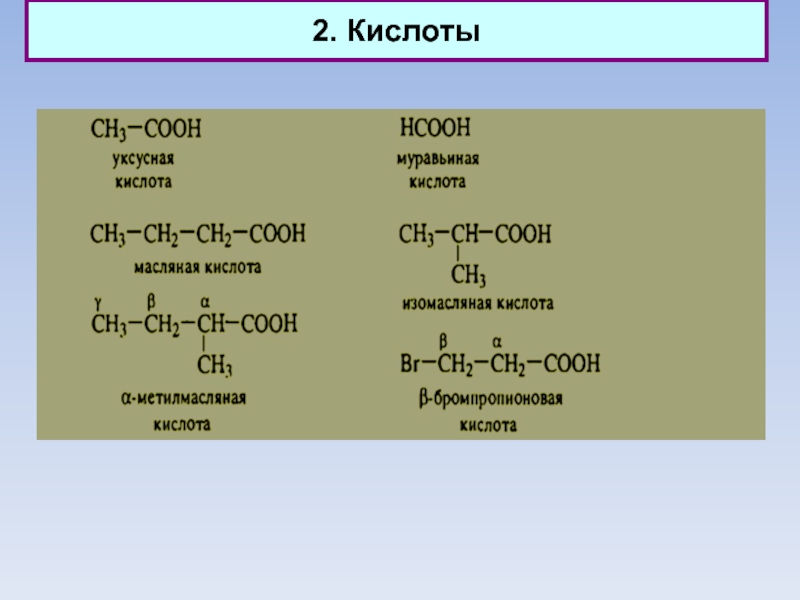
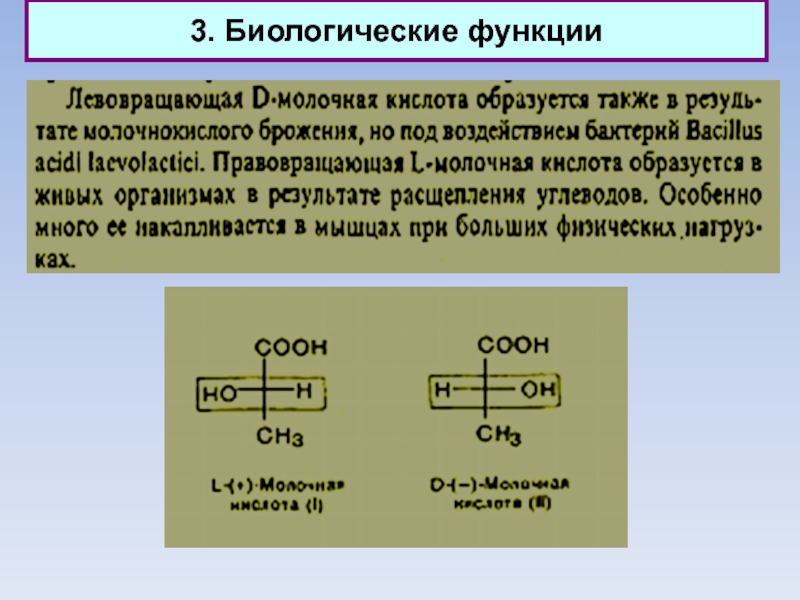
1. Альдегиды, кетоны, кетены. Кислоты. Эфиры
2. Биологические функции карбонильных соединений
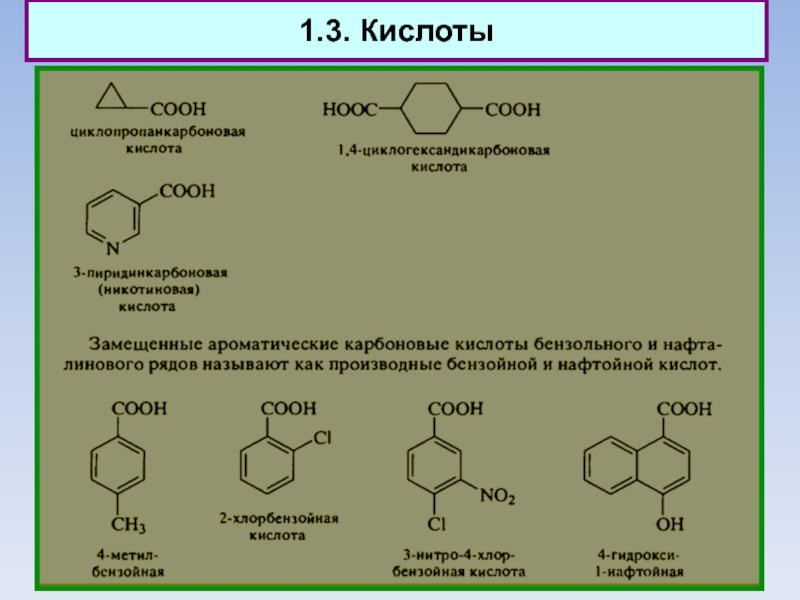
3. Ароматические соединения
4. Биологические функции циклических углеводородов
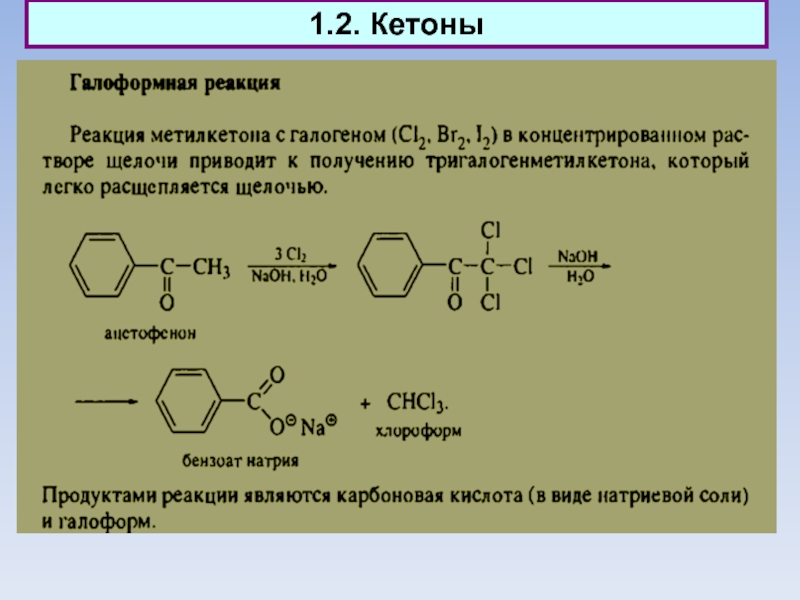
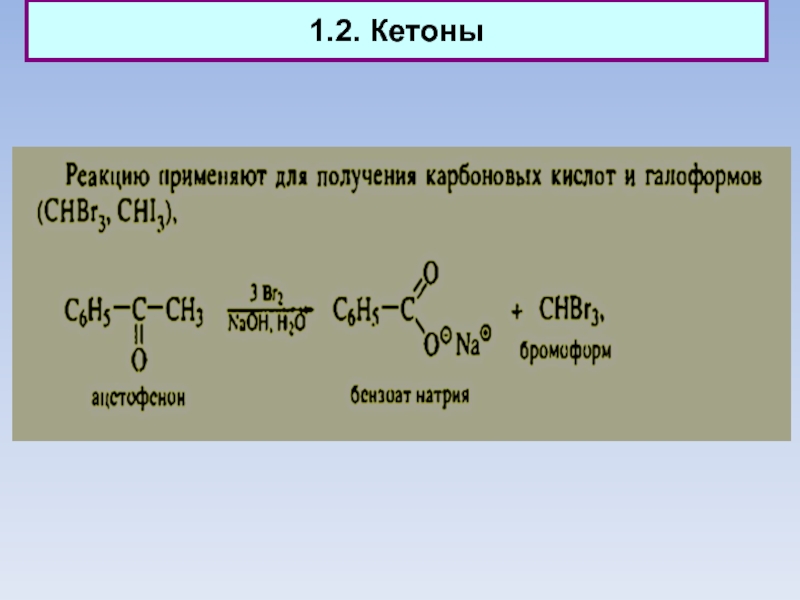
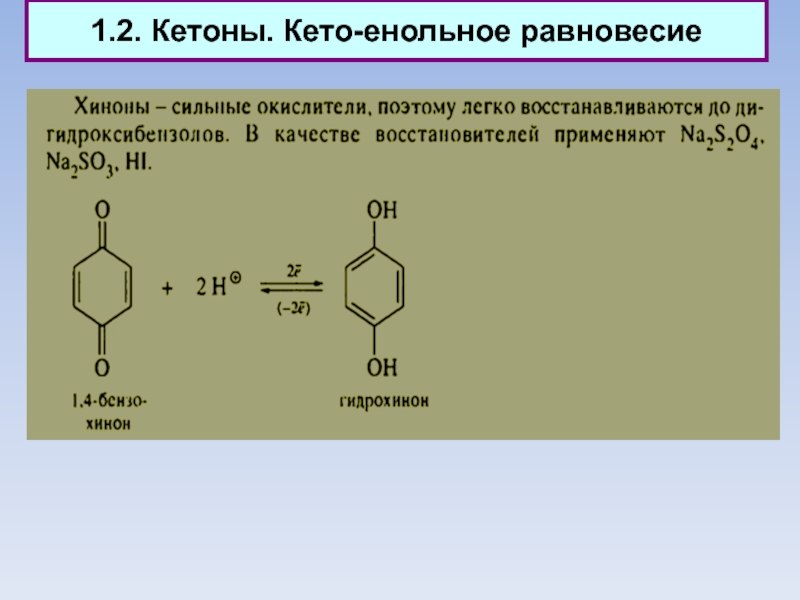
Слайд 101.2. Кетоны. Кето-енольное равновесие
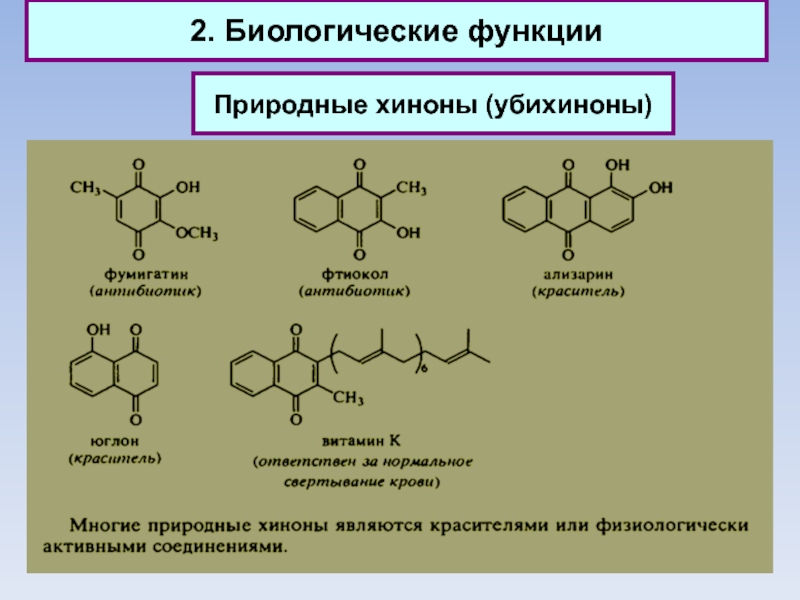
Слайд 342. Биологические функции
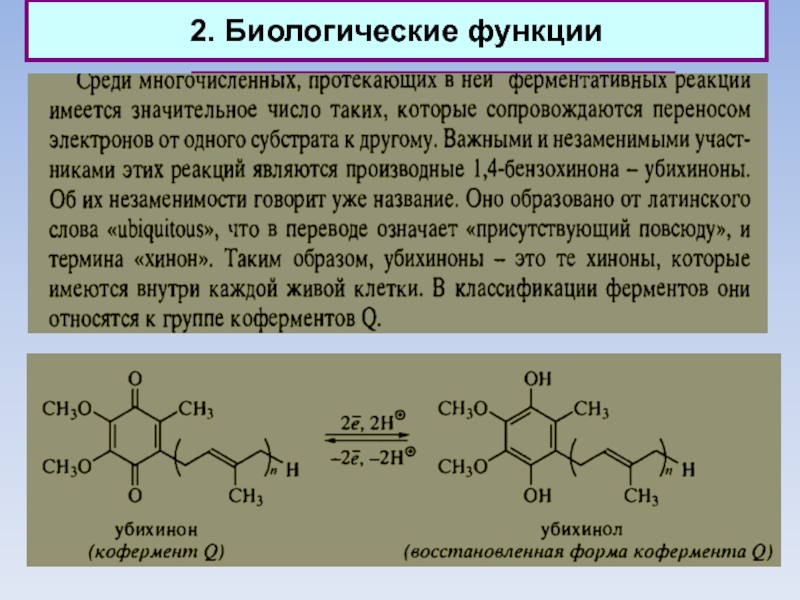
Природные хиноны (убихиноны)
Слайд 352. Биологические функции
Природные хиноны (убихиноны)
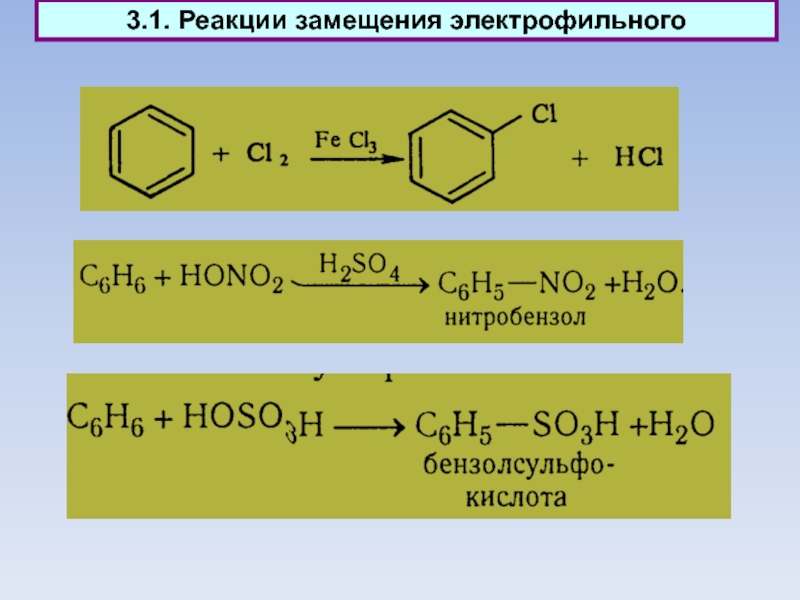
Слайд 423. Ароматические соединения
Химические свойства
Плоская структура бензола определяет многие его особенности.
В последнее время выявлено исключительно сильное влияние на свойства производных
бензола положения заместителей в пространстве по отношению к кольцу.
Заместители только тогда влияют на свойства кольца, когда они находятся с ним в одной плоскости и, следовательно, не нарушается их сопряжение с бензольным кольцом.
Слайд 433.1. Реакции замещения электрофильного
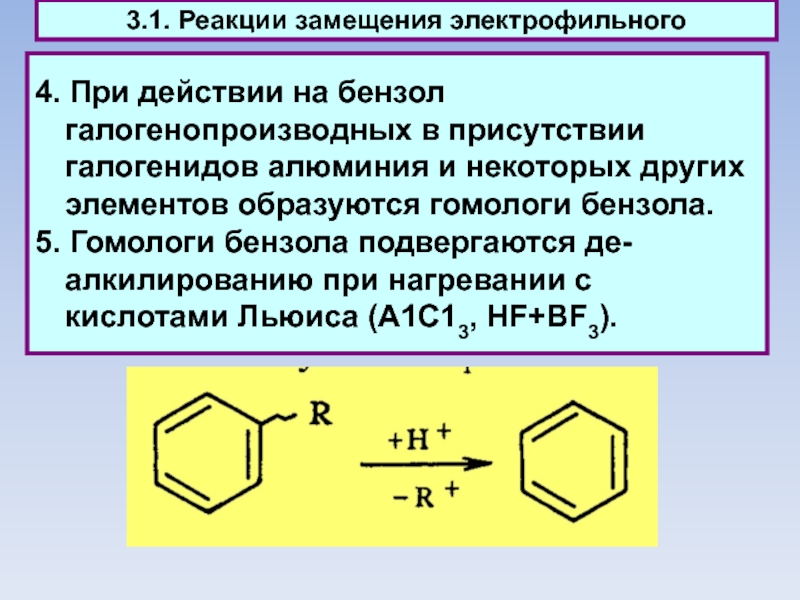
Слайд 444. При действии на бензол галогенопроизводных в присутствии галогенидов алюминия
и некоторых других элементов образуются гомологи бензола.
5. Гомологи бензола
подвергаются де-алкилированию при нагревании с кислотами Льюиса (А1С13, HF+BF3).
3.1. Реакции замещения электрофильного
Слайд 456. Бензол реагирует с три-фтор-ацетатом таллия в трифторуксусной кислоте с
образованием фенил-таллий-три-фтор-ацетата, который с успехом используется для синтеза ароматических соединений
различных классов:
3.1. Реакции замещения электрофильного
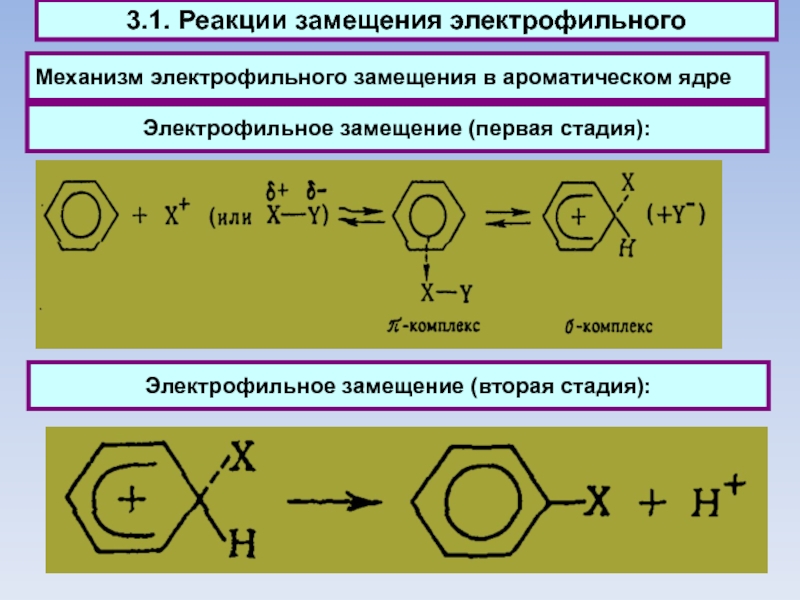
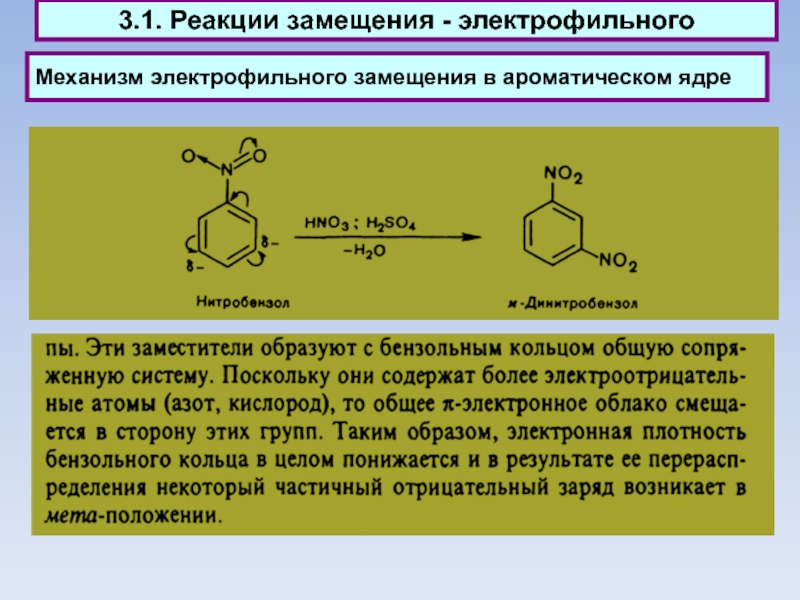
Слайд 46Механизм электрофильного замещения в ароматическом ядре
3.1. Реакции замещения электрофильного
Электрофильное
замещение (вторая стадия):
Электрофильное замещение (первая стадия):
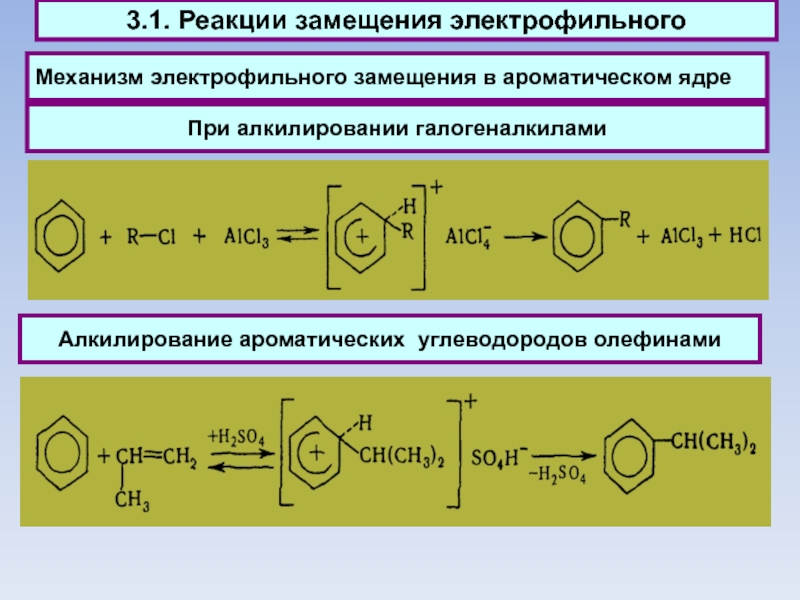
Слайд 47Механизм электрофильного замещения в ароматическом ядре
3.1. Реакции замещения электрофильного
Алкилирование
ароматических углеводородов олефинами
При алкилировании галогеналкилами
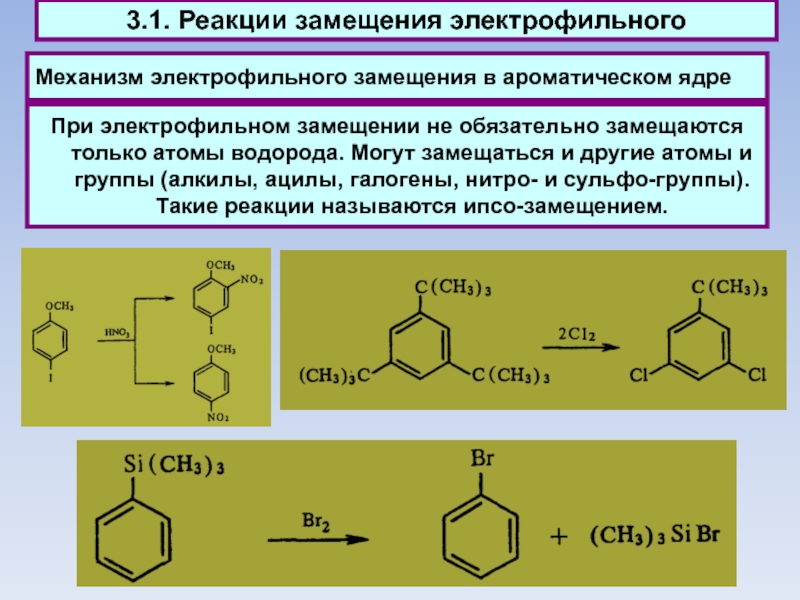
Слайд 48Механизм электрофильного замещения в ароматическом ядре
3.1. Реакции замещения электрофильного
При
электрофильном замещении не обязательно замещаются только атомы водорода. Могут замещаться
и другие атомы и группы (алкилы, ацилы, галогены, нитро- и сульфо-группы). Такие реакции называются ипсо-замещением.
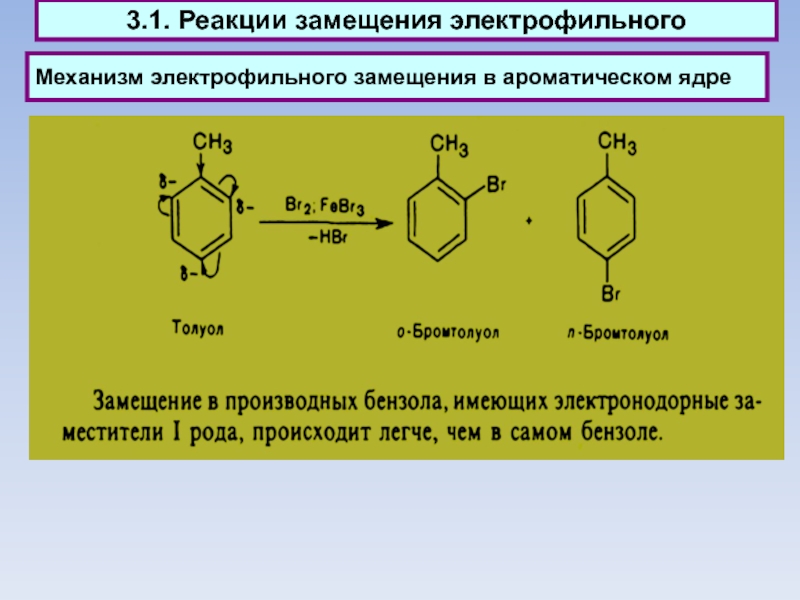
Слайд 49Механизм электрофильного замещения в ароматическом ядре
3.1. Реакции замещения электрофильного
Слайд 50Механизм электрофильного замещения в ароматическом ядре
3.1. Реакции замещения электрофильного
Слайд 51Механизм электрофильного замещения в ароматическом ядре
3.1. Реакции замещения -
электрофильного
Слайд 52Механизм электрофильного замещения в ароматическом ядре
3.1. Реакции замещения -
электрофильного
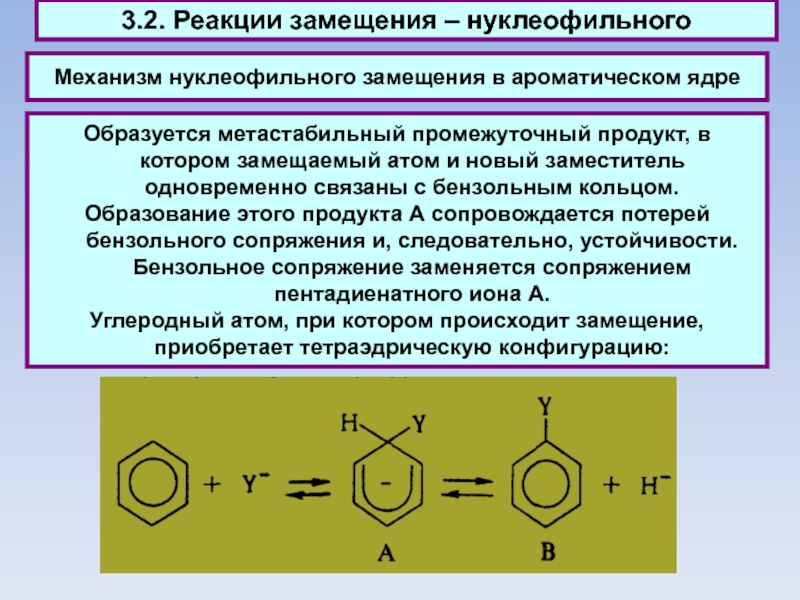
Слайд 53Механизм нуклеофильного замещения в ароматическом ядре
3.2. Реакции замещения –
нуклеофильного
Образуется метастабильный промежуточный продукт, в котором замещаемый атом и новый
заместитель одновременно связаны с бензольным кольцом.
Образование этого продукта А сопровождается потерей бензольного сопряжения и, следовательно, устойчивости. Бензольное сопряжение заменяется сопряжением пентадиенатного иона А.
Углеродный атом, при котором происходит замещение, приобретает тетраэдрическую конфигурацию:
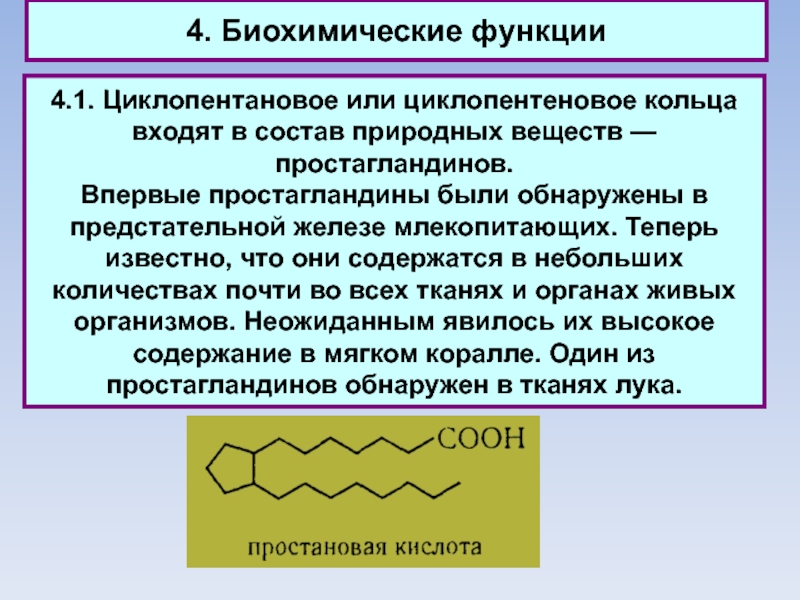
Слайд 544. Биохимические функции
4.1. Циклопентановое или циклопентеновое кольца входят в состав
природных веществ — простагландинов.
Впервые простагландины были обнаружены в предстательной
железе млекопитающих. Теперь известно, что они содержатся в небольших количествах почти во всех тканях и органах живых организмов. Неожиданным явилось их высокое содержание в мягком коралле. Один из простагландинов обнаружен в тканях лука.
Слайд 554. Биохимические функции
4.1. Простагландины являются регуляторами функций клетки и обладают
гормональной активностью.
В отличие от гормонов они синтезируются в организмах
не в специальных железах, а непосредственно в клетках. Выделено около 20 простагландинов - они стимулируют сокращение гладких мышц, понижают кровяное давление и проявляют иные виды терапевтического действия, причём в ничтожных концентрациях.
Простагландины получили широкое применение в медицине, ветеринарии, растениеводстве.
Так, например, простагландин Е1 применяется при лечении бронхиальной астмы.
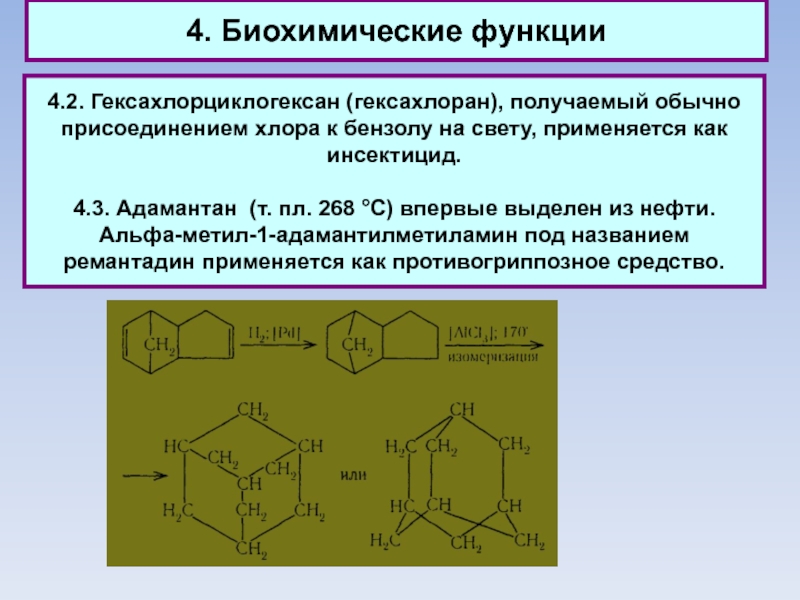
Слайд 564. Биохимические функции
4.2. Гексахлорциклогексан (гексахлоран), получаемый обычно присоединением хлора к
бензолу на свету, применяется как инсектицид.
4.3. Адамантан (т. пл. 268
°С) впервые выделен из нефти.
Альфа-метил-1-адамантилметиламин под названием ремантадин применяется как противогриппозное средство.
Слайд 574. Биохимические функции
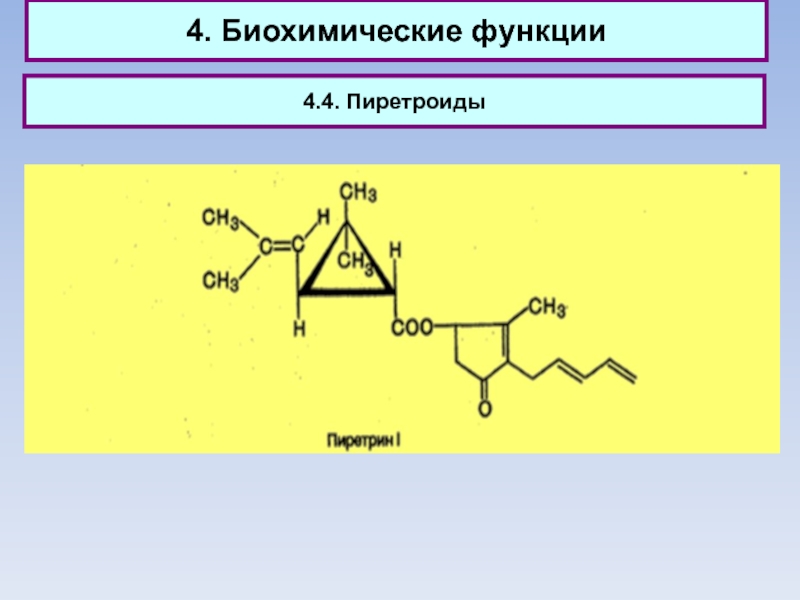
4.4. Пиретроиды
Слайд 584. Биохимические функции
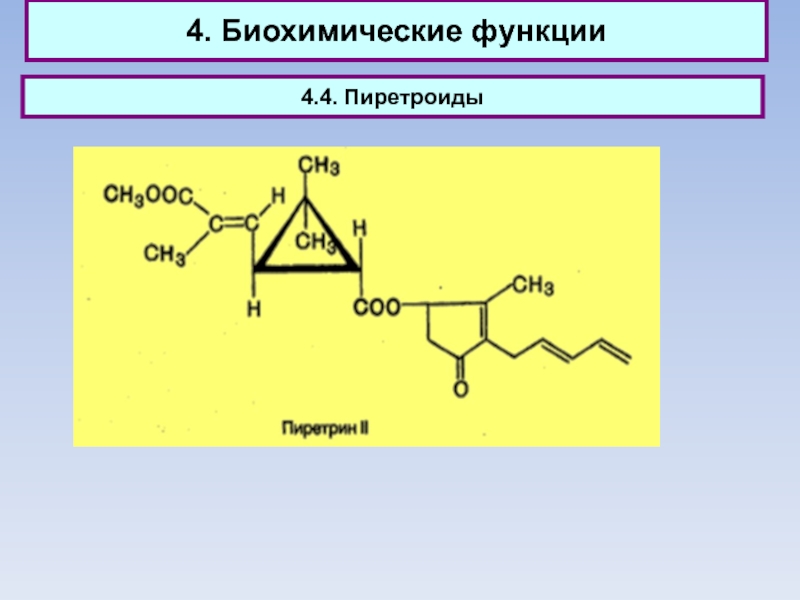
4.4. Пиретроиды
Слайд 594. Биохимические функции
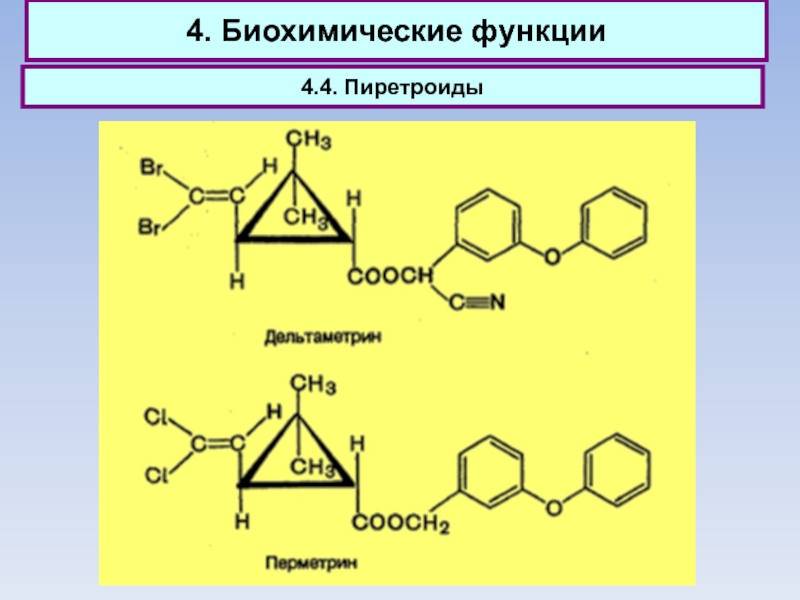
4.4. Пиретроиды
Слайд 604. Биохимические функции
4.4. Пиретроиды
Слайд 614. Биохимические функции
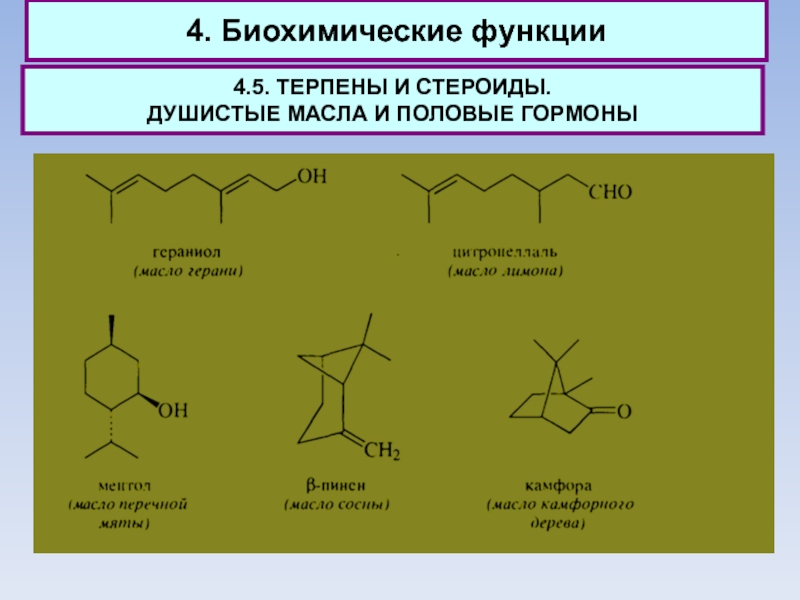
4.5. ТЕРПЕНЫ И СТЕРОИДЫ.
ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ
ГОРМОНЫ
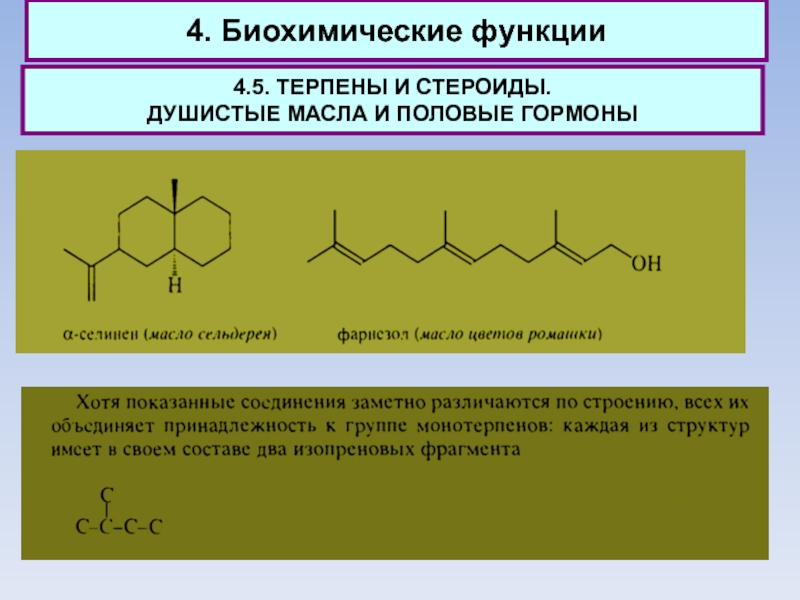
Количество компонентов, образующих душистое масло, весьма велико, однако большая часть
из них относится к группе терпенов.
К группе монотерпенов относят энантиомеры карвопа.
Наиболее ценные по запаху монотерпены получили значительное применение для изготовления косметических средств. Монотерпены - простейшие терпеноиды, встречающиеся в природе.
Соединения С15, содержащие три изопреновых фрагмента, относят к группе сесквитерпенов.
Слайд 624. Биохимические функции
4.5. ТЕРПЕНЫ И СТЕРОИДЫ.
ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ
ГОРМОНЫ
Слайд 634. Биохимические функции
4.5. ТЕРПЕНЫ И СТЕРОИДЫ.
ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ
ГОРМОНЫ
Слайд 644. Биохимические функции
4.5. ТЕРПЕНЫ И СТЕРОИДЫ.
ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ
ГОРМОНЫ
Слайд 654. Биохимические функции
4.5. ТЕРПЕНЫ И СТЕРОИДЫ.
ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ
ГОРМОНЫ
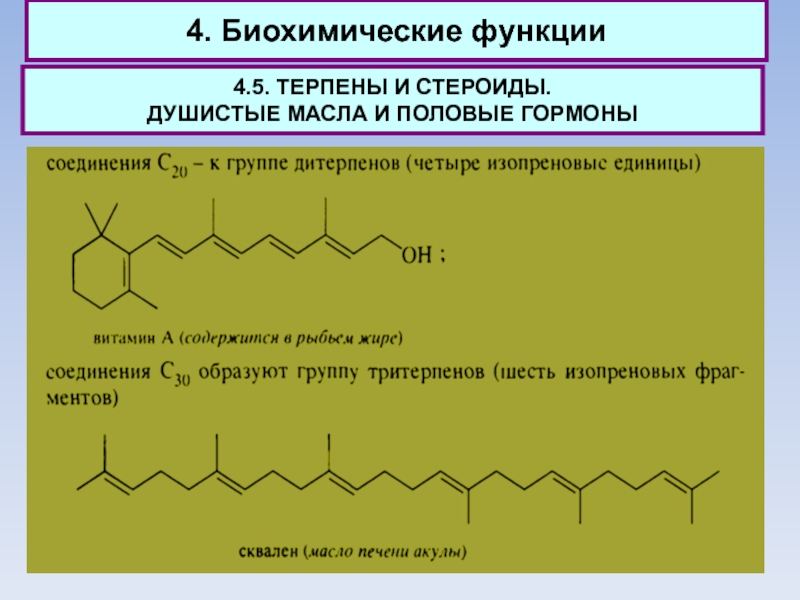
Все названные терпеноиды являются природными соединениями растительного или животного происхождения.
Общими чертами обладают не только структуры терпенов, поскольку они построены из одних и тех же изопреновых фрагментов С5. Терпены имеют общие биохимические пути синтеза.
Важно при этом, что первые стадии биосинтеза терпенов лежат в основе синтеза еще одной многочисленной группы природных соединений - стероидов.
Слайд 664. Биохимические функции
4.5. ТЕРПЕНЫ И СТЕРОИДЫ.
ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ
ГОРМОНЫ
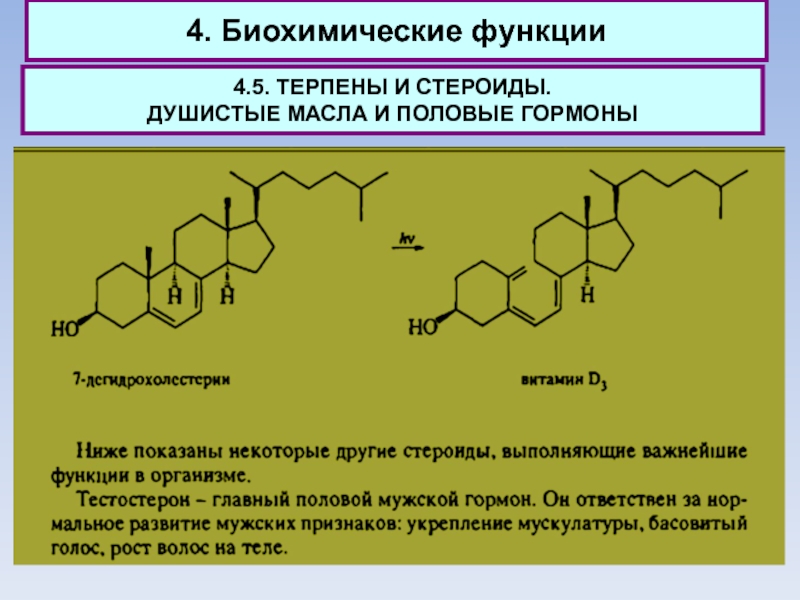
В наибольшем количестве в организме человека присутствует холестерин: ~200 г
этого стероида содержится во взрослом организме. Именно холестерин является источником других стероидов, участвующих в различных биохимических процессах. При его ферментативном окислении образуется 7-дегидрохолестерин, из которого при облучении солнечным светом образуется витамин D3, препятствующий развитию рахита у детей.
Слайд 674. Биохимические функции
4.5. ТЕРПЕНЫ И СТЕРОИДЫ.
ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ
ГОРМОНЫ
Слайд 684. Биохимические функции
4.5. ТЕРПЕНЫ И СТЕРОИДЫ.
ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ
ГОРМОНЫ
Слайд 694. Биохимические функции
4.5. ТЕРПЕНЫ И СТЕРОИДЫ.
ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ
ГОРМОНЫ
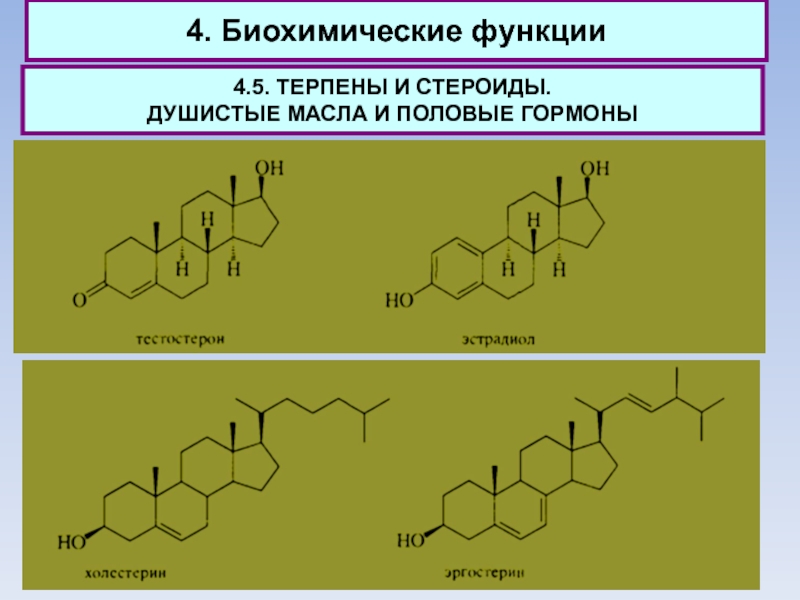
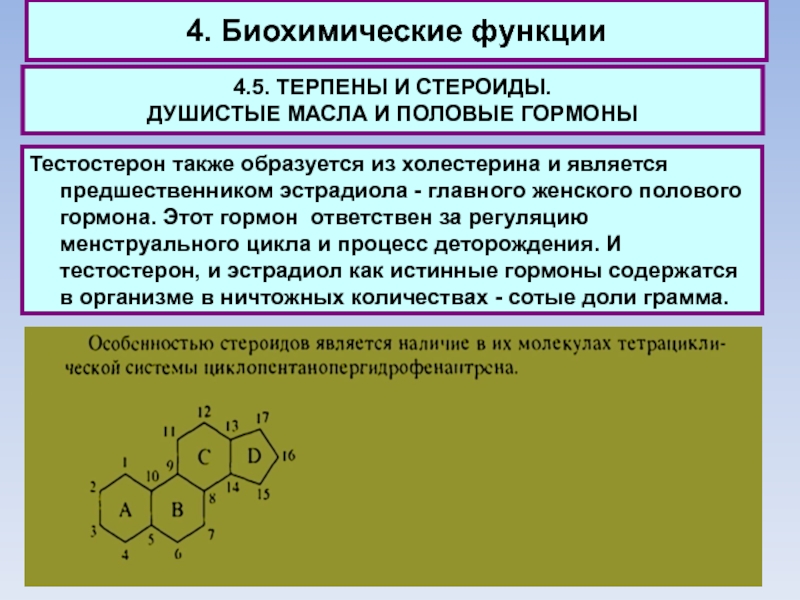
Тестостерон также образуется из холестерина и является предшественником эстрадиола -
главного женского полового гормона. Этот гормон ответствен за регуляцию менструального цикла и процесс деторождения. И тестостерон, и эстрадиол как истинные гормоны содержатся в организме в ничтожных количествах - сотые доли грамма.
Слайд 704. Биохимические функции
4.5. ТЕРПЕНЫ И СТЕРОИДЫ.
ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ
ГОРМОНЫ
Подчеркивая несомненную ценность холестерина для организма человека, надо отметить и
связанные с ним проблемы. Избыток холестерина ведет к серьезному заболеванию - атеросклерозу, поскольку именно этот стероид является основным материалом бляшек, образующихся на стенках артерий и препятствующих нормальному кровообращению.
Неудивительно, что столь популярной стала диета, обеднённая холестерином. Соблюдая эту диету, не следует, однако, забывать, что вредным может быть только избыток холестерина.
Слайд 714. Биохимические функции
4.5. ТЕРПЕНЫ И СТЕРОИДЫ.
ДУШИСТЫЕ МАСЛА И ПОЛОВЫЕ
ГОРМОНЫ
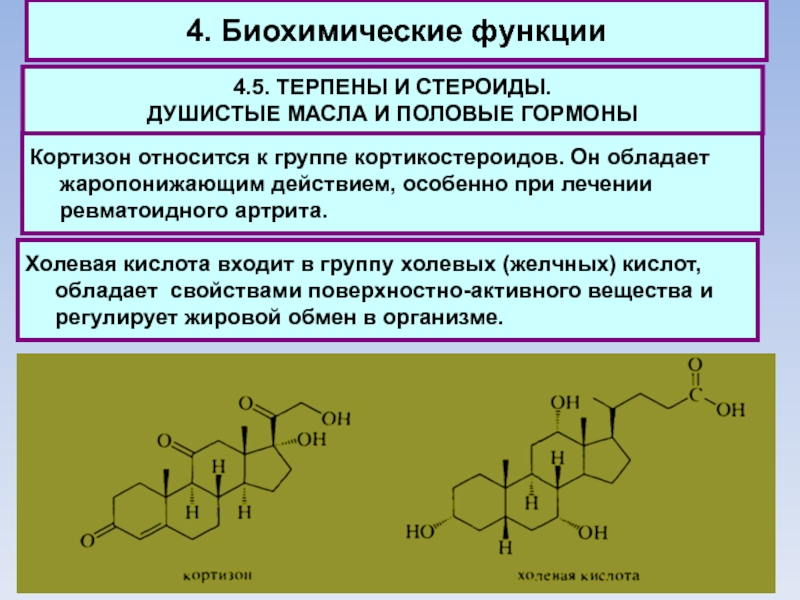
Кортизон относится к группе кортикостероидов. Он обладает жаропонижающим действием, особенно
при лечении ревматоидного артрита.
Холевая кислота входит в группу холевых (желчных) кислот, обладает свойствами поверхностно-активного вещества и регулирует жировой обмен в организме.
Слайд 724. Биохимические функции
4.6. ГАЛОГЕНУГЛЕВОДОРОДЫ В ОКРУЖАЮЩЕЙ СРЕДЕ
Галогенпроизводные углеводородов с большим
трудом подвергаются в природе каким-либо превращениям и создают поэтому значительные
экологические проблемы.
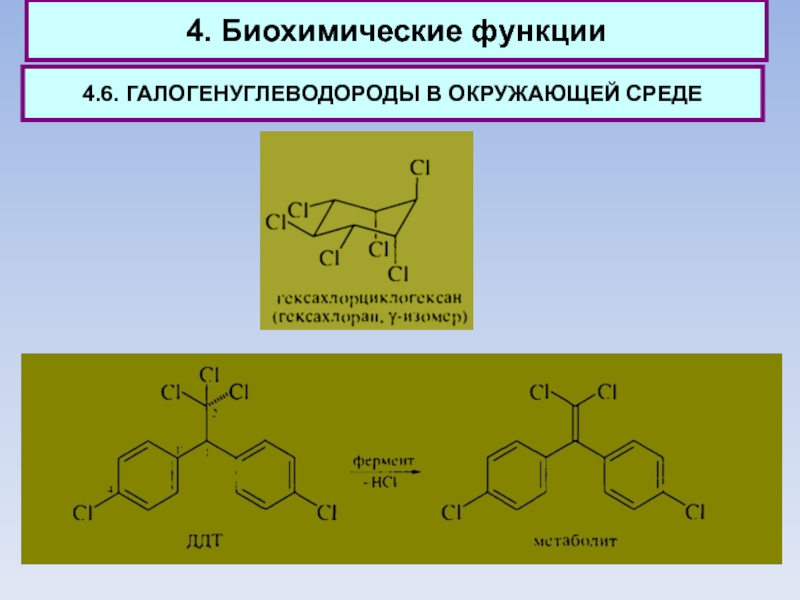
В последние годы применение гексахлорана запрещено. Он устойчив в физиологических условиях, способен накапливаться в живом организме и является весьма токсичным.
По тем же причинам запрещено применение 1,1-ди(4'-хлорфенил)-2,2,2- трихлорэтана (ДДТ).
Слайд 734. Биохимические функции
4.6. ГАЛОГЕНУГЛЕВОДОРОДЫ В ОКРУЖАЮЩЕЙ СРЕДЕ
Слайд 754. Биохимические функции
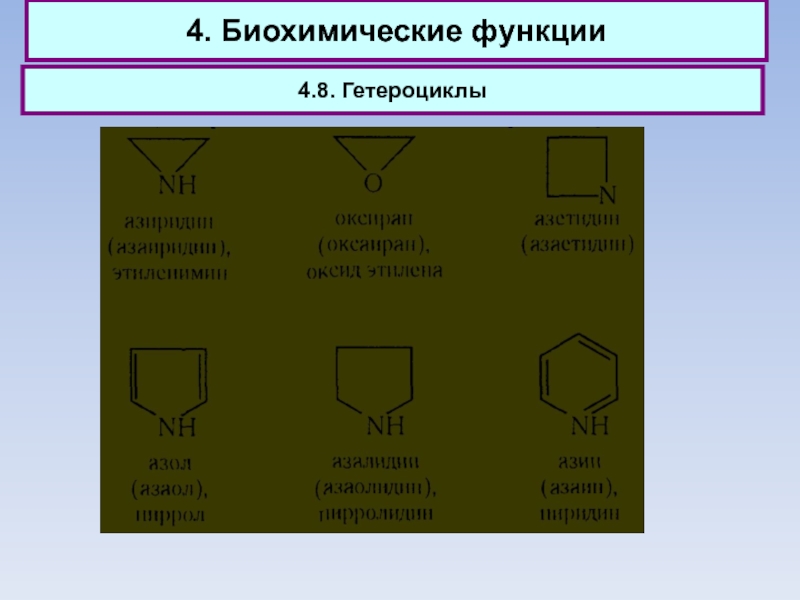
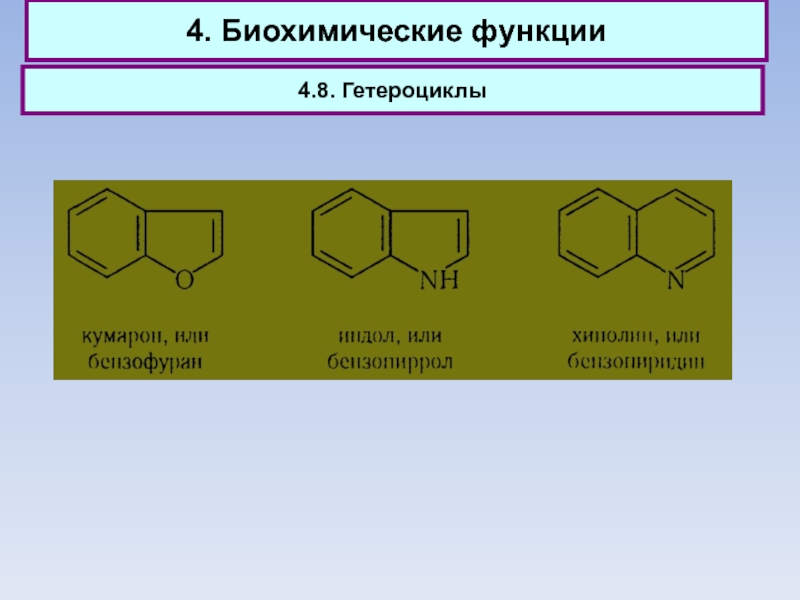
4.8. Гетероциклы
Слайд 764. Биохимические функции
4.8. Гетероциклы
Слайд 774. Биохимические функции
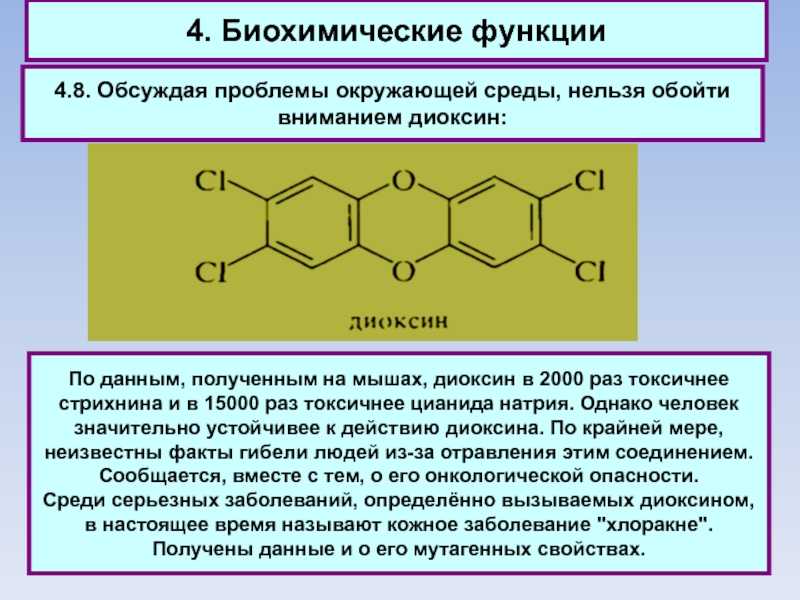
4.8. Обсуждая проблемы окружающей среды, нельзя обойти вниманием
диоксин:
По данным, полученным на мышах, диоксин в 2000 раз токсичнее
стрихнина и в 15000 раз токсичнее цианида натрия. Однако человек значительно устойчивее к действию диоксина. По крайней мере, неизвестны факты гибели людей из-за отравления этим соединением. Сообщается, вместе с тем, о его онкологической опасности.
Среди серьезных заболеваний, определённо вызываемых диоксином, в настоящее время называют кожное заболевание "хлоракне". Получены данные и о его мутагенных свойствах.
Слайд 784. Биохимические функции
4.8. Гетероциклы
Фуран, тиофен и пиррол — бесцветные жидкости,
практически нерастворимые в воде. Температура их кипения значительно выше, чем
у соответствующих им по числу углеродных атомов соединений жирного ряда (имеются в виду эфиры, сульфиды и амины), а дипольные моменты ниже.
Из производных фурана наиболее важным соединением является альдегид фурфурол. В промышленных масштабах фурфурол получают в качестве побочного продукта при кислотном гидролизе древесины и пентозансодержащих отходов сельского хозяйства, главным образом кукурузных кочерыжек, подсолнечной лузги, соломы и т.д.
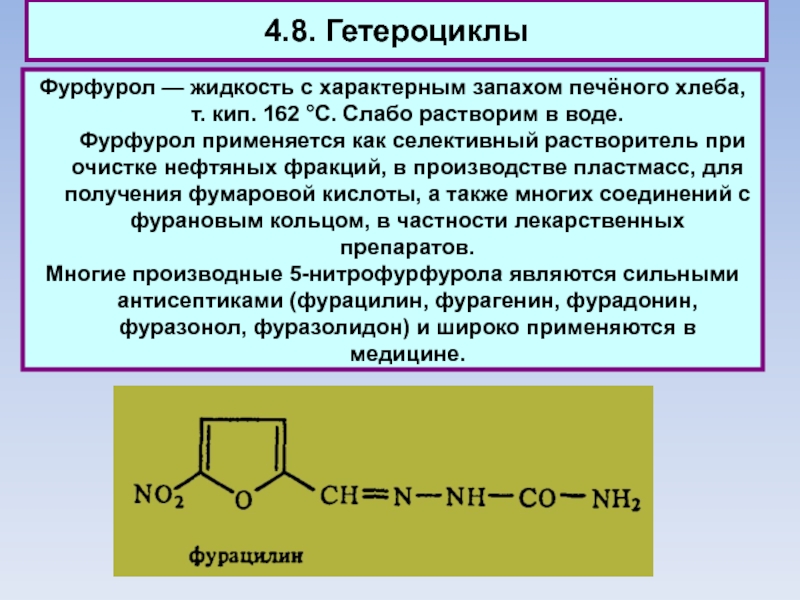
Слайд 794.8. Гетероциклы
Фурфурол — жидкость с характерным запахом печёного хлеба, т.
кип. 162 °С. Слабо растворим в воде.
Фурфурол применяется как селективный
растворитель при очистке нефтяных фракций, в производстве пластмасс, для получения фумаровой кислоты, а также многих соединений с фурановым кольцом, в частности лекарственных препаратов.
Многие производные 5-нитрофурфурола являются сильными антисептиками (фурацилин, фурагенин, фурадонин, фуразонол, фуразолидон) и широко применяются в медицине.
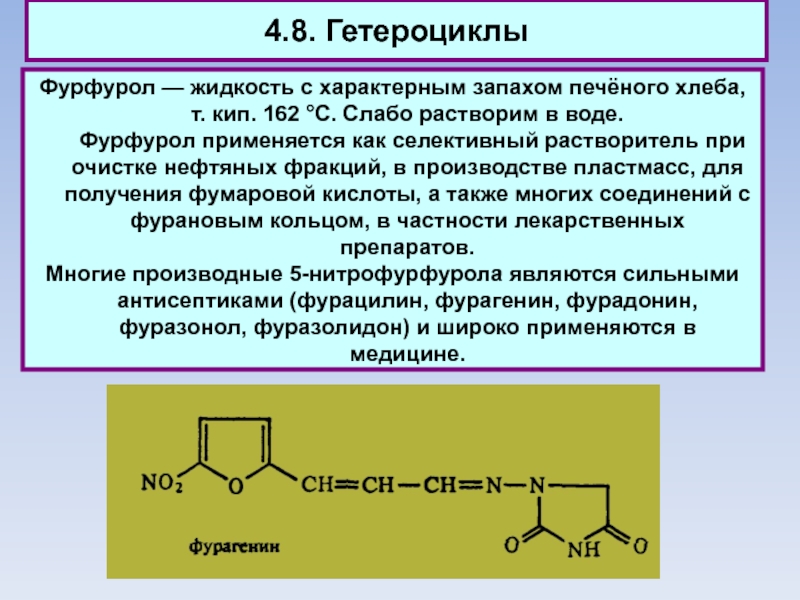
Слайд 804.8. Гетероциклы
Фурфурол — жидкость с характерным запахом печёного хлеба, т.
кип. 162 °С. Слабо растворим в воде.
Фурфурол применяется как селективный
растворитель при очистке нефтяных фракций, в производстве пластмасс, для получения фумаровой кислоты, а также многих соединений с фурановым кольцом, в частности лекарственных препаратов.
Многие производные 5-нитрофурфурола являются сильными антисептиками (фурацилин, фурагенин, фурадонин, фуразонол, фуразолидон) и широко применяются в медицине.
Слайд 814.8. Гетероциклы
Интерес к химии тиофена возродился в недавние годы в
связи с тем, что некоторые его производные обладают антигистаминным действием
(способностью предупреждать развитие анафилактического шока), а также оказывают противовоспалительное действие.
Кроме того, было показано, что природный продукт — витамин биотип — содержит тиофеновое кольцо.
Производные пиррола имеют большое биологическое значение. К ним относятся такие вещества, как хлорофилл растений, гемин крови, пигменты желчи. Восстановленное кольцо пиррола (пирролидиновое) присутствует во многих алкалоидах и аминокислотах белков.
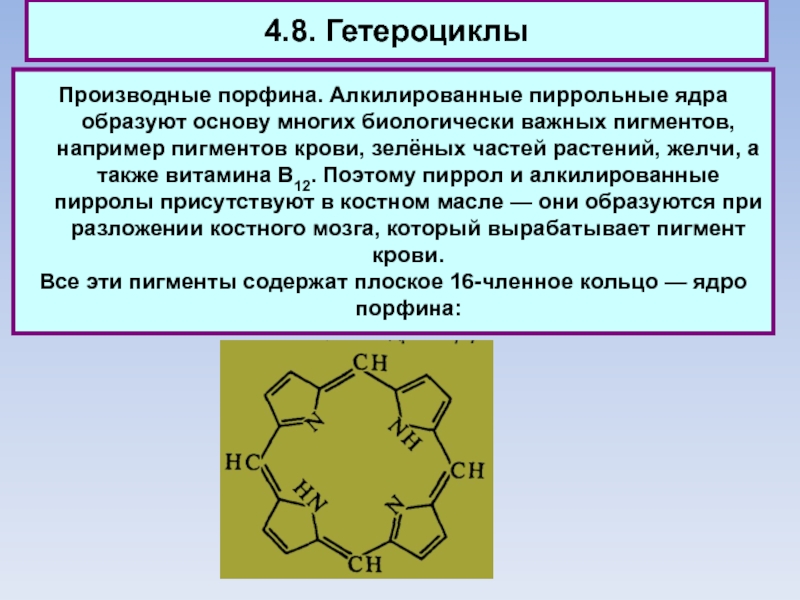
Слайд 824.8. Гетероциклы
Производные порфина. Алкилированные пиррольные ядра образуют основу многих биологически
важных пигментов, например пигментов крови, зелёных частей растений, желчи, а
также витамина В12. Поэтому пиррол и алкилированные пирролы присутствуют в костном масле — они образуются при разложении костного мозга, который вырабатывает пигмент крови.
Все эти пигменты содержат плоское 16-членное кольцо — ядро порфина:
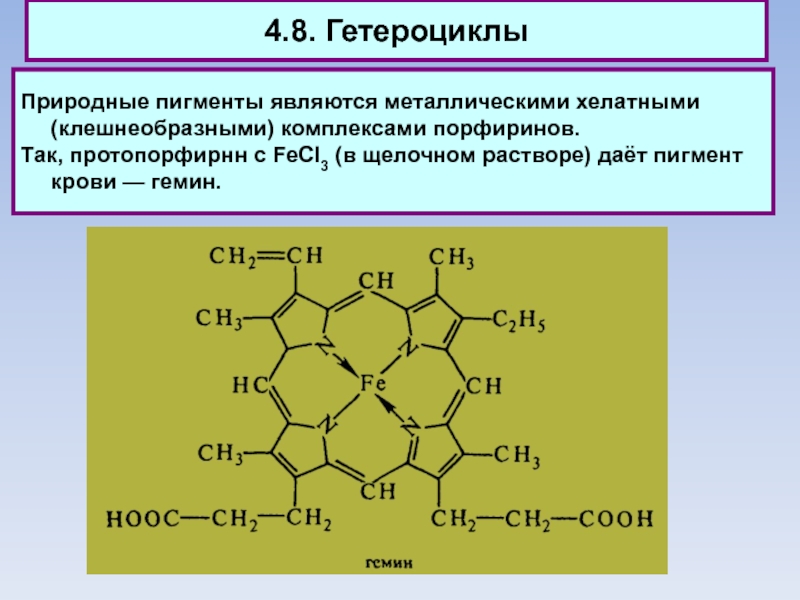
Слайд 834.8. Гетероциклы
Природные пигменты являются металлическими хелатными (клешнеобразными) комплексами порфиринов.
Так,
протопорфирнн с FeCI3 (в щелочном растворе) даёт пигмент крови —
гемин.
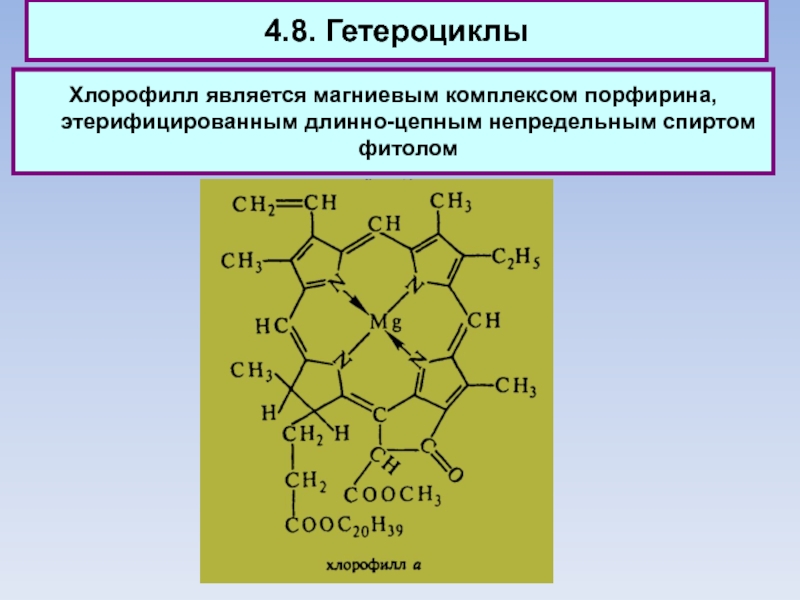
Слайд 844.8. Гетероциклы
Хлорофилл является магниевым комплексом порфирина, этерифицированным длинно-цепным непредельным спиртом
фитолом
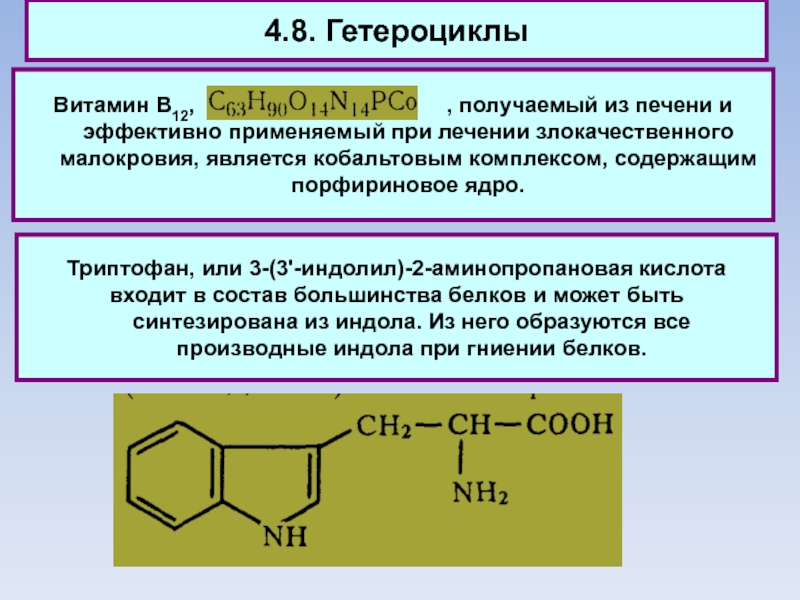
Слайд 854.8. Гетероциклы
Витамин В12,
, получаемый из печени и эффективно применяемый при лечении злокачественного малокровия, является кобальтовым комплексом, содержащим порфириновое ядро.
Триптофан, или 3-(3'-индолил)-2-аминопропановая кислота
входит в состав большинства белков и может быть синтезирована из индола. Из него образуются все производные индола при гниении белков.
Слайд 864.8. Гетероциклы
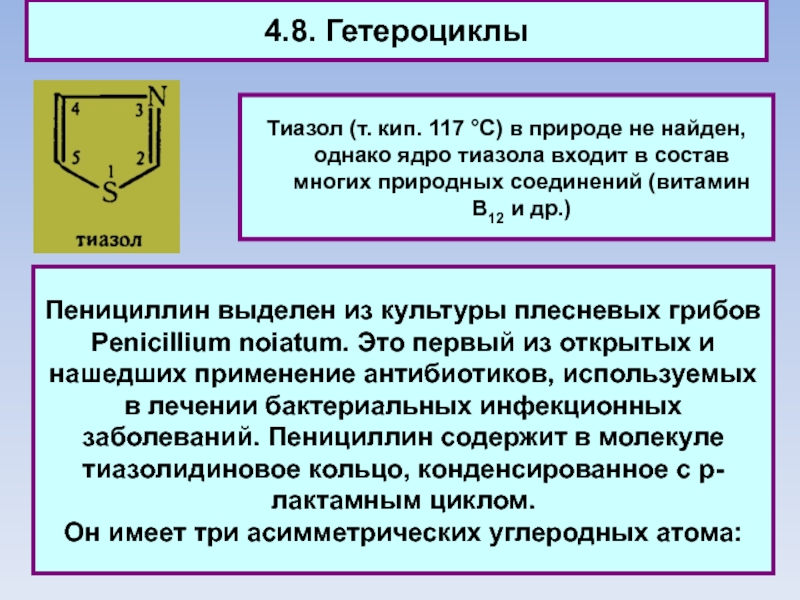
Тиазол (т. кип. 117 °C) в природе не найден,
однако ядро тиазола входит в состав многих природных соединений (витамин
В12 и др.)
Пенициллин выделен из культуры плесневых грибов Penicillium noiatum. Это первый из открытых и нашедших применение антибиотиков, используемых в лечении бактериальных инфекционных заболеваний. Пенициллин содержит в молекуле тиазолидиновое кольцо, конденсированное с р-лактамным циклом.
Он имеет три асимметрических углеродных атома:
Слайд 874.8. Гетероциклы
Алкалоиды
Производными пиридина и пиперидина являются некоторые представители большой группы
природных веществ основного характера — алкалоидов.
Алкалоиды содержатся в растительных
организмах и часто обладают сильным физиологическим и фармакологическим действием.
Слайд 884.8. Гетероциклы
Алкалоиды
Большинство изученных алкалоидов имеет в своей основе более или
менее сложно построенные гетероциклические системы; они могут быть классифицированы по
природе гетеро-циклов:
1. Алкалоиды группы пиридина (кониин, никотин, анабазин).
2. Алкалоиды группы хинолина (хинин, цинхонин).
3. Алкалоиды группы изохинолина (папаверин, наркотин, курарин).
4. Алкалоиды группы фенантренизохинолина (морфин, кодеин, тебаин).
5. Алкалоиды группы конденсированных пирролидинпиперидиновых циклов, группы тропина (атропин, кокаин).
6. Алкалоиды группы пурина (кофеин, теобромин).
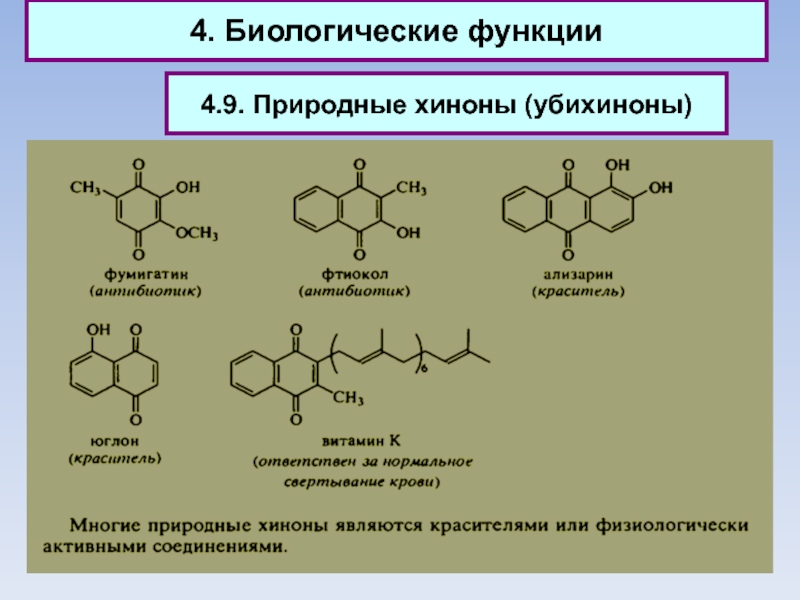
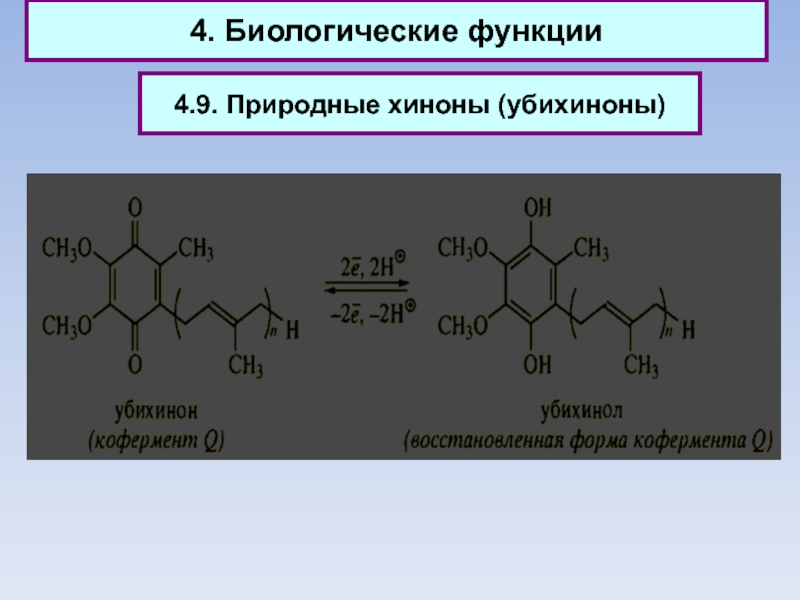
Слайд 904. Биологические функции
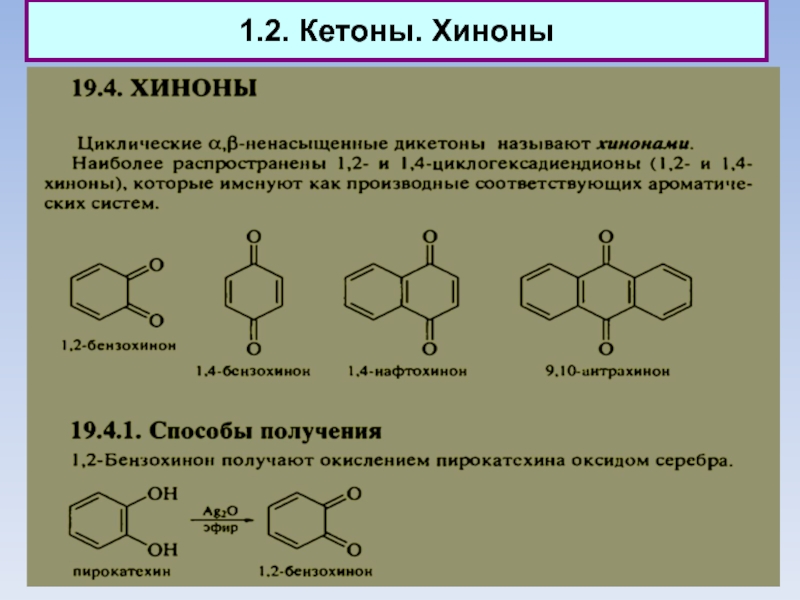
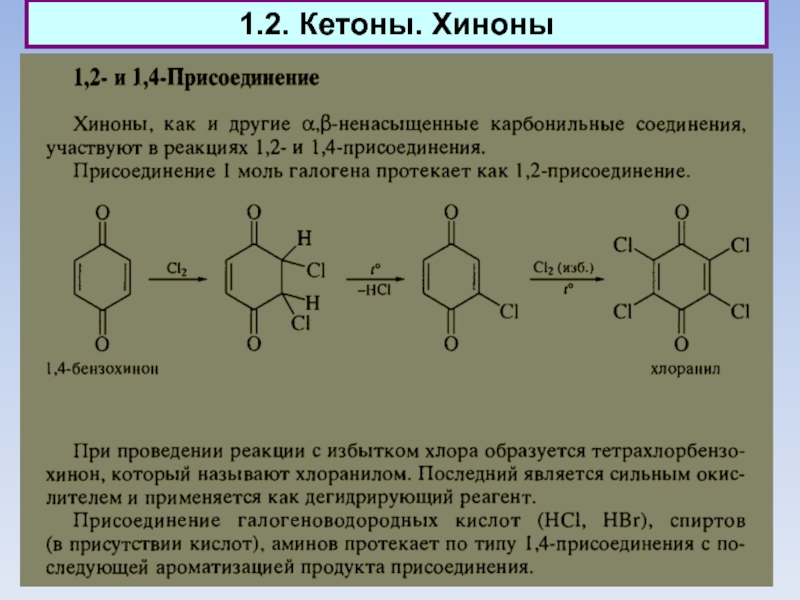
4.9. Природные хиноны (убихиноны)
Слайд 914. Биологические функции
Природные хиноны (убихиноны)
Слайд 924. Биологические функции
4.9. Природные хиноны (убихиноны)