Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ЛЕКЦИЯ 11
Содержание
- 1. ЛЕКЦИЯ 11
- 2. Характеристика элементов I-Б группы
- 3. Cu
- 4. ХИМИЧЕСКИЕ СВОЙСТВАCuCI + 2NH3 = [Cu(NH3)2]CI Au(OH)+NaOH→ Na[Au(OH)4]
- 5. Cu, Ag, Au – малоактивные металлы, стоят
- 6. Биологическая роль d- элементов I Б группГидроксилазы
- 7. Биологическая роль d-элементов I-Б группыСОД (супероксиддисмутаза) [СОД×Сu2+]+ О2- → [СОД×Cu+] + O2[СОД×Сu+]+O2- +2H+→[СОД×Сu+2] +H2O2
- 8. Биологическая роль d-элементов I-Б группы
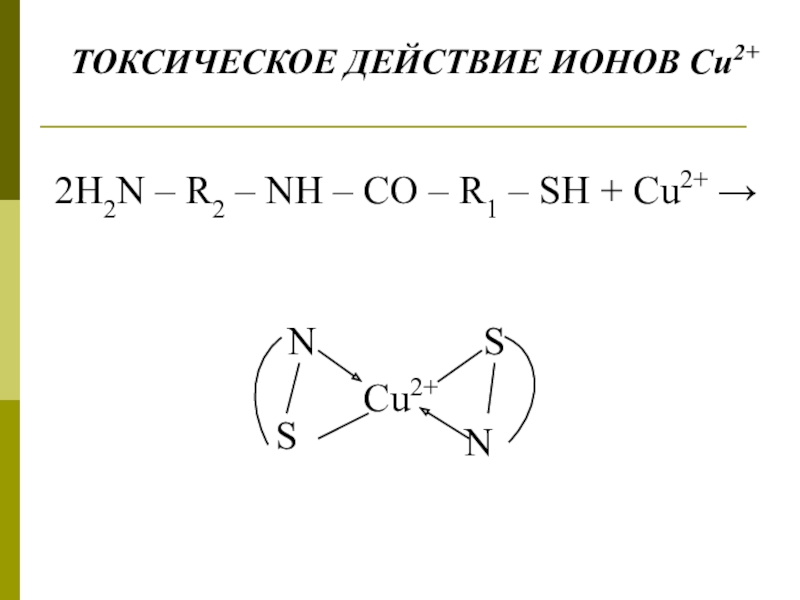
- 9. 2Н2N – R2 – NH – CO
- 10. Электронное строение элементов II-Б группы(n-1)d10 nS2
- 11. Общая характеристика d-элементов II-Б группы
- 12. ХИМИЧЕСКИЕ СВОЙСТВАZnO + 2HCI +3H2O = [Zn(H2O)4]CI2ZnO
- 13. Из солей ртути известны:Hg2Cl2 – каломель (
- 14. БИОЛОГИЧЕСКАЯ РОЛЬ d-ЭЛЕМЕНТОВ II-Б ГРУППЫH2O-HCO3--карбоангидраза – катализирует обратимую гидратацию углекислого газа
- 15. БИОЛОГИЧЕСКАЯ РОЛЬ ЭЛЕМЕНТОВ II-Б ГРУППЫ- карбоксипептидаза – катализирует процесс гидролиза пептидной связи+КОП·Zn+2O++R2 – NH2
- 16. ОБЩАЯ ХАРАКТЕРИСТИКА d-ЭЛЕМЕНТОВ VI- Б ГРУППЫ(n –
- 17. ОБЩАЯ ХАРАКТЕРИСТИКА d-ЭЛЕМЕНТОВ VI- Б ГРУППЫ
- 18. Свойства соединений элементов VI-Б группыВ низшей степени окисления – основные и восстановительные свойства – Cr+2O, (Сr(OH)2)
- 19. Свойства соединений VI –Б группыВ промежуточой степени
- 20. В высшей степени окисления –кислотные и окислительные
- 21. БИОЛОГИЧЕСКАЯ РОЛЬ VI-Б ГРУППЫ R – COH
- 22. ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII –Б ГРУППЫ
- 23. ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII-Б ГРУППЫСтепень окисления Mn: +4 MnO2, Mn(OH)4 H4MnO4- орто-марганцеватистая H2MnO3 – мета-марганцеватистая
- 24. ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII-Б ГРУППЫСтепень окисления : +6MnO3H2MnO4 –марганцовистая к-таК2MnO4- манганат калия соединения неустойчивы, являются окислителями
- 25. ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII-Б ГРУППЫСтепень окисления : +7Mn2O7
- 26. БИОЛОГИЧЕСКАЯ РОЛЬ МАРГАНЦАВ организме находится в степени
- 27. ПРИМЕНЕНИЕ СОЕДИНЕНИЙ МАРГАНЦА В МЕДИЦИНЕKMnO4 – 5%
- 28. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VIII-Б ГРУППЫ
- 29. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VIII-Б ГРУППЫСтепень окисления +3
- 30. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VIII-Б ГРУППЫСтепень окисления :
- 31. Применение в медицинеЖелезо восстановленное, при лечении анемииФерамид [Fe(C6H5CONH2)2CI2]FeCI2 наружное –кровоостанавливающее и дезинфицирующее
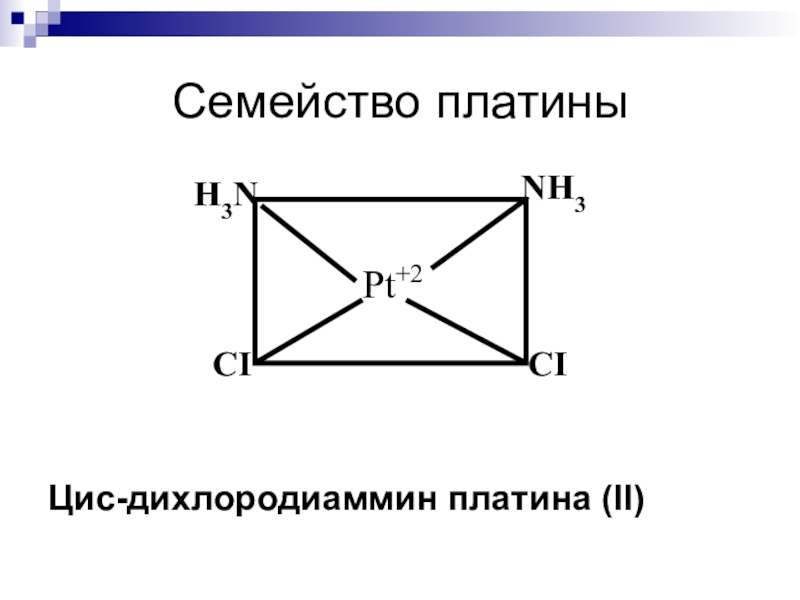
- 32. Семейство платины Цис-дихлородиаммин платина (II) Pt+2NH3H3NCICI
- 33. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Характеристика элементов
I-Б группы
Электронная формула этих элементов:
(n-1)d9nS2
Для
стабилизации наблюдается «провал» электрона и электронная формула имеет вид:
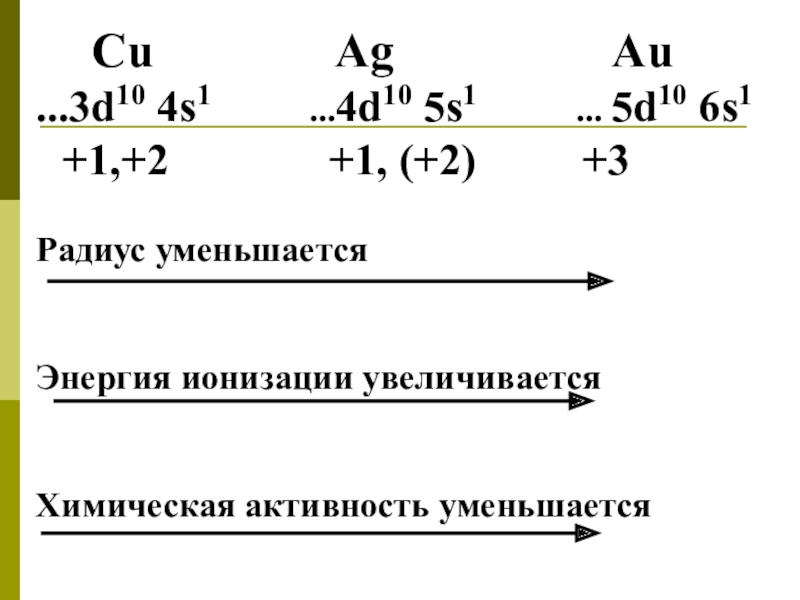
Слайд 3 Cu
Ag
Au...3d10 4s1 ...4d10 5s1 ... 5d10 6s1
+1,+2 +1, (+2) +3
Радиус уменьшается
Энергия ионизации увеличивается
Химическая активность уменьшается
Слайд 5Cu, Ag, Au – малоактивные металлы, стоят в ряду напряжения
после водорода
Cu, Ag – взаимодействуют с концентрированными кислотами HNO3,
H2SO4Au-растворяется в «царской водке»
Au +4HCI + HNO3 = H[AuCI4] + NO + H2O
«золотая кислота»
ХИМИЧЕСКИЕ СВОЙСТВА
Слайд 6Биологическая роль d- элементов
I Б групп
Гидроксилазы Е +
О2→ Е-О- + [O]
Оксигеназы
[E1×Cu+] + O2 → + R-CH2-OH →
→ RCOOH + [E1×Cu+] + H2O
Слайд 7Биологическая роль d-элементов
I-Б группы
СОД (супероксиддисмутаза)
[СОД×Сu2+]+ О2- → [СОД×Cu+]
+ O2
[СОД×Сu+]+O2- +2H+→[СОД×Сu+2] +H2O2
Слайд 8Биологическая роль d-элементов I-Б группы
O2+4e-+4H+
Fe+2 + [ЦП×Сu+2] → Fe+3 + [ЦП×Cu+] → 2H2O
ЦП + Сu+2 → [орган×Cu+2] + ЦП
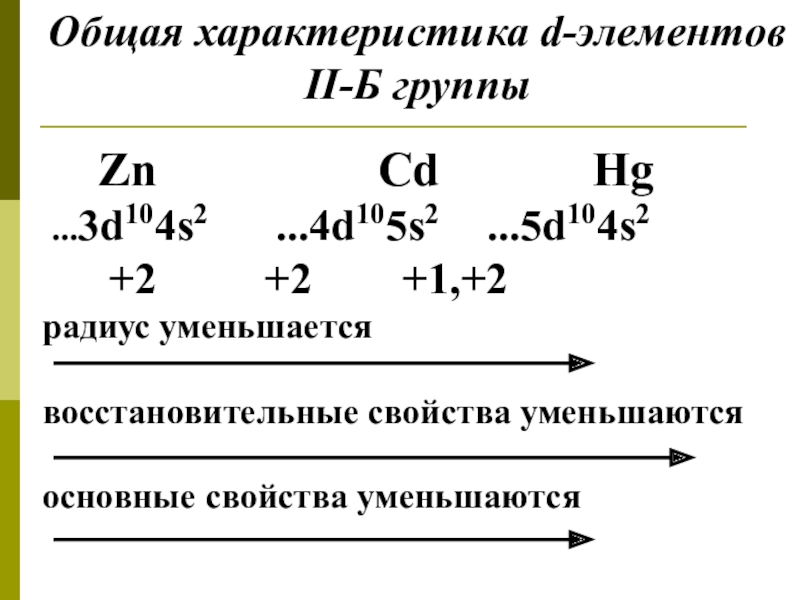
Слайд 11Общая характеристика d-элементов II-Б группы
Zn
Cd
Hg...3d104s2 ...4d105s2 ...5d104s2
+2 +2 +1,+2
радиус уменьшается
восстановительные свойства уменьшаются
основные свойства уменьшаются
Слайд 12ХИМИЧЕСКИЕ СВОЙСТВА
ZnO + 2HCI +3H2O = [Zn(H2O)4]CI2
ZnO + 2NaOH +
H2O = Na2[Zn(OH)4]
Cd(OH)2 + 6NH3 = [Cd(NH3)6](OH)2
Сd(OH)2 + 2HCl =
CdCl2 +2H2OСлайд 13Из солей ртути известны:
Hg2Cl2 – каломель ( практически не растворима
в воде)
Hg+2Cl2 – сулема (устойчива на воздухе, токсична, растворяется в
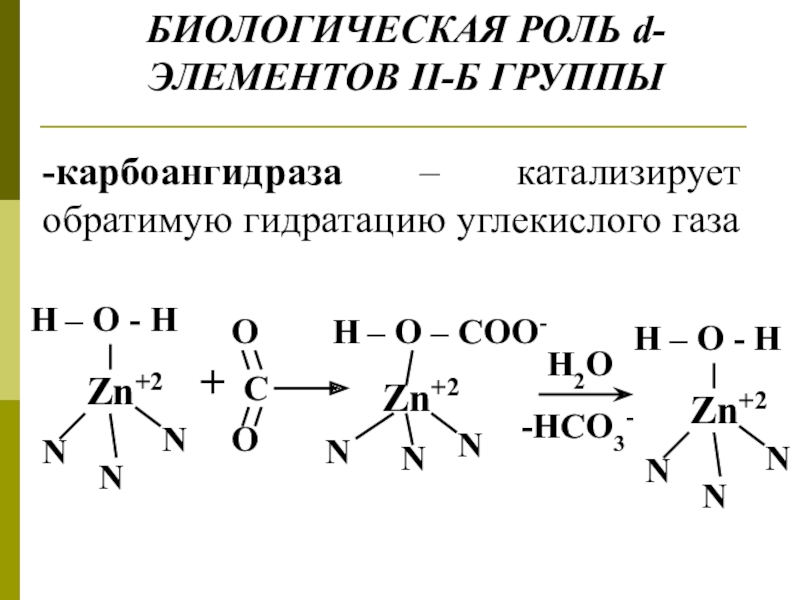
воде. Сильнейший яд. Применяется в медицине как сильное дезинфицирующее средство, в с/х для протравы семян, дубления кожи.Слайд 14БИОЛОГИЧЕСКАЯ РОЛЬ d-ЭЛЕМЕНТОВ II-Б ГРУППЫ
H2O
-HCO3-
-карбоангидраза – катализирует обратимую гидратацию углекислого
газа
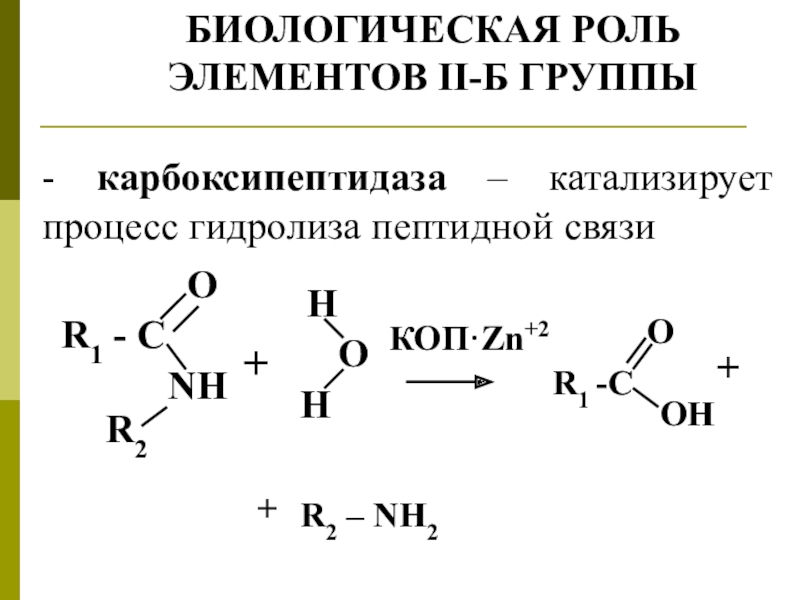
Слайд 15БИОЛОГИЧЕСКАЯ РОЛЬ ЭЛЕМЕНТОВ II-Б ГРУППЫ
- карбоксипептидаза – катализирует процесс гидролиза
пептидной связи
+
КОП·Zn+2
O
+
+
R2 – NH2
Слайд 16ОБЩАЯ ХАРАКТЕРИСТИКА d-ЭЛЕМЕНТОВ VI- Б ГРУППЫ
(n – 1) danSb,
где
а = от 1 до 10, b = от 1
до 2Слайд 17ОБЩАЯ ХАРАКТЕРИСТИКА d-ЭЛЕМЕНТОВ VI- Б ГРУППЫ
Cr
Mo W
̣̣̣̣̣̣̣̣̣̣̣̣̣̣ ̣̣...3d54s1 ...4d55s1
...5d46s2+2,+3,+6 +6 +6
Радиус уменьшается
Энергия ионизации увеличивается
Химическая активность снижается
Слайд 18Свойства соединений элементов VI-Б группы
В низшей степени окисления – основные
и восстановительные свойства – Cr+2O, (Сr(OH)2)
Слайд 19Свойства соединений VI –Б группы
В промежуточой степени окисления –амфотерные свойства
- Cr2O3
Cr(OH)3 – гидроксид хрома (III)
H3CrO3 – ортохромистая к-та
HCrO2
– метахромистая к-таCr2O3 + 2NaOH = 2NaCrO2 + H2O
Cr(ОН)3 + 3Н2О + 3HCI = [Cr(Н2О)6]CI3
Cr(ОН)3 + 3NaОН = Na3[Cr(ОН)6]3-
Слайд 20В высшей степени окисления –
кислотные и окислительные свойства - CrO3
Свойства соединений VI –Б
группы
CrO3 + Н2О = H2CrO4
хромовая кислота (желтая )
2CrO3 + Н2О = H2Cr2O7 дихромовая кислота
(оранжевая)
Слайд 21БИОЛОГИЧЕСКАЯ РОЛЬ VI-Б ГРУППЫ
R – COH + КОКС·Мо+6 +Н2О
→
→H3O ... OCR - КОКС·Мо+4 →
→ RCOOH +
КОКС ·Мо+6 + 2Н+Ксантиноксидаза (КОКС) – катализирует окисление ксантина и гипоксантина до мочевой кислоты, альдегидов и кислот
Слайд 22ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII –Б ГРУППЫ
Mn
Tc
Re...3d54s2 ...4d55s2 ...5d56s2
+2,+3,+4,+6,+7 +4,+7
Степень окисления Mn: +2
MnO, Mn(OH)2, [Mn(H2O)4]CI2
Слайд 23ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VII-Б ГРУППЫ
Степень окисления Mn: +4
MnO2, Mn(OH)4
H4MnO4- орто-марганцеватистая
H2MnO3 – мета-марганцеватистая
Слайд 24ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ
VII-Б ГРУППЫ
Степень окисления : +6
MnO3
H2MnO4 –марганцовистая к-та
К2MnO4- манганат
калия
соединения неустойчивы, являются
окислителями
Слайд 25ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ
VII-Б ГРУППЫ
Степень окисления : +7
Mn2O7 -оксид марганца (VII)
HMnO4
–марганцовая к-та (соли наз. - перманганаты)
KMnO4 – перманганат калия
Слайд 26БИОЛОГИЧЕСКАЯ РОЛЬ МАРГАНЦА
В организме находится в степени окисления Mn+2
1. Образует
комплексы с нуклеиновыми кислотами и аминокислотами
2.Входит в состав ферментов: аргиназы,
холинэстеразы, фосфоглюкомутазы, пируваткарбокси лазы.3.Участвует в синтезе витаминов С и В12
Марганец содержится в красной свекле, картофеле, печени.
Слайд 27ПРИМЕНЕНИЕ СОЕДИНЕНИЙ МАРГАНЦА В МЕДИЦИНЕ
KMnO4 – 5% дезинфицирующее средство, как
кровоостанавливающее
MnSO4 – при лечении анемии
MnCI2 – при лечении атеросклероза
Слайд 28ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ VIII-Б ГРУППЫ
Fe
Co
Ni...3d64s2 ...3d74s2 ... 3d84s2
+2,+3,+6; +2,+3,+5; +2,+3,+4;
В степени окисления +2 элементы проявляют основные и восстановительные свойства;
+3 – амфотерные;
+4,+5,+6 – окислительные и кислотные
Слайд 29ОБЩАЯ ХАРАКТЕРИСТИКА
ЭЛЕМЕНТОВ VIII-Б ГРУППЫ
Степень окисления +3
Fe2O3, Co2O3,
Ni2O3
Fe(OH)3 – амфотерное соединение
Fe(OH)3 + 3HCI + 3H2O
= [Fe(H2O)6]CI3Fe(OH)3 + 3NaOH = Na3[Fe(OH)6]
Сплавление
Fe(OH)3 + 3NaOH = Na3FeO3 + 3H2O
феррит натрия
Соль железистой кислоты: H3FeO3- орто
HFeO2 - мета


![ЛЕКЦИЯ 11 ХИМИЧЕСКИЕ СВОЙСТВАCuCI + 2NH3 = [Cu(NH3)2]CI Au(OH)+NaOH→ Na[Au(OH)4] ХИМИЧЕСКИЕ СВОЙСТВАCuCI + 2NH3 = [Cu(NH3)2]CI Au(OH)+NaOH→ Na[Au(OH)4]](/img/tmb/6/581159/5be69383cdc80979fbf546792ffacbce-800x.jpg)

![ЛЕКЦИЯ 11 Биологическая роль d- элементов I Б группГидроксилазы Е + О2→ Е-О- Биологическая роль d- элементов I Б группГидроксилазы Е + О2→ Е-О- + [O]](/img/tmb/6/581159/5b7b6f0a5b775f2bc6e13ff35fa414b2-800x.jpg)
![ЛЕКЦИЯ 11 Биологическая роль d-элементов I-Б группыСОД (супероксиддисмутаза) [СОД×Сu2+]+ О2- → [СОД×Cu+] + O2[СОД×Сu+]+O2- +2H+→[СОД×Сu+2] +H2O2 Биологическая роль d-элементов I-Б группыСОД (супероксиддисмутаза) [СОД×Сu2+]+ О2- → [СОД×Cu+] + O2[СОД×Сu+]+O2- +2H+→[СОД×Сu+2] +H2O2](/img/tmb/6/581159/0c41e70b7df23e41fc5183221ef338f9-800x.jpg)


![ЛЕКЦИЯ 11 ХИМИЧЕСКИЕ СВОЙСТВАZnO + 2HCI +3H2O = [Zn(H2O)4]CI2ZnO + 2NaOH + H2O ХИМИЧЕСКИЕ СВОЙСТВАZnO + 2HCI +3H2O = [Zn(H2O)4]CI2ZnO + 2NaOH + H2O = Na2[Zn(OH)4]Cd(OH)2 + 6NH3 = [Cd(NH3)6](OH)2Сd(OH)2](/img/tmb/6/581159/9b6c6b06e129d101780c52a0dfa7c906-800x.jpg)
















![ЛЕКЦИЯ 11 Применение в медицинеЖелезо восстановленное, при лечении анемииФерамид [Fe(C6H5CONH2)2CI2]FeCI2 наружное –кровоостанавливающее и дезинфицирующее Применение в медицинеЖелезо восстановленное, при лечении анемииФерамид [Fe(C6H5CONH2)2CI2]FeCI2 наружное –кровоостанавливающее и дезинфицирующее](/img/tmb/6/581159/e02cc31cb419c021a9abd0e2a8c18d9f-800x.jpg)