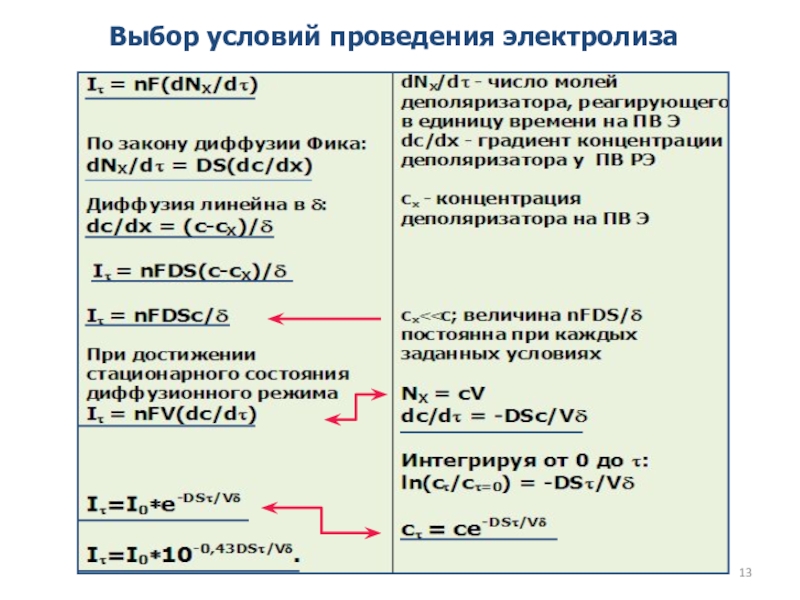
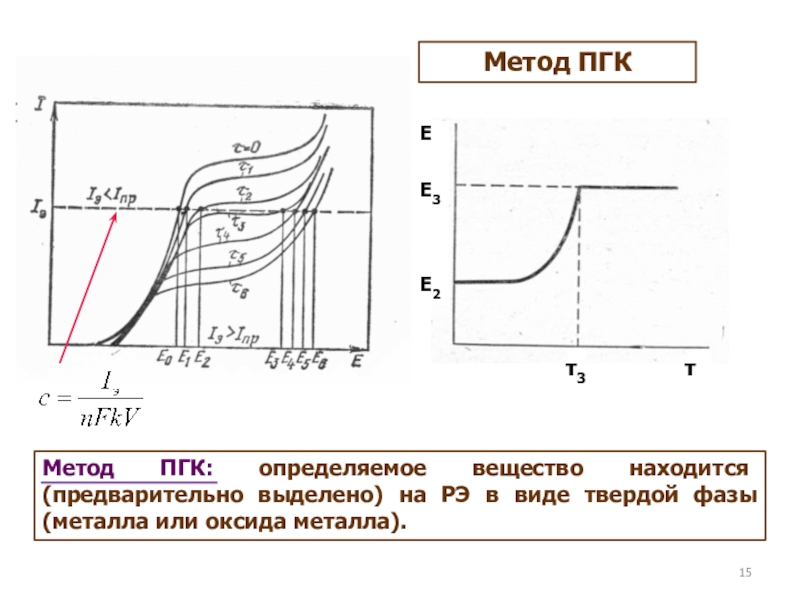
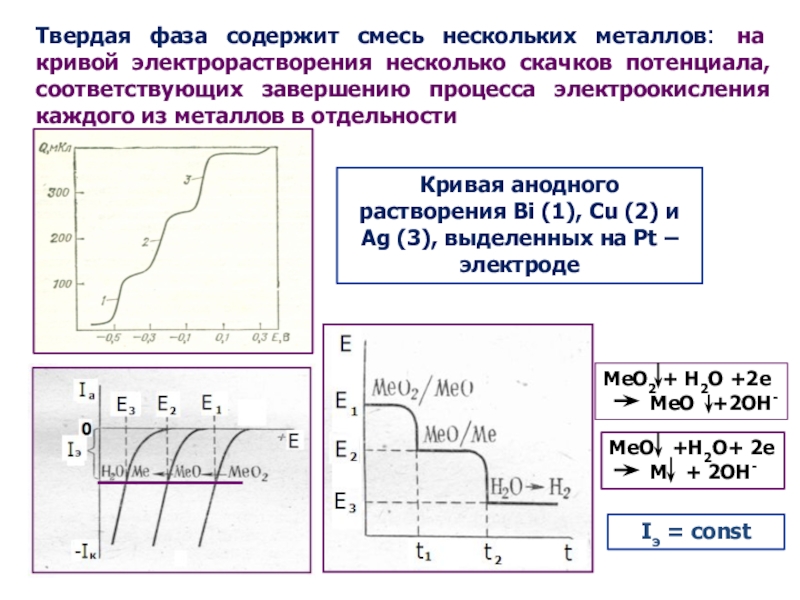
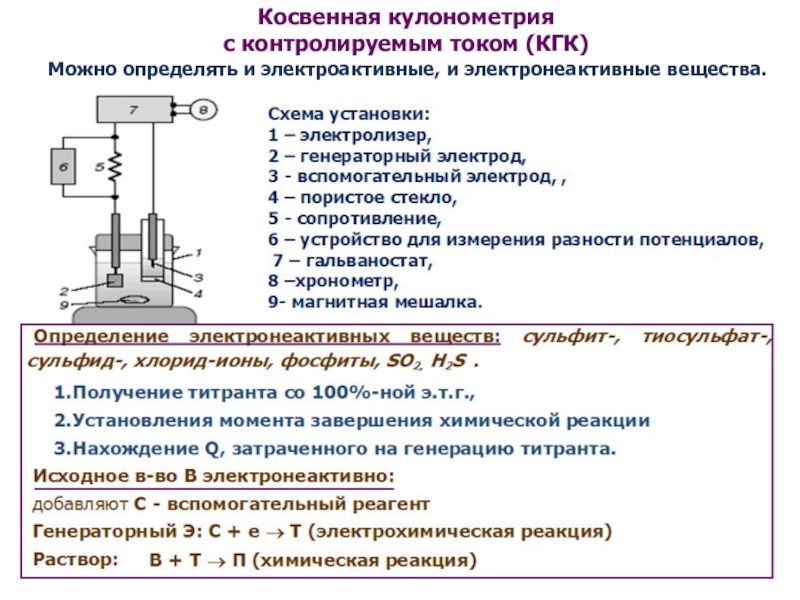
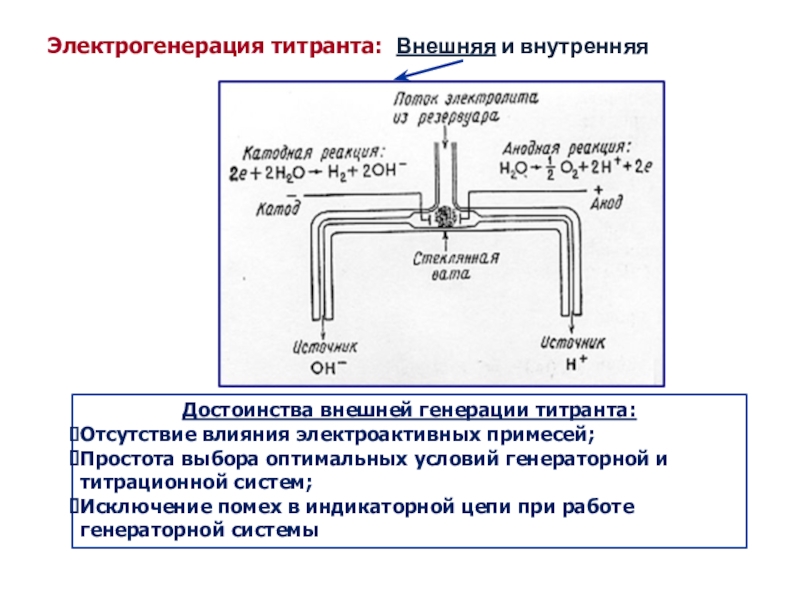
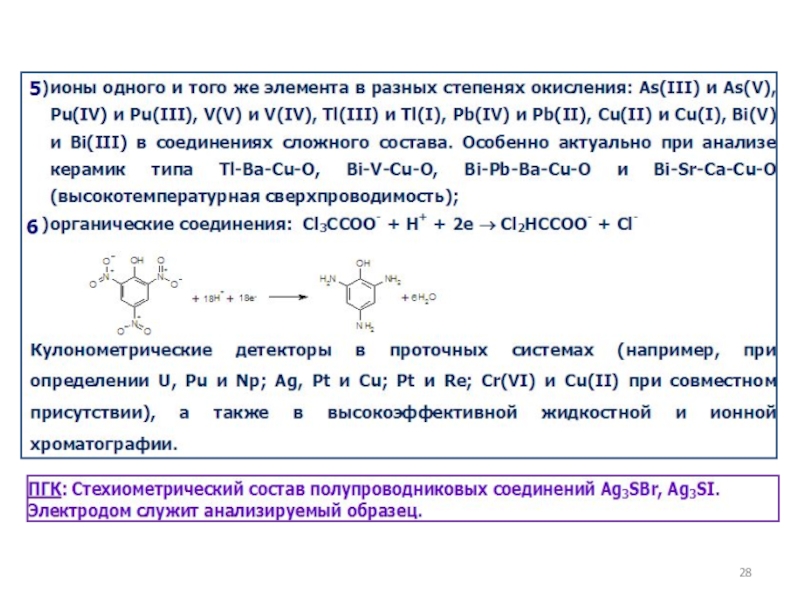
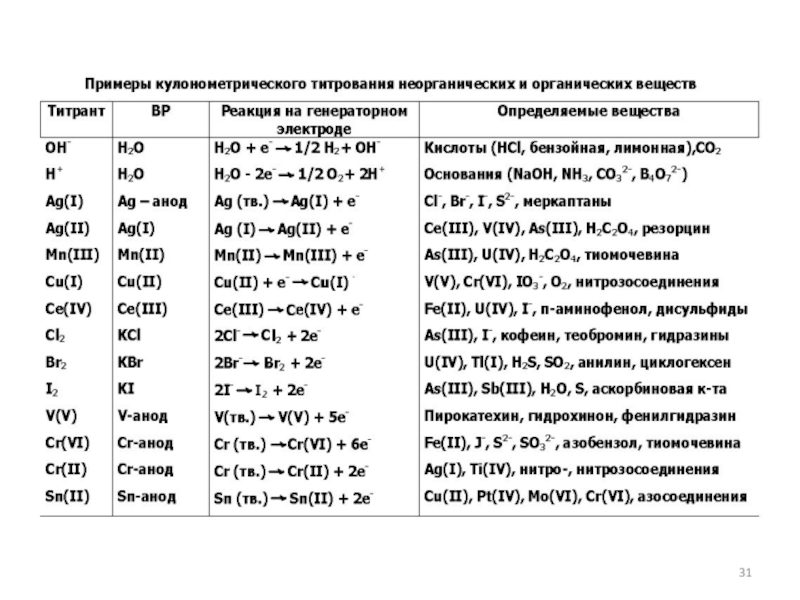
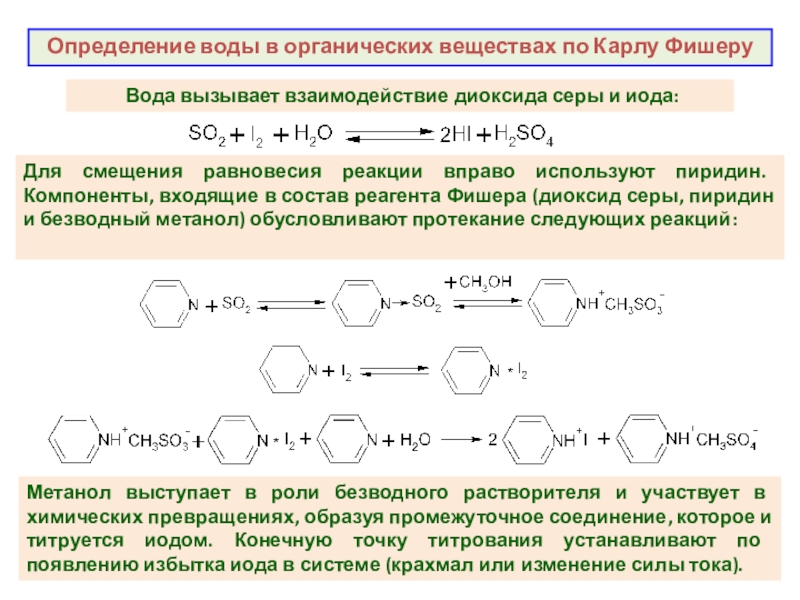
как основных компонентов вещества, так и примесей, часто без предварительного
разделения и концентрирования;Возможность автоматизации.
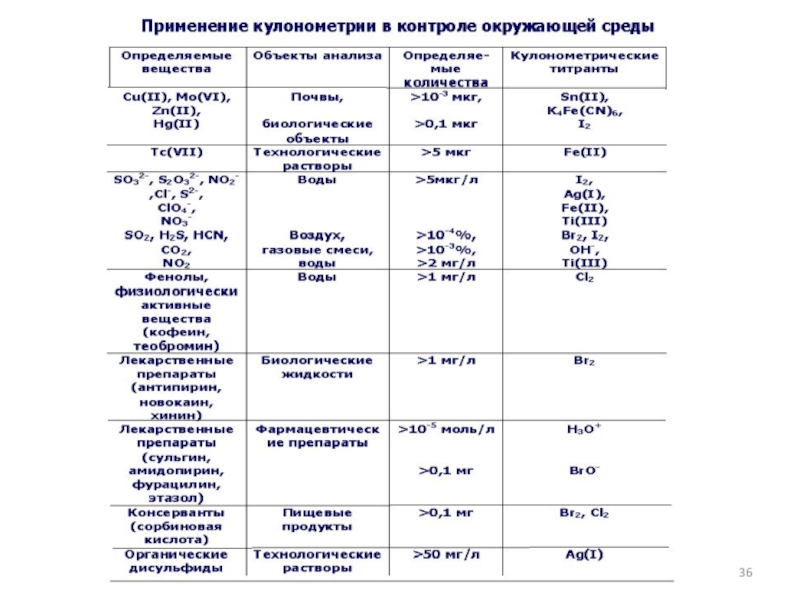
Области применения метода:
Количественный анализ (точное установление содержания компонента в образце);
Фундаментальные научные исследования (изучение механизма, кинетики и стехиометрии реакций, протекающих в жидкой, твердой и газовой фазах, оценка величин констант равновесия реакций, идентификация продуктов реакций, установление состава малорастворимых и комплексных соединений, установление числа электронов) ;
Фазовый анализ;
Различные отрасли промышленности (например, изучение коррозии металлов).