Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 22. Биохимия соединительной ткани
Содержание
- 1. Лекция 22. Биохимия соединительной ткани
- 2. Актуальность темыШирокая распространенность соединительной ткани в организме
- 3. Цель лекции Знать:Строение, свойства и функции основных
- 4. План лекцииБиохимия межклеточного матрикса гетерополисахаридыструктурные и адгезивные белкиМинерализованная соединительная ткань. Ремоделирование костной ткани.
- 5. Биохимия Межклеточного матриксаГетерополисахариды и протеогликаныСтруктурные и адгезивные белки
- 6. Межклеточный матриксГетерополисахариды и протеогликаны Гликозамингликаныгиалуроновая кислотахондроитинсульфатдерматансульфатгепарансульфатгепаринкератансульфат Протеогликаны (гликозамингликаны + белки)Белки Структурныеколлагенэластин Адгезивныефибронектинламининнидоген
- 7. Гликозамингликаны, или мукополисахариды (ГАГ)Линейные отрицательно заряженные гетерополисахариды,
- 8. Дисахаридная единица гиалуроновой кислоты (всего несколько тыс.
- 9. Особенности строения отдельных ГАГКератансульфаты вместо гексуроновой кислоты
- 10. Функции гликозамингликанов и протеогликановСтруктурный компонент межклеточного матриксаФормируют
- 11. Протеогликаны – основное вещество межклеточного матриксаСостав протеогликанов:Гликозамингликаны
- 12. Протеогликаны: связь гликозамингликана с белкомА и Б – дисахаридная единица гликозамингликана
- 13. Синтез протеогликанов1. Синтез белковой части2. Образование линкерного
- 14. Синтез хондроитинсульфата
- 15. Катаболизм гликозамингликанов и протеогликановПолупериод жизни: 3 –
- 16. Структурные белки соединительной ткани: КоллагенКоллагены – семейство
- 17. Коллаген: особенности строенияПептидная левозакрученная α-спираль коллагена содержит
- 18. Синтез и созревание коллагена1. Внутриклеточный этап (фибробласты,
- 19. Слайд 19
- 20. Гидроксилирование пролина и лизина осуществляют монооксигеназы (гидроксилазы).
- 21. Гликозилирование ГидЛиз путем присоединения остатков глюкозы и
- 22. Слайд 22
- 23. Дезаминирование лизина и гидроксилизина с образованием реакционноспособного
- 24. Макрофибрилла коллагена
- 25. Прочность коллагеновых волокон обусловленаСтроением тройной спирали из
- 26. Катаболизм коллагенаКоллаген – медленно обменивающийся белок (время
- 27. Регуляция обмена коллагенаАскорбиновая кислота стимулирует синтеза коллагена,
- 28. Метаболизм коллагенаПри старении увеличивается количество поперечных сшивок
- 29. Метаболизм коллагена При патологииНарушение катаболизма приводит к
- 30. Структурные белки соединительной ткани: ЭластинОсновной компонент волокон
- 31. ЭластинВремя полураспада – 75 летПротеолиз под действием
- 32. Адгезивные белки соединительной ткани: фибронектинДимер (2 цепи
- 33. Структура фибронектина
- 34. Адгезивные белки соединительной ткани: ламининОсновной гликопротеин базальных
- 35. Адгезивные белки соединительной ткани: нидогенСульфатированный гликопротеин базальных
- 36. Минерализованная соединительная тканьРемоделирование костной тканиМаркеры метаболизма костной ткани
- 37. Кость – минерализованная соединительная тканьФункции: размер и
- 38. Костный обмен Костный обмен (ремоделирование) включает:резорбцию (разрушение)
- 39. Минеральный состав и строение апатитовЯчейка гидроксиапатитаКристалл гидроксиапатита
- 40. Строение апатитов Оптимальное расстояние между ионами Са2+
- 41. Органические вещества кости: коллагенОсобенности строения коллагена I
- 42. Органические вещества кости: неколлагеновые белкиБольшинство неколлагеновых белков
- 43. Органические вещества кости: неколлагеновые белкиНеколлагеновые белки, содержащие
- 44. Другие органические вещества костиФакторы роста и дифференцировки
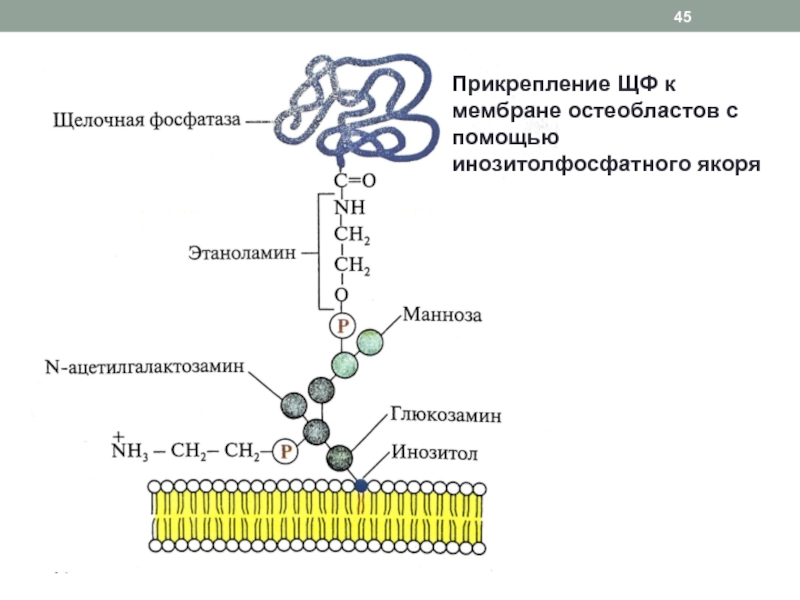
- 45. Прикрепление ЩФ к мембране остеобластов с помощью инозитолфосфатного якоря
- 46. Роль щелочной фосфатазы в костной тканиПроявляет активность
- 47. Ремоделирование костной тканиКаждые 10 лет костная ткань
- 48. Этапы цикла ремоделирования костной ткани1. Активация: остеобласты
- 49. Этапы цикла ремоделирования костной ткани2. Резорбция: «работа»
- 50. Активация остеокластов в процессе костной резорбции
- 51. Этапы цикла ремоделирования костной ткани3. Реверсия Действие
- 52. Регуляция ремоделированияПаракринно-аутокринная (местная) регуляция: цитокины, фаторы роста, простагландины костной тканиСистемная регуляция Основные регуляторы:ПаратгормонКальцитриолКальцитонинПоловые гормоны
- 53. Регуляция ремоделирования
- 54. Регуляция ремоделирования
- 55. Регуляция ремоделированияПК А фосфорилирует белок-переносчик Са2+, что
- 56. Регуляция ремоделированияКортизол замедляет костеобразование: подавляет пролиферацию остеобластов,
- 57. Регуляция ремоделированияГормон роста повышает активность остеобластов, которые
- 58. Регуляция ремоделированияВ остеобластах эстрогены стимулируют синтез остеоколлагена,
- 59. Маркеры метаболизма костной тканиДля большинства патологических состояний
- 60. ЗаключениеФункции соединительной ткани обусловлены особенностями ее строения
- 61. Литература1. Биохимия: учебник для студентов медицинских ВУЗов
- 62. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Лекция 22.
Биохимия соединительной ткани
Дисциплина: Б1.Б.15. Биохимия
Специальность: 31.05.02 Педиатрия
НГМУ, кафедра медицинской
химии
Слайд 2Актуальность темы
Широкая распространенность соединительной ткани в организме (до 50%), разнообразные
функции, участие практически во всех физиологических и патологических процессах обусловливают
необходимость изучения метаболизма соединительной тканиСоединительная ткань — это вне (меж-)клеточный матрикс вместе с клетками различного типа (фибро-, хондро-, остеобласты,тучные клетки, макрофаги) и волокнистыми структурами.
Функции соединительной ткани:
опорная: формирование структуры органов (каркаса, стромы)
защитная: формирование наружных покровов органов, регуляция функций макрофагов и клеток иммунной системы
трофическая: обмен веществ между кровью и тканями
межклеточные взаимодействия, регенерация
Соединительная ткань является основным компонентом кожи и костей.
Нарушения обмена соединительной ткани являются основой патогенеза ряда заболеваний человека.
Слайд 3Цель лекции
Знать:
Строение, свойства и функции основных биохимических компонентов соединительной
ткани
Химико-биологическую сущность метаболических процессов, происходящих в соединительной ткани организма ребенка
и подростка на молекулярном и клеточном уровняхЗнания биохимии соединительной ткани необходимы для формирования умения
объяснять молекулярные механизмы возникновения ряда заболеваний, связанных с нарушением метаболизма соединительной ткани
анализировать результаты лабораторных исследований, используемых для диагностики ряда заболеваний, для выявления патологических процессов в органах и системах
Слайд 4План лекции
Биохимия межклеточного матрикса
гетерополисахариды
структурные и адгезивные белки
Минерализованная соединительная ткань.
Ремоделирование костной ткани.
Слайд 5Биохимия Межклеточного матрикса
Гетерополисахариды и протеогликаны
Структурные и адгезивные белки
Слайд 6Межклеточный матрикс
Гетерополисахариды и протеогликаны
Гликозамингликаны
гиалуроновая кислота
хондроитинсульфат
дерматансульфат
гепарансульфат
гепарин
кератансульфат
Протеогликаны (гликозамингликаны + белки)
Белки
Структурные
коллаген
эластин
Адгезивные
фибронектин
ламинин
нидоген
Слайд 7Гликозамингликаны, или мукополисахариды (ГАГ)
Линейные отрицательно заряженные гетерополисахариды, состоящие из повторяющихся
дисахаридных звеньев (см. след. слайд):
гексуроновая кислота (глюкуроновая или идуроновая)
ацетилпроизводное аминосахара (глюкоз- или галактозамина)Ацетилирование NH2 группы аминосахаров приводит к исчезновению положительного заряда
Карбоксильные группы кислот и сульфатные группы ацетилпроизводных аминосахаров придают большой отрицательный заряд – полианионные свойства, поэтому ГАГ:
связывают Na+, К+, Ca 2+, воду (молекула гиалуроновой кислоты связывает 200 – 500 молекул воды, поэтому межклеточное вещество приобретает характер желеобразного матрикса)
препятствуют прохождению отрицательно заряженных молекул, клеток (например, белков и эритроцитов через базальную мембрану клубочков почек)
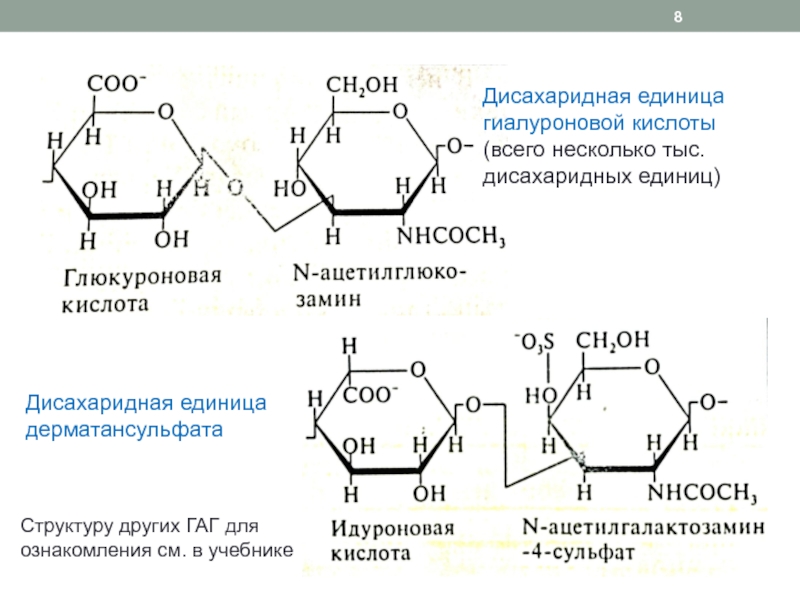
Слайд 8Дисахаридная единица гиалуроновой кислоты (всего несколько тыс. дисахаридных единиц)
Дисахаридная единица
дерматансульфата
Структуру других ГАГ для ознакомления см. в учебнике
Слайд 9Особенности строения отдельных ГАГ
Кератансульфаты вместо гексуроновой кислоты содержат галактозу и
кроме дисахаридных единиц –фукозу, маннозу, сиаловую кислоту
Гепарин имеет большее количество
сульфатных групп за счет сульфатированной глюкуроновой кислотыСлайд 10Функции гликозамингликанов и протеогликанов
Структурный компонент межклеточного матрикса
Формируют тургор тканей (гиалуроновая
кислота)
«Смазка» в суставах (гиалуроновая кислота)
Фильтрационный барьер в почках (гепарансульфаты)
«Молекулярное сито»:
препятствуют распространению патогенных микроорганизмовРессоры в суставных хрящах
Прозрачность роговицы (кератан-, дерматансульфаты)
Антикоагуляция (гепарин)
Межклеточные взаимодействия, клеточная адгезия (гепарансульфаты)
Самые распространенные ГАГ - хондроитинсульфаты (Х-4-сульфат, Х-6-сульфат): хрящи, кожа, связки, сухожилия, артерии, роговица глаза
Слайд 11Протеогликаны – основное вещество межклеточного матрикса
Состав протеогликанов:
Гликозамингликаны (кроме гиалуроновой кислоты)
– 90-95%
Белковая часть – 5-10%
Примеры протеогликанов: агрекан, версикан (крупные), декорин,
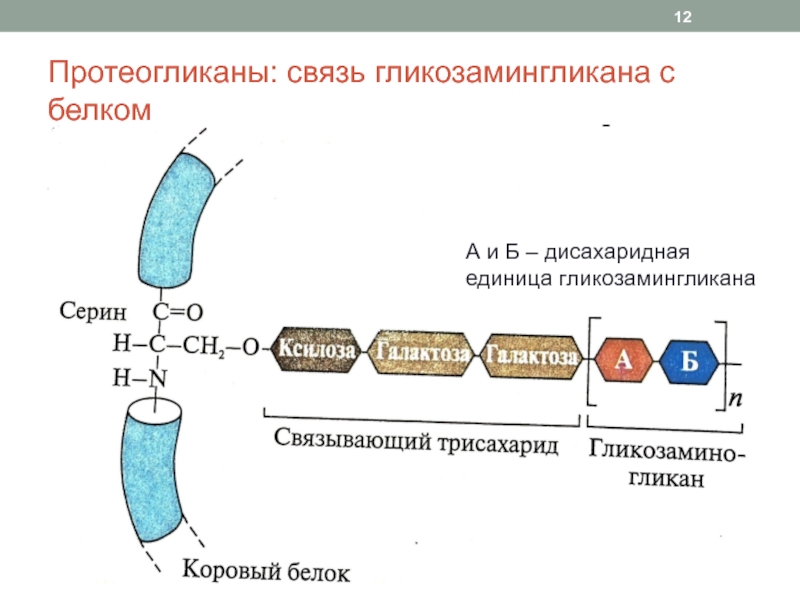
бигликан, перлекан, люмикан, фибромодулин (малые)Связь гликозамингликана с белком осуществляется через связывающий трисахарид: ксилоза – галактоза – галактоза
Связывание осуществляется через ОН-группу серина, треонина или NH2-группу аспарагина в молекуле белка
Слайд 12Протеогликаны: связь гликозамингликана с белком
А и Б – дисахаридная единица
гликозамингликана
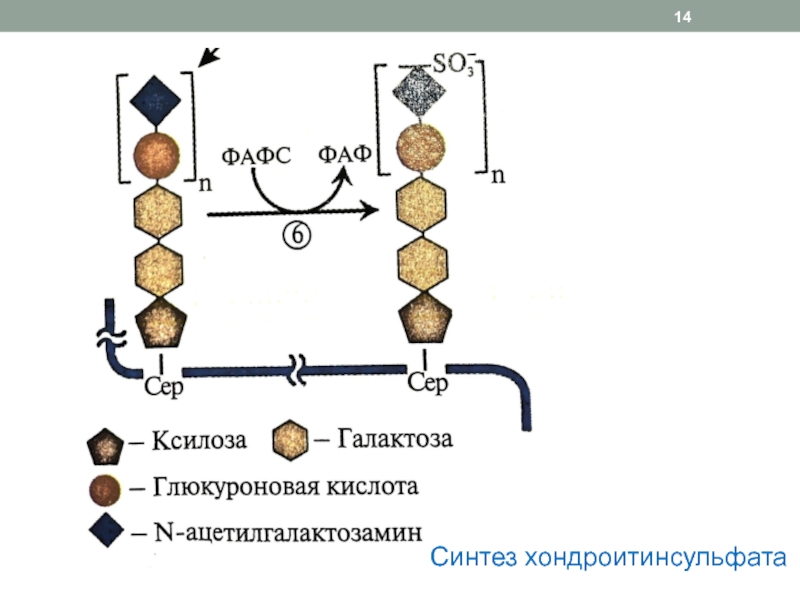
Слайд 13Синтез протеогликанов
1. Синтез белковой части
2. Образование линкерного трисахарида
3. Рост цепи
гликозамингликана
Реакции 2 и 3 этапов осуществляют гликозилтрансферазы, использующие в качестве
субстрата активные формы сахаров (связанные с УДФ).Все сахара синтезируются из глюкозы
Источник NH2 – глутамин, ацетильной группы – ацетил-КоА, сульфатной группы - фосфоаденозил-фосфосульфат (ФАФС)
Активация сахара: присоединение УДФ к С1-фосфорилированному моносахариду при участии трансфераз:
Галактоза-1-фосфат + УТФ → УДФ-галактоза + Н4Р2О7
Нарушений синтеза протеогликанов не описано
Слайд 15Катаболизм гликозамингликанов и протеогликанов
Полупериод жизни: 3 – 10 дней (кератансульфат
120 дней)
Осуществляют лизосомные протеазы, гликозидазы, сульфатазы
Отсутствие или снижение активности ферментов
приводит к нарушению катаболизма – лизосомные болезни – мукополисахаридозы (МПС)Типология МПС основана на виде фермента, недостаточность которого имеет место
Например, МПС 1 типа (синдром Гурлера) обусловлен недостаточностью идуронидазы. Накапливаются дерматансульфат, гепарансульфат и в повышенных количествах выводятся с мочой
Клиническая картина: помутнение роговицы, гепатоспленомегалия, тугоподвижность суставов, дисплазия костей, грубые черты лица, ССЗ, отставание психического развития, смерть в первые 10 лет жизни
Слайд 16Структурные белки соединительной ткани: Коллаген
Коллагены – семейство полиморфных фибриллярных белков
(19 типов коллагена), имеющих трехспиральную структуру, сформированную скручиванием 3-х полипептидных
α-цепейИдентифицировано более 20 различных α-цепей, каждая из которых кодируется отдельным геном. В разных тканях экспрессируются различные комбинации генов
Наиболее распространенные типы коллагенов: I, II, III, IV
Коллагены I (кости, роговица, сухожилия), II (хрящи, стекловидное тело), III (почки, печень, сосуды), IV (базальная мембрана)
Пример обозначения вида коллагена: [α1 (IV)]2 α2 (IV) – коллаген IV типа, состоящий из 2-х альфа-цепей варианта 1 и одной альфа-цепи варианта 2
Слайд 17Коллаген: особенности строения
Пептидная левозакрученная α-спираль коллагена содержит 600 – 3000
АК (в отличие от α-спирали глобулярных белков она более развернута:
на одни виток приходится 3 АК)Гли-Про-ГидПро – Гли-Ала-ГидПро-Гли-Лей-ГидПро (в спиральной цепи глицин всегда находится над глицином)
Присутствие глицина в каждом триплете обеспечивает плотность укладки 3-х цепей
Модифицированные АК: гидроксипролин и гидроксилизин
Коллаген – неполноценный белок. Отсутствуют цистеин, триптофан, мало метионина, гистидина и тирозина
Из 3-х α-цепей коллагена образуется правозакрученная суперспираль (глицин расположен по центральной оси, что способствует образованию линейной молекулы тропоколлагена и включению ее в волокно)
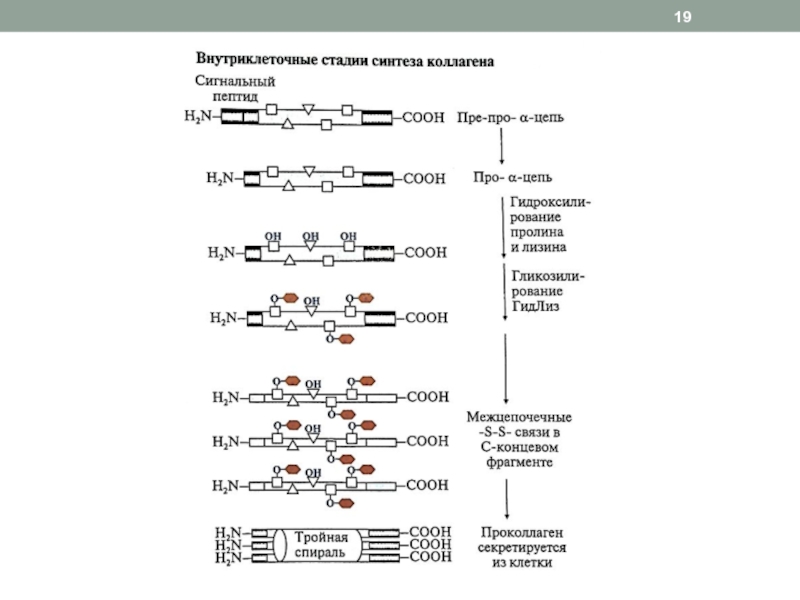
Слайд 18Синтез и созревание коллагена
1. Внутриклеточный этап (фибробласты, хондробласты, остеобласты):
образование
пре-про-α-цепи, содержащей сигнальный пептид, облегчающий перемещение белка в ЭР
образование
про-α-цепигидроксилирование пролина и лизина
гликозилирование ГидЛиз
образование дисульфидных связей в области N- и C-концевых пептидов (внутри- и межцепочечных) для формирования тройной спирали
образование проколлагена из 3-х про-α-цепей
2. Внеклеточный этап
частичный протеолиз N- и C-концевых неспирализованных пептидов, образование тропоколлагена
дезаминирование лизина и гидроксилизина
образование фибрилл коллагена
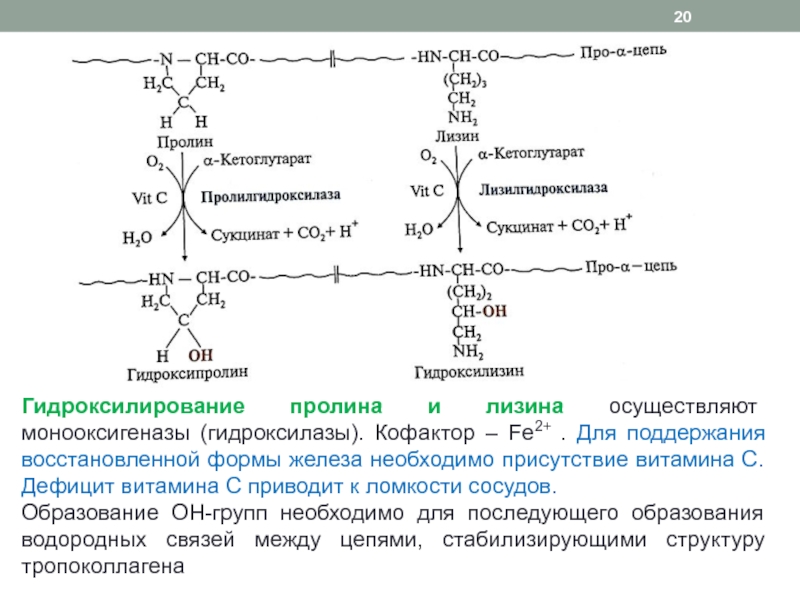
Слайд 20Гидроксилирование пролина и лизина осуществляют монооксигеназы (гидроксилазы). Кофактор – Fe2+
. Для поддержания восстановленной формы железа необходимо присутствие витамина С.
Дефицит витамина С приводит к ломкости сосудов.Образование ОН-групп необходимо для последующего образования водородных связей между цепями, стабилизирующими структуру тропоколлагена
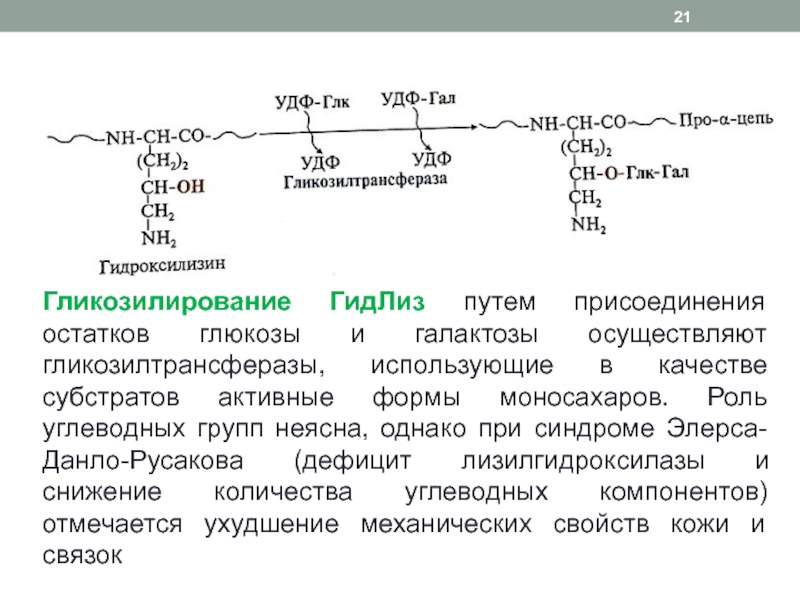
Слайд 21Гликозилирование ГидЛиз путем присоединения остатков глюкозы и галактозы осуществляют гликозилтрансферазы,
использующие в качестве субстратов активные формы моносахаров. Роль углеводных групп
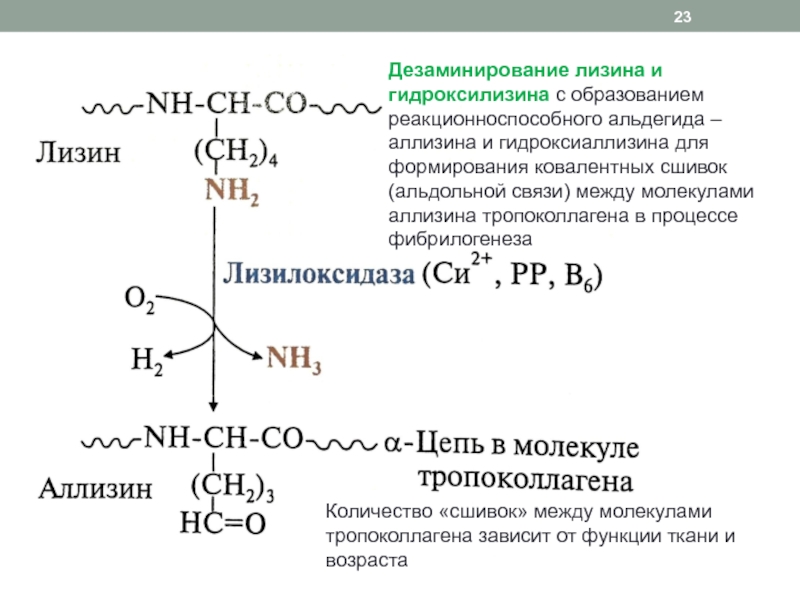
неясна, однако при синдроме Элерса-Данло-Русакова (дефицит лизилгидроксилазы и снижение количества углеводных компонентов) отмечается ухудшение механических свойств кожи и связокСлайд 23Дезаминирование лизина и гидроксилизина с образованием реакционноспособного альдегида – аллизина
и гидроксиаллизина для формирования ковалентных сшивок (альдольной связи) между молекулами
аллизина тропоколлагена в процессе фибрилогенезаКоличество «сшивок» между молекулами тропоколлагена зависит от функции ткани и возраста
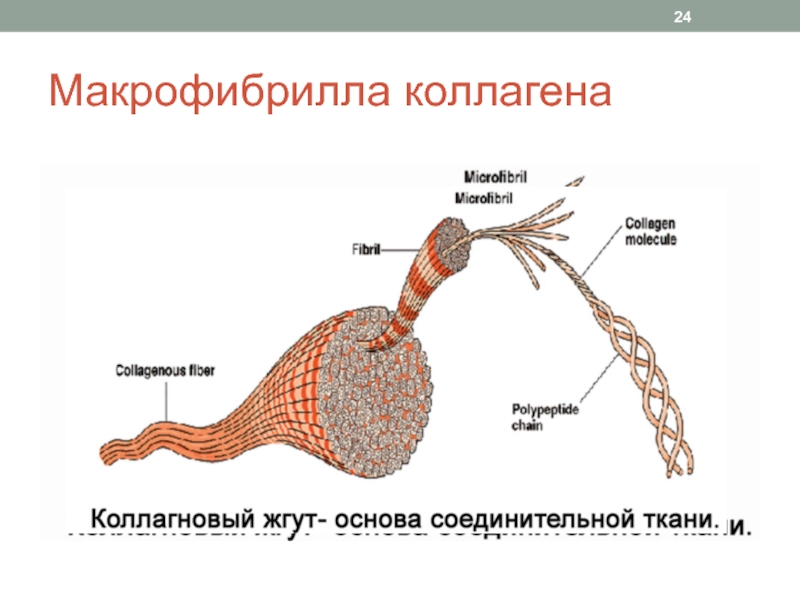
Слайд 25Прочность коллагеновых волокон обусловлена
Строением тройной спирали из полипептидных цепей
Водородными связями
между цепями в молекуле тропоколлагена
Ковалентными (альдольными) связями между молекулами тропоколлагена
в микрофибриллеСдвигом молекул тропоколлагена на ¼ относительно друг друга в микрофибрилле коллагена
Зрелое коллагеновое волокно толщиной в 1 мм выдерживает нагрузку до 10 кг
Слайд 26Катаболизм коллагена
Коллаген – медленно обменивающийся белок (время полужизни – недели,
месяцы). Обмен более активен у молодых людей до 20 лет.
Синтез коллагена увеличивается, например, при заживлении ран.О скорости обмена коллагена судят по содержанию гидроксипролина в крови и моче (норма15-50 мг/сут у взрослых после 20 лет).
Протеолиз осуществляет коллагеназа – Са2+, Zn2+ -зависимая матриксная металлопротеиназа (ММР-1) – расщепляет молекулу на 2 фрагмента (1/4 и ¾). Дальнейший протеолиз осуществляют лизосомальные протеазы.
Коллагеназа – индуцируемый фермент (синтез в фибробластах и макрофагах под влиянием цитокинов, эстрогенов и др.), механизм активации – частичный протеолиз. Небольшое количество ММР присутствует в матриксе в неактивной форме, ингибированные специфическим ингибитором TIMP
Изменение активности ММР играет важную роль в патогенез ряда заболеваний (деструкция хряща при ревматоидном артрите, развитие сердечно-сосудистых патологий и др.). Например, снижение активности ММР при сахарном диабете наряду с гликозилированием коллагена способствует развитию микро- и макроангиопатий
Слайд 27Регуляция обмена коллагена
Аскорбиновая кислота стимулирует синтеза коллагена, протеогликанов и пролиферацию
фибробластов
Половые гормоны регулируют синтез коллагена
Коллаген и N-концевые пептиды после отщепления
тормозят трансляцию коллагена (отрицательная обратная связь)Кортизол снижает экспрессию генов коллагена, ингибирует активность пролил- и лизилгидроксилазы
Слайд 28Метаболизм коллагена
При старении
увеличивается количество поперечных сшивок между молекулами тропоколлагена,
затрудняющих действие коллагеназы
уменьшается соотношение гликозамингликаны / коллаген
уменьшается количество связанной воды
увеличивается
сухость кожиизменяются свойства хряща и сухожилий
снижается прозрачность роговицы глаза
«Человек стар в той степени, в какой постарела его соединительная ткань» (Слуцкий Л.И., 1969)
Слайд 29Метаболизм коллагена
При патологии
Нарушение катаболизма приводит к фиброзу органов
Усиление распада
происходит при аутоиммунных заболеваниях
Нарушение синтеза. Основная причина – мутации в
генах коллагена (гены очень большие, что увеличивает вероятность мутаций). Примеры таких патологий (известно более 250 синдромов):несовершенный остеогенез (повышенная ломкость костей, аномалии зубов, гиперподвижность суставов)
хондродисплазии
синдром Стиклера и Вагнера – нарушение синтеза коллагена в стекловидном теле с отслойкой сетчатки
семейная аневризма аорты
прогрессирующая миопия
Слайд 30Структурные белки соединительной ткани:
Эластин
Основной компонент волокон тканей, обладающих значительной эластичностью
(сосуды, связки, легкие)
70 кДа, структура кодируется 1 геном
800 АК: глицин,
валин, аланин, пролин (70%), ГидПро мало, отсутствуют ГидЛиз, цис, мет, триНет строго определенной конформации
Этапы синтеза эластина:
образование мономерной формы – тропоэластина
гидроксилирование пролина
образование аллизина (лизилоксидазная реакция)
взаимодействие аллизина разных цепей тропоэластина с образованием десмозина (пиридинолина), который связывает между собой 2, 3, 4 молекулы эластина
Наличие поперечных сшивок (структура десмозина) и гибкой случайной конформации – основа «резиноподобных» свойств эластина
Слайд 31Эластин
Время полураспада – 75 лет
Протеолиз под действием эластазы (нейтрофилы)
Нарушения
образования эластина (в частности десмозина) проявляются патологиями сердца, легких, сосудов
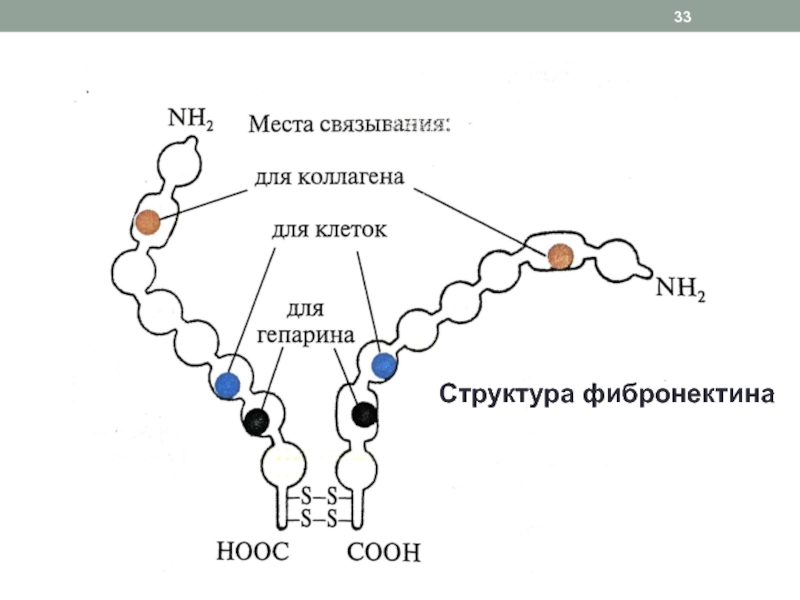
(дефект сердечных клапанов, аневризмы аорты, варикоз, эмфизема легких)Слайд 32Адгезивные белки соединительной ткани:
фибронектин
Димер (2 цепи сходны, но не идентичны,
соединены дисульфидными мостиками), гликопротеин, 2500 АК, 1 ген
Альтернативный сплайсинг является
причиной образования различных по структуре и функциональной активности молекул фибронектина в разных клеткахИмеет домены для связывания с клетками, с биомолекулами соединительной ткани, обеспечивая их ориентацию, интеграцию, адгезию клеток
Взаимодействие с биомолекулами происходит за счет ковалентной связи между остатками лизина и глутамина под действием трансглутаминазы, которая также связана с фибронектином в одном из его доменов
В опухолевой ткани снижено количество фибронектина, что является одной из причин метастазирования
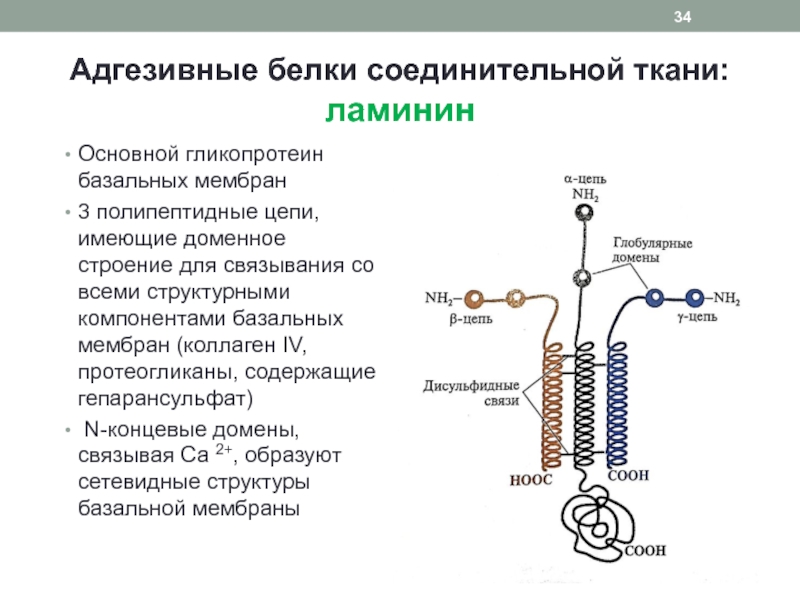
Слайд 34Адгезивные белки соединительной ткани:
ламинин
Основной гликопротеин базальных мембран
3 полипептидные цепи, имеющие
доменное строение для связывания со всеми структурными компонентами базальных мембран
(коллаген IV, протеогликаны, содержащие гепарансульфат)N-концевые домены, связывая Са 2+, образуют сетевидные структуры базальной мембраны
Слайд 35Адгезивные белки соединительной ткани:
нидоген
Сульфатированный гликопротеин базальных мембран
Одна полипептидная цепь
Три глобулярных
домена:
центр связывания ламинина
центр связывания коллагена IV типа
центр
связывания гепарансульфата Слайд 36Минерализованная соединительная ткань
Ремоделирование костной ткани
Маркеры метаболизма костной ткани
Слайд 37Кость – минерализованная соединительная ткань
Функции: размер и форма тела, защита
внутренних органов, минеральный гомеостаз, кроветворение
Основные клетки
остеобласты (синтезируют органический компонент)
остеоциты (участвуют в ремоделировании кости)остеокласты (секретируют ферменты, разрушающие органический компонент костного матрикса при ремоделировании)
Твердый (минерализованный) межклеточный матрикс
неорганический компонент (65%): гидроксиапатиты кальция Са10(РО4)6(ОН)2
органические соединения: коллаген I типа, неколлагеновые белки, гликозамингликаны, протеогликаны, фосфолипиды, цитрат – матрица для формирования гидроксиапатитов
Слайд 38Костный обмен
Костный обмен (ремоделирование) включает:
резорбцию (разрушение) костной ткани
костеобразование (обновление,
реорганизация органической матрицы и ее минерализация)
Ремоделирование костной ткани ускоряется при
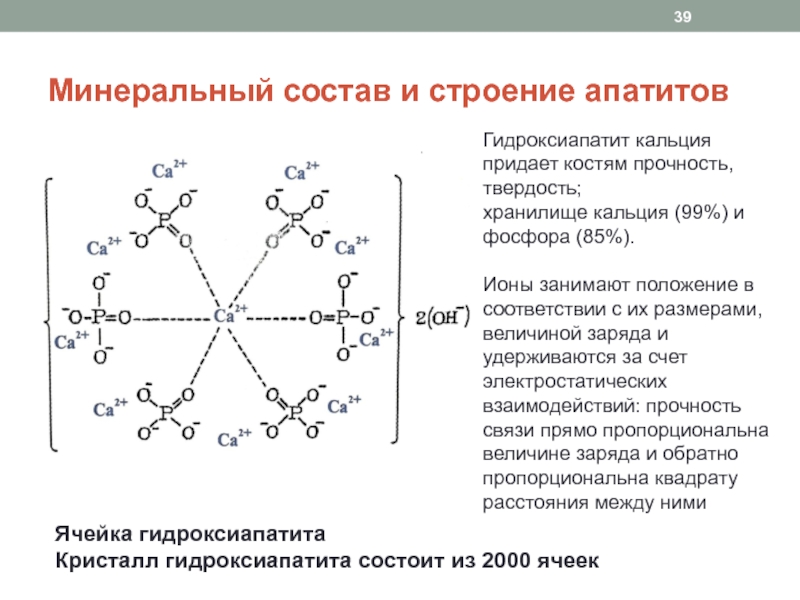
изменении физической нагрузки на ткань (снижение массы тела при похудании), при локальных воспалительных процессах (ревматоидный артрит), гормональных изменениях (дефицит эстрогенов, гиперпаратиреоз)Слайд 39Минеральный состав и строение апатитов
Ячейка гидроксиапатита
Кристалл гидроксиапатита состоит из 2000
ячеек
Гидроксиапатит кальция придает костям прочность, твердость;
хранилище кальция (99%) и
фосфора (85%).Ионы занимают положение в соответствии с их размерами, величиной заряда и удерживаются за счет электростатических взаимодействий: прочность связи прямо пропорциональна величине заряда и обратно пропорциональна квадрату расстояния между ними
Слайд 40Строение апатитов
Оптимальное расстояние между ионами Са2+ и РО43- задается
органической матрицей. Изменение строения компонента матрицы приводит к нарушению минерализации
или образованию кристаллов неправильной структуры, снижению прочности костиАпатиты легко обмениваются ионами с молекулами окружающей среды (изоморфные замещения), изменяется коэффициент Са/Р (в норме 1,33 – 2,0).
Примеры изоморфных замещений:
при недостатке кальция в пище его место занимает стронций (стронциевый апатит хрупкий)
при ацидозе (сахарный диабет, голодание) Са2+ замещается Н+ (кристаллы разрушаются)
Слайд 41Органические вещества кости: коллаген
Особенности строения коллагена I типа (остеоколлагена):
Больше гидроксипролина,
но меньше гидроксилизина
Менее гликозилирован, при гликозилировании присоединяется галактоза (а не
галактоза-глюкоза)Содержит меньше межцепочечных ковалентных связей (альдольных сшивок)
Содержит фосфорилированные остатки серина (для связывания кальция)
Имеет специфические структуры – пиридинолин (десмозин) и дезоксипиридинолин (изодесмозин) (см. структуру эластина). Определение уровня данных структур в моче используется в диагностике остеопороза
Слайд 42Органические вещества кости: неколлагеновые белки
Большинство неколлагеновых белков – гликопротеины или
гликофосфопротеины; присутствуют и в других тканях (например, эпителиальной)
Остеонектин - связывает
кальций, коллаген, гидроксиапатиты, формирует центры кристаллизации и инициирует процесс минерализацииОстеокальцин (содержит карбоксиглутаминовую кислоту, образованную при участии витамина К) – участвует в Са2+-зависимом взаимодействии с фосфолипидами мембран клеток, активирует остеокласты, уменьшает связывание кальция с остеонектином, замедляет образование центров кристализации; экспрессия гена регулируется кальцитриолом; концентрация в крови отражает активность остеобластов
Gla (γ-глу)- протеин – активирует остеокласты
Слайд 43Органические вещества кости:
неколлагеновые белки
Неколлагеновые белки, содержащие RGD-последовательность: -Арг-Глу-Асп- (комплементарна рецепторам
остеокластов):
Сиалопротеин, остеопонтин – стимулируют прикрепление остеокластов к кости; экспрессию гена
остеопонтина регулирует кальцитриолАктивированные остеокласты секретируют кислую фосфатазу, которая дефосфорилирует сиалопротеин и остеопонтин, вызывая потерю сродства к рецепторам остеокластов; происходит снижение активности остеокласта
Тромбоспондин – адгезивный белок
Слайд 44Другие органические вещества кости
Факторы роста и дифференцировки (IGF-1, TGF-β, PDGF)
Протеогликаны
(ГАГ: хондроитин-, дерматан-, кератансульфаты) – в гидратированном состоянии занимают большое
по объему пространство в межклеточном матриксе, которое в дальнейшем должно стать костью; связывают кальций и являются его источником в процессе минерализацииЛипиды: фосфатидилсерин играет ведущую роль в связывании кальция на начальных этапах минерализации, обеспечении кальцием растущих кристаллов гидроксиапатитов, образовании их связи с белками
Цитрат (активность цитратсинтазы высокая) – участвует в обмене кальция, образуя нерастворимые и растворимые соли
Например, воздействие паратгормона на остеобласты способствует активации остеокластов, снижению рН, разрушению кости, приводит к увеличению содержания цитрата, образованию его солей с кальцием и повышению кальция в крови
Ферменты: кислая фосфатаза (замедляет скорость резорбции, см. слайд 43) и щелочная фосфатаза (ЩФ) (см. слайд 46)
Слайд 46Роль щелочной фосфатазы в костной ткани
Проявляет активность на стадии минерализации
(рН 9,6)
Катализирует реакцию дефосфорилирования фосфорорганических соединений матрикса кости
Повышая концентрацию РО43-
, способствует образованию центров кристаллизации и формированию гидроксиапатитовМожет переносить фосфатные остатки на органические соединения (трансферазная активность), что приводит к изменению активности фосфопротеинов, участвующих в регуляции минерализации
Отделившись от мембраны под действием фосфолипазы С, может высвобождаться в кровоток (активность ЩФ высокая у детей в период роста)
Слайд 47Ремоделирование костной ткани
Каждые 10 лет костная ткань заменяется новой (ежегодно
обновляется 5-10% скелета)
Интенсивность обмена определяется соотношением скоростей резорбции и костеобразования:
до 18 лет образование новой костной ткани идет быстрее, чем резорбция18 – 40 лет – равновесие процессов
после 40 лет скорость костеобразования снижается по сравнению с резорбцией, развивается остеопороз
Ремоделирование = Резорбция (2-3 нед) + костеобразование (2-3 мес)
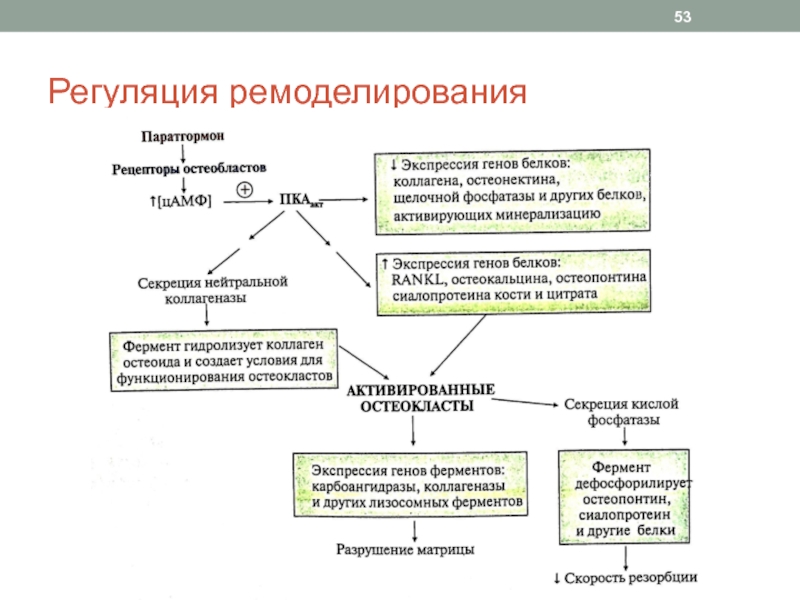
Слайд 48Этапы цикла ремоделирования костной ткани
1. Активация: остеобласты под влиянием стимулирующих
факторов секретируют
фактор RANKL (receptor activator of nuclear factor KB
ligand), стимулирующий образование колоний моноцитов, формирующих остеокластыколлагеназу, которая гидролизует коллаген остеоида (для связывания остеокласта с костью)
остеокальцин, сиалопротеин, остеопонтин, Gla-протеин, которые участвуют в прикреплении остеокласта к кости
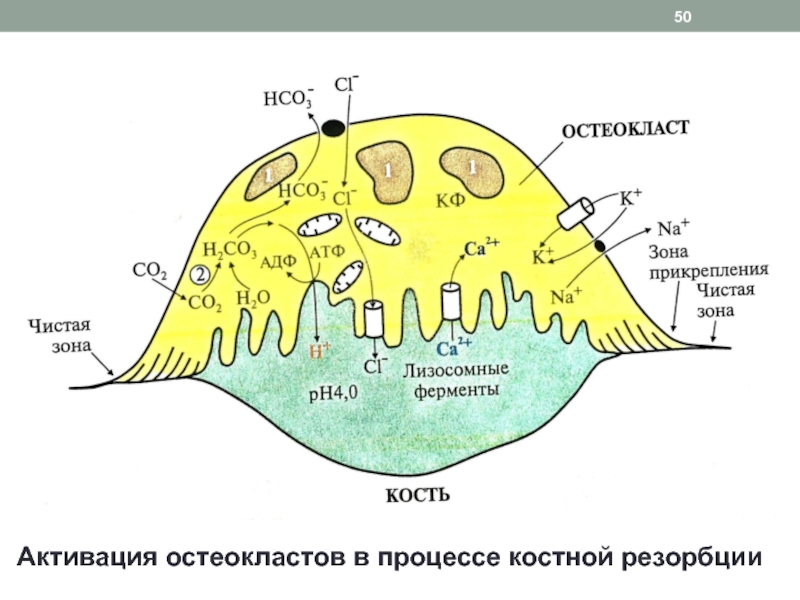
Слайд 49Этапы цикла ремоделирования костной ткани
2. Резорбция: «работа» остеокластов
Прикрепление
остеокласта к кости
Карбоангидразная реакция и диссоциация угольной кислоты
с образованием Н+Перекачивание протонов из остеокласта в зону резорбции при помощи Н+ -АТФ-азы, Н+,К+ - АТФ-азы, переносчиков Сl- / Н+ и образование «щеточной» каемки (рН 3,5 – 4)
Секреция лизосомальных ферментов – гидролаз
Гидролиз коллагена и разрушение органической матрицы
Вымывание кальция из апатитов
Образование в кислой среде растворимых солей цитрата кальция и их поступление в кровь
Слайд 51Этапы цикла ремоделирования костной ткани
3. Реверсия
Действие локальных ростовых факторов
на остеобласты приводит к синтезу белков матрикса, секреции остеопротегерина, который
связывает RANKL и снижает активность остеокластовСекреция кислой фосфатазы остеокластами приводит к дефосфорилированию остеопонтина, сиалопротеина (белки-активаторы остеокластов), снижению активности остеокластов и к переходу к следующей стадии ремоделирования – костеобразованию
4. Костеобразование (минерализация): усиление оксигенации, синтез белков, протеогликанов, фосфорилирование белков матрикса (условие для формирования центров кристаллизации), формирование центров кристаллизации, рост кристаллов. По завершении процесса остеобласты теряют активность и превращаются в остеоциты.
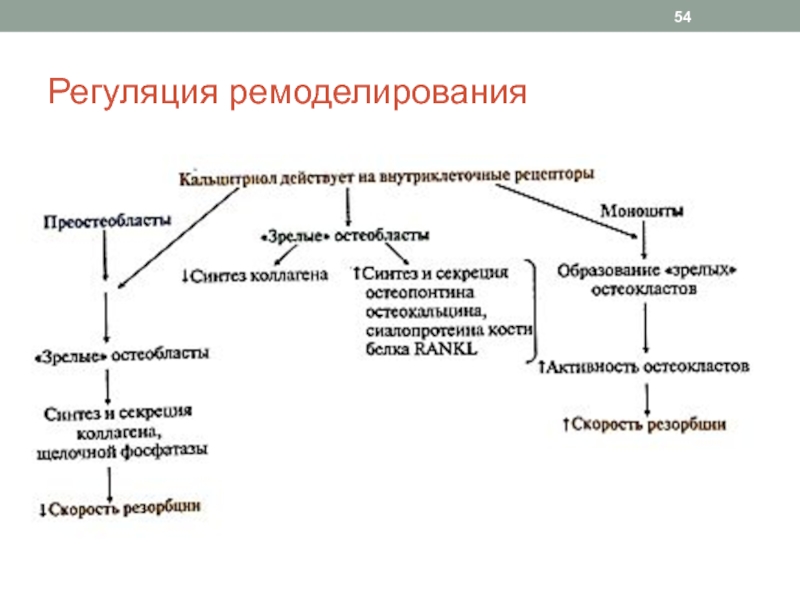
Слайд 52Регуляция ремоделирования
Паракринно-аутокринная (местная) регуляция: цитокины, фаторы роста, простагландины костной ткани
Системная
регуляция
Основные регуляторы:
Паратгормон
Кальцитриол
Кальцитонин
Половые гормоны
Слайд 55Регуляция ремоделирования
ПК А фосфорилирует белок-переносчик Са2+, что приводит к поступлению
Са2+ в цитозоль остеокласта из зоны резорбции;
это вызывает деполяризацию мембраны
и инактивацию остеокласта Кальцитонин оказывает большее влияние на растущие кости, поэтому образование костной ткани у детей и подростков происходит быстрее
Слайд 56Регуляция ремоделирования
Кортизол замедляет костеобразование: подавляет пролиферацию остеобластов, синтез остеоколлагена, остеонектина,
протеогликанов
Кортизол стимулирует костную резорбцию: индуцирует синтез рецепторов к паратгормону
Андрогены стимулируют
в остеобластах синтез фактора, ингибирующего дифференцировку преостеокластов (наступление половой зрелости тормозит рост скелета в длину). Анаболический эффект гормонов наиболее активно проявляется в присутствии гормона ростаГормоны щитовидной железы. При гипертиреозе увеличивается скорость обмена кости, повышается экскреция кальция с мочой, костеобразование начинает отставать от резорбции. При гипотиреозе замедляется образование и минерализация кости
Слайд 57Регуляция ремоделирования
Гормон роста повышает активность остеобластов, которые стимулируют остеокласты, поэтому
происходит очаговая деминерализация, затем увеличение объема органической основы кости и
ее минерализацияИнсулин активирует метаболизм остеобластов, стимулирует синтез костного матрикса, обеспечивает минерализацию костной ткани.
Слайд 58Регуляция ремоделирования
В остеобластах эстрогены стимулируют синтез остеоколлагена, остеонектина, ЩФ. Вызывают
раннюю минерализацию, поэтому в период полового созревания происходит остановка роста
скелетаЭстрогены стимулируют синтез 1-α-гидроксилазы в почках (синтез кальцитриола) и рецепторов к кальцитриолу в энтероцитах
Слайд 59Маркеры метаболизма костной ткани
Для большинства патологических состояний характерно ускорение ремоделирования
кости с усилением процесса резорбции
Маркеры резорбции костной ткани:
пиридинолин,
дезоксипиридинолин (продукты деградации остеоколлагена)остеопротегерин (остеокласт-ингибирующий фактор) / RANKL (стимулятор образования остеокластов)
Маркеры формирования костной ткани:
остеокальцин (активатор остеокластов) – снижение содержания – усиление минерализации
щелочная фосфатаза
специфические пептиды проколлагена I типа
Слайд 60Заключение
Функции соединительной ткани обусловлены особенностями ее строения и метаболизма
Нарушения метаболизма
соединительной ткани лежат в основе патогенеза ряда заболеваний, таких как
мукополисахаридозы (лизосомные болезни, или болезни накопления вследствие снижения активности ферментов катаболизма гликозамингликанов), латиризм (деформация позвоночника вследствие дестабилизации коллагеновых фибрилл в результате снижения активности лизилоксидазы), патологии костной ткани, связанные с изоморфными замещениями, рахит, остеопетроз (дисфункция остеокластов вследствие недостаточности карбоангидразы), остеопороз.Слайд 61Литература
1. Биохимия: учебник для студентов медицинских ВУЗов / Е. С.
Северин -М.: ГЭОТАР-Медиа, 2014. -768 с. (раздел 15)
2. Биологическая химия
с упражнениями и задачами: учебник / ред. С. Е. Северин. - М.: ГЭОТАР-Медиа, 2013. - 624 с. (С. 301 – 324)3. Биологическая химия: учебник для студентов медицинских вузов / А.Я. Николаев. – М.: Мед. информ. агенство, 2007. – 568 с.