или
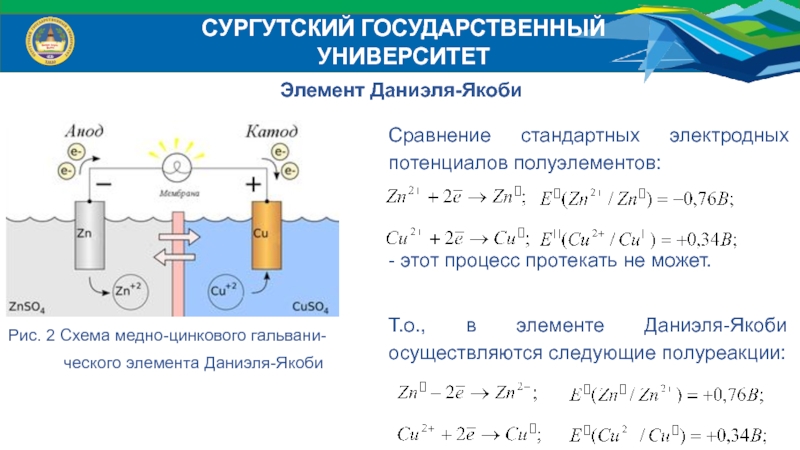
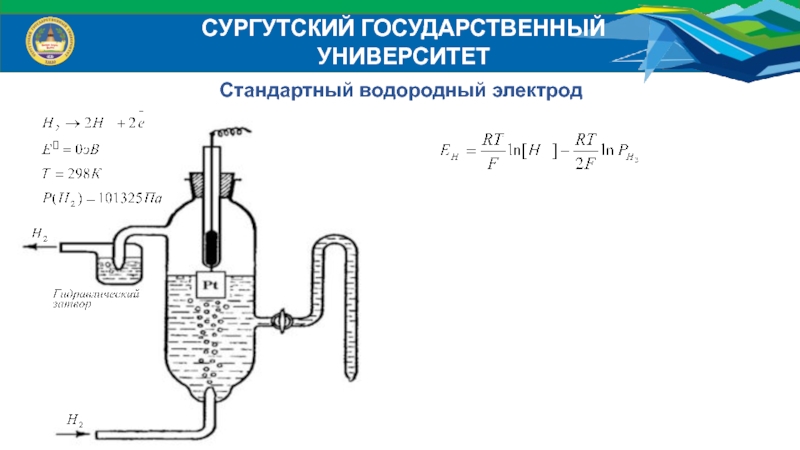
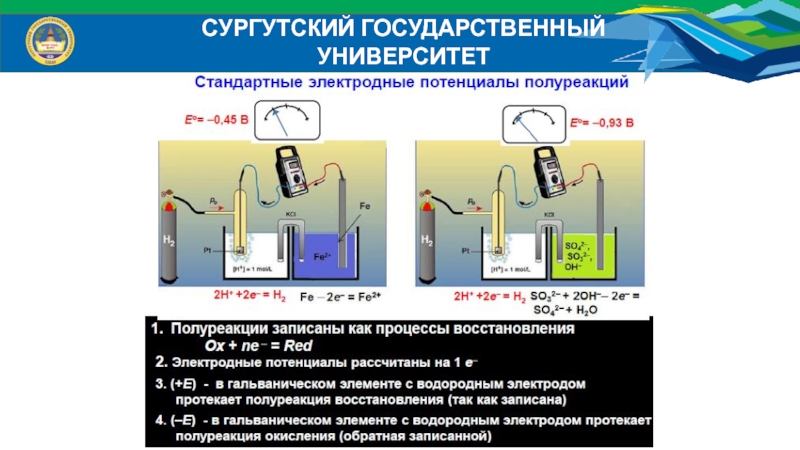
Окислительно-восстановительными называют взаимодействия, связанные с передачей электронов от одних атомов к другим.
Окисление металла:
Восстановление металла из его оксида:
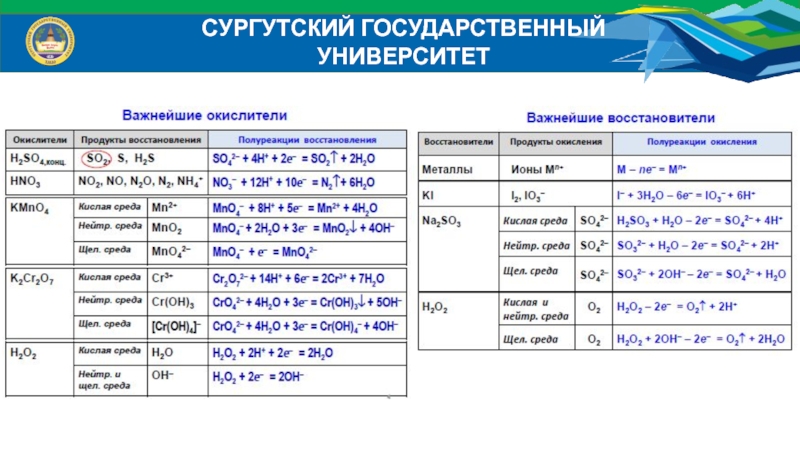
Окислителем называют ион, который при взаимодействии принимает электроны;
восстановителем - ион, отдающий электроны.
СУРГУТСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ