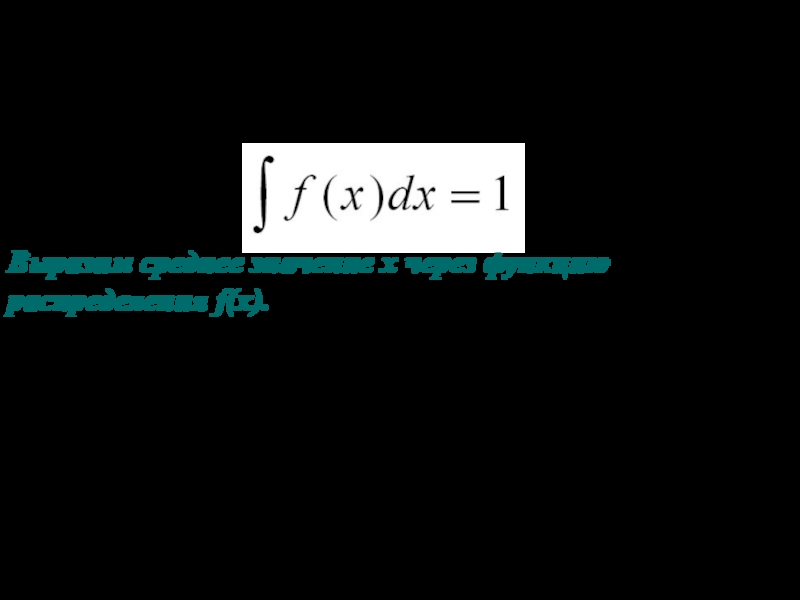Слайд 1Лекция № 11
Статистическое описание системы частиц.
1. Элементарные сведения из теории
вероятностей.
1.1. Статистический ансамбль. Вероятность.
1.2.
Среднее значение случайной величины.
1.3. Функция распределения (плотность вероятности).
2. Функция распределения молекул по скоростям – распределение Максвелла.
2.1. Фазовое пространство и пространство скоростей молекул. Принцип детального равновесия.
2.2. Функция распределения молекул по модулю скорости и по энергии.
2.3. Характерные скорости.
3. Распределение молекул в поле сил тяжести. 3.1.Барометрическая формула.
3.2.Распределение Больцмана.
3.3. Распределение Максвелла-Больцмана
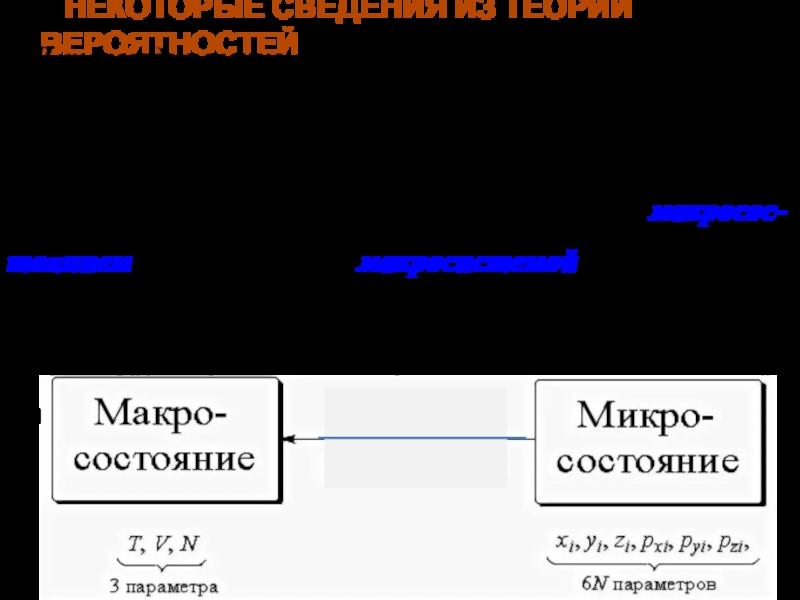
Слайд 2НЕКОТОРЫЕ СВЕДЕНИЯ ИЗ ТЕОРИИ ВЕРОЯТНОСТЕЙ
В термодинамике состояние любого тела, образован-
ного огромным числом молекул, задается параметрами P,V,T, характеризующими все тело
в целом. Состояние тела, описанное таким образом называют макросос- тоянием, а само тело — макросистемой. В противопо- ложность этому, подробное описание тела с указанием, к примеру, координат и скоростей для каждой молеку- лы называют микросостоянием.
Слайд 3Практически реализовать такое описание невозможно, вследствие огромного числа молекул.
Но
оказывается системы, состоящие из такого большого числа частиц, подчиняются еще
и другим закономерностям.
Эти закономерности называются статистическими или вероятностными. Для их описания используется математический аппарат теории вероятностей.
Слайд 4Пусть имеется некоторая макросистема. Возьмем конкретную характеристику микросостояния этой системы,
например, число молекул в какой-то части сосуда. Фиксируя это число
в различные моменты времени, мы получим набор дискретных значений
х1, х2, х3 ... .
которые называют статистическим ансамблем. Некоторые результаты могут повторяться в ходе измерений. Число измерений,
давших один и тот же резуль-
тат, будем обозначать Ni .
Пусть
N1 измерений дали результат х1;
N2 измерений дали результат х2;
...
Ni измерений дали результат хi.
Слайд 5Обозначим
ΣNi = N. (1)
Набор из N результатов представляет собой весь
статистический ансамбль. Отношение Ni /N назовем относительной частотой появления результата
хi , а величину Рi, равную
назовем вероятностью появления результата хi. Имея ввиду, что N очень велико, будем опускать в дальнейшем знак lim. Из (1) следует, что
Pi = (Ni /N) = 1,
то есть сумма вероятностей всех возможных результатов измерений равна единице.
Слайд 6Вероятность получения результата xi либо xk равна
Pi или k =
(Ni + Nk)/N = Pi + Pk.
Это соотношение выражает теорему
о сложении вероятностей.
Нетрудно доказать, что вероятность одновременного появления двух статистически независимых результатов равна произведению вероятностей появления каждого:
Pi,k = PiPk.
По вероятностям появления конкретных результатов хi можно найти среднее значение х всех результатов.
Поскольку среднее значение х величины х равно сумме всех значений этой величины, деленной на количество всех значений N, то х = Nixi /N = Pixi (2)
Слайд 7Введенное нами понятие вероятности относилось к величинам, характеризуемым дискретными значениями.
Распространим
полученные результаты на случай, когда измеряемая величина х может принимать
непрерывный ряд значений от 0 до ∞. Разобьем всю область значений х на малые интервалы, величиной ε и определим вероятность ΔРх попадания результата измерения непрерывной величины х в некоторый интервал от х до х+ε.
ΔРх = ΔNx /N , (3)
где Nx число измерений, результаты которых попадают в указанный интервал(от х до х+ε).
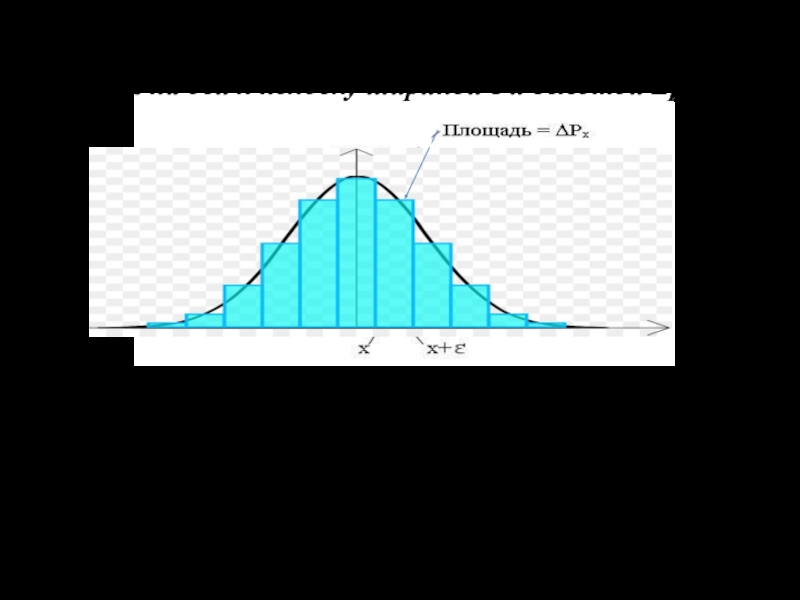
Слайд 8Отобразим графически все величины ΔРх на одной диаграмме . Для
этого отложим вверх от каждого интервала на оси х полоску
шириной ε и высотой Δрх/ε.
Эту столбчатую диаграмму называют гистограммой. В ней соотношение высот полосок отображает соотношение вероятностей получения результатов в конкретных интер- валах. Наглядно можно увидеть распределение вероятнос-тей по всему диапазону значений х. Площадь каждой полос-ки равна Рх, а площадь всей гистограммы на основании теоремы о сложении вероятностей равна единице.
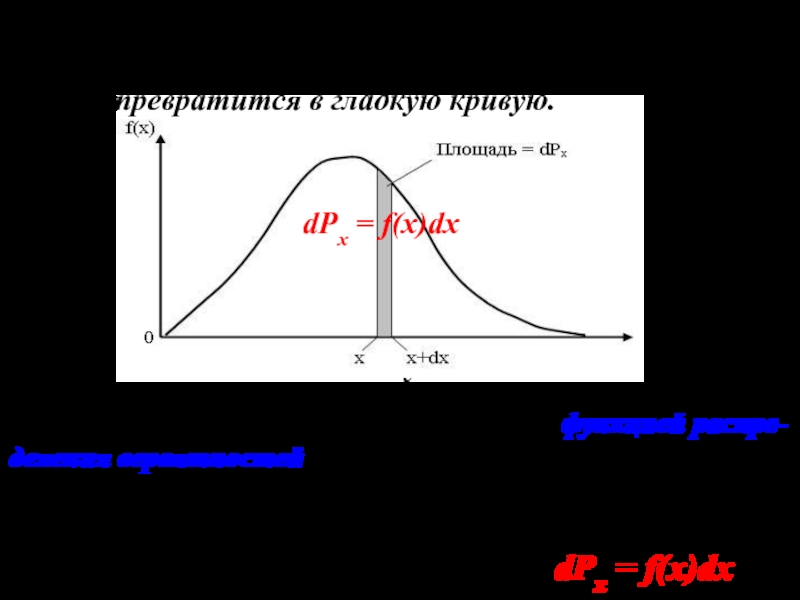
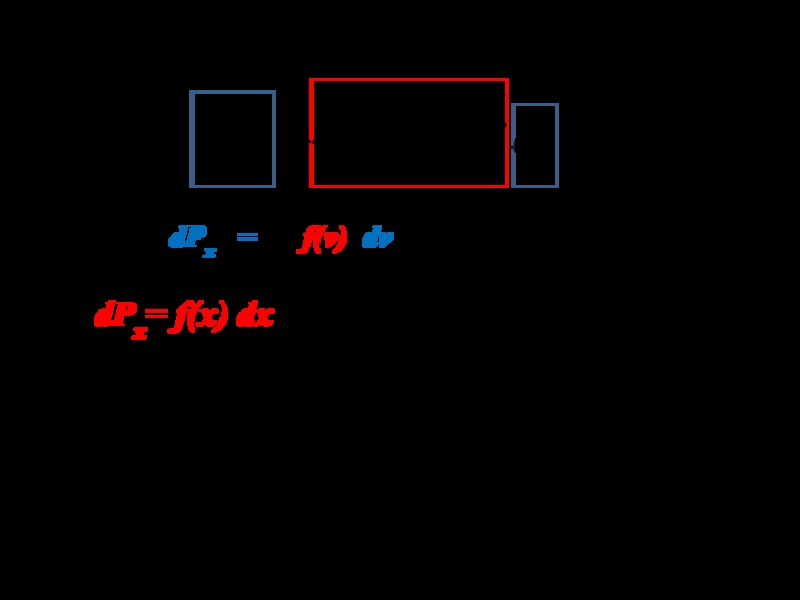
Слайд 9Если теперь устремить величину интервала ε к нулю, то ступенчатая
линия, ограничивающая гистограмму сверху, превратится в гладкую кривую.
dPx =
f(x)dx
Эта кривая с математической точки зрения представля- ет некоторую функцию f(x). Ее называют функцией распре- деления вероятностей. Площадь любого столбика шириной dx под кривой f(x) по аналогии с гистограммой будет равня- ться вероятности dPx попадания результата измерения в интервал значений от х до х+dx. То есть dPx = f(x)dx (4)
Слайд 10Площадь, ограниченная всей кривой распределения вероятностей, так же как и
площадь гистограммы, равна единице. То есть
(5)
Выразим среднее значение х через
функцию распределения f(x).
Результат в интерале х — x+dx получается в числе случаев, равном NdPx . Сумма измеренных результатов для данного диапазона составит хNdPx . Полная сумма Σ всех результатов измерения х (по всему диапазону х) выразится интегралом
Слайд 11
Отношение этой суммы к общему числу N всех измерений даст
среднюю величину х
(6)
Некоторые физические величины выражаются через квадраты
измеренных величин, например, кинетическая энергия пропорциональна квадрату скорости. По аналогии с формулой (6) можно выразить средний квадрат измеренной величины х
(7)
Слайд 12Функция распределения молекул по скоростям – распределение Максвелла.
В разных областях
физики используют понятие фазового пространства, в котором каждому возможному состоянию
системы соответствует одна точка фазового пространства. К примеру для системы материальных точек фазовым пространством являются координаты и импульсы всех точек. Такое представление во многих случаях упрощает описание поведения и эволюции сложных систем.
Мы будем рассматривать задачу о распределении молекул газа по скоростям и для ее решения тоже воспользуемся некоторым абстрактным пространством, описывающем состояние совокупности большого числа молекул. Назовем его пространством скоростей частиц. Допустим, мы знаем скорости всех молекул газа.
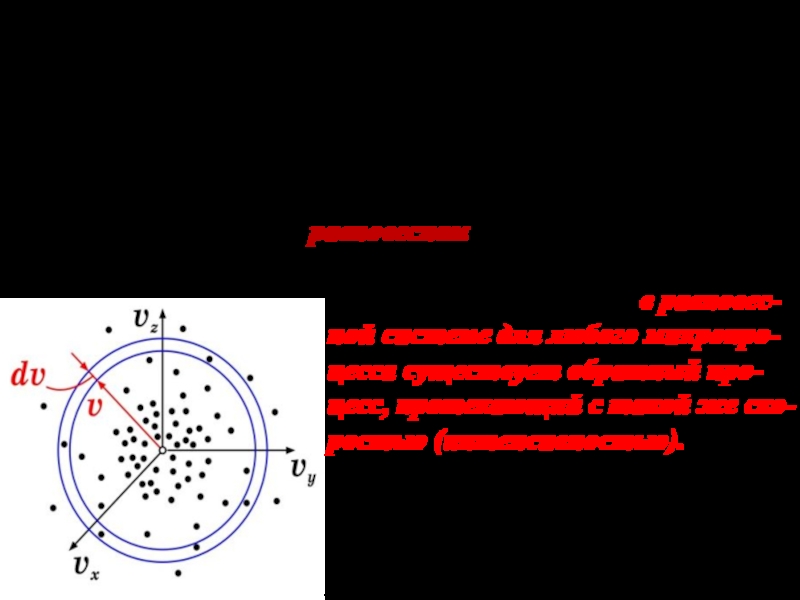
Слайд 13Введем трехмерное пространство скоростей vx,vy,vz . Каждая молекула имеет скорость
и отобразится в этом пространстве точкой. Весь набор молекул создаст
в пространстве скоростей облако точек. Внутри облака происходит движение, т.к. молекулы при столкновениях изменяют свою скорость.
Пусть газ находится в равновесном состоянии.
В стат. физике установлен принцип детального равновесия: в равновес- ной системе для любого микропро- цесса существует обратный про- цесс, протекающий с такой же ско- ростью (интенсивностью). Соглас- но этому принципу за любой интер- вал времени число перескоков моле- кул с высоких скоростей на низкие равно числу обратных перескоков.
Слайд 14В результате плотность распределения точек в пространстве скоростей в условиях
равновесия газа во времени не изменяется и можно говорить о
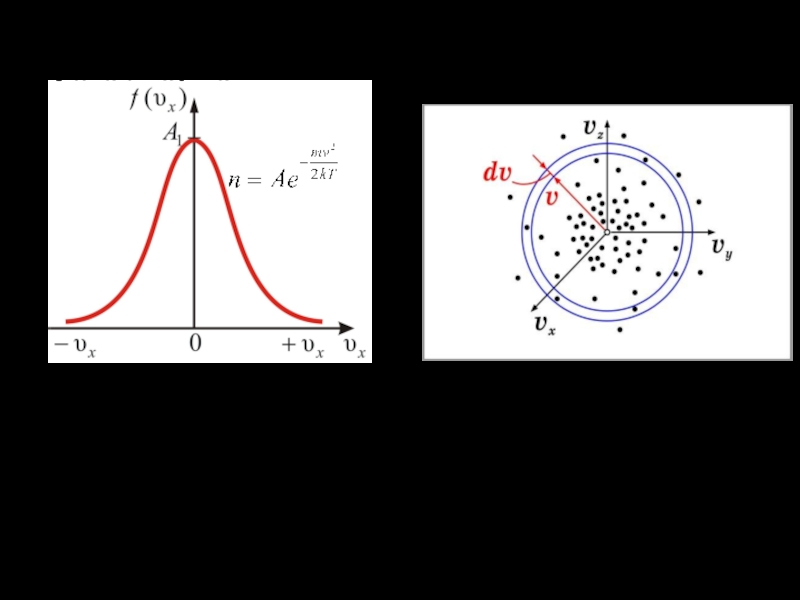
равновесном распределении плотности точек в пространстве скоростей. Максвелл нашел вид функции, определяющей плотность точек в пространстве скоростей. Оказалось, что концентрация n (число точек в единичном объеме скоростей) равна
где А — константа,
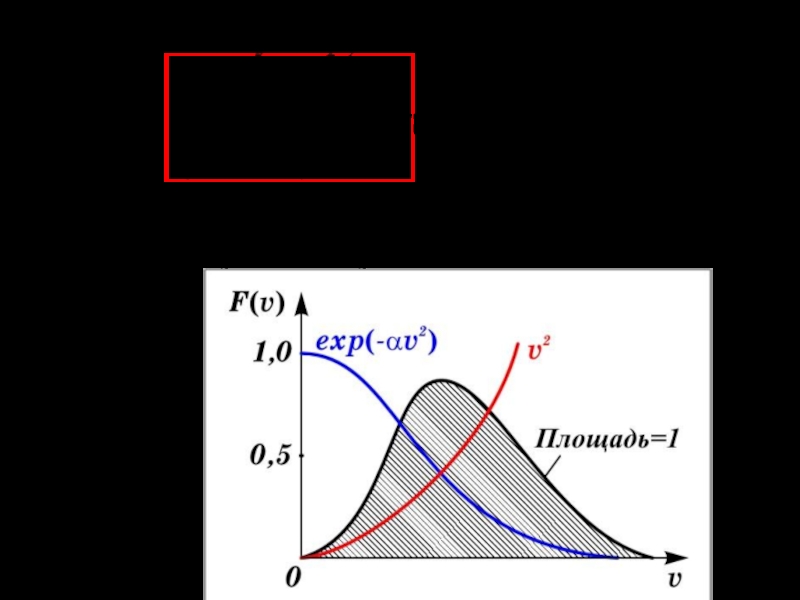
Слайд 15Графиком этой функции является, так называемая, кривая Гаусса.
Определим число точек
dNv , попадающих в интервал скоростей от v до v
+ dv ( то есть попадающих в промежуток между сферами с радиусами v и v + dv). Объем этого промежутка равен 4πv2dv. Таким образом,
dNv = n4πv2dv.
Слайд 16Относительное число молекул, имеющих скорость в интервале от v до
v + dv будет равно
dPx =
f(v) dv
В левой части уравнения согласно (3) dNx /N = dРх. Тогда из (4) (dPx= f(x) dx) следует, что в правой части стоит произведение функции распределения по скоростям f(v) на dv. Таким образом,
Константу А можно найти из условия нормировки.
Слайд 17Окончательно получаем
Ход кривой распределения по скоростям обусловлен конкуренцией двух сомножителей, входящих в функцию распределения: v2 и exp(-av2)
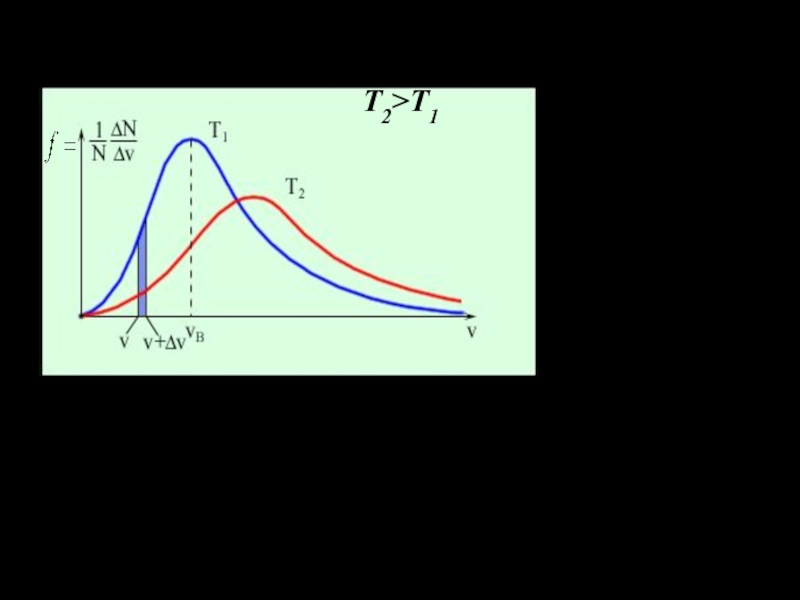
Слайд 18График функции распределения для различных температур имеет вид:
Т2>T1
Площадь заштрихованной полоски равна вероятно- сти того, что скорость молекулы лежит внутри интервала скоростей: Площадь под кривыми равна 1 (то есть, это вероятность, того что скорость молекулы лежит в интервале от 0 до ∞) .
Слайд 19Итак, f(υ) – имеет смысл вероятности, то есть показывает,
какова вероятность, что любые молекулы газа имеет скорость, заключённую в
единичном интервале, включающем заданную скорость υ.
Функцию f(υ) также называют плотностью вероятности.
Максвелл Джеймс Клерк
(1831 – 1879) –
английский физик. Работы посвящены электродинамике,
молекулярной физике, оптике, механике, теории упругости.
Слайд 20Из функции распределения молекул по скоростям (8)
(8)
следует что:
- вид распределения
молекул газа по скоростям, для каждого газа зависит от рода
газа — массы молекулы m и от параметра состояния - температуры Т. Давление p и объём газа V на распределение молекул не влияют.
В показателе степени стоит отношение кинети-ческой энергии, соответствующей данной скорости v к средней энергии kT теплового движения молекул при данной температуре:
Слайд 21Фактически, распределение Максвелла характеризует распределение молекул по значениям кинетической энергии
молекул ε.
Из распределения Максвелла можно получить функцию распределения молекул по
энергиям ε в явном виде. Для этого в вероятности f(v)dv от переменной v нужно перейти к переменной ε = mv2/2. С этой целью в функцию f(v)dv нужно подставить
и
Получим
Слайд 22Имея в явном виде функцию распределения молекул по энергиям f(ε),
мы можем вычислить среднюю кинетическую энергию теплового движения молекул, пользуясь
формулой (6).
(6)
Подставив сюда найденную нами функцию f(ε), в результате интегрирования получим
Этот результат согласуется с полученным ранее в рамках молекулярно-кинетической теории.
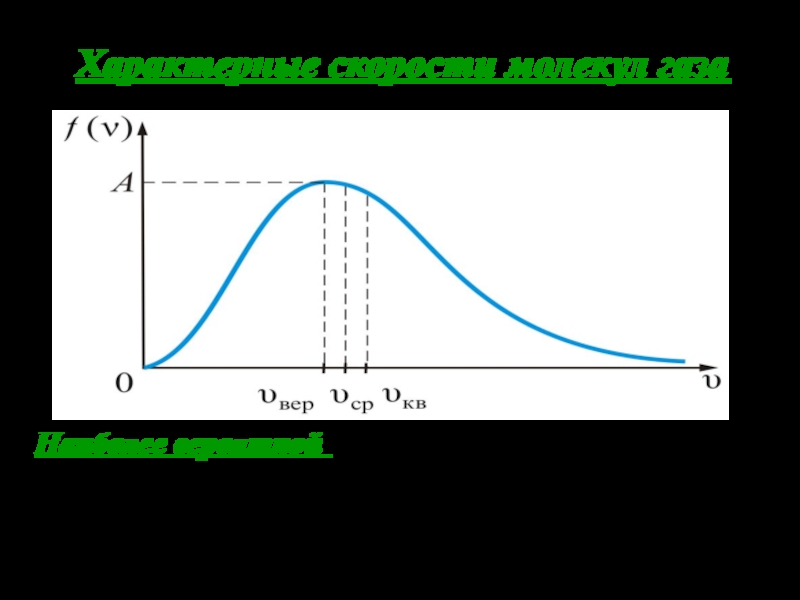
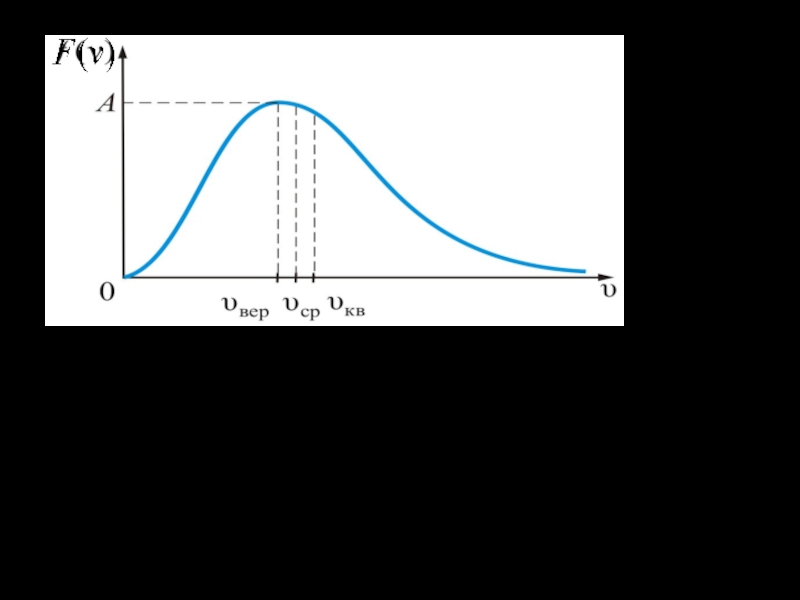
Слайд 23Характерные скорости молекул газа
Наиболее вероятной называют такую скорость молекул Vвер
, для которой функция распределения f(v) принимает максимальное значение. Находится
из условия экстремума функции: f ′(vвер ) = 0.
Слайд 24Решение этого уравнения дает следующее значение наиболее вероятной скорости:
Здесь М
– масса моля.
Для средней скорости молекул Vc по формуле
(6), подставив туда функцию распределения Максвелла, получим:
Слайд 25 Средней квадратичной скоростью молекул Vкв называется квадратный корень
из среднего значения квадрата скорости, то есть
Нахождении
(Vкв) c помощью функции распределения по формуле (7) дает значение:
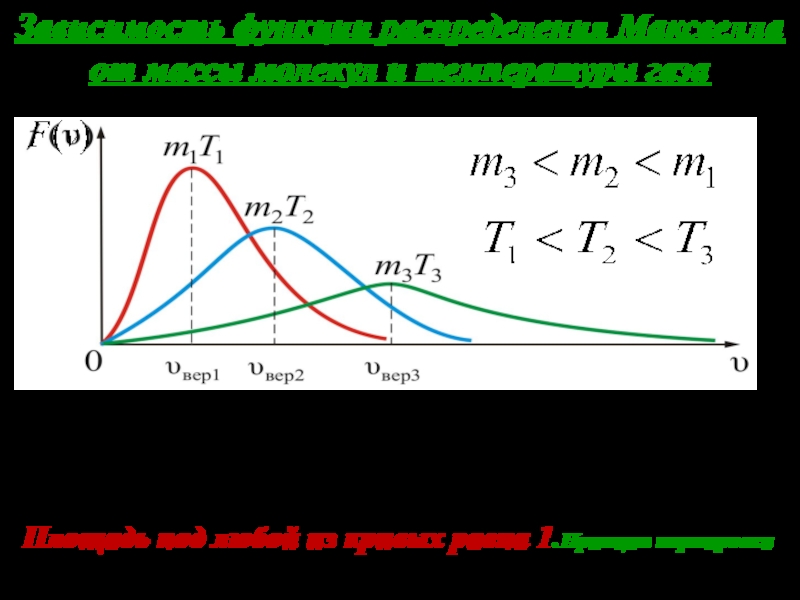
Слайд 27Зависимость функции распределения Максвелла от массы молекул и температуры газа
На
рисунке изображены три кривые, которые можно тракто- вать, либо как
соответствующие разным m (при одинаковой Т), либо как отвечающие разным Т при одинаковых m. Чем больше температура и меньше масса молекул, тем выше их скорости.
Площадь под любой из кривых равна 1.Принцип нормировки
Слайд 28 Важно знать как будет изменяться положение максимума кривой:
Максвелловский
закон распределения по скоростям и все вытекающие следствия справедливы только
для газа в равновесной системе при условии, что на молекулы не действуют внешние силы. Закон статистический и выполняется тем лучше, чем больше число молекул.
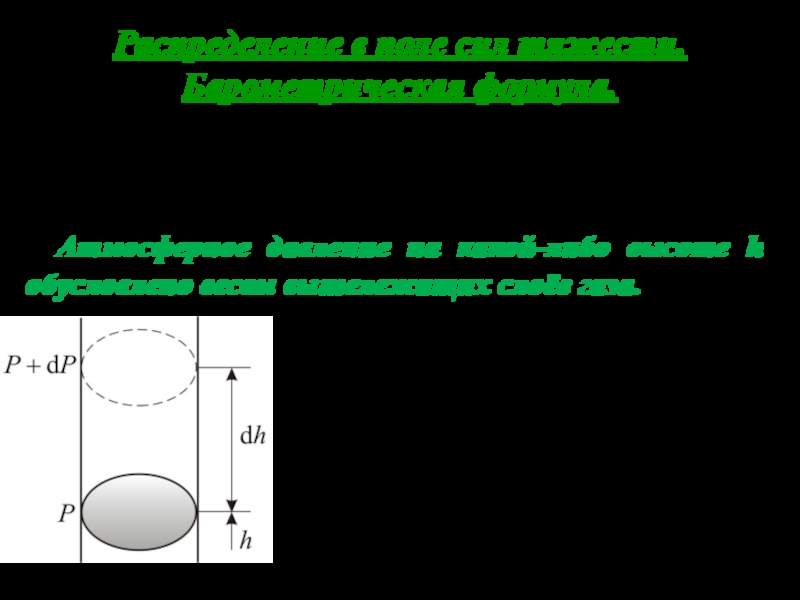
Слайд 29Распределение в поле сил тяжести. Барометрическая формула.
Рассмотрим ещё один,
очень важный закон – распределение молекул по высоте в поле
земного тяготения.
Атмосферное давление на какой-либо высоте h обусловлено весом вышележащих слоёв газа.
Пусть P – давление на высоте h, а P + dP – на высоте
С увеличением высоты давление уменьшается (на рис. показана алгебраическая сумма )
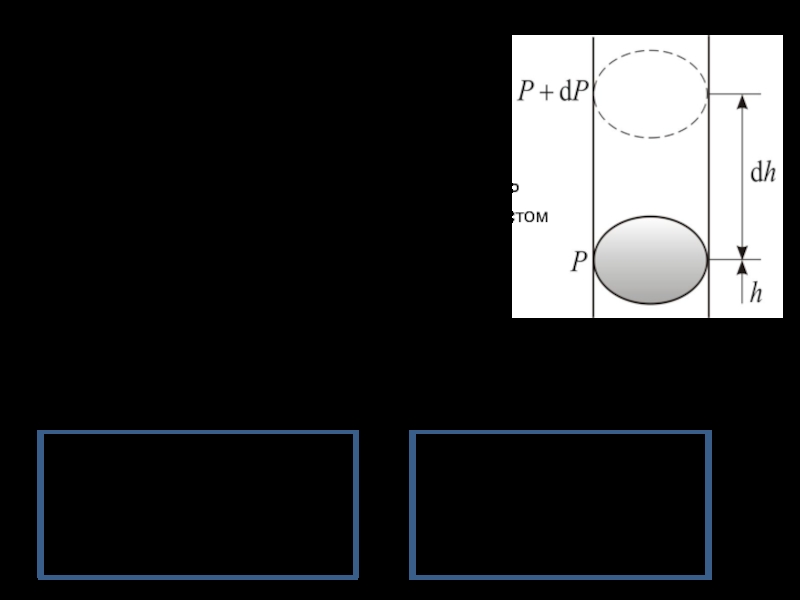
Слайд 30Поскольку давление Р слоя воздуха толщиной h равно
приращение давления dP
в слое dh
– плотность газа на высоте h,
масса одной
молекулы,
- концентрация молекул,
учтено, что Р
падает с ростом h
Слайд 31Проинтегрируем последнее уравнение при
(условие т/д равновесия) и
.
- давление
Потенцируем
или
Полученные формулы называются барометрической
формулой
при
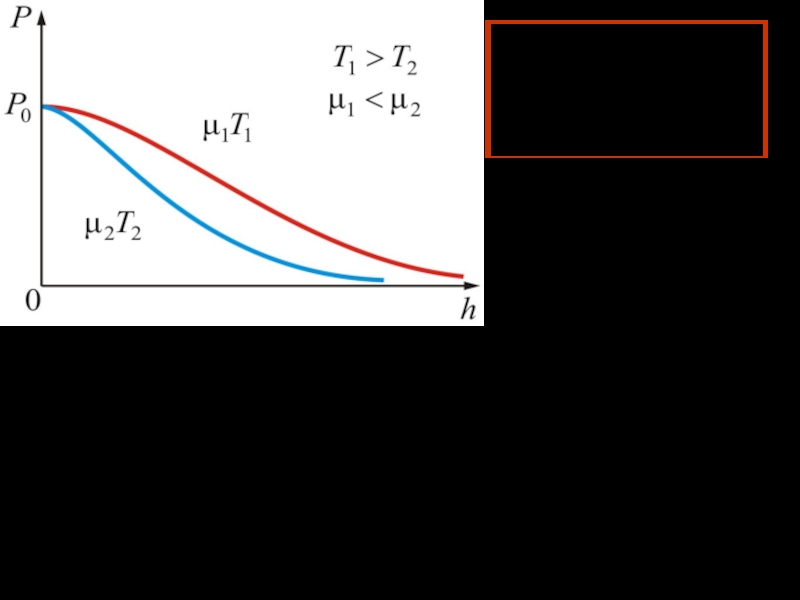
Слайд 32Из барометрической формулы следует, что P убывает с высотой тем
быстрее, чем тяжелее газ (чем больше μ) и чем ниже
температура (например, на больших высотах концентрация легких газов Не и Н2 гораздо больше чем у поверхности Земли).
На рисунке изображены две кривые, которые можно трактовать, либо как соответствующие разным μ (при одина-ковой Т), либо как отвечающие разным Т при одинаковых μ.
Слайд 33Распределение Больцмана
Распределение Больцмана определяет распределение частиц в силовом поле
Земли в условиях теплового равновесия.
Из основного уравнения молекулярно-кинетической теории:
следует, что давление Р пропорционально концентрации n. Заменим P и P0 в барометрической формуле на n и n0 и получим распределение Больцмана :
где n0 и n концентрации молекул на высоте h = 0 и h, соответственно.
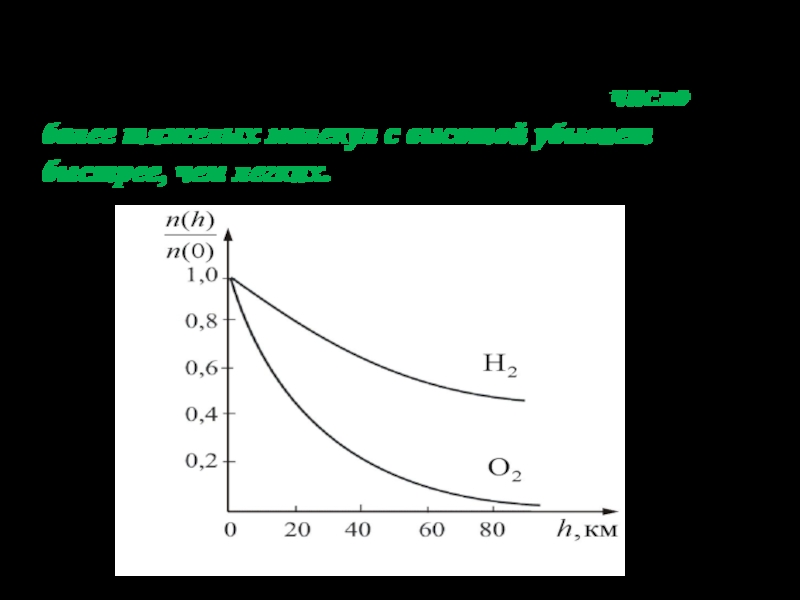
Слайд 34На рисунке показана зависимость концентрации различных газов от высоты. Видно,
что число более тяжелых молекул с высотой убывает быстрее, чем
легких.
– потенциальная энергия, следовательно, распределение
Больцмана характеризует распределение частиц по значениям потенциальной энергии:
– это закон распределения частиц по потенциальным энергиям – распределение Больцмана. Здесь n0 – число молекул в единице объёма там, где .
Больцман доказал, что формула справедлива не только в потенциальном поле сил гравитации, но и в любом потенциальном поле, для совокупности любых одинаковых частиц, находящихся в состоянии хаотического теплового движения.
Слайд 36Закон распределения Максвелла-Больцмана
Распределение Максвелла и Больцмана можно объединить
в один закон Максвелла-Больцмана.
Число частиц, координаты которых лежат
в объеме , то есть в интервалах
Из них число молекул, скорости которых лежат в интервале
Слайд 37Окончательно:
Функция распределения Максвелла-Больцмана:
Ф - это число молекул, находящихся в единичном
объеме с центром в точке (x,y,z), скорости которых находятся в
единичном интервале скоростей вблизи скорости v.