Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция № 2 ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Содержание
- 1. Лекция № 2 ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- 2. Термохимия - это область химической науки, изучающая
- 3. Формы существования энергии: химическая, электрическая, механическая, ядерная, солнечная и др.
- 4. Энергия - это мера способности взаимодействия и
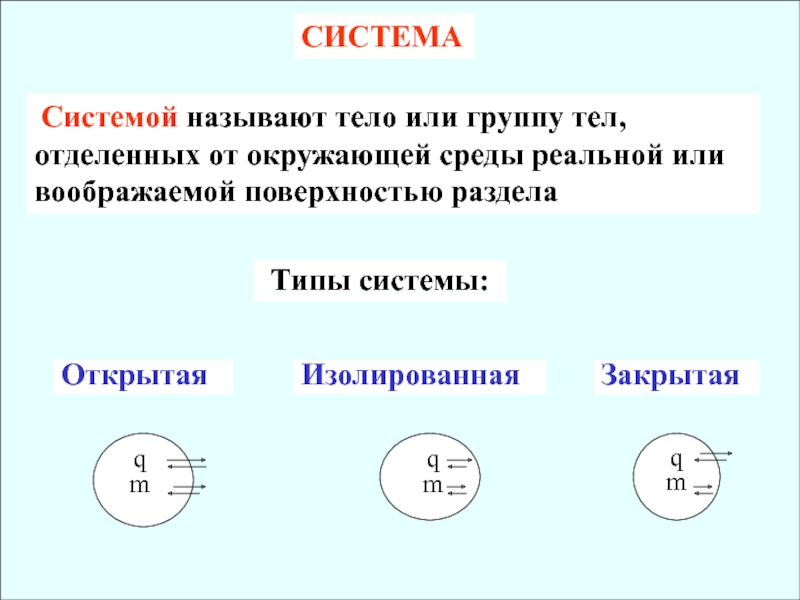
- 5. CИСТЕМА Системой называют тело или группу тел,
- 6. Параметры состояния cистемы: P,V,T, m или С
- 7. Внутренняя энергия UЧто такое внутренняя энергия системы
- 8. Переход системы из одного состояния в другое
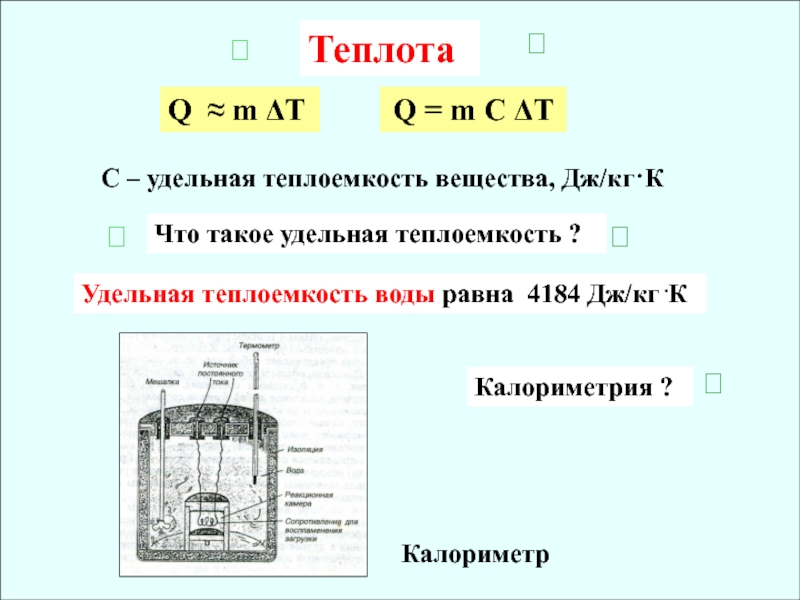
- 9. ТеплотаQ m TQ = m C
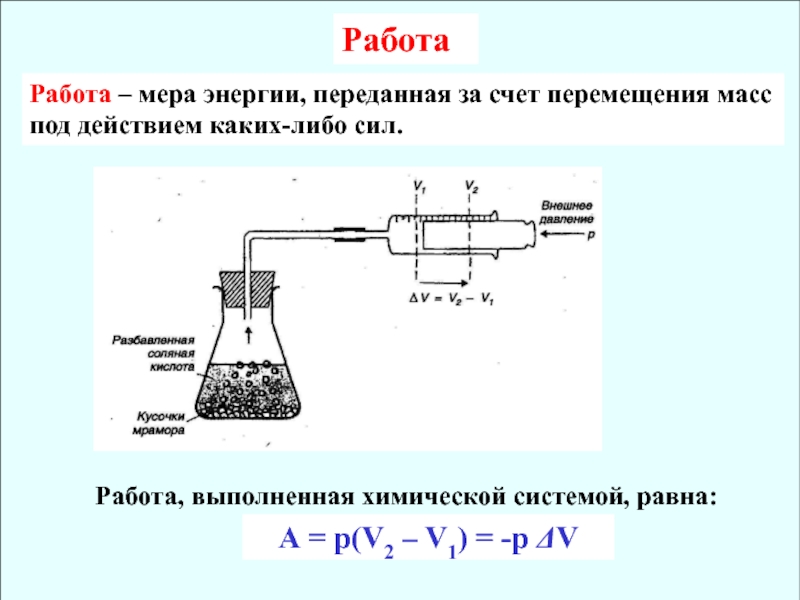
- 10. РаботаРабота – мера энергии, переданная за счет
- 11. Тепловой эффект реакцииЕсли к системе подводится тепло
- 12. Тепловой эффект реакции (Q) – это количество
- 13. Экзотермические реакции Н < 0 Эндотермические
- 14. Si(к) + O2(г) = SiO2(к) + 860
- 15. О стандартной энтальпии образования веществаΔH°f
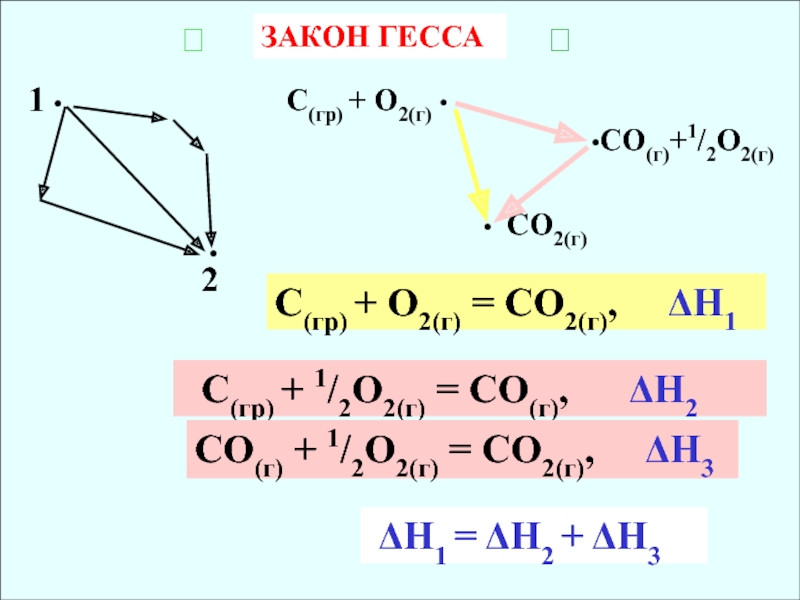
- 16. ЗАКОН ГЕССА1 • •СO(г)+1/2O2(г) • 2С(гр) +
- 17. СЛЕДСТВИЕ ИЗ ЗАКОНА ГЕССАH = (Hобр)прод
- 18. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Формы существования энергии: химическая, электрическая, механическая, ядерная, солнечная и др.
Слайд 4Энергия - это мера способности взаимодействия и движения материальных систем
Другими
словами
Энергия - это мера способности совершать работу системой
(или над системой)Энергия химических реакций способна превращаться в следующие виды энергии: например - электрическую, cветовую, тепловую
Слайд 5CИСТЕМА
Системой называют тело или группу тел, отделенных от окружающей
среды реальной или воображаемой поверхностью раздела
Типы системы:
Открытая
Изолированная
Закрытая
Слайд 6Параметры состояния cистемы: P,V,T, m или С (независимые термодинамические переменные)
Функции
состояния системы: U, H, S, G …
(зависят от термодинамических параметров
состояния)PV =
m
M
RT
Слайд 7Внутренняя энергия U
Что такое внутренняя энергия системы ?
U = Eкин.
+ Eпот.
Размерность внутренней энергии:
Дж/моль или кал/моль; 1
кал = 4,18 Дж
U = U2 – U1
Слайд 8Переход системы из одного состояния в другое называется процессом. Различают
процессы:
изотермические (Т
- const)изобарные (Р - const),
изохорные (V - const).
Передача энергии системе или от системы происходит в форме теплоты Q или в форме работы А.
Теплота – это неупорядоченная форма передачи энергии
Работа – это упорядоченная форма передачи энергии
Слайд 9Теплота
Q m T
Q = m C T
C – удельная
теплоемкость вещества, Дж/кг·К
Что такое удельная теплоемкость ?
Удельная теплоемкость воды равна
4184 Дж/кг ККалориметрия ?
Калориметр
Слайд 10Работа
Работа – мера энергии, переданная за счет перемещения масс под
действием каких-либо сил.
А = р(V2 – V1) = -р V
Работа,
выполненная химической системой, равна:Слайд 11Тепловой эффект реакции
Если к системе подводится тепло Q, оно распределяется
на изменение внутренней энергии и на работу
Q = U +
рVУравнение теплового эффекта реакции
Изобарный процесс
Qp = U + pV = (U2 –U1) + p (V2 – V1)
Qp = (U2 + pV2) – (U1 + pV1)
Изохорный процесс
Qv = U
Энтальпия Н (H = U + PV)
Qp = H2 – H1 = H
Энтальпия – это энергия, запасенная веществом при его образовании.
Слайд 12Тепловой эффект реакции (Q) – это количество теплоты, которое выделяется
или поглощается в результате реакции между определенными количествами реагентов, задаваемых
стехиометрическими коэффициентамиТепловой эффект реакции (Q) равен изменению внутренней энергии (U) для изохорного процесса или изменению энтальпии (H) для изобарного процесса.
Для химических реакций: Q (или Н) 50-500 кДж/моль
Для фазовых переходов: Q (или Н) 5-50 кДж /моль
Слайд 13Экзотермические реакции Н < 0
Эндотермические реакции Н
> 0
Н = – Н = Н1 - Н2
Н+ +
ОН- Н2ОН
– Н
Стандартная энтальпия реакции:
(р = 101325 Па (~105 Па), Т = 298 К (25 ºС)
Н298 или H
Слайд 14Si(к) + O2(г) = SiO2(к) + 860 кДж
Si(к) + O2(г) = SiO2(к), H = – 860 кДж
термохимическое уравнение
Термохимические уравнения
Si + O2 = SiO2 уравнение химической реакции
Внимание! H – со знаком “минус”, Q - со знаком “плюс”
Слайд 15О стандартной энтальпии образования вещества
ΔH°f (Br2(ж)) = 0
ΔH°f
(Br2(г)) = 29 кДж/моль
Нобр или Hf
CаО(к) + СО2(г) = СаСО3(к),
ΔH° = –175 кДж Са(к) + С(гр) + 3/2О2(г) = СаСО3(к), ΔH° = ?
СаСО3
Нобр = ?
Слайд 16ЗАКОН ГЕССА
1 •
•СO(г)+1/2O2(г)
• 2
С(гр) + О2(г) •
• СО2(г)
С(гр)
+ О2(г) = СО2(г), H1
С(гр) + 1/2О2(г)
= СО(г), H2CО(г) + 1/2О2(г) = СО2(г), H3
H1 = H2 + H3
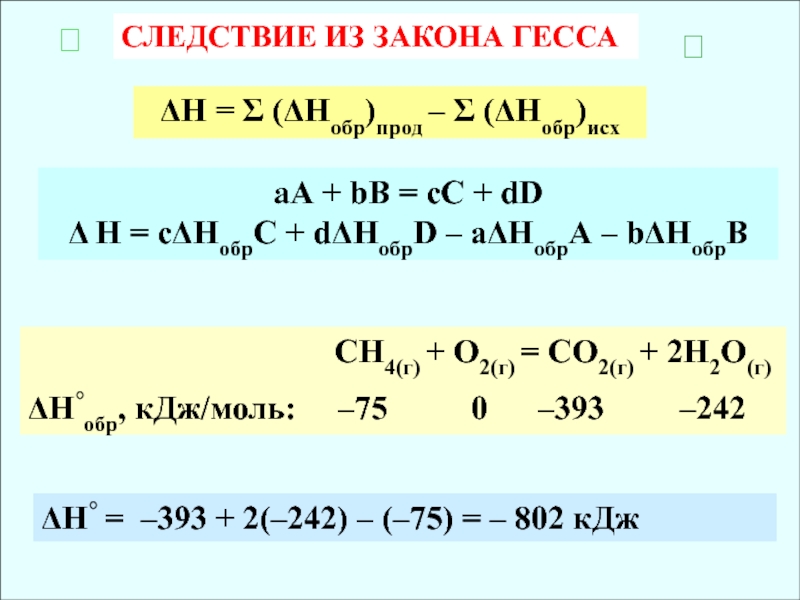
Слайд 17СЛЕДСТВИЕ ИЗ ЗАКОНА ГЕССА
H = (Hобр)прод – (Hобр)исх
аА
+ bB = cC + dD
H = cHобрС +
dHобрD – аHобрА – bHобрB СН4(г) + О2(г) = СО2(г) + 2Н2О(г)
H°обр, кДж/моль: –75 0 –393 –242
H° = –393 + 2(–242) – (–75) = – 802 кДж