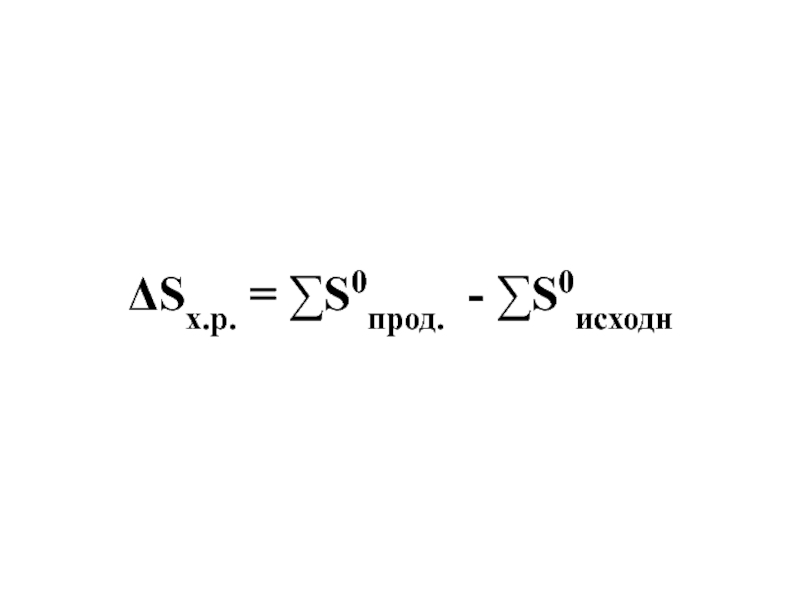Слайд 1
Лекция №1
Тема: Предмет и задачи курса. Термодинамика. Термохимия.
Дисциплина «Химия»
Для
студентов 1 курса специальности: “Общая медицина”, “Стоматология”
Лектор: и.о.доцента кафедры биохимии
и химических дисциплин, кандидат химических наук
Болысбекова Салтанат Манарбековна
Слайд 2Цель и задачи:
Определить значение химии в системе медицинского образования
Сформировать основные понятия химической термодинамики и термохимии
Ознакомить с методикой расчетов
на основании закона Гесса.
Слайд 3Актуальность:
Химическая термодинамика является теоретической основой для изучения обмена веществ
и энергии в живом организме. Позволяет установить специфические особенности преобразования
различных видов энергии, определяет возможность, направление и пределы протекания химических процессов.
Слайд 4План лекции:
Введение.
Основные понятия термодинамики.
Закон Гесса и следствия из него.
Заключение
Обратная
связь
Слайд 5«…медик без довольного познания химии совершен быть не может…».
М.В.Ломоносов
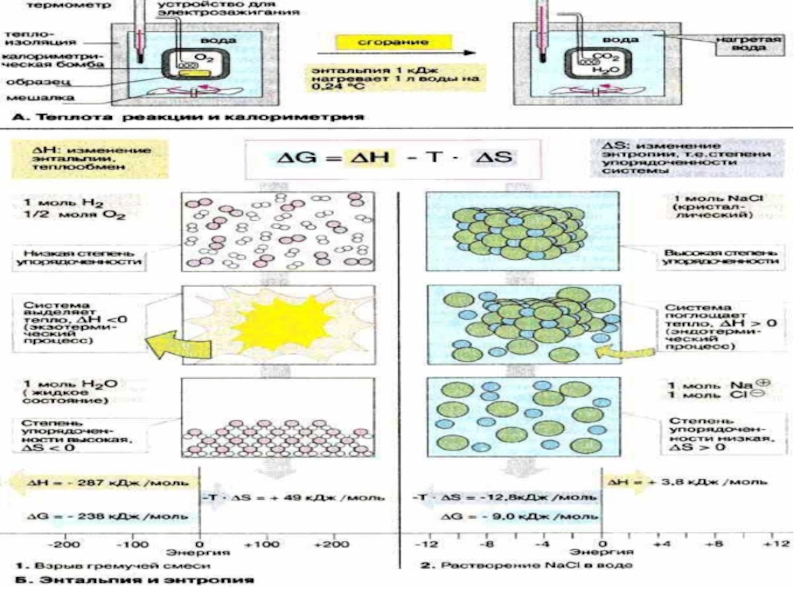
Слайд 6Основные понятия термодинамики.
Термодинамика – это наука о взаимосвязи между различными
видами энергии, о возможности, направленности и пределах самопроизвольно идущих процессов.
Слайд 7Термодинамическая система – это отдельное тело, состоящее из большого числа
частиц, или часть пространства физического мира, отделенная от внешней среды
реальной или воображаемой границей.
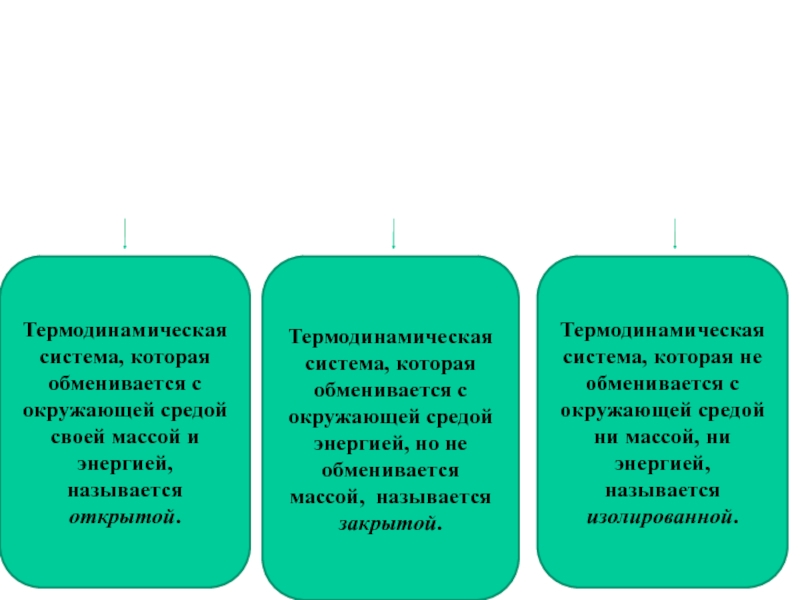
Слайд 8Термодинамическая система, которая обменивается с окружающей средой своей массой и
энергией, называется открытой.
Термодинамическая система, которая обменивается с окружающей средой энергией,
но не обменивается массой, называется закрытой.
Термодинамическая система, которая не обменивается с окружающей средой ни массой, ни энергией, называется изолированной.
Слайд 10Гомогенной термодинамической системой называется система, все части которой, во всем
объеме, имеют одинаковые свойства.
Гетерогенной называется термодинамическая система, отдельные части
которой отделены друг от друга видимой поверхностью раздела при переходе через которую резко изменяются свойства системы.
Фаза – это часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком.
Слайд 12Теплота Q, поглощенная системой, идет на изменение ее внутренней энергии
U и на совершение работы А :
Q = U + А
А-это работа против внешнего давления:
А = рV, где V = (V2 –V1) – изменение объема системы.
Слайд 15Раздел термодинамики, изучающий тепловые эффекты химических реакций, называют термохимией.
Слайд 16ГЕСС, ГЕРМАН ИВАНОВИЧ
(1802–1850), русский химик. Родился 26 июля (7
августа) 1802 в Женеве. Вместе с семьей переехал в Россию,
где и прошла вся его жизнь. По окончании медицинского факультета Дерптского университета (1825) занялся химией. Окончил Стокгольмский университет.
Мировую известность Гесс получил как основатель термохимии. Ученый сформулировал основной закон термохимии – «закон постоянства сумм тепла», являющийся приложением закона сохранения энергии к химическим процессам.
Слайд 17Основным законом термохимии является закон Гесса:
Тепловой эффект химических реакций не
зависит от пути протекания реакции, а зависит только от начального
и конечного состояния системы.
Слайд 18Первое следствие из закона Гесса:
Слайд 20Н Х.Р. = Н обр. (продуктов) - Нобр. (исх.)
Fе2О3(к) +
3 СО (г) → 2 Fе(к) + 3 СО2(г) +
Н
Н Х.Р. = 2Н обр.(Fе) + 3Н обр.(СО2) –
(Нобр. (Fе2О3) + 3Нобр. (СО))=
3Н обр.(СО2) - Нобр. (Fе2О3) - 3Нобр. (СО)
Слайд 21Второе следствие из закона Гесса
тепловой эффект реакции горения равен
сумме теплот (энтальпий) сгорания Нсгор. исходных веществ за вычетом суммы
теплот (энтальпий) сгорания продуктов реакции, взятых с учетом коэффициентов перед формулами этих веществ в уравнении реакции
Н0Х.Р. = Н0сгор. (исходн) - Н0сгор. (продуктов.)
Слайд 22S - энтропия - мера неупорядоченности системы (Дж/(К·моль).
Слайд 25Энергия Гиббса (G) или изобарно-изотермический потенциал -
- это часть внутренней
энергии системы, которая может перейти в полезную работу при р=const
, Т=const.
в прямом направлении;
2) если G=0, процесс (система) находится в состоянии
термодинамического равновесия;
3) если G>0, процесс самопроизвольно протекать в прямом направлении не может.
Слайд 28Чем меньше G, тем сильнее стремление к протеканию данного процесса
и тем дальше система находится от состояния равновесия.
G=G 2 -
G 1
Слайд 29Термодинамические функции систем
Слайд 30Соотношение и взаимосвязь термодинамических функций
Слайд 31Процессы, при которых в условиях р=const, Т=const – энергия Гиббса,
а при V=const, Т=const –энергия Гельмгольца убывают, наз. экзэргоническими, а
процессы, при которых эти величины возрастают - эндэргоническими
Слайд 33 По изменению величины энергии Гиббса определить возможность
протекания следующих химических реакций в прямом направлении:
СаСО3 СаО +
CO2 , G = +129 кДж
2) 8Al + 3Fe3O4 9Fe + 4 Al2O3 , G = - 3285 кДж
3) N2O4 2NO2, G = 0,0 кДж
Слайд 34Не производя вычислений определить, как изменяется энтропия в следующих реакциях:
1)
NH4NO3(к) N2O(г) + 2H2O(г)
2) Н2(г) + О2(г)
2Н2О(г) ,
3) Н2(г) + J2(г) 2НJ(г) ,
4) СО(г) + Cl2(г) COCl2(г) ,
5) FeO(к) + H2(г) Fe(к) + H2O(ж).