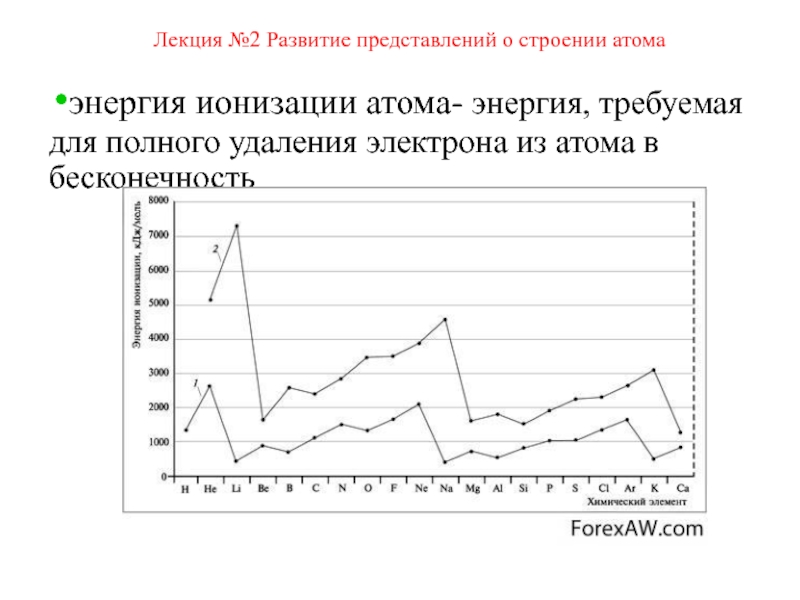
электрического тока через газы и растворы — электрон, катодные лучи
прохождение электрического тока через растворы электролита — катионы и анионы, равенство минимального заряда иона и электронаА. Беккерель (1896 г.) открытие радиоактивности
В. Томсон и Д. Д. Томсон (1904 г.) — модель строения атома (рождественский пудинг)
X. Нагаока 1904 г. — модель строения атома (Сатурн)
Э. Резерфорд (1906—1911 гг.) —ядерная модель атома