2019
ГОУ ВПО «Донбасская Национальная академия строительства и архитектуры»,
кафедра «Прикладная химия»
Курс
лекций по дисциплине «Химия» для студентов 1 курса
Направление подготовки – 08.03.01 Строительство












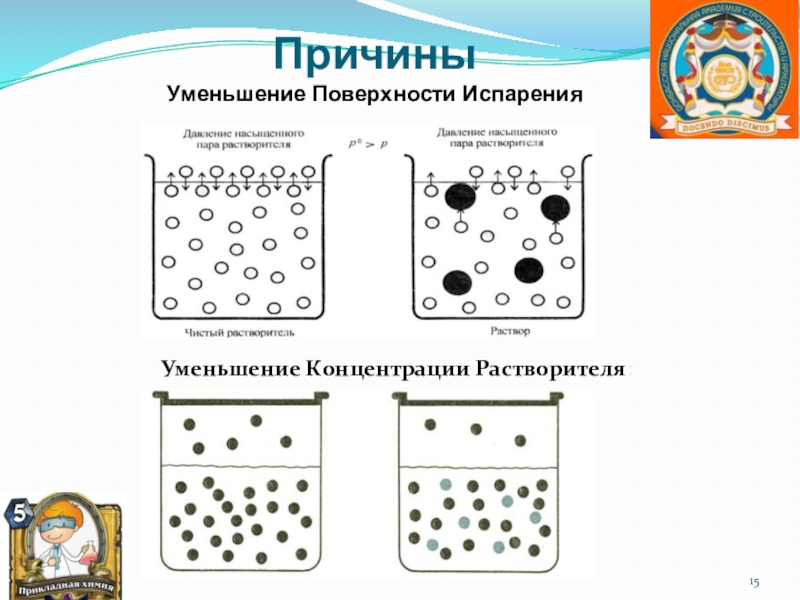
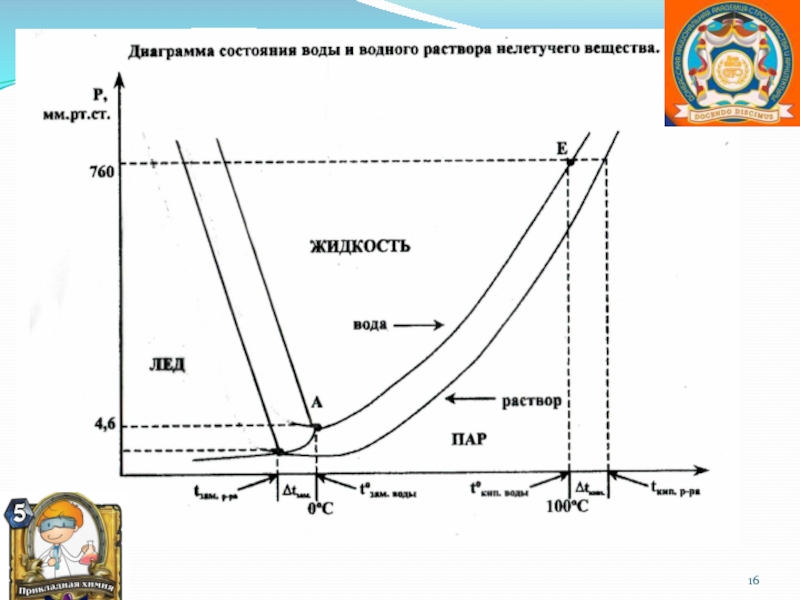
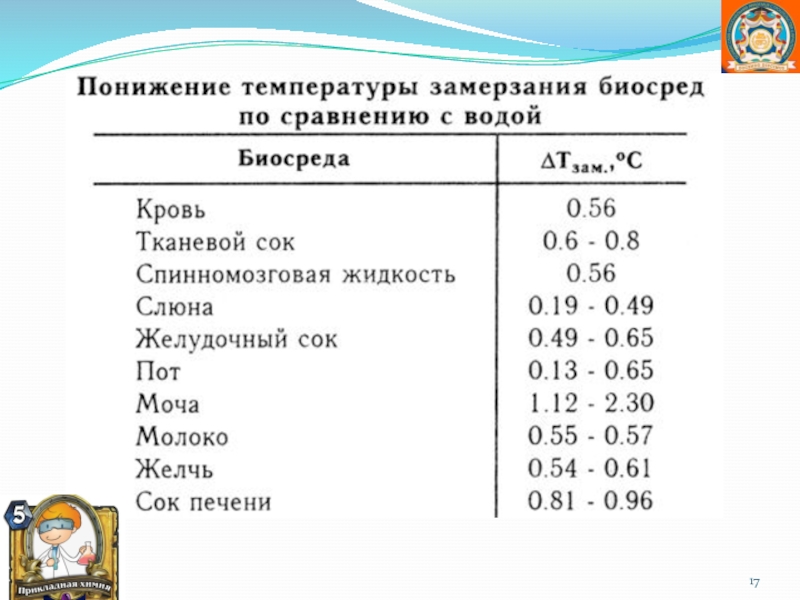
















![Автоматизация звука [ Р ] в предложениях и связной речи](/img/thumbs/6a620e2b7fb4d97433c1d0c57484cbb1-800x.jpg)