Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция9. Строение атома и периодическая система Д.И.Менделеева
Содержание
- 1. Лекция9. Строение атома и периодическая система Д.И.Менделеева
- 2. Важнейшие понятия1. Строение атома. Протоны, нейтроны и
- 3. ОСНОВНЫЕ ОПРЕДЕЛЕНИЯИзотопы— это атомы одного и того
- 4. Пример 1.1Каков символ и порядковый номер брома?
- 5. Эрне́ст Ре́зерфорд 1871 — 1937Рассеяние a –
- 6. Классическая модель строения атома – квантовая модель
- 7. Современная модель строения атомаОсновные положения: 1. Электрон
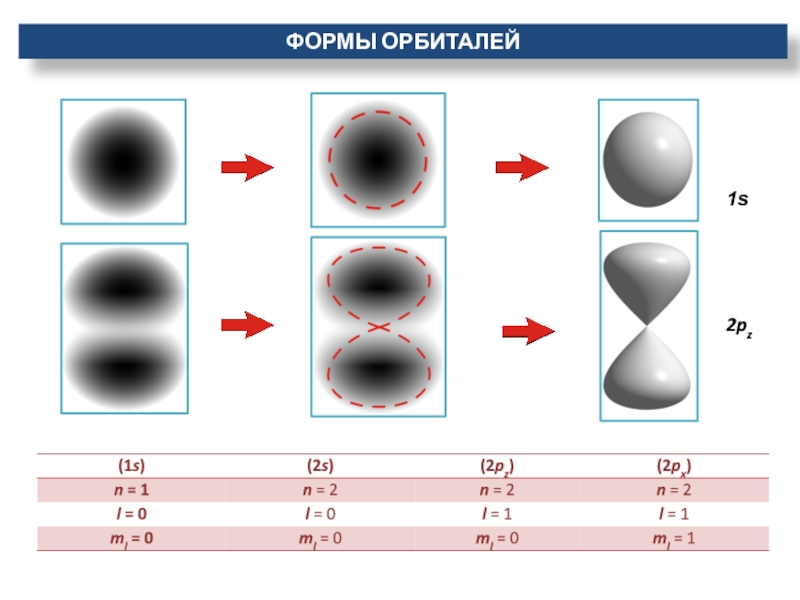
- 8. Квантовые числаОрбитальное квантовое число (l) характеризует состояние
- 9. Квантовые числа n, l, ml и ms характеризуют состояние электрона в атоме
- 10. 1s2pzФормы орбиталей
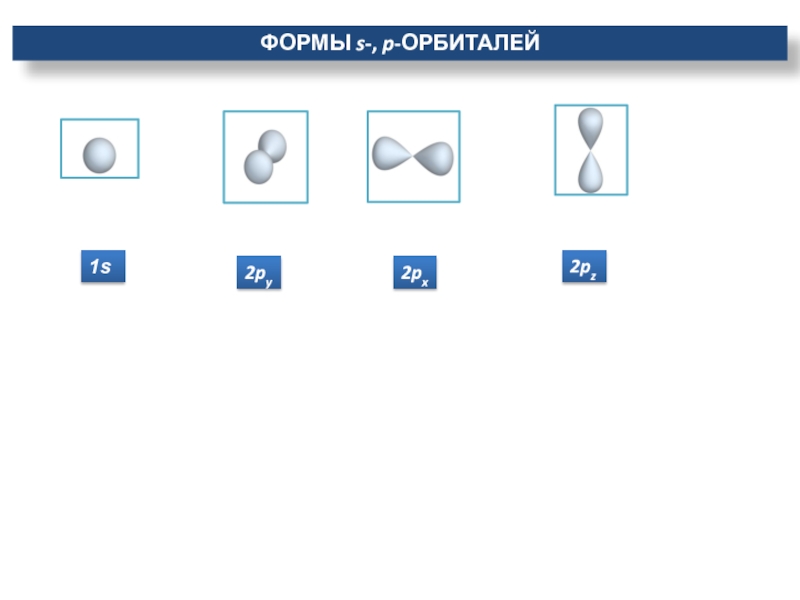
- 11. 1sФормы s-, p-орбиталей 2px2py2pz
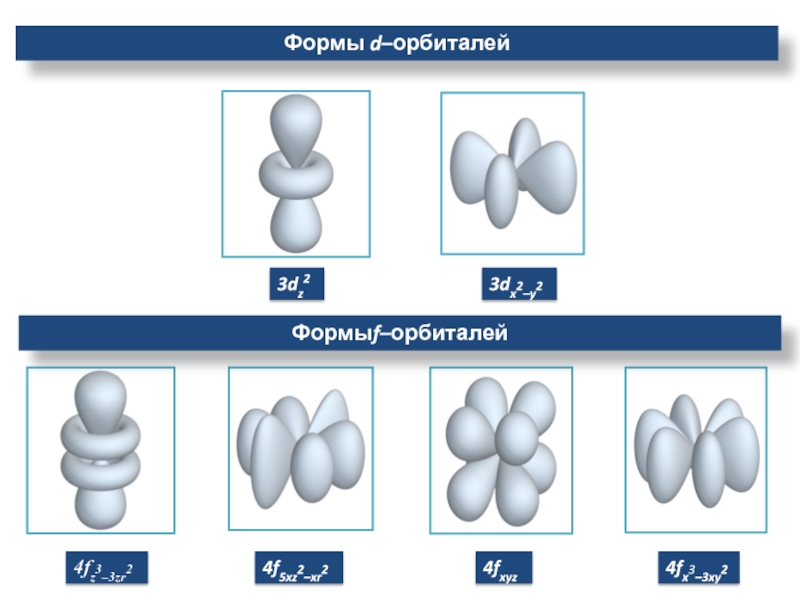
- 12. 3dz23dx2–y24fz3–3zr24f5xz2–xr24fxyz4fx3–3xy2 Формыf–орбиталейФормы d–орбиталей
- 13. Распределение электронов в атомах подчиняется: 1.
- 14. Правила Клечковского1. По мере увеличения заряда ядра атома
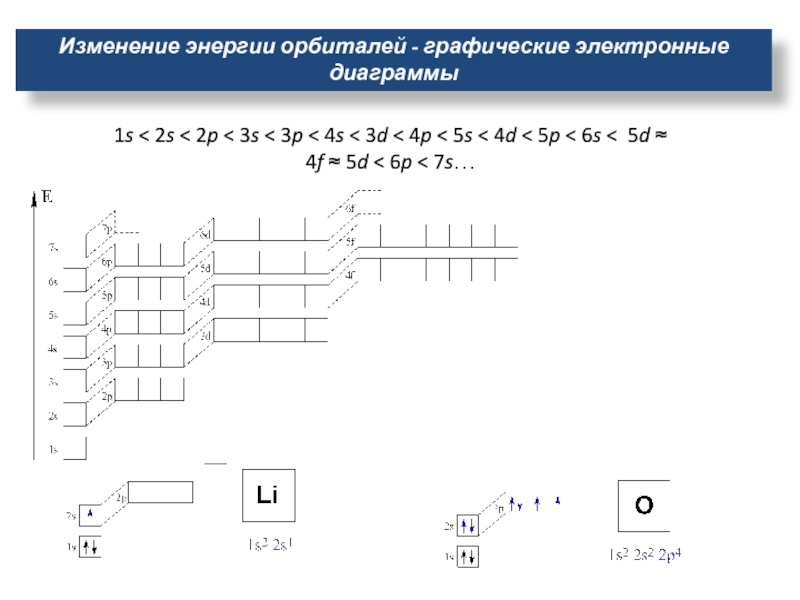
- 15. Изменение энергии орбиталей - графические электронные диаграммы1s
- 16. Правило октетовАтом удовлетворяет правилу октетов, когда он,
- 17. *Элементы – органогены: Участвуют в образовании органических
- 18. Современная формулировка периодического закона: Свойства элементов находятся
- 19. периодическая таблица Д.И. Менделеева Дмитрий Иванович Менделеев 1834 – 1907
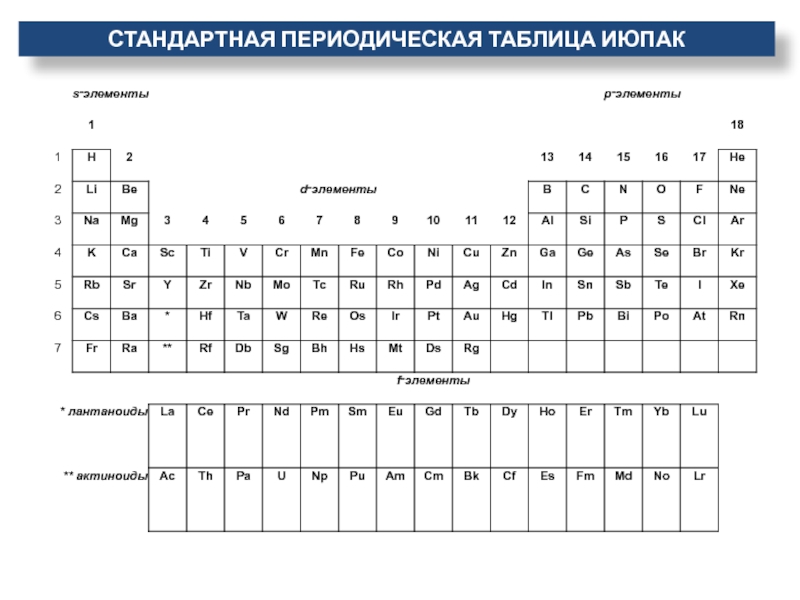
- 20. Стандартная периодическая таблица ИЮПАК
- 21. Расположение элементов в периодической таблицеМеталлоиды — химические элементы,
- 22. 2H → H20H2 + Cl2 → 2H+1ClH2
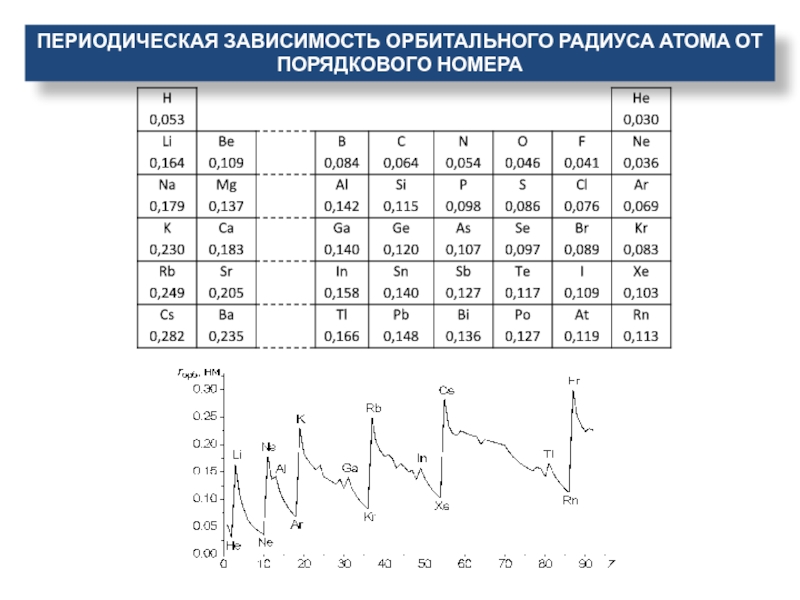
- 23. Периодическая зависимость орбитального радиуса атома от порядкового номера
- 24. ЭНЕРГИЯ ИОНИЗАЦИИ, СРОДСТВО К ЭЛЕКТРОНУПервая энергия ионизации
- 25. Энергия сродства к электрону (Eea, кДж/моль) элементов
- 26. Относительные электроотрицательности (χr) элементов главных подгруппЛайнус Карл
- 27. Периодичность химических и физических свойств элементов
- 28. Слайд 28
- 29. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Лекция9. Строение атома
и периодическая система Д.И.Менделеева
к. х.н., доцент
Асланукова М.М.
Слайд 2Важнейшие понятия
1. Строение атома. Протоны, нейтроны и электроны. Атомная единица
массы, порядковый (атомный) номер и массовое число. Элементы и их
символы.2. Изотопы. Атомные массы и естественная усредненная атомная масса. Энергия связи.
3. Металлы и неметаллы. Основа периодической систематизации элементов. Периодический закон, периодическая система.
4. Современные формы периодической таблицы. Периоды и группы. Семейства элементов.
5. Периодичность изменения химических свойств элементов на примере бинарных соединений с водородом и оксидов. Кислотные, основные и амфотерные свойства.
Слайд 3ОСНОВНЫЕ ОПРЕДЕЛЕНИЯ
Изотопы— это атомы одного и того же элемента, но
с различным числом нейтронов в ядре
Атом — мельчайшая химически неделимая
частица вещества, состоящая из положительно заряженного ядра, окруженного электронами
Ядро состоит из протонов и нейтронов. Заряд протона равен заряду
электрона, но противоположен ему по знаку
Атомный номер элемента (номер в периодической таблице) равен числу протонов в атоме этого элемента
Атомная единица массы (а.е.м.) —1/12 абсолютной массы атома изотопа
углерода 12C (1.66.10–24 г)
Относительная атомная масса (Ar) — отношение массы атома к атомной единице массы
Относительная молекулярная масса (Mr) — отношение массы молекулы к атомной единице массы
Слайд 4Пример 1.1
Каков символ и порядковый номер брома? Почему в качестве
символа брома не используется только первая буква его названия? Какой
другой элемент имеет символ В?Решение
Химический элемент — вид атомов с одинаковым числом протонов в ядре (т. е. с одинаковым зарядом ядра). Каждый элемент имеет свое название и свой символ.
Атомный номер Z =Число протонов = Число электронов
Массовое число А = Число протонов + Число нейтронов
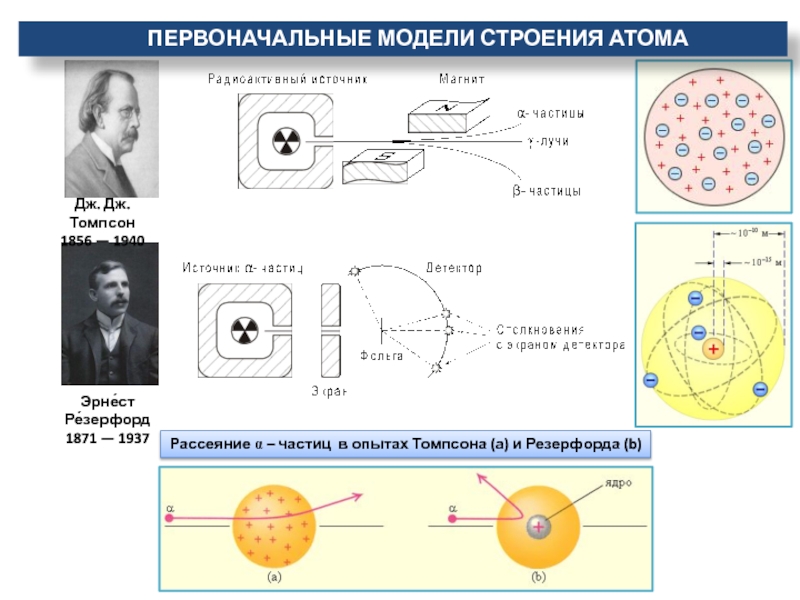
Слайд 5Эрне́ст Ре́зерфорд
1871 — 1937
Рассеяние a – частиц в опытах
Томпсона (а) и Резерфорда (b)
Первоначальные модели строения атома
Слайд 6Классическая модель строения атома – квантовая модель Бора
Нильс Бор
1885
– 1962
Электрон в атоме может находиться не в любых, а
лишь в некоторых устойчивых (стационарных) состояниях, каждому из которых соответствуют определенное значение энергии En (n = 1, 2, 3, …)Переход электрона из одного стационарного состояния в другое сопровождается излучением или поглощением кванта электромагнитного излучения (фотона, Е), частота (u) которого определяется соотношением: |E2 – E1| = hu (h = 6.625•10–34)
Макс Планк
1858 – 1947
Находясь в стационарном состоянии, электрон не излучает и не поглощает энергии
Состояние атома, способного к самопроизвольному переходу в состояние с меньшей энергией путем самопроизвольного излучения фотонов, называется возбужденным
Слайд 7Современная модель строения атома
Основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую)
природу: он может себя вести и как частица и как
волна2. Для электрона невозможно одновременно точно определить координату и скорость - принцип неопределенности Гейзенберга.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части околоядерного пространства. Вероятность нахождения электрона в разных частях пространства неодинакова. Совокупность различных положений электрона образует электронное облако. Часть электронного облака, где наиболее вероятно нахождение электрона (90%), называется атомной орбиталью.
4. Так как электроны имеют волновую природу, то состояние электрона в атоме описывается при помощи волновых уравнений. Параметрами решения волнового уравнения являются некие числа, называемые квантовыми. Они описывают состояние электрона в атоме.
Слайд 8Квантовые числа
Орбитальное квантовое число (l) характеризует состояние электрона в пределах
данного подуровня и форму орбитали. Число энергетических п/у данного уровня
= nПринимает значения от 0 до n-1: l 0, 1, 2, 3, … n-1
s p d f
Магнитное квантовое число (m l) характеризует ориентацию орбиталей в атоме и число одинаковых орбиталей на одном п/у.
Принимает значения от - l …0…. до + l
Спиновое квантовое число (ms) характеризует собственный момент импульса электрона. Для электрона в атоме величина ms может принимать только два значения: +½ и –½. Два электрона с одинаковыми значениями главного, побочного и магнитного квантовых чисел (т. е. занимающие одну и ту же орбиталь), но с противоположными (антипараллельными) значениями спинового квантового числа называют спаренными, или электронной парой
Главное квантовое число (n) — характеризует состояние электрона на уровне, т. е. общий запас энергии электрона и размеры электронного облака.
Принимает значения: n 1, 2, 3, 4, ….
Слайд 13Распределение электронов в атомах подчиняется:
1. Принцип запрета (В.
Паули, 1925)
Вольфганг Паули
1900 - 1958
В атоме не может быть
двух электронов в одинаковом квантовом состоянии, т. е. любые два электрона должны различаться значениями хотя бы одного из квантовых чисел2. Принцип наименьшей энергии - наиболее устойчивому распределению электронов по уровням и подуровням атома соответствует минимально возможное значение энергии
Слайд 14Правила Клечковского
1. По мере увеличения заряда ядра атома электроны в первую
очередь заполняют подуровень с наименьшим значением суммы главного и орбитального
квантовых чисел (n + l).Всеволод Маврикиевич Клечковский
1900 - 1958
2. Если сумма (n + l) оказывается одинаковой для двух или более подуровней, то электроны в первую очередь поступают на подуровень с меньшим значением главного квантового числа
Правило Хунда
Фридрих Хунд
1896 - 1997
В пределах данного подуровня электроны стремятся занять максимальное число свободных орбиталей, при этом неспаренные электроны имеют одинаковые (параллельные) спины.
Пример 1.3
Определите неверную запись электронных орбиталей:
Слайд 16Правило октетов
Атом удовлетворяет правилу октетов, когда он, путем присоединения, потери
или обобществления электронов с другими атомами, принимает конфигурацию ns2np6.
Уровень является
завершенным, если на нем 8 электронов (октет)или 2 электрона (для первого периода). Такой завершенный уровень обладает минимумом энергии и отвечает наиболее устойчивому состоянию атома (инертные элементы).Слайд 17*Элементы – органогены: Участвуют в образовании органических веществ.
«Металлы жизни» –
Ca, K, Na, Mg, Fe, Mn, Co, Cu, Zn, Mo
Биогенные
элементы – элементы, необходимые для построения и обеспечения жизнедеятельности различных клеток и организмовМакроэлементы (содержание > 10–3 %): O, C, H, N, P, S, Ca, K, Na, Mg, Cl, Fe
Микроэлементы (содержание 10–6 – 10–3 %): Cu, Co, Zn, Mn, Mo, V, Sr, Ba, I, F, Br, As
Основные элементы, входящие в состав организма
Слайд 18Современная формулировка периодического закона:
Свойства элементов находятся в периодической зависимости
от их атомных номеров
Периодический закон (1869 г.)
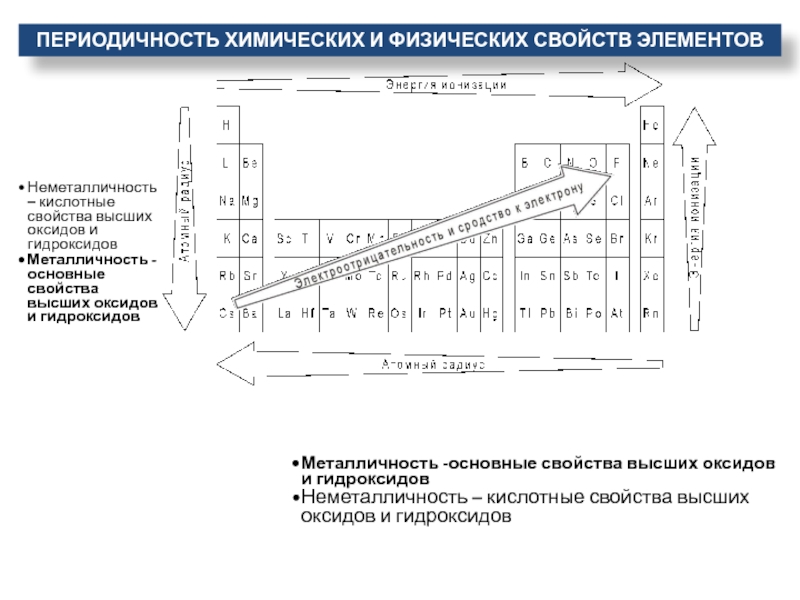
Слайд 21Расположение элементов в периодической таблице
Металлоиды — химические элементы, расположенные на границе
между металлами и неметаллами. Для них характерно образование ковалентной кристаллической
решётки и наличие металлической проводимостиНеметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической таблицы
Металлы — группа элементов, обладающая характерными металлическими свойствами (высокая тепло- и электропроводность, положительный температурный коэффициент и др.)
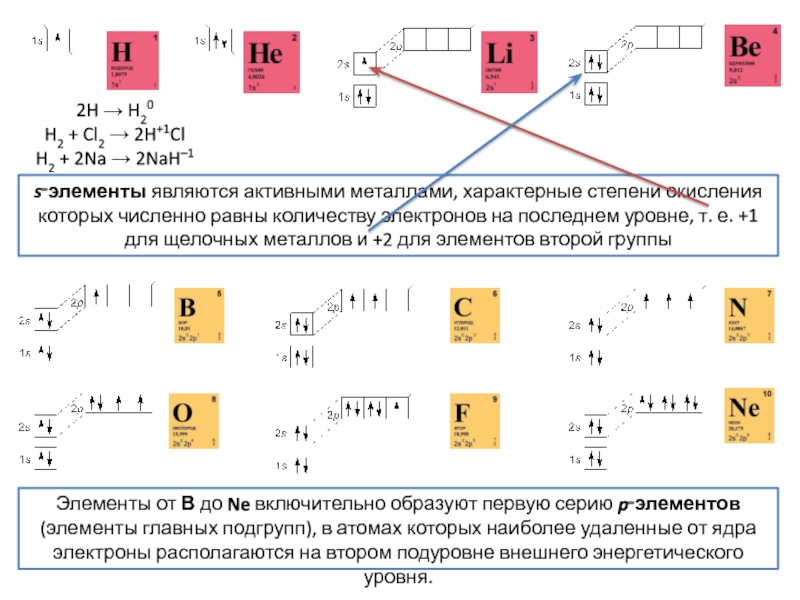
Слайд 222H → H20
H2 + Cl2 → 2H+1Cl
H2 + 2Na →
2NaH–1
s‑элементы являются активными металлами, характерные степени окисления которых численно
равны количеству электронов на последнем уровне, т. е. +1 для щелочных металлов и +2 для элементов второй группыЭлементы от В до Ne включительно образуют первую серию p‑элементов (элементы главных подгрупп), в атомах которых наиболее удаленные от ядра электроны располагаются на втором подуровне внешнего энергетического уровня.
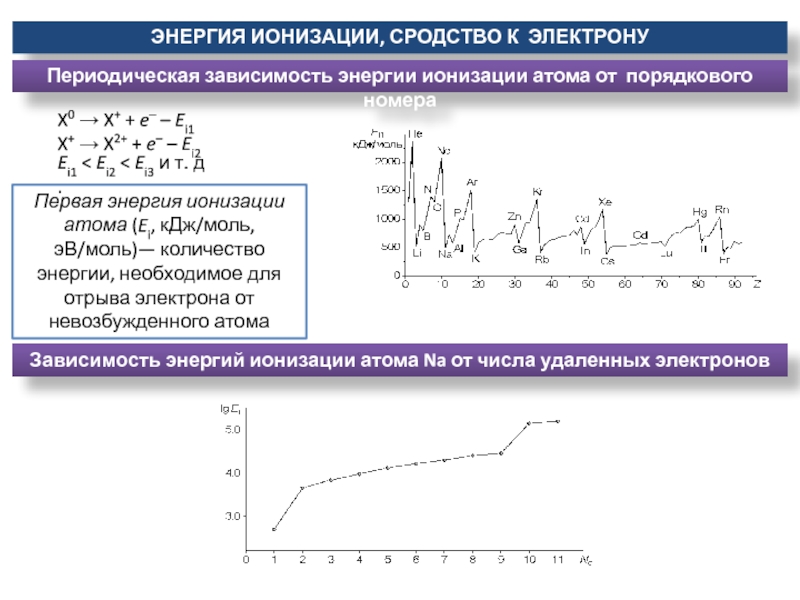
Слайд 24ЭНЕРГИЯ ИОНИЗАЦИИ, СРОДСТВО К ЭЛЕКТРОНУ
Первая энергия ионизации атома (Ei, кДж/моль,
эВ/моль)— количество энергии, необходимое для отрыва электрона от невозбужденного атома
Зависимость энергий ионизации атома Na от числа удаленных электронов
Периодическая зависимость энергии ионизации атома от порядкового номера
Слайд 25Энергия сродства к электрону (Eea, кДж/моль) элементов главных подгрупп
Сродство атома
к электрону (electron affinity ,
Eср, кДж/моль, эВ/моль)— энергетический эффект
присоединения электрона к нейтральному атому Э, с превращением его в отрицательный ион Э–X0 + e– → X– + Eср
Потенциал ионизации (φi)
Ei = eφi, где e — заряд электрона
1 эВ равен 1,6021 × 10–19 Дж (96,4853 кДж/моль)
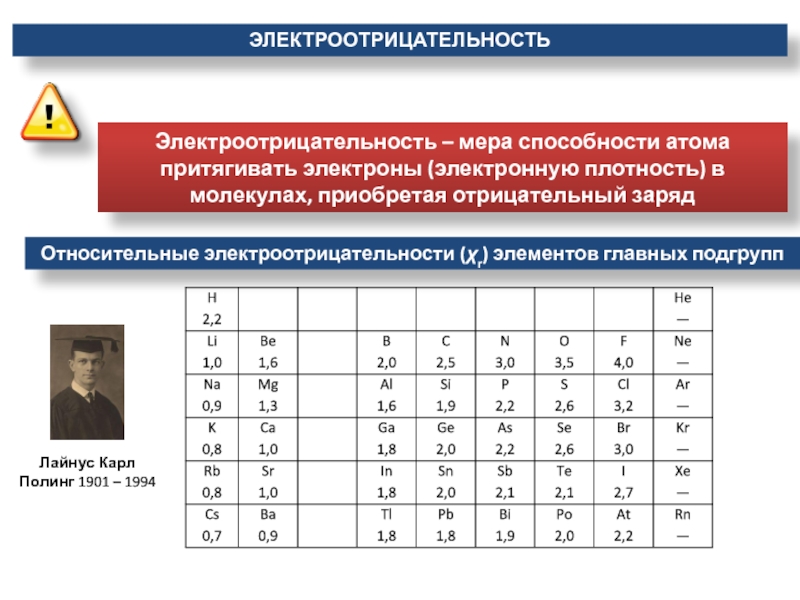
Слайд 26Относительные электроотрицательности (χr) элементов главных подгрупп
Лайнус Карл Полинг 1901 –
1994
Электроотрицательность – мера способности атома притягивать электроны (электронную плотность) в
молекулах, приобретая отрицательный заряд ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ