Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекція №1 з біологічної хімії для студентів фармфакультету, спеціальність “
Содержание
- 1. Лекція №1 з біологічної хімії для студентів фармфакультету, спеціальність “
- 2. Біохімія – це наука, яка досліджує процеси
- 3. Біохімія - одна з провідних дисциплін, що
- 4. Досягнення українських біохіміків Льв. біхімік Парнас Я.О.
- 5. Слайд 5
- 6. Молекулярна маса білків від 6000 Дал.Ізоелектрична точка
- 7. Денатурація білка– це втрата ним нативних властивостей
- 8. ФЕРМЕНТИ (ензими) це біокаталізатори переважно білкової природи
- 9. Будова складного фермента
- 10. Позначення в ензимології:Е – фермент, ензим –
- 11. Номенклатура ферментів (прийнята у 1961 році у
- 12. Класифікація ферментів 1. Оксидоредуктази - каталізують ОВР
- 13. Одиниці активності ферментівU-unit,(англ.) - це та кількість
- 14. Властивості ферментів як біокаталізаторів1. Специфічність дії:а) абсолютна
- 15. 3. Термолабільність опт. 37-40 гр.4. Ферменти прискорюють
- 16. Активний центр це ділянка ферменту, що взаємодіє з
- 17. Структурі активного центру містить: ділянку, що зв’язує
- 18. Алостеричний центр це ділянка ферменту, що взаємодіє з
- 19. Активатори ферментівЦе хімічні речовини, які підвищують швидкість
- 20. Неорганічної природи:HCl активує пепсиноген;іони металів 1 та
- 21. Інгібітори ферментів - це хімічні речовини, що
- 22. Слайд 22
- 23. Інгібітори ферментів
- 24. Використання інгібіторів ферментів в медициніІнгібітор протеолітичних ферментів
- 25. Ізоферменти це родина ферментів, які відрізняються за
- 26. Мультиферменти Це надмолекулярні комплекси ферментів та коферментів,
- 27. Регуляція ферментативної активності 1. На генетичному рівні:
- 28. 6. Хімічною модифікацією ферменту: найчастіше фосфорилуванням. 7.
- 29. Основні напрямки медичної ензимології
- 30. Коферменти І групи – переносники е- та
- 31. Коферменти ІІ групи – переносники хімічних групА.
- 32. Слайд 32
- 33. Слайд 33
- 34. Убіхінон
- 35. Убіхінон – ліпідрозчинний хінон, що оборотно зв’язує
- 36. Слайд 36
- 37. Аскорбінова кислота (вітамін С)
- 38. АК є кофактором проліл- та лізилгідрок-силаз, що
- 39. Нікотинамідаденіндинуклеотид (НАД) нікотинамідаденіндинуклеотидфосфат (НАДФ)
- 40. Механізм дії НАД
- 41. Біологічна рольНАД, НАДФ - коферменти піридинзалежних дегідрогеназ.
- 42. 2. Субстратна функція в синтетичних реакціях. НАД
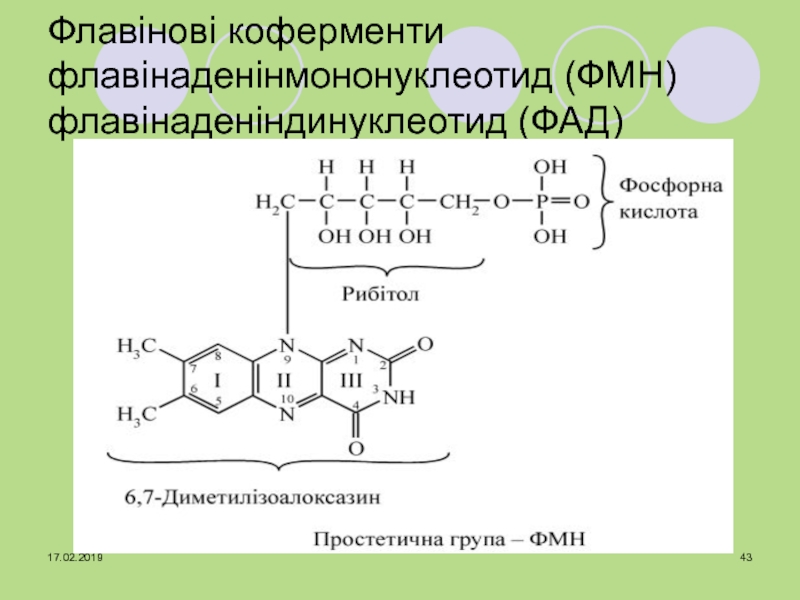
- 43. Флавінові коферменти флавінаденінмононуклеотид (ФМН) флавінаденіндинуклеотид (ФАД)
- 44. Механізм дії:ФМН (ФАД) + Н2 = ФМНН2
- 45. Є 2 типи хімічних реакцій,що каталізуються флавіновими
- 46. 5-дезоксиаденозилкобаламін ДА-В12кофермент метилмалоніл-КоА-мутази, що перетворює метилмалоніл-КоА в
- 47. Вітамін Е (токоферол)Кофактор десатурази жирних кислот, окислює в мітохондріях насичені жирні кислоти в мононенасичені
- 48. ХАРАКТЕРИСТИКА НЕВІТАМІННИХ КОФЕРМЕНТІВ ІІ ГРУПИ :1.Фосфати нуклеозидів:
- 49. Фосфати вуглеводівтранспортують фосфатні
- 50. ХАРАКТЕРИСТИКА ВІТАМІННИХ КОФЕРМЕНТІВ ІІ ГРУПИ1. Тіаміндифосфат (ТДФ)
- 51. КОФЕРМЕНТ АЦИЛУВАННЯ КоА-SH – нуклеотидний кофермент,
- 52. 4-фосфопантетеїн – ще одна коферментна форма вітаміну
- 53. 3. Піридоксальфосфат (ПАЛФ) Придоксамінфосфат (ПАМФ)Похідні
- 54. 4. Біоцитин - коферментна форма
- 55. ТГФК- тетрагідрофолієва кислота (В9)ТГФК переносить одновуглецеві фрагменти:1.
- 56. Біологічна
- 57. 6. Метилкобаламін – коферментна форма вітаміну В12Біологічна
- 58. 7. Вітамін А - ретиноляк кофактор глікозилтрансфераз
- 59. є кофактором γ-глутамілкарбоксилази, яка вводить в γ-положення
- 60. БІОЕНЕРГЕТИКАОсновні терміни та поняття:метаболізм – обмін речовин;анаболізм
- 61. біологічне окислення - це окислення біологічних речовин
- 62. Обмін речовин У першій стадії всі біомолекули
- 63. Кінцевим продуктом другої стадії є ацетил-КоА.У третій
- 64. Слайд 64
- 65. Слайд 65
- 66. Цикл трикарбонових кислот (ЦТК) (цикл
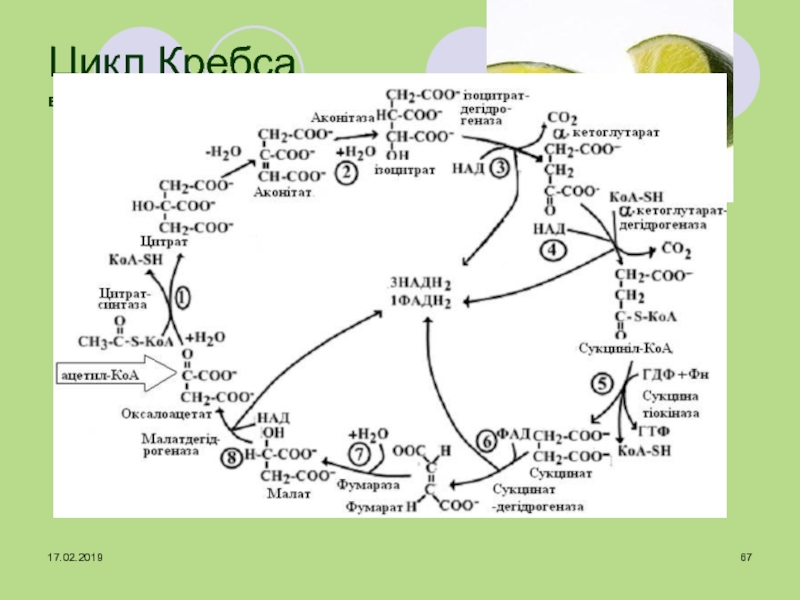
- 67. Цикл Кребса включає 8 реакцій
- 68. Енергетичний баланс циклу Кребса2 молекули СО23 молекули
- 69. Значення ЦТК1. Інтегративне - цикл об'єднує шляхи
- 70. 4. Гідрогендонорне. Реакції дегідрування, що проходять в
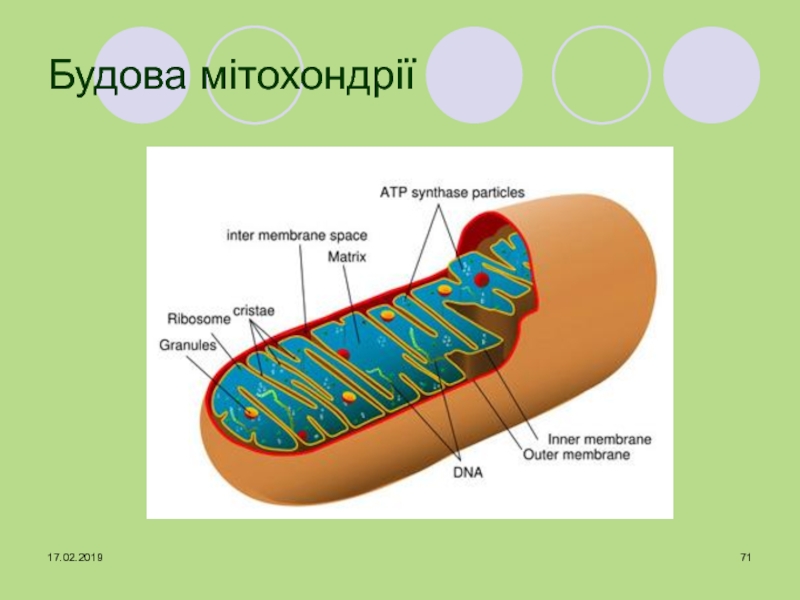
- 71. Будова мітохондрії
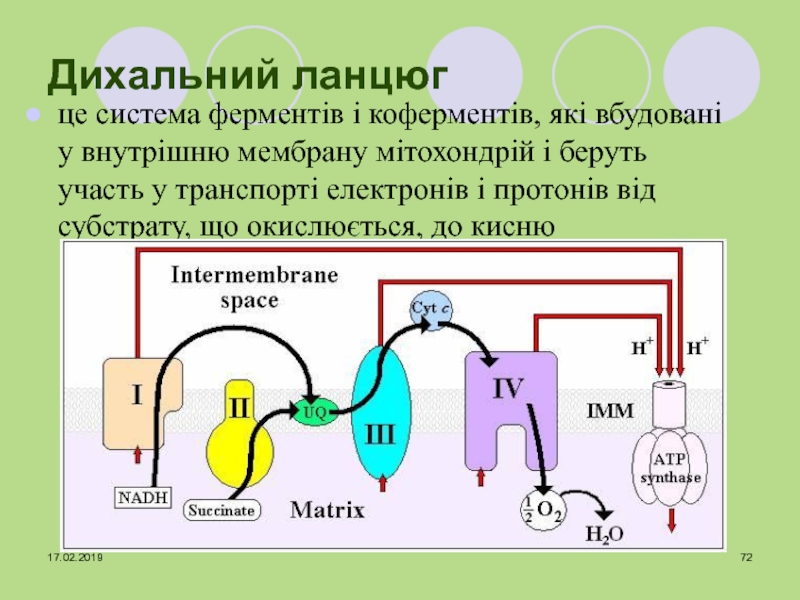
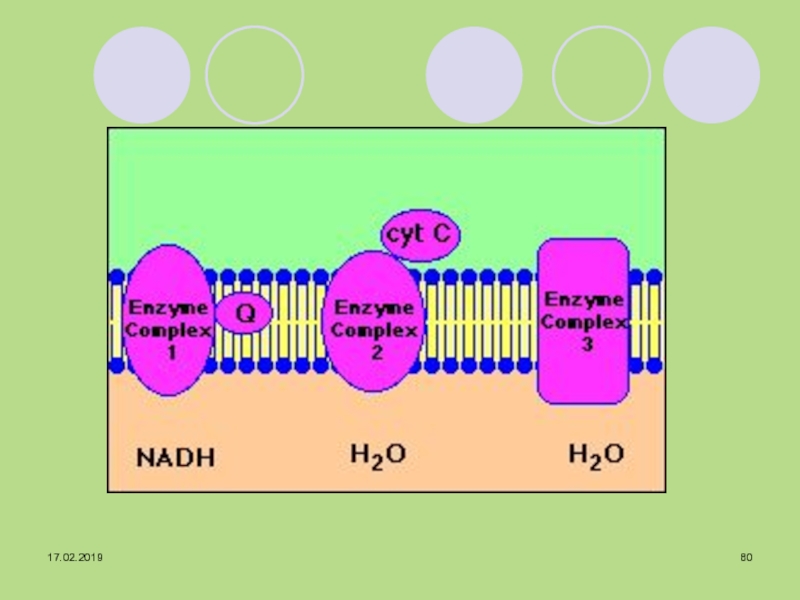
- 72. Дихальний ланцюгце система ферментів і коферментів, які
- 73. I - НАДН- коензим Q-оксидоредуктаза. Флавопротеїн, що
- 74. II комплекс (сукцинат- коензим Q-оксидоредуктаза). Включає ФАД-залежну
- 75. III комплекс – КоQ.Н2-цитохром-С-оксидоредуктаза. Включає цитохроми b,
- 76. IV комплекс - (цитохромоксидаза)Включає 2 цитохроми -
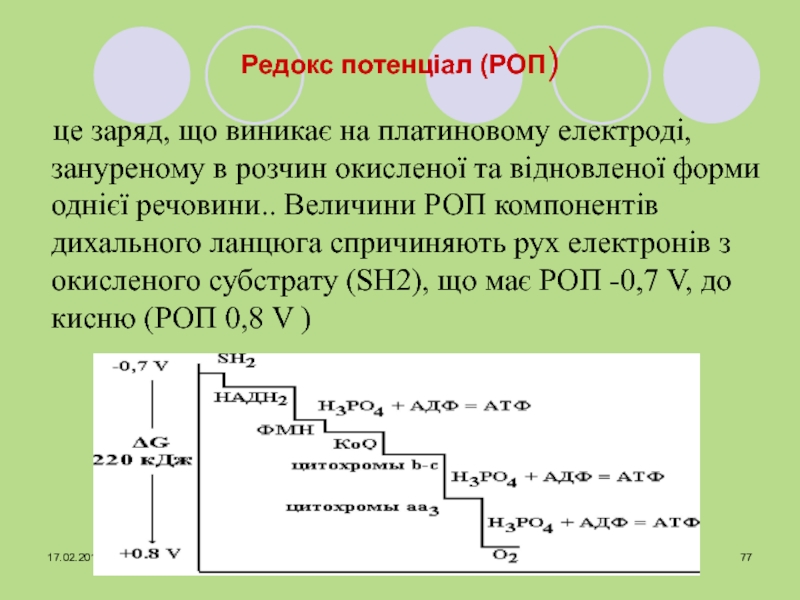
- 77. Редокс потенціал (РОП)це заряд, що виникає на
- 78. З кожною парою електронів, які передаються
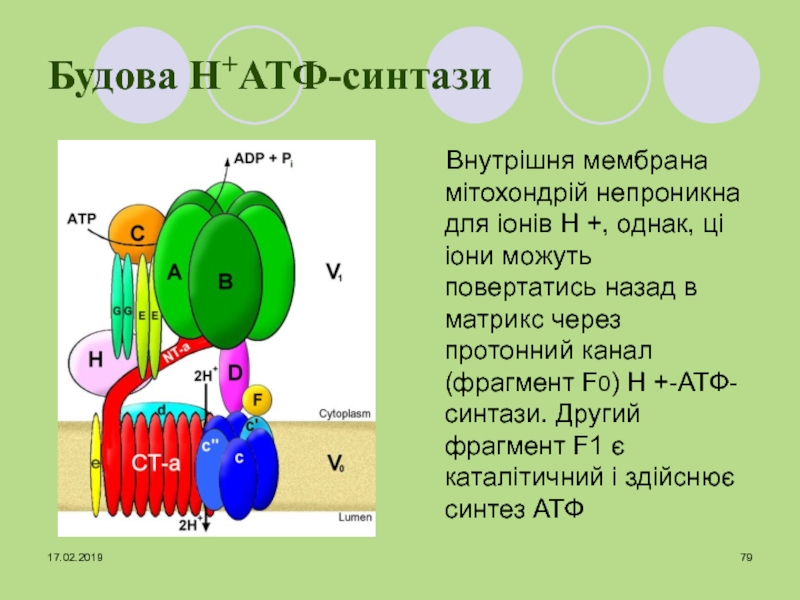
- 79. Будова Н+АТФ-синтазиВнутрішня мембрана мітохондрій непроникна для іонів
- 80. Слайд 80
- 81. Коефіцієнт окисного фосфорилювання (Р/О)це число молекул неорганічного
- 82. Інгібітори електронного транспорту взаємодіють з компонентами дихального ланцюга (клітинні токсини, викликають тканинну гіпоксію)
- 83. Роз'єднувачі тканинного дихання та окисного фосфорилюванняце речовини,
- 84. При гіперфункції щитовидної залози у людей підвищується
- 85. Дослідження виявили, що в основі багатьох захворювань
- 86. Допоміжні ферменти тканинного диханняНАДФН + 2O2
- 87. Речовини, гідроліз яких призводить до вивільнення понад
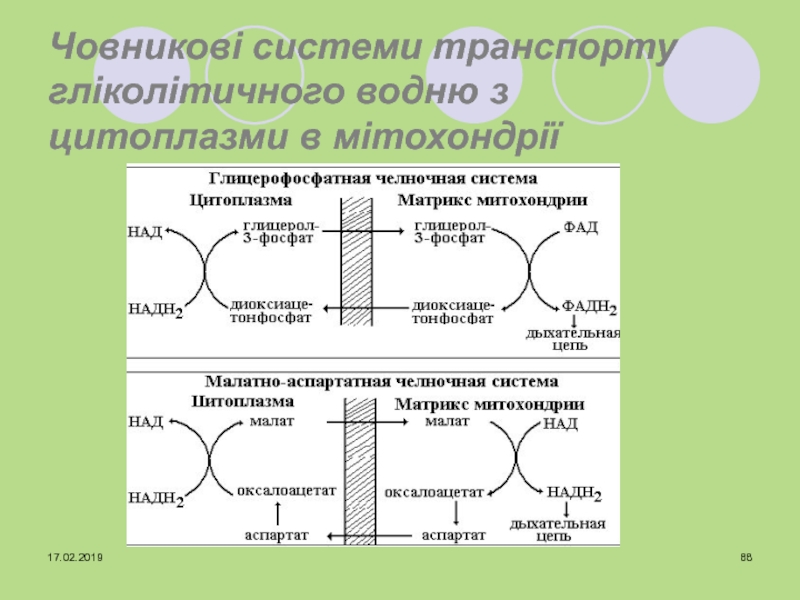
- 88. Човникові системи транспорту гліколітичного водню з цитоплазми в мітохондрії
- 89. Скачать презентанцию
Біохімія – це наука, яка досліджує процеси життєдіяльності на молекулярному рівні.Молекулярна біологія - це розділ біохімії, що вивчає структуру й функції білків та нуклеїнових кислот. Методологія біохімії – діалектичний матеріалізмОб’єктом
Слайды и текст этой презентации
Слайд 2Біохімія – це наука, яка досліджує процеси життєдіяльності на молекулярному
рівні.
Молекулярна біологія - це розділ біохімії, що вивчає структуру й
функції білків та нуклеїнових кислот.Методологія біохімії – діалектичний матеріалізм
Об’єктом дослідження біохімії – вся жива природа (людина та мікроорганізми)
Методи біохімії: хімічні, фізичні, статистичні та інші.
Власний метод ферментативний аналіз
Слайд 3Біохімія - одна з провідних дисциплін, що формує світогляд майбутнього
фармацевта та його професійні знання, бо вона вивчає:
обмін речовин та
його регуляція у здорової людини; зміни метаболізму в умовах патології;
біохімічні методи діагностики та лікування захворювань;
контроль за перебігом захворювань та ефективністю лікування;
створення нових лікарських засобів та методів лікування.
Слайд 4Досягнення українських біохіміків
Льв. біхімік Парнас Я.О. відкрив гліколіз.
Укр. вчений
Беліцер В.О. встановив, що тканинне дихання пов’язане з транспортом електронів.
Акад.
Палладін О.В. - автор підручника з біохімії.Бах А. вивчав тканинне дихання, заснував в Москві “Інститут біохімії”
Горбачевський І.Я. – біохімік української діаспори, був президентом чешської академії наук.
Слайд 5
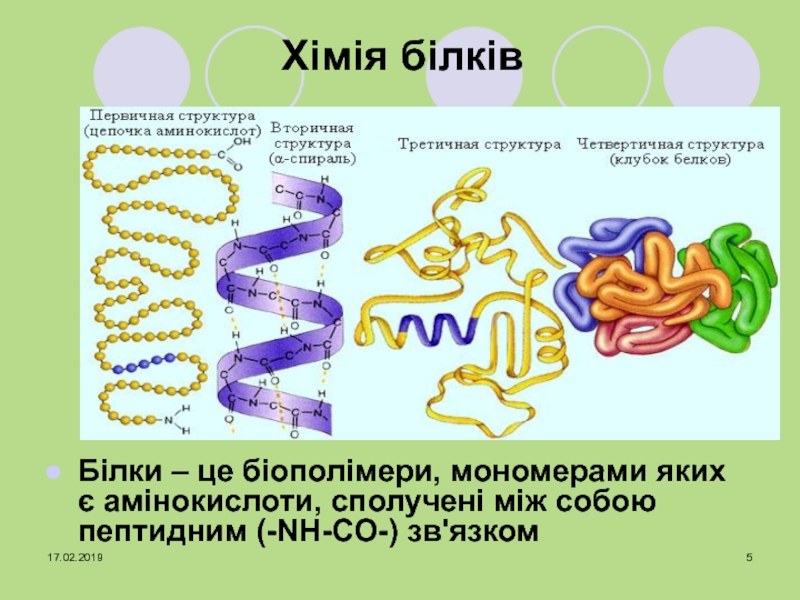
Хімія білків
Білки – це біополімери, мономерами яких є амінокислоти, сполучені
між собою пептидним (-NH-СО-) зв'язком Слайд 6Молекулярна маса білків від 6000 Дал.
Ізоелектрична точка білків – це
те значення рН, при якому білки не мають заряду.
Білкам властива
амфотерність. Функційні білки розчинні у воді, опорні ні
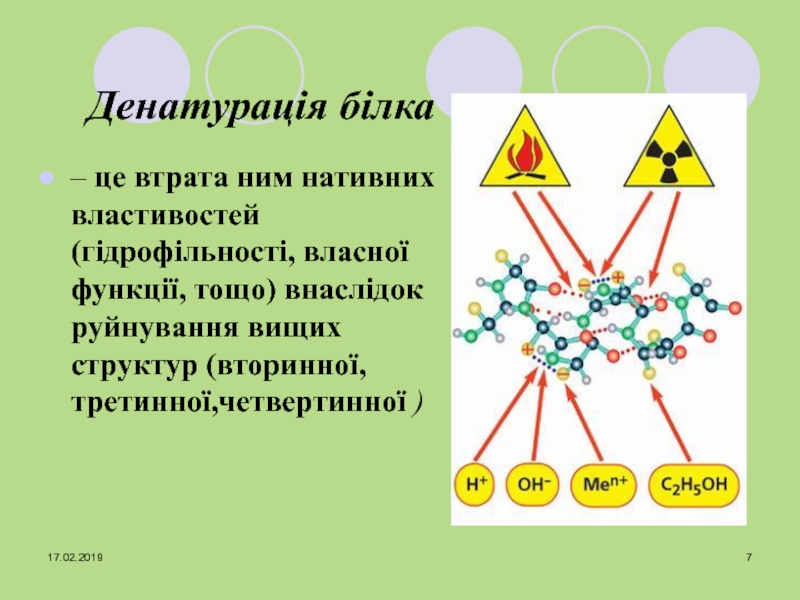
Слайд 7Денатурація білка
– це втрата ним нативних властивостей (гідрофільності, власної функції,
тощо) внаслідок руйнування вищих структур (вторинної, третинної,четвертинної )
Слайд 8ФЕРМЕНТИ (ензими)
це біокаталізатори переважно білкової природи (за винятком мя-РНК),.
фермент від fermentatio, що означає бродіння
ензим – від en zyme,
що означає закваска в дріжджах Прості складаються тільки з амінокислот
Складні – з апофермента (білкова частина) та кофактора (небілкова)
Слайд 10Позначення в ензимології:
Е – фермент, ензим – біокаталізатор;
S – субстрат
– хімічна сполука, що перетворюється ферментом;
Р – продукт реакції, що
утворивсяЕ + S ↔ ЕS ↔ Е + Р
Слайд 11Номенклатура ферментів
(прийнята у 1961 році у Москві)
тривіальна (пепсин, трипсин, хімотрипсин,
тромбін, тощо)
систематична (до назви субстрату, типу реакції додається суфікс “аза”:
лактаза, сахараза, піруватдегідрогеназа, тощо)сучасна, шифрова: код ферменту складається з 4-х цифр
цифри означають: 1-клас, 2-підклас, 3-підпідклас,
4-порядковий номер ферменту в підпідкласі.
Наприклад: 1.1.1.27-лактатдегідрогеназа
Слайд 12Класифікація ферментів
1. Оксидоредуктази - каталізують ОВР (дегідрогенази, оксидази, цитохроми та
ін.).
2. Трансферази- переносять групи атомів
(метил-, сульфо-, аміно-, фосфотрансферази)
3. Гідролази-
розщеплюють зв’язки за участі води (пептидази, естерази, фосфатази, глікозидази).4. Ліази - руйнують зв’зки без участі води (декарбоксилази, альдолази, та ін.).
5. Ізомерази - каталізують реакції ізомеризації (епімерази, рацемази, ізомерази та ін.).
6. Лігази (синтетази) - каталізують реакції синтезу (АТФ-синтаза, піруваткарбоксилаза та ін.).
Слайд 13Одиниці активності ферментів
U-unit,(англ.) - це та кількість фермента, яка каталізує
перетворення 1 мкМ S за 1 хв. за оптимальних умов
(1U= 1 мкМ/хв).В системі СІ (SІ) активність виражають в каталах: це така кількість ферменту, яка каталізує перетворення 1 моля S за 1 с. (1кат. = 1 моль/с).
Питома активність визначається кількістю одиниць ферментативної активності на 1 мг білка в біологічному об’єкті (U/мг білка).
У медичній ензимології активність ферменту виражають в одиницях (U) на 1 л біологічної рідини (сироватки крові, сечі тощо): U/л.
Слайд 14Властивості ферментів як біокаталізаторів
1. Специфічність дії:
а) абсолютна - 1 фермент
– 1 субстрат (уреаза розщеплює сечовину, аргіназа – аргінін
б), відносна,
- 1 фермент – 1 тип хім. зв’язку ( пептидази, глікозидази, естерази) в) стереоструктурна – оксидази L і D-амінокислот
3. Залежність ферментативної активності від рН середовища. Більшість при рН 6-8.
Пепсин 1,5-2, аргіназа 10-11
Слайд 153. Термолабільність опт. 37-40 гр.
4. Ферменти прискорюють швидкість як прямої,
так і оборотньої реакції
5. Активність ферментів суттєво змінюється під впливом
активаторів або інгібіторів6. Надзвичайно висока ефективність (1 моль карбангідрази розщеплює 36 млн. моль Н2СO3)
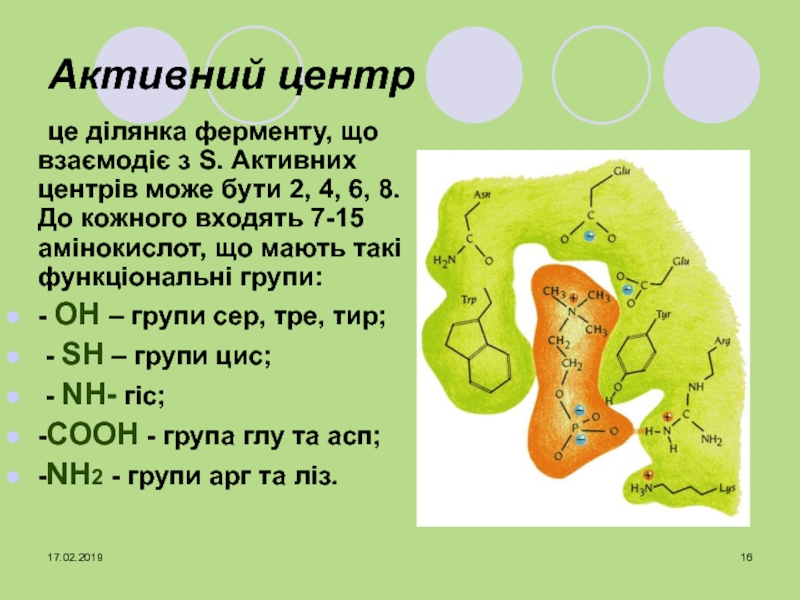
Слайд 16Активний центр
це ділянка ферменту, що взаємодіє з S. Активних центрів
може бути 2, 4, 6, 8. До кожного входять 7-15
амінокислот, що мають такі функціональні групи:- ОН – групи сер, тре, тир;
- SН – групи цис;
- NН- гіс;
-СООН - група глу та асп;
-NН2 - групи арг та ліз.
Слайд 17Структурі активного центру містить:
ділянку, що зв’язує субстрат, або контактну
(“якірну”) ділянку;
каталітичну ділянку, до складу якої входять хімічні групи,
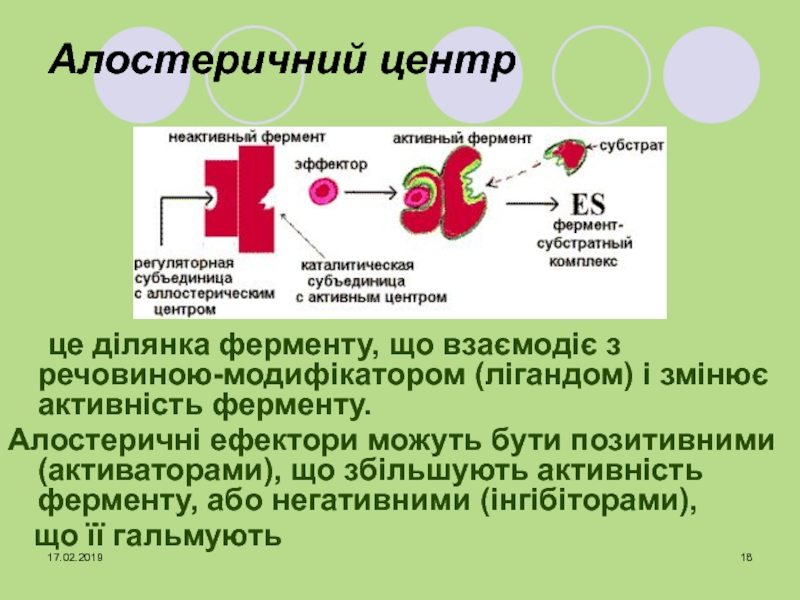
що беруть участь у перетворенні субстрату Слайд 18Алостеричний центр
це ділянка ферменту, що взаємодіє з речовиною-модифікатором (лігандом) і
змінює активність ферменту.
Алостеричні ефектори можуть бути позитивними (активаторами), що збільшують
активність ферменту, або негативними (інгібіторами),що її гальмують
Слайд 19Активатори ферментів
Це хімічні речовини, які підвищують швидкість ферментативних реакцій.
Органічної природи:
ентерокіназа (активує трипсиноген).
жовчні кислоти (активують підшлункову ліпазу);
глутатіон, цистеїн,
вітамін С підвищують активність оскидоредуктаз.Слайд 20Неорганічної природи:
HCl активує пепсиноген;
іони металів 1 та 2-х валентні (Na,
K, Mg, Mn, Zn);
сприяють утворенню фермент-субстратного комплексу;
є донорами та акцепторами
електронів;входять в склад активного центру ферментів (Zn → в карбоангідразі, Fe → у цитохромах);
виступають в ролі алостеричних регуляторів.
Слайд 21Інгібітори ферментів - це хімічні речовини, що зменшують активність ферментів,
інгібування:
А) незворотне (денатурація F кислотами та лугами, органічними кислотами,
УФ-опромі-ненням, солями важких металів; тканинними отрутами (ціаніди, алкілюючі агенти); ФОСБ) зворотне :
Конкурентне зумовлене лігандами, які по структурі близькі до S і теж взаємодіють з активним центром ферменту.
Класичний приклад: конкурентним інгібітором СДГ є малонова кислота.
Слайд 24Використання інгібіторів ферментів в медицині
Інгібітор протеолітичних ферментів Контрікал (Гордокс) для
лікування гострого панкреатиту
Інгібітор ацетальдегіддегідрогенази Тетурам (Антабус) для лікування алкоголізму
Інгібітор ферментів
синтезу холестерину Ловастатін для лікування атеросклерозуІнгібітор МАО Піразідол (Фенелзін) для лікування депресивних розладів
Інгібітор ксантиноксидази Алопуринол для лікування подагри
Інгібітор фібрінолізу – амінокапронова кислота
Слайд 25Ізоферменти
це родина ферментів, які відрізняються за будовою та фізико-хімічними
властивостями, але каталізують одну реакцію. Наприклад, лактатдегідрогеназа (ЛДГ) каталізує взаємоперетворення
лактату та пірувату.ЛДГ1 синтезується в серцевому м’язі та мозку, ЛДГ5 – в склетних м’язах та печінці. Інші фракції - в інших органах.
Гіперферментемія свідчить про ураженні клітин, тому підвищення активності ЛДГ1 в крові спостерігається при ураженні серцевого м’язу, а ЛДГ5 - при гепатитах та ураження склетних м’язів
Слайд 26Мультиферменти
Це надмолекулярні комплекси ферментів та коферментів, що каталізують послідовні
етапи перетворення S.
Прикладом мультиферментів є реакція окисного декарбоксилювання пірувату
піруватдегідрогеназою (складається з 3 ензимів та 5 коферментів). Продуктом реакції є ацетил-КоАСлайд 27Регуляція ферментативної активності
1. На генетичному рівні: виділяють конститутивні ферменти,
що синтезуються завжди згідно генетичному коду; та адаптивні (індуцибельні), що
синтезуються за умов надходження субстрату та розблокування відповідних генів.2. За законом діючих мас:
3. Перетворення профермента в активний фермент; неактивний пепсиноген під дією НСl перетворюється в активний пепсин.
4. За принципом зворотного зв’язку: продукт послідовних стадій перетворення певного субстрату гальмує перший фермент.
5. Ативація попередником. Наприклад: S (глю-6-ф) активує фермент його перетворення – (глю-6-до-дегідрогеназу) у пентозо-фосфатному шляху.
Слайд 286. Хімічною модифікацією ферменту: найчастіше фосфорилуванням.
7. Швидкістю синтеза та
розпаду речовин.
8. Впливом активаторів та інгібіторів.
9. Конкуренцією за загальний
субстрат.10. Компартменталізація – регуляція за допомогою біомембран. Наприклад: мембрани лізосом обмежують активність лізосомальних гідролаз.
Слайд 30Коферменти І групи – переносники е- та Н+
А. Невітамінні:
гем
глутатіон
Б. Вітаміноподібні:
убіхінон
(КоQ)
ліпоєва кислота (ЛК)
тетрагідробіоптерин (ТГБП)
хінонові коферменти
В. Вітамінні:
аскорбінова кислота (АК)
НАД та НАДФ
ФАД
та ФМН5-дезоксиаденозил-кобаламін
Слайд 31Коферменти ІІ групи – переносники хімічних груп
А. Невітамінні:,
фосфати нуклеозидів
фосфати вуглеводів.
Б. Вітамінні:
ТДФ (В1)
КоА (В3)
ПАЛФ (В6)
Біоцитин (В8)
ТГФК (В9)
метилкобаламін (В12)
вітамін К
вітамін А
Слайд 32
ГЕМ
Гем – суперсупряжена система з 4-х піролів.
Міцно сполучений з апоферментом (простетична група). Активний центр – іон заліза, що оборотньо змінює свій ступінь окиснення:Fe2+ - e = Fe3+ Fe3+ + e + Fe2+
Гем транспортує лише електрони.
складовий ферментів дихального ланцюга (цитохромів та цитохромоксидази), метаболізму ксенобіотиків та допоміжних ферментів дихального ланцюга, що руйнують пероксид водню:
Каталази Пероксидази
2Н2О2 2Н20 + О2 Н202 Н20 + 0
Слайд 33 Глутатіон G-SH
Трипептид γ-глу-цис-глі,
що має вільну групу SH (цис) – активний центр
Механізм дії:
2G-SH G-S-S-G Є складовим глутатіонпероксидази ( в активному центрі Se), що руйнує органічні пероксиди, попереджаючи ПОЛ;
бере участь в знешкодженні ксенобіотиків в складі глутатіонтрансферази;
є складовим глутатіондегідрогенази, що інактивує інсулін
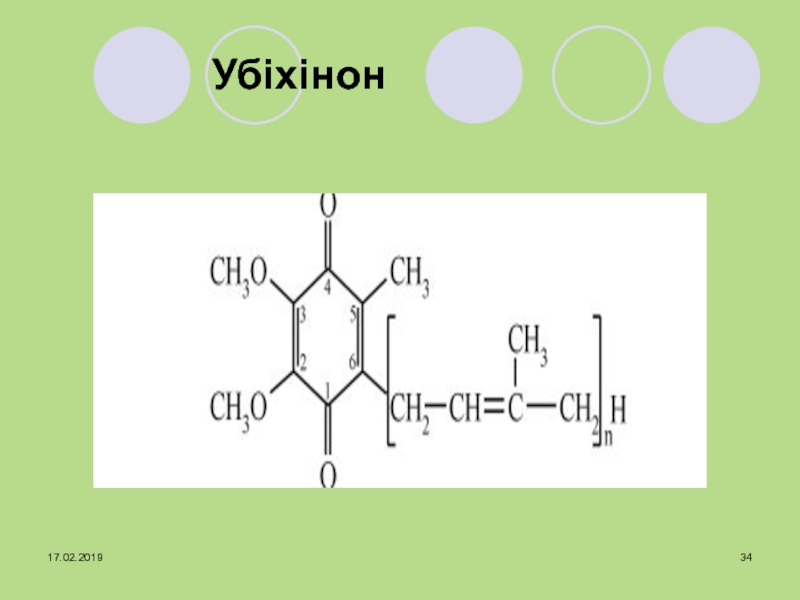
Слайд 35Убіхінон – ліпідрозчинний хінон, що оборотно зв’язує атоми водню.
КоQ +
Н2 КоQН2
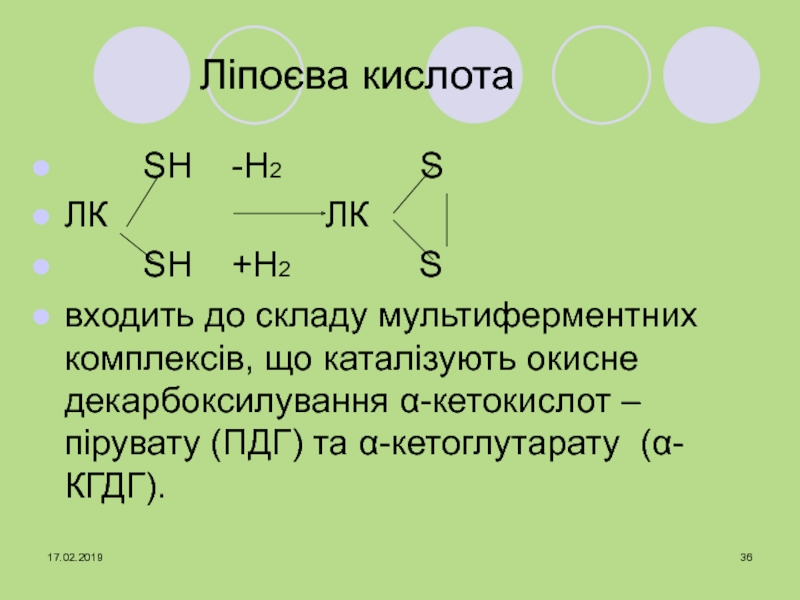
Переносить електрони й протони від внутрішньої до зовнішньої поверхні внутрішньої мембрани мітохондрій при тканинному диханні. Працює без апоферменту.Слайд 36 Ліпоєва кислота
SH -Н2
SЛК ЛК
SH +Н2 S
входить до складу мультиферментних комплексів, що каталізують окисне декарбоксилування α-кетокислот – пірувату (ПДГ) та α-кетоглутарату (α-КГДГ).
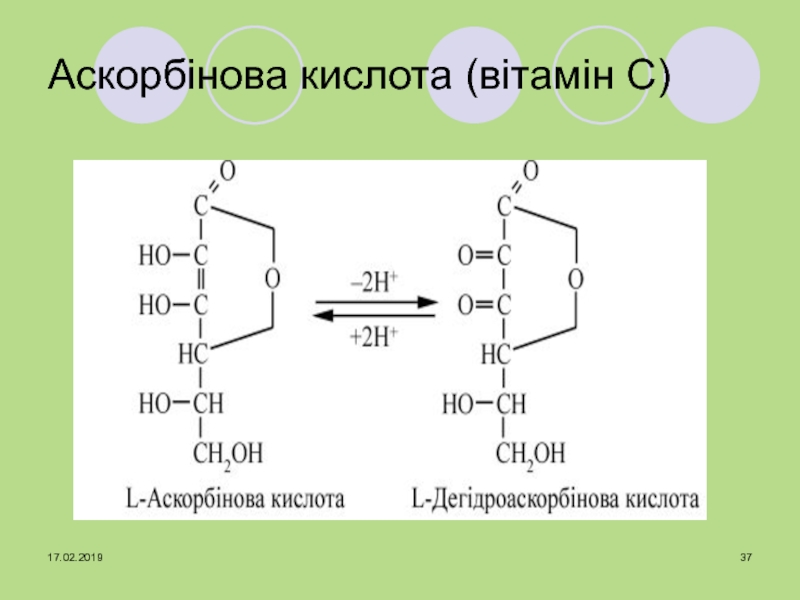
Слайд 38АК є кофактором проліл- та лізилгідрок-силаз, що беруть участь в
посттрансля-ційній модифікації білків колагену, гідрок-силюючи залишки проліну та лізину
Перетворює дофамін
в норадреналінТриптамін в 5-окситриптамін
Гідроксилує стероїди
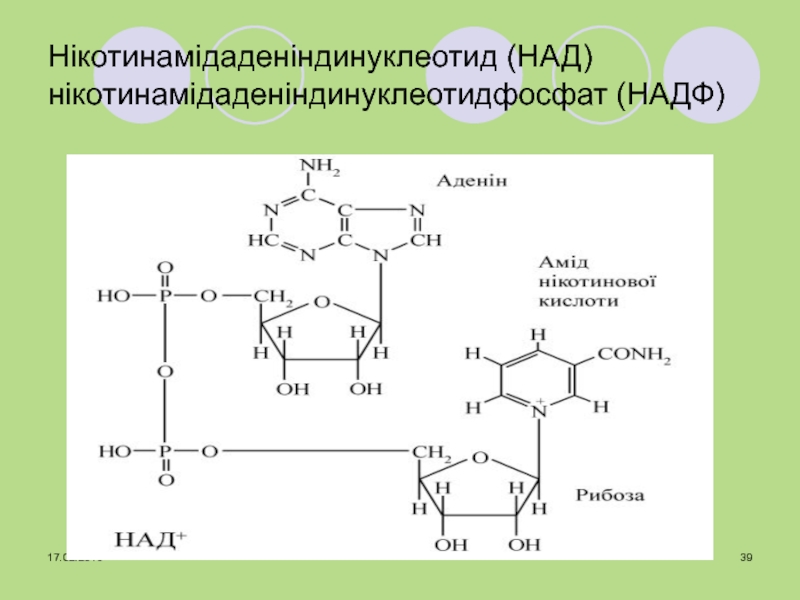
Слайд 41Біологічна роль
НАД, НАДФ - коферменти піридинзалежних дегідрогеназ. Переносять е і
Н+. Беруть участь в окисненні спиртів, альдегідів, кето- й гідроксикислот,
амінів, тощо.НАДФН + Н+ є сильним відновником і бере участь у синтезі жирних кислот, стероїдних гормонів, холестерину, в знешкодженні ксенобіотиків.
Слайд 422. Субстратна функція в синтетичних реакціях. НАД – субстрат для
ДНК-лігазної реакції (реплікація, репарація)
3. Регуляторна функція в якості алостеричного ефектора
регуляторних ферментів ЦТК, глюконеогенезу, пентозного циклуСлайд 44Механізм дії:
ФМН (ФАД) + Н2 = ФМНН2 (ФАДН2)
Біологічна роль:
ФМН
і ФАД беруть участь в ОВР у складі флавінових ферментів.
Слайд 45Є 2 типи хімічних реакцій,що каталізуються флавіновими ферментами:
1. реакції, в
яких фермент окиснює S в присутності О2 з утворенням Н2О2.
Це оксидази амінокислот, альдегідоксидази, моноамінооксидази, ксантиноксидаза та ін.2. реакції переносу водню від відновлених піридинових коферментів або деяких субстратів окиснення (сукцинату, пірувату, жирних кислот та ін. в мітохондріях) на інші ланки дихального ланцюга мітохондрій
Слайд 465-дезоксиаденозилкобаламін ДА-В12
кофермент метилмалоніл-КоА-мутази, що перетворює метилмалоніл-КоА в сукциніл-КоА. Ця реакція
потрібна для згорання в ЦТК жирних кислот з непарним числом
атомів карбону.ДА бере участь в окисненні бокового ланцюга холестерину і радикалів амінокислот, а також тиміну
Слайд 47Вітамін Е (токоферол)
Кофактор десатурази жирних кислот, окислює в мітохондріях насичені
жирні кислоти в мононенасичені
Слайд 48ХАРАКТЕРИСТИКА НЕВІТАМІННИХ КОФЕРМЕНТІВ ІІ ГРУПИ :
1.Фосфати нуклеозидів: АТФ, ГТФ, УТФ,
ЦТФ, ТТФ.
Механізм дії: транспортують фосфатні залишки.
Біологічна роль:
в
складі ферментів кіназ фосфорилюють речовини частіше за участю АТФГлюкоза + АТФ Глюкозо-6-фосфат + АДФ
В складі трансфераз активують речовин шляхом приєднання нуклеотиддифосфатів: активна форма глюкози (УДФ-глюкоза), холіну - (ЦДФ-холін
Слайд 49 Фосфати вуглеводів
транспортують фосфатні залишки.
Біологічна роль:
входять до складу ферментів:
-глюкозофосфатізомерази:
Глю-6-Ф
Глю-1-Ф- фосфогліцератмутази.
Слайд 50ХАРАКТЕРИСТИКА ВІТАМІННИХ КОФЕРМЕНТІВ ІІ ГРУПИ
1. Тіаміндифосфат (ТДФ)
коферментна форма вітаміну В1
(тіаміну)
Біологічна роль:
- каталізує окисне декарбоксилювання
α-кетокислот – ПВК та α
-КГ- переносить глікольальдегідну частинку від кетоцукрів на альдоцукри (транскетолаза в ПФШ перетворення глюкози).
Слайд 51КОФЕРМЕНТ АЦИЛУВАННЯ КоА-SH –
нуклеотидний кофермент, похідне вітаміну В3
(пантотенової кислоти)
Активує
і переносить залишки кислот (ацили) –КоА-SH є одним з ключових
коферментів в реакціях метаболізму:- вуглеводів (окиснення ПВК і α-КГ),
- ліпідів - окисненні та синтезі жирних кислот, синтезі холестерину,
- ацилювання при утворенні гему, ацетилхоліну, знешкодженні чужорідних речовин та ін.
Слайд 524-фосфопантетеїн – ще одна коферментна форма вітаміну В3
Утворюється при гідролізі
КоА-SН.
Простетична група ацилтранспортую-чого білка, що є складовим синтетази жирних кислот
Слайд 533. Піридоксальфосфат (ПАЛФ)
Придоксамінфосфат (ПАМФ)
Похідні вітаміну В6
ПАЛФ переносить
хімічні групи:
-СООН (декарбоксилування амінокислот з утворенням біогенних амінів, медіаторів
ЦНС);- NH2 (переамінування амінокислот) в складі амінотрансфераз АсАТ і АлАТ;
- SО3Н – десульфування;
ПАЛФ бере участь в обміні амінокислот, синтезі гему, взаємоперетворенні серину і гліцину, окисненні триптофану, у знешкодженні амінів (амінооксидази), глікогенолізі (кофактор фосфорилази) і т.і.
Слайд 544. Біоцитин - коферментна форма
вітаміну Н (В8) Кофермент карбоксилаз
1) в реакціях карбоксилування
з витратою АТФ: а) карбоксилування ацетил-КоА до малоніл-КоА (в синтезі жирних кислот);
карбоксилування пірувату в оксалоацетат в глюконеогенезі;
б) в синтез пуринових азотистих основ.
2) в реакціїї транскарбоксилювання (без участі АТФ).
Слайд 55ТГФК- тетрагідрофолієва кислота (В9)
ТГФК переносить одновуглецеві фрагменти:
1. Метильний (-СН3 ),
ТГФК є синергістом іншого коферменту – метилкобаламіну.
2. Метиленовий (-СН2- )
3. Метинільний (-СН = )
4. Оксиметильний (-СН2– ОН )
5. Формільний (- СОН )
6. Формімінний (- СН=NH )
Слайд 56 Біологічна роль:
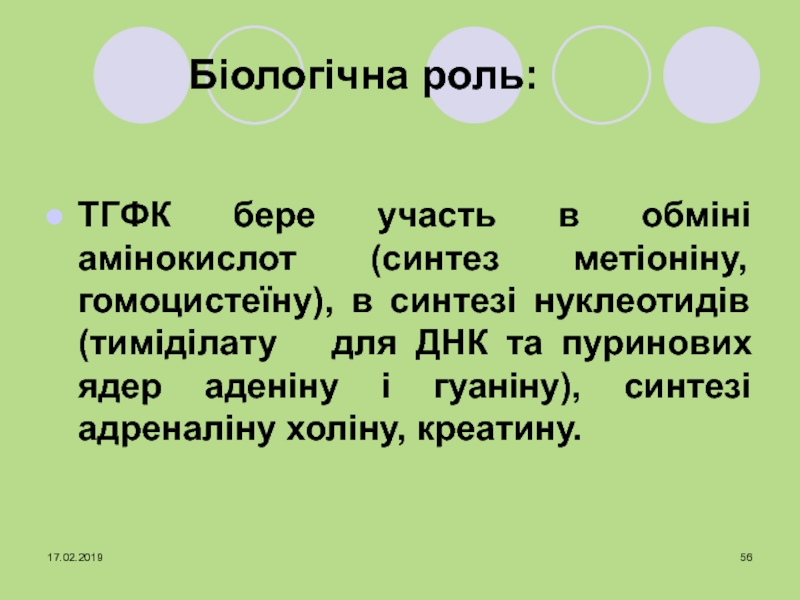
ТГФК бере участь
в обміні амінокислот (синтез метіоніну, гомоцистеїну), в синтезі нуклеотидів (тиміділату
для ДНК та пуринових ядер аденіну і гуаніну), синтезі адреналіну холіну, креатину.Слайд 576. Метилкобаламін – коферментна форма вітаміну В12
Біологічна роль:
участь у трансметилування,
наприклад, при синтезі метіоніну. Здійснюючи ресинтез метіоніну (донора метильних груп),
метилкобаламін фактично бере участь в синтезі креатину, адреналіну, ацетилхоліну, азотистих основ НК та інших БАС.Слайд 587. Вітамін А - ретинол
як кофактор глікозилтрансфераз переносить олігосахаридні залишки
крізь мембрани і бере участь в синтезі глікопротеїнів – основи
муцинів – слизів, що вкривають епітеліальні покриви шлунково-кишечного, дихальних шляхів і т.дСлайд 59є кофактором γ-глутамілкарбоксилази, яка вводить в γ-положення глутамінової кислоти білків
- факторів згортання крові
(протромбін, фактори УІІ, ІХ Х, протеїн
С та протеїн S), 5 білків кісткової тканини додаткову карбоксильну групу, що дає можливість зв’язати іони Са і запустити процес згортання крові і процеси мінералізації кісток8. Вітаміни групи К
Слайд 60БІОЕНЕРГЕТИКА
Основні терміни та поняття:
метаболізм – обмін речовин;
анаболізм – синтез речовин
в організмі із затратою АТФ
катаболізм – розпад речовин в організмі
із виділенням АТФпроміжний обмін – синтез, розпад, перетворення речовин в клітині,
Слайд 61біологічне окислення - це окислення біологічних речовин з виділенням енергії
тканинне дихання – процес поглинання тканинами кисню та виділення вуглекислоти;
окисне
фосфорилювання – синтез АТФ, пов’язаний з тканинним диханням;субстратне фосфорилювання – синтез АТФ за рахунок інших макроергічних сполук
Слайд 62Обмін речовин
У першій стадії всі біомолекули розщеплюються до мономерів:
1) полісахариди - до моносахаридів;
2) триацилглицероли) – до жирних
кислот і глицерола; 3) білки – до амінокислот;
У другій стадії реакціями катаболізму є:
1) для моносахаридів – гліколіз до пірувату, який далі піддається окислювальному декарбоксилюванню до активної форми оцтової кислоти – ацетил-КоА;
2) для жирних кислот – бета-окислення до ацетил-КоА; для глицерола – окислення до пірувату і далі до ацетил-КоА;
3) для амінокислот – дезамінування і розщеплення безазотистих молекул до ди- і тривуглецевих карбонових кислот і їх похідних. Більшість з них перетворюються на ацетил-КоА.
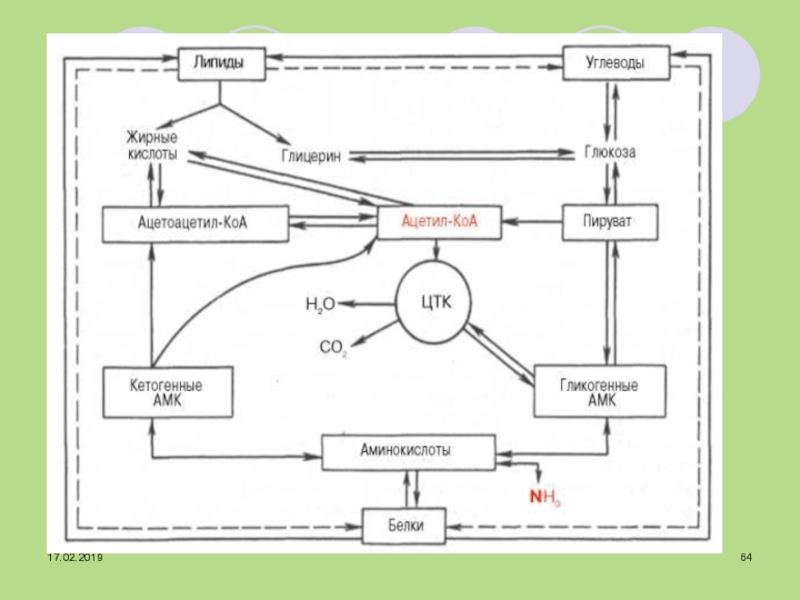
Слайд 63Кінцевим продуктом другої стадії є ацетил-КоА.
У третій стадії катаболізму відбувається
окислення ацетил-КоА до СО2 і Н2О в ЦТК з утворенням
АТФ за участю коферментів НАД і ФАД на дихальному ланцюзі.Слайд 66Цикл трикарбонових кислот (ЦТК)
(цикл лимонної кислоти, цикл Кребса)
- аеробний метаболічний цикл, в якому ацетил-КоА (ключовий метаболіт обміну
вуглеводів, білків і жирів) окислюється до СО2 з утворенням атомів водню, які використовуються в дихальному ланцюзі мітохондрій для отримання АТФСлайд 68Енергетичний баланс циклу Кребса
2 молекули СО2
3 молекули НАДН2 (9 АТФ)
1
молекула ФАДН2 (2 АТФ)
1 АТФ (субстратне фосфорилювання)
Разом: 12 молекул АТФ
Слайд 69Значення ЦТК
1. Інтегративне - цикл об'єднує шляхи катаболізму вуглеводів, білків
і жирів,
2. Енергетичне. При розщепленні 1 молекули ацетил-КоА до
кінцевих продуктів (СО2 і Н2О) генерується 12 молекул АТФ3. Амфіболічне. Субстрати ЦТК йдуть й на реакції синтезу (анаболічні процеси). Так, з оксалоацетату синтезуються Асп і фосфоенолпіруват; з -КГ – Глу,
сукцинат на синтез порфіринів
Слайд 704. Гідрогендонорне. Реакції дегідрування, що проходять в ЦТК, постачають атомами
водню дихальний ланцюг. Анаплеротичні реакції - це реакції клітинного метаболізму,
що підвищують концентрацію субстратів ЦТК в інших метаболічних шляхах (карбоксилювання пірувату в оксалоацетат)Слайд 72Дихальний ланцюг
це система ферментів і коферментів, які вбудовані у внутрішню
мембрану мітохондрій і беруть участь у транспорті електронів і протонів
від субстрату, що окислюється, до киснюСлайд 73I - НАДН- коензим Q-оксидоредуктаза.
Флавопротеїн, що містить ФМН, і
5 FeS білки. Комплекс транспортує електрони й протони водню від
субстратів, що окиснюються в матріксі мітохондрій, до коензиму Q.Слайд 74II комплекс (сукцинат- коензим Q-оксидоредуктаза).
Включає ФАД-залежну сукцинатдегід-рогеназу (CДГ), FeS
білки і каталізує транспорт водню від сукцинату до коензиму-Q.
Коензим-Q
- колектор електронів і протонів не тільки від I і II комплексів, але й від інших ФАД-залежних ферментів, (ферментів β-окиснення жирних кислот тощо). Слайд 75III комплекс –
КоQ.Н2-цитохром-С-оксидоредуктаза.
Включає цитохроми b, c1 і білок
(FeS).
Транспортує електрони до цит. с.
QН2 + цит. с (Fe3+)
→ Q + цит.с (Fe2+) + 2H+Слайд 76IV комплекс - (цитохромоксидаза)
Включає 2 цитохроми - а і а3,
(що містять мідь СuA і CuB (Cu 1+ ↔ Cu
2+).ЦХО каталізує кінцеву реакцію окиснення - відновлення 2 електронами кисню та утворення води.
Слайд 77Редокс потенціал (РОП)
це заряд, що виникає на платиновому електроді, зануреному
в розчин окисленої та відновленої форми однієї речовини.. Величини РОП
компонентів дихального ланцюга спричиняють рух електронів з окисленого субстрату (SН2), що має РОП -0,7 V, до кисню (РОП 0,8 V )Слайд 78 З кожною парою електронів, які передаються від субстрату до
кисню, в міжмебранний простір переноситься 8-10 Н+. Формується трансмембранний електрохімічний
градієнт концентрації іонів Н+ - ΔμН+.Зовнішня поверхня внутрішньої мембрани, обернена в міжмембранний простір, заряджається позитивно (+), а внутрішня - негативно (-).
Слайд 79Будова Н+АТФ-синтази
Внутрішня мембрана мітохондрій непроникна для іонів Н +, однак,
ці іони можуть повертатись назад в матрикс через протонний канал
(фрагмент F0) Н +-АТФ-синтази. Другий фрагмент F1 є каталітичний і здійснює синтез АТФСлайд 81Коефіцієнт окисного фосфорилювання (Р/О)
це число молекул неорганічного фосфату (Фн), що
перейшли в органічну форму (АТФ) з розрахунку на кожен атом
кисню, що поглинувся.(максимальне значення Р/О - 3).
При окислення субстратів через НАДН-КоQ-редуктази (через I, III, IV комплекси), утворюється 3 молекули АТФ (Р/О = 3).
При окисленні субстратів через сукцинат-КоQ-редуктази (II, III, IV комплекси) про-разуется 2 молекули АТФ (Р/О = 2)
Слайд 82Інгібітори електронного транспорту взаємодіють з компонентами дихального ланцюга (клітинні токсини,
викликають тканинну гіпоксію)
Слайд 83Роз'єднувачі тканинного дихання та окисного фосфорилювання
це речовини, що порушують утворення
електрохімічного потенціалу. Вони, з одного боку, посилюють поглинання мітохондріями кисню,
а з іншого боку, знижують генерацію АТФ. Виникає феномен неконтрольованого дихання мітохондрій. До роз’єднувачів відносяться ліпофільні речовини, що мають рухливий атом водню. Вони вбудовуються в мітохондріальну мембрану і переносять іони водню, знижуючи тим самим трансмембранний градієнт протонів і синтез АТФ.Тироксин
Саліцилова кислота, дікумарін та ін
Слайд 84При гіперфункції щитовидної залози у людей підвищується продукція тироксину і
температура тіла. Тироксин, зменшує утворення АТФ в мітохондріях і одночасно
посилює окислення субстратів в дихальном ланцюгу, а також продукцію теплаСлайд 85Дослідження виявили, що в основі багатьох захворювань (вікове ожиріння, інсуліннезалежний
цукровий діабет, ГХ, атеросклероз, психічна вікова депресія, тощо) та старіння
полягає невідповідність процесів окисного фосфорилювання і тканинного дихання до енергетичних потреб організмаСлайд 86Допоміжні ферменти тканинного дихання
НАДФН + 2O2 НАДФ+ + 2О2-
+ Н+ (О2-. – супероксидний радикал)
O2- + O2- +
2Н+ Н2О2 +О2 (супероксиддисмутаза) _ 2H2O2 → 2H2O + O2 (каталаза)
H2O2 → H2O + O (пероксидаза)
H2O2 + 2G-SH → 2H2O + G-S-S-G (глутатіонпероксидаза)
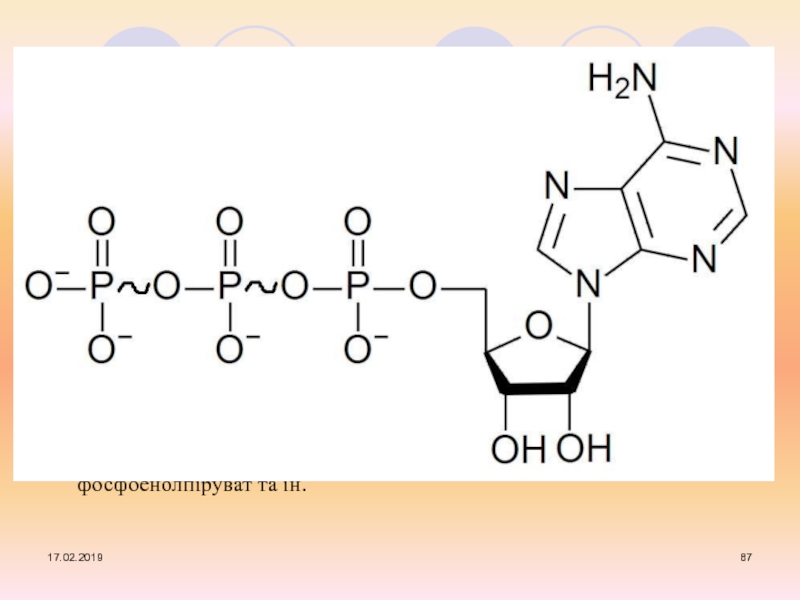
Слайд 87Речовини, гідроліз яких призводить до вивільнення понад 21кДж/моль енергії, відносять
до високоенергетичних (макроергів)
Макроергічний зв'язок позначається символом (знак «тільда» )
До макроергів відносять: АТФ та інші трифосфати нуклеозидів (ГТФ, ЦТФ, УТФ, ТТФ), аргінінфосфат, креатинфосфат, ацетилфосфат, 1,3-дифосфогліцерат, фосфоенолпіруват та ін.