Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
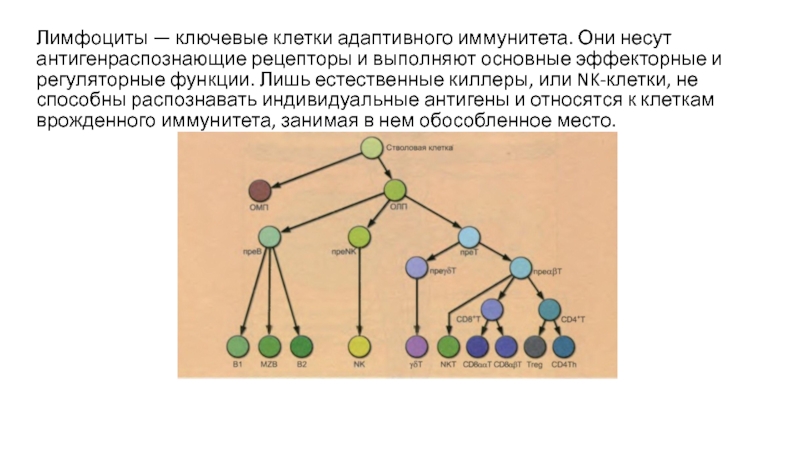
Лимфоциты
Содержание
- 1. Лимфоциты
- 2. Лимфоциты — ключевые клетки адаптивного иммунитета. Они
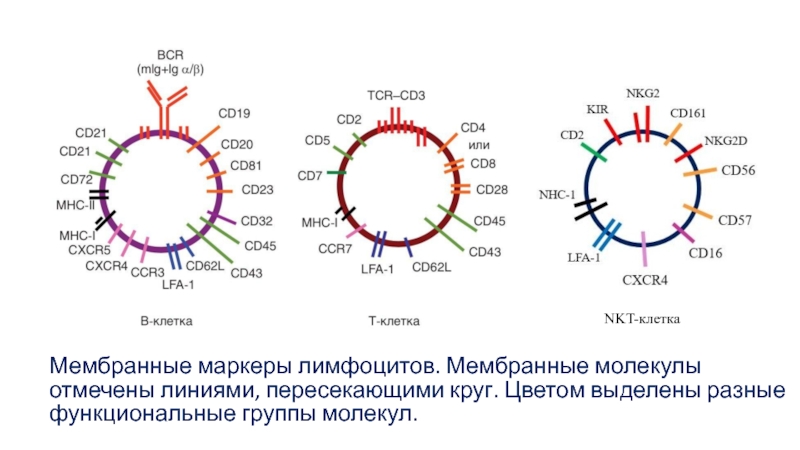
- 3. Мембранные маркеры лимфоцитов. Мембранные молекулы отмечены линиями, пересекающими круг. Цветом выделены разные функциональные группы молекул. NKT-клетка
- 4. Лимфоциты — клетки малого размера (6–8 мкм),
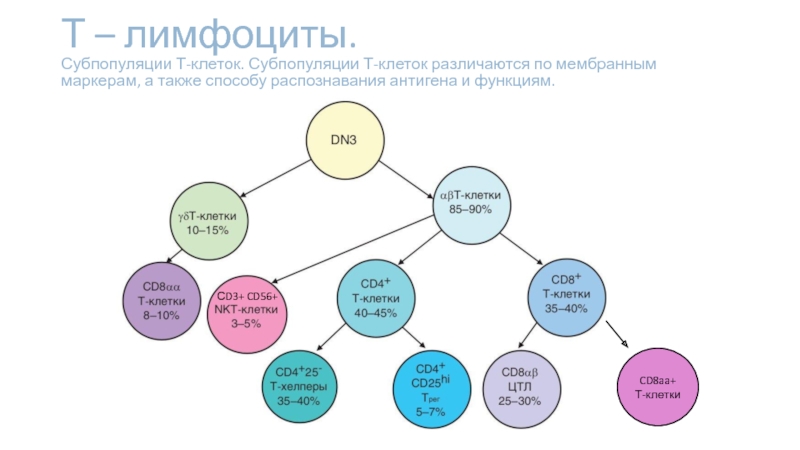
- 5. Т – лимфоциты. Субпопуляции Т-клеток. Субпопуляции
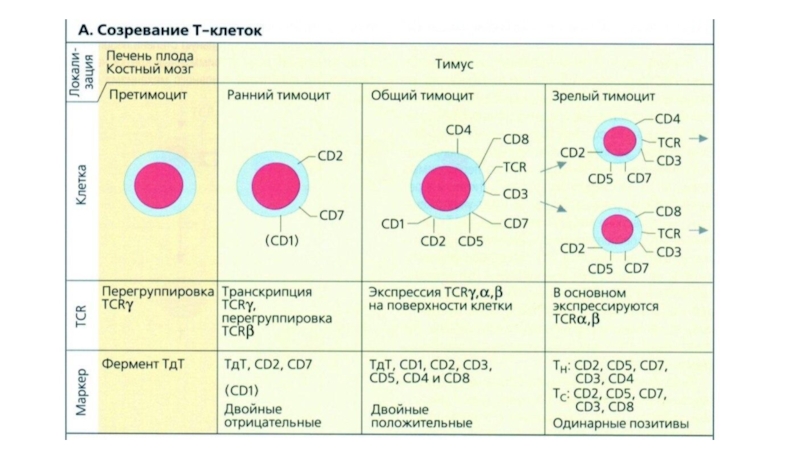
- 6. Т-клетки — разновидность лимфоцитов, основные этапы развития
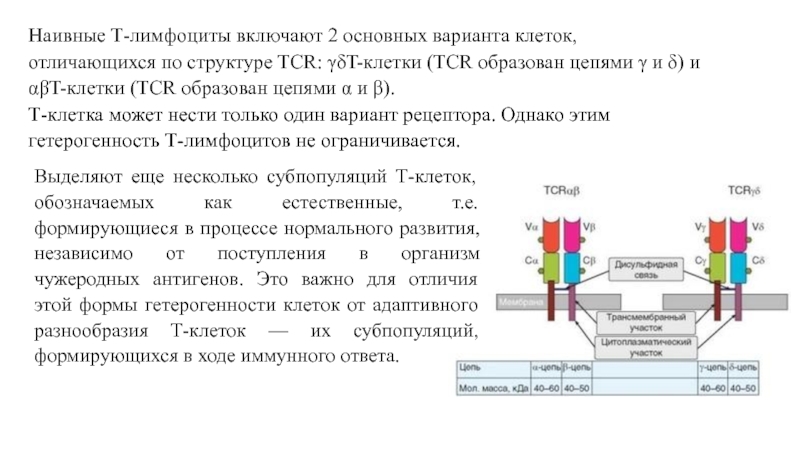
- 7. Наивные Т-лимфоциты включают 2
- 8. Слайд 8
- 9. В составе αβТ-клеток выявляют 4 субпопуляции: CD8+
- 10. В развитие αβТ-клеток выделяют следующие стадии:Миграция в
- 11. В тимус мигрируют ранние лимфоидные предшественники (ELP)
- 12. Самые ранние CD44+ CD25- тимоциты локализуются в
- 13. На стадии DN2 тимоциты перемещаются в сторону
- 14. К концу фазы DN3 тимоциты приобретают фенотип
- 15. Селекция тимоцитов и формирование субпопуляций CD4+ и
- 16. Если TCR обладает сродством к молекуле MHC,
- 17. Т-лимфоциты, рецепторы которых лишены сродства к МНС,
- 18. Отрицательная селекция. Клетки, обладающие высоким сродством, подвергаются
- 19. Дифференцировка CD4+ и CD8+ тимоцитов Одновременно с
- 20. После такой селекции путем подтверждения адекватности корецептора
- 21. Естественные субпопуляции переферических Т-лимфоцитов Развитие Т-клеток в
- 22. Т-цитотоксические лимфоциты CD8abЦитотоксические T-лuмфоциты. Наивные CD8 Т-клетки
- 23. Действие Тс-лимфоцитов направлено, главным образом, против вирус-инфицированных
- 24. Однако накопление клеточных эффекторов занимает период в
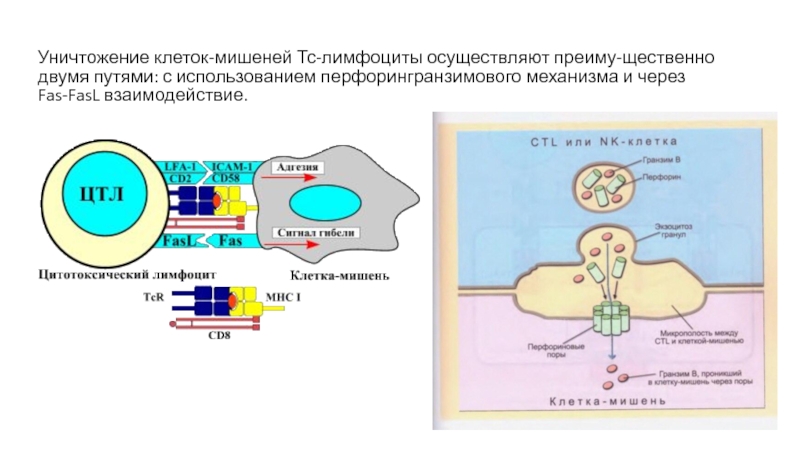
- 25. Уничтожение клеток-мишеней Тс-лимфоциты осуществляют преиму-щественно двумя путями: с использованием перфорингранзимового механизма и через Fas-FasL взаимодействие.
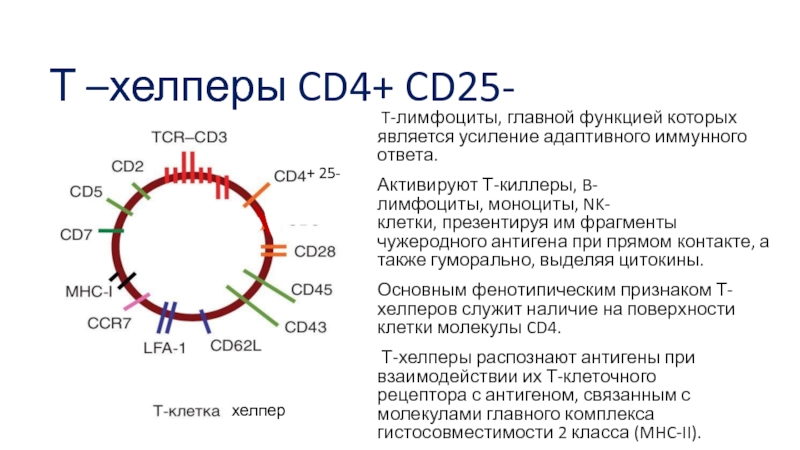
- 26. Т –хелперы CD4+ CD25- T-лимфоциты, главной функцией которых
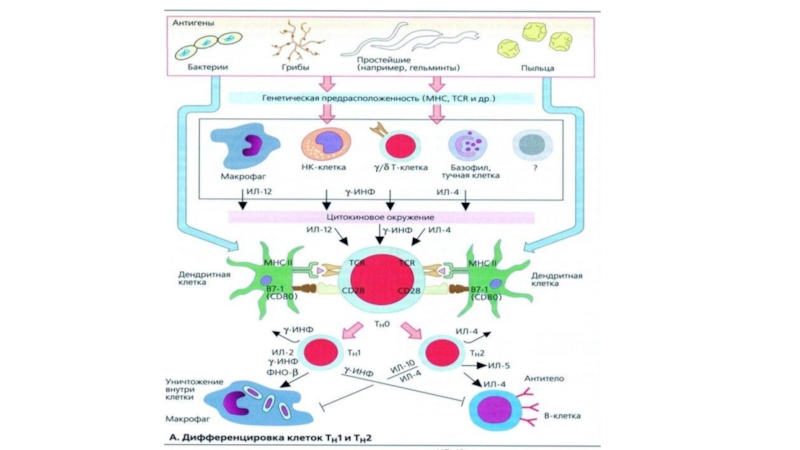
- 27. Дифференцировка Т-хелперовПод влиянием активации в результате изменений
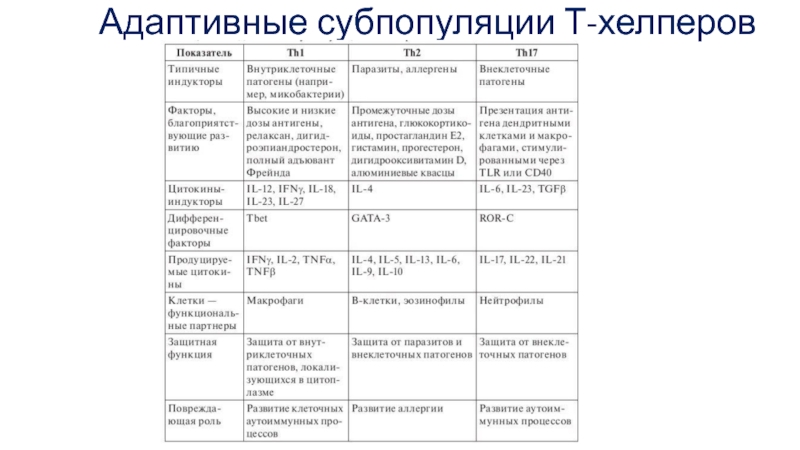
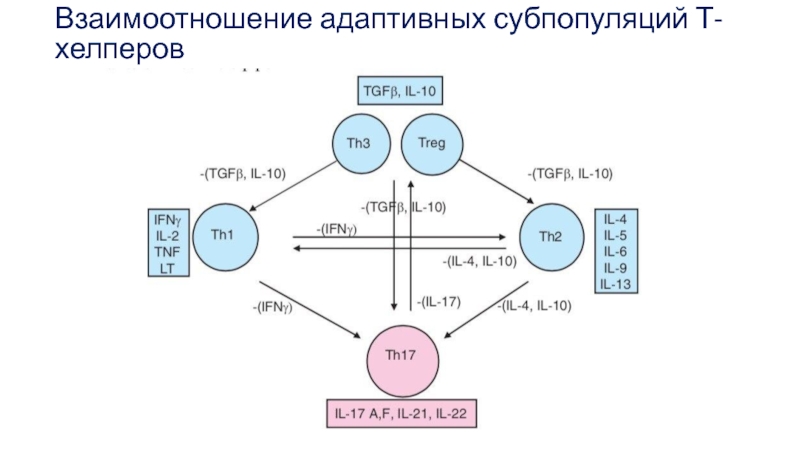
- 28. Адаптивные субпопуляции Т-хелперов
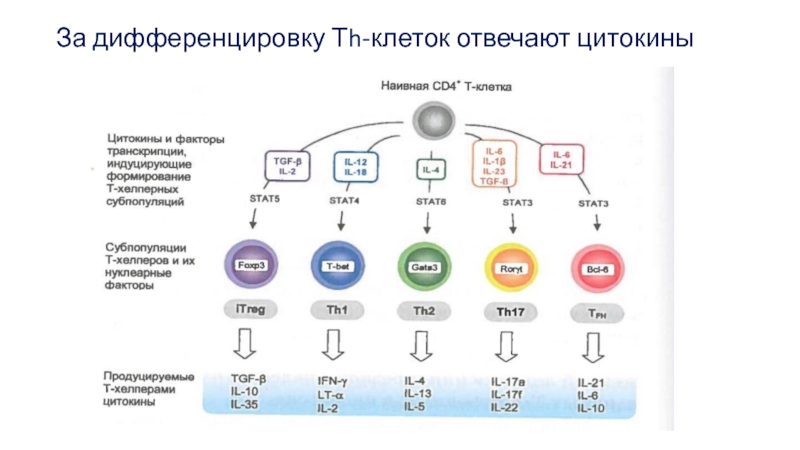
- 29. За дифференцировку Тh-клеток отвечают цитокины
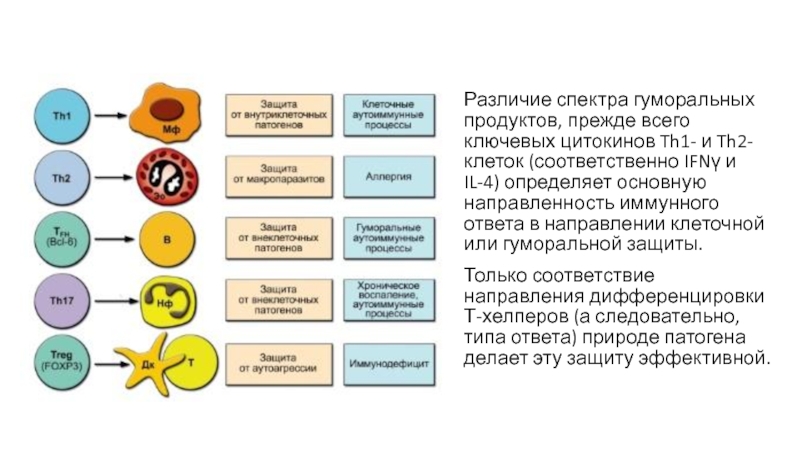
- 30. Различие спектра гуморальных продуктов, прежде всего ключевых
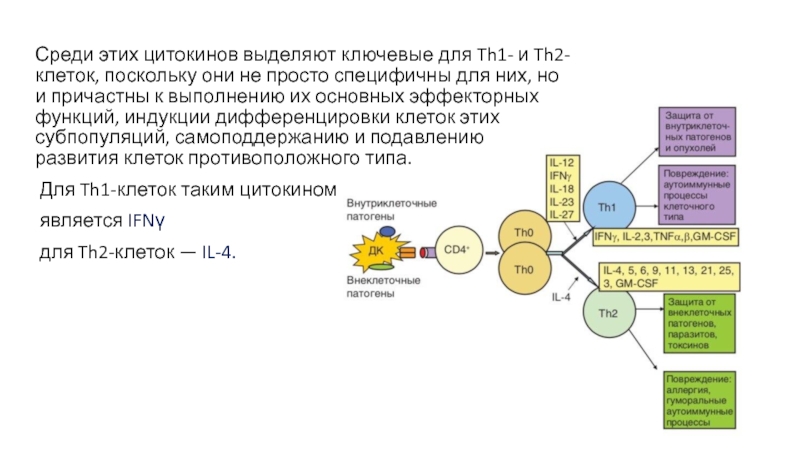
- 31. Среди этих цитокинов выделяют ключевые для Th1-
- 32. Слайд 32
- 33. Факторы запускающую дифференцировку Th1- и Th2-клеток: первый
- 34. Th1- лимфоцитыОни активны в отношении внутриклеточных микроорганизмов.
- 35. Th2- лимфоцитыДифференцировка Th2-лимфоцитов приводит к индукции антипарзиторного
- 36. Th-17 лимфоцитыОбразование Th17-клеток преимущественно направлено против ряда
- 37. Слайд 37
- 38. Слайд 38
- 39. iTreg- лимфоцитыЕще одна субпопуляция, развивающаяся из наивных
- 40. Взаимоотношение адаптивных субпопуляций Т-хелперов
- 41. Естественные регуляторные Т-клетки (Тreg). Они выполняют супрессорные
- 42. Кроме того, на их поверхности присутствуют супрессорные
- 43. Показано, что супрессорная активность CD4+ регуляторных T-клеток
- 44. Развитие Т-регуляторных клеток Естественные регуляторные T-клетки развиваются
- 45. Слайд 45
- 46. Экспрессия FOXP3 делает клетки устойчивыми к
- 47. Функциональные особенности этих клеток гарантируют подавление активности
- 48. В-лимфоцитыОсновное свойство В-лимфоцитов — экспрессия иммуноглобулинового рецептора
- 49. Так, В-клетки несут на поверхности молекулы MHC
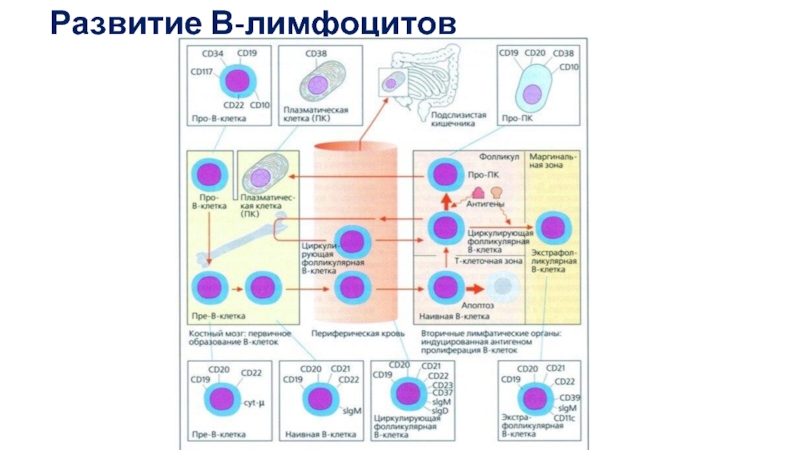
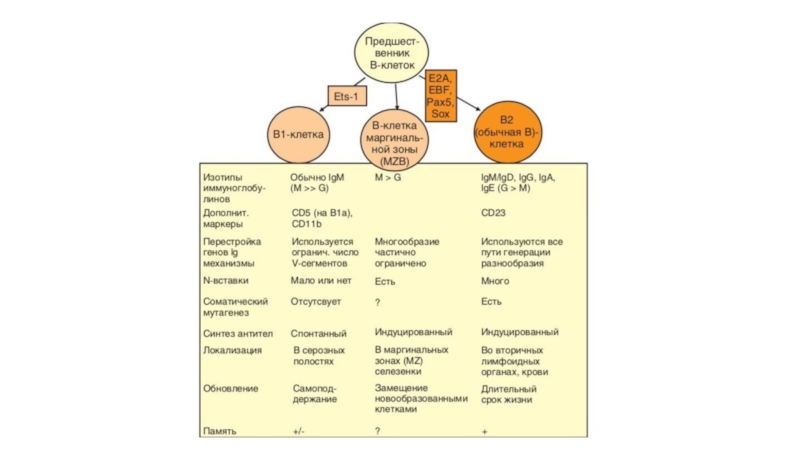
- 50. Развитие В-лимфоцитов
- 51. Основное событие дифференцировки В-клеток — формирование BCR,
- 52. Перестройку V-генов в В-клетках контролирует микроокружение, индуцирующее
- 53. Слайд 53
- 54. Первым типом Н-цепейкоторые появляется на поверхности, является
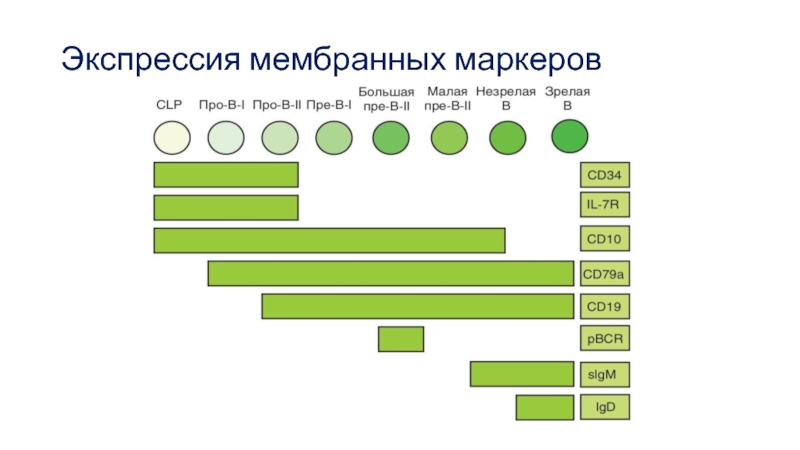
- 55. Экспрессия мембранных маркеров
- 56. Установлено, что 55–75% В-клеток, образующихся в костном
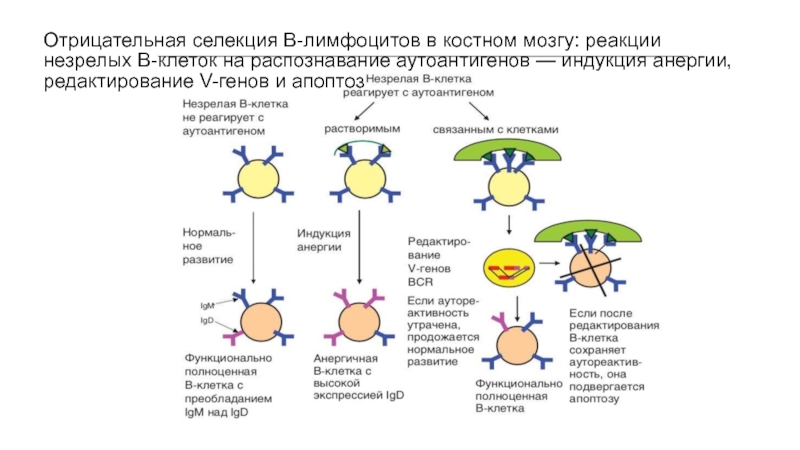
- 57. Отрицательная селекция В-лимфоцитов в костном мозгу: реакции
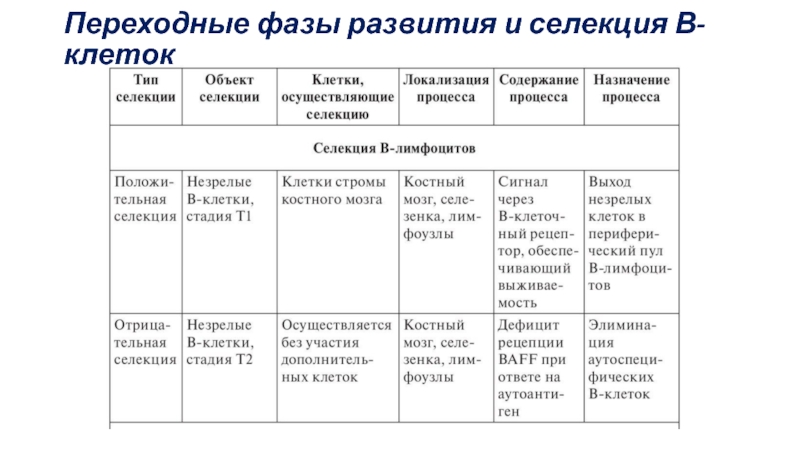
- 58. Переходные фазы развития и селекция В-клеток
- 59. Стадии T1. Фенотип В-клеток на стадии Т1
- 60. Несмотря на ≪щадящий≫ режим селекции, на этом
- 61. Популяции
- 62. Слайд 62
- 63. В1-клеткиВ1-клетки локализуются преимущественно в серозных полостях —
- 64. B1а- и B1b-клетки экспрессируют BCR, содержащий мембранную
- 65. Обе разновидности В1-клеток могут дифференцироваться в антителообразующие
- 66. В2-лимфоцитыВ2-клетки , локализующиеся преимущественно в селезенке, костном
- 67. B-клетки маргинальной зоны (MZB)Они локализуются почти исключительно
- 68. Отделение линии MZB-клеток от общей линии В2-клеток
- 69. MZB-клетки участвуют в гуморальном иммунном ответе на
- 70. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Мембранные маркеры лимфоцитов. Мембранные молекулы отмечены линиями, пересекающими круг. Цветом
выделены разные функциональные группы молекул.
NKT-клетка
Слайд 4Лимфоциты — клетки малого размера (6–8 мкм), имеющие округлую форму
с большим бобовидным ядром, занимающим почти всю клетку, и слабо
выраженной цитоплазмой, бедной гранулами. Специфическим признаком Т- и В-лимфоцитов является наличие на их поверхности антигенраспознающих рецепторов.Популяции Т- и В-клеток имеют клональную структуру: в процессе дифференцировки каждая клетка приобретает рецептор уникальной специфичности. При встрече с антигеном и активации лимфоциты пролиферируют, образуя клон, каждая клетка которого несет рецептор точно такой же специфичности, что и «материнская» клетка.
Клетки разных клонов отличаются по структуре и специфичности антигенраспознающих рецепторов.
Слайд 5Т – лимфоциты. Субпопуляции Т-клеток. Субпопуляции Т-клеток различаются по мембранным
маркерам, а также способу распознавания антигена и функциям.
CD8aa+
Т-клетки
СD3+ CD56+
Слайд 6Т-клетки — разновидность лимфоцитов, основные этапы развития которых проходят в
тимусе, что и определило их название (тимусзависимые, или Т-лимфоциты). Для
них характерен определенный способ распознавания антигенов и участие в реализации иммунного ответа в качестве исполнительных и регуляторных клеток.Т-лимфоциты морфологически неотличимы от В-лимфоцитов. Эти клетки дифференцируют по экспрессии на их поверхности маркерных молекул. Общий маркер для всех разновидностей этих Т-лимфоцитов, отсутствующий у других клеток, — молекулярный комплекс TCR–CD3.
Слайд 7 Наивные Т-лимфоциты включают 2 основных варианта клеток,
отличающихся по структуре TCR: γδT-клетки (TCR образован цепями γ и
δ) и αβT-клетки (TCR образован цепями α и β). Т-клетка может нести только один вариант рецептора. Однако этим гетерогенность Т-лимфоцитов не ограничивается.Выделяют еще несколько субпопуляций Т-клеток, обозначаемых как естественные, т.е. формирующиеся в процессе нормального развития, независимо от поступления в организм чужеродных антигенов. Это важно для отличия этой формы гетерогенности клеток от адаптивного разнообразия Т-клеток — их субпопуляций, формирующихся в ходе иммунного ответа.
Слайд 9В составе αβТ-клеток выявляют 4 субпопуляции:
CD8+ Т-лимфоциты выполняют функции цитотоксических
клеток, что и определило их название — цитотоксические Т-лимфоциты, или
Т-киллеры.CD4+ Т-клеток относят к Т-хелперам, поскольку Т-хелперы поставляют вспомогательные сигналы при активации В-лимфоцитов и макрофагов. Взаимодействие Т-хелперов с дендритными клетками служит пусковым событием Т-зависимого иммунного ответа.
Субпопуляция естественных регуляторных Т-клеток – Т рег CD4 +CD25 +FOXP3 +. Их основная функция — предотвращение реакции других Т-клеток на аутоантигены, а также ограничение (супрессия) любых форм иммунного ответа.
NKT-клетки CD3+ CD56+ на поздних этапах развития приобретающие признаки NK-клеток. В результате они коэкспрессируют ключевые маркеры Т- и NK-клеток: на их поверхности представ лены комплекс TCR–CD3 и типичные молекулы NK-клеток CD56 и CD16, а также ингибирующие (KIR, NKRG2) и активирующие (NKG2D) рецепторы.
Слайд 10В развитие αβТ-клеток выделяют следующие стадии:
Миграция в тимус клеток-предшественников;
Развитие дважды
отрицательных тимоцитов и перестройка генов T-клеточного рецептора;
Положительная селекция;
Отрицательная селекция;
Дифференцировка CD4+
и CD8+ тимоцитов.Слайд 11В тимус мигрируют ранние лимфоидные предшественники (ELP) — клетки, находящиеся
на более ранней стадии развития, чем общий лимфоидный предшественник CLP.
Фенотипически эти клетки можно охарактеризовать как СD34+ SCA-1+ CD117 (c-Kit)+ Flt-3+ CCR9+ СD4lo.Это, в частности, проявляется способностью ELP дифференцироваться как в лимфоидные, так и в миело- идные клетки. По мере развития тимоцитов в тимусе эта полипотентность сужается и затем утрачивается.
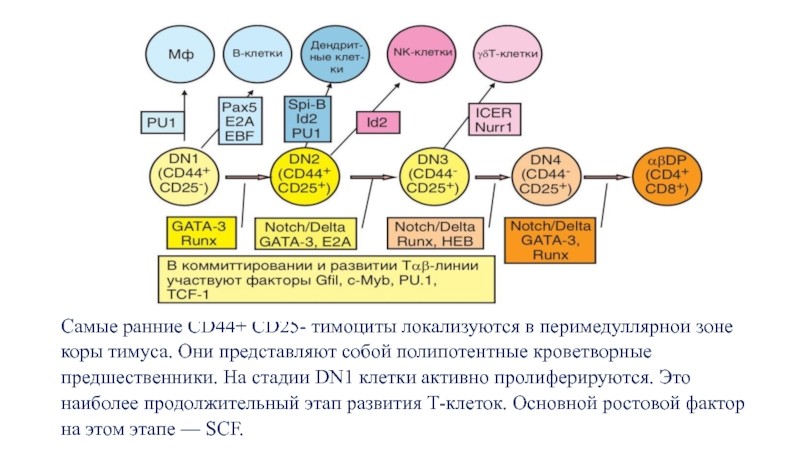
Слайд 12Самые ранние CD44+ CD25- тимоциты локализуются в перимедуллярной зоне коры
тимуса. Они представляют собой полипотентные кроветворные предшественники. На стадии DN1
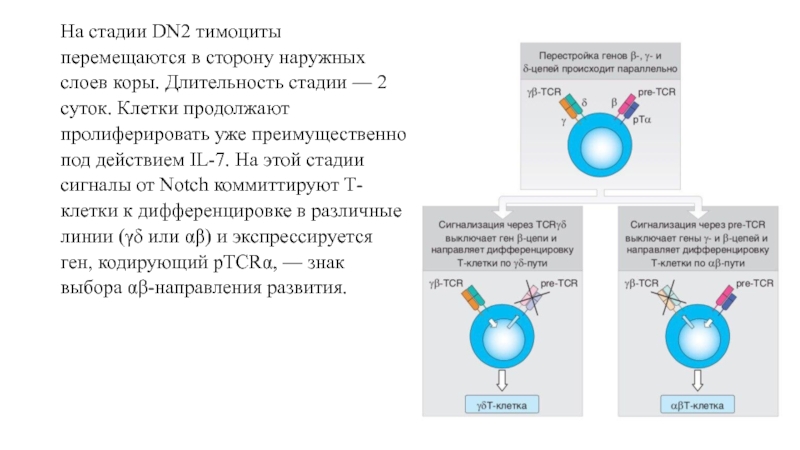
клетки активно пролиферируются. Это наиболее продолжительный этап развития Т-клеток. Основной ростовой фактор на этом этапе — SСF.Слайд 13На стадии DN2 тимоциты перемещаются в сторону наружных слоев коры.
Длительность стадии — 2 суток. Клетки продолжают пролиферировать уже преимущественно
под действием IL-7. На этой стадии сигналы от Notch коммиттируют Т-клетки к дифференцировке в различные линии (γδ или αβ) и экспрессируется ген, кодирующий pTCRα, — знак выбора αβ-направления развития.Слайд 14К концу фазы DN3 тимоциты приобретают фенотип CD44-CD25+. Длительность фазы
DN3 до β-селекции составляет 2 сут, а период β-селекции —
еще 1 сут.На заключительном этапе фазы DN3 на клетках экспрессируется корецептор CD4.
После перестройки V-генов обеих цепей происходит сборка их продуктов и экспрессия «зрелого» TCR на поверхности клетки.
Слайд 15Селекция тимоцитов и формирование субпопуляций CD4+ и CD8+ клеток.
Дважды положительные
клетки очень чувствительны к апоптозу. Для выживания дифференцирующимся Т-клеткам нужна
поддержка микроокружения. Для нормального функционирования иммунной системы нужно, чтобы Т-клетки несли TCR, распознающие молекулы MHC, содержащие пептидные фрагменты антигенов.Положительной селекции подвергаются дважды положительные тимоциты фенотипа CD4+ CD8+ CD3lo CD27-.
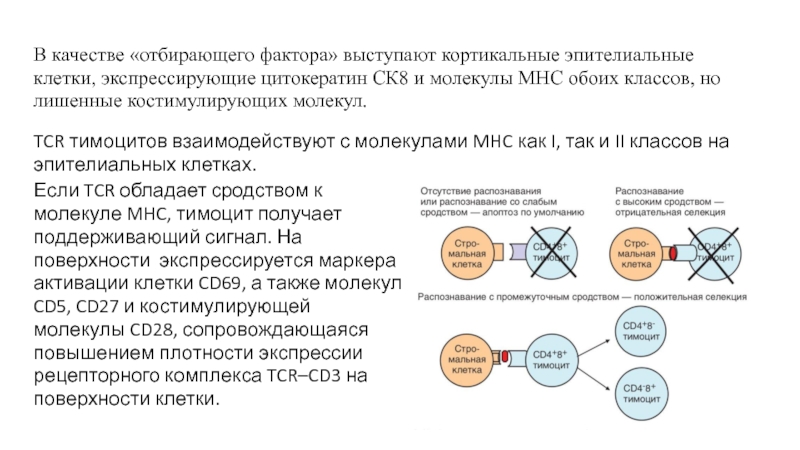
Слайд 16Если TCR обладает сродством к молекуле MHC, тимоцит получает поддерживающий
сигнал. На поверхности экспрессируется маркера активации клетки CD69, а также
молекул CD5, CD27 и костимулирующей молекулы CD28, сопровождающаяся повышением плотности экспрессии рецепторного комплекса TCR–CD3 на поверхности клетки.В качестве «отбирающего фактора» выступают кортикальные эпителиальные клетки, экспрессирующие цитокератин СК8 и молекулы MHC обоих классов, но лишенные костимулирующих молекул.
TCR тимоцитов взаимодействуют с молекулами MHC как I, так и II классов на эпителиальных клетках.
Слайд 17Т-лимфоциты, рецепторы которых лишены сродства к МНС, подвергаются апоптозу «по
умолчанию», т.е. не в силу сигнала извне, передаваемого через мембранные
рецепторы, а вследствие срабатывания внутренних механизмов.Поскольку сродством к молекулам MHC обладают TCR лишь незначительной части клонов образующихся тимоцитов, на этапе положительной селекции погибает 90% CD4+ CD8+ тимоцитов.
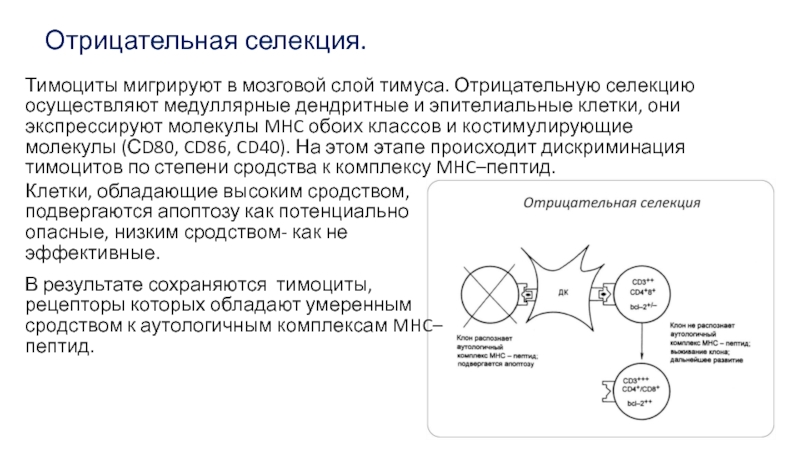
Слайд 18Отрицательная селекция.
Клетки, обладающие высоким сродством, подвергаются апоптозу как потенциально опасные,
низким сродством- как не эффективные.
В результате сохраняются тимоциты, рецепторы которых
обладают умеренным сродством к аутологичным комплексам MHC–пептид.
Тимоциты мигрируют в мозговой слой тимуса. Отрицательную селекцию осуществляют медуллярные дендритные и эпителиальные клетки, они экспрессируют молекулы MHC обоих классов и костимулирующие молекулы (СD80, CD86, CD40). На этом этапе происходит дискриминация тимоцитов по степени сродства к комплексу MHC–пептид.
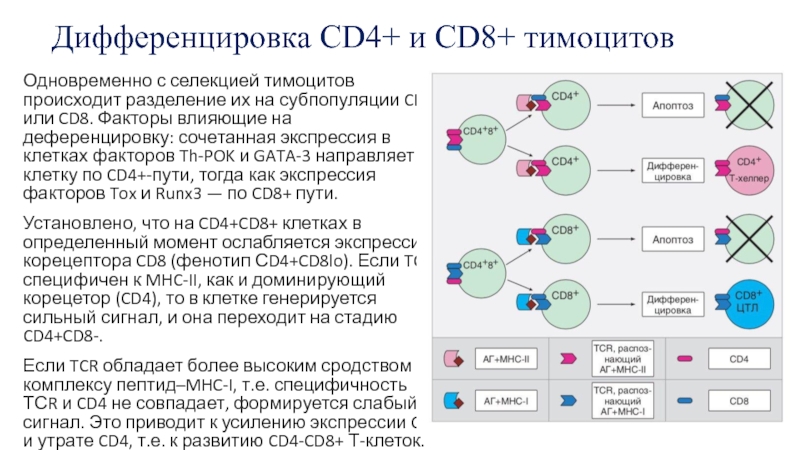
Слайд 19Дифференцировка CD4+ и CD8+ тимоцитов
Одновременно с селекцией тимоцитов происходит разделение
их на субпопуляции CD4 или CD8. Факторы влияющие на деференцировку:
сочетанная экспрессия в клетках факторов Th-POK и GATA-3 направляет Т-клетку по CD4+-пути, тогда как экспрессия факторов Tox и Runx3 — по CD8+ пути.Установлено, что на CD4+CD8+ клетках в определенный момент ослабляется экспрессия корецептора CD8 (фенотип СD4+CD8lo). Если TCR специфичен к MHC-II, как и доминирующий корецетор (CD4), то в клетке генерируется сильный сигнал, и она переходит на стадию CD4+CD8-.
Если TCR обладает более высоким сродством к комплексу пептид–MHC-I, т.е. специфичность ТСR и CD4 не совпадает, формируется слабый сигнал. Это приводит к усилению экспрессии CD8 и утрате CD4, т.е. к развитию CD4-CD8+ Т-клеток.
Слайд 20После такой селекции путем подтверждения адекватности корецептора клетка приобретает функциональные
свойства, соответствующие ее назначению.
CD8+ T-клетки (Т-киллеры) приобретают способность формировать
цитолитический молекулярный комплекс, что обеспечивает функционирование такой Т-клетки в качестве цитотоксического Т-лимфоцита. В CD4+ T-лимфоцитах (Т-хелперах) формируются внутриклеточные механизмы, необходимые для выполнения «хелперной» функции, прежде всего — способность активно вырабатывать цитокины при активации.
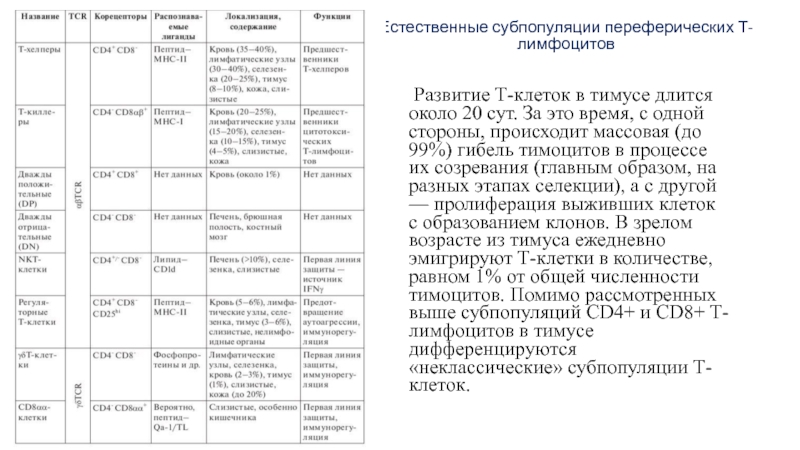
Слайд 21Естественные субпопуляции переферических Т-лимфоцитов
Развитие Т-клеток в тимусе длится около
20 сут. За это время, с одной стороны, происходит массовая
(до 99%) гибель тимоцитов в процессе их созревания (главным образом, на разных этапах селекции), а с другой — пролиферация выживших клеток с образованием клонов. В зрелом возрасте из тимуса ежедневно эмигрируют Т-клетки в количестве, равном 1% от общей численности тимоцитов. Помимо рассмотренных выше субпопуляций CD4+ и CD8+ Т-лимфоцитов в тимусе дифференцируются «неклассические» субпопуляции Т-клеток.Слайд 22Т-цитотоксические лимфоциты CD8ab
Цитотоксические T-лuмфоциты. Наивные CD8 Т-клетки являются предшественниками Тс-лимфоцитов.
Они не проявляю цитотоксической активности не экспрессируют IL-2R и не
синтезируют IL-2.После контакта с дендритной клеткой, презентирующей антиген в составе МНС-I, на поверхности этих лимфоцитов появляются IL-2R, и запускается продукция IL-2. Однако уровень синтеза IL-2 обычно невысок. Его недостаточно для аутоиндукции пролиферации и дифференцировки. Поэтому для реализации цитотоксического ответа необходимо участие специфичных к антигену Th1-клеток основного источника IL-2.
Кроме того, Th1-клетки через продукцию IFNY дополнительно активируют антигенпрезентирующие клетки и макрофаги, которые, в свою очередь, синтезируя IL-12, не только поддерживают Th1-ответ, усиливают клональную экспансию CD8 Т-клеток, и подключают в реакцию NK-лимфоциты.
Важную роль в активации и дифференцировке CD8 Т-клеток играют плазмацитoидные дендритные клетки, реализующие свои эффекты через интерфероны I класса (IFN-a/B).
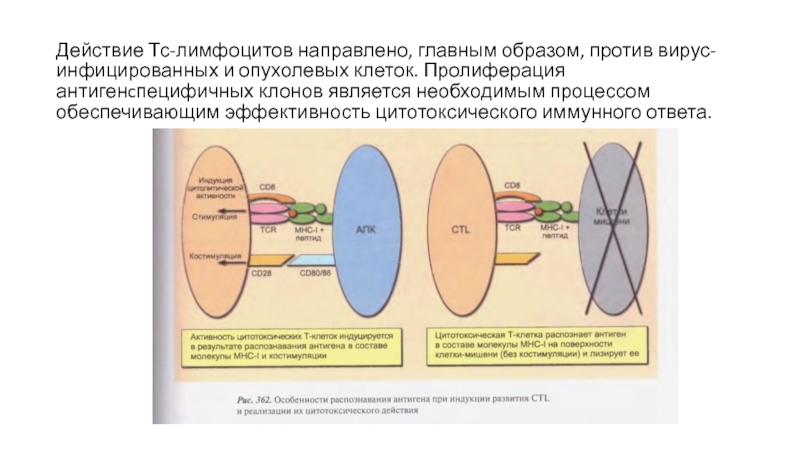
Слайд 23Действие Тс-лимфоцитов направлено, главным образом, против вирус-инфицированных и опухолевых клеток.
Пролиферация антигенcпецифичных клонов является необходимым процессом обеспечивающим эффективность цитотоксического иммунного
ответа.Слайд 24Однако накопление клеточных эффекторов занимает период в 5-7 дней. Это
и определяет подключение на ран лимфоцитов, пик активности них этапах
инфекции которых обычно наблюдается на 2-3 сутки В период дифференцировки Тс-клетки начинают экспрессировать перфорин и гранзимы, а также FasL.Параллельно с эффекторными Тс-лимфоцитами происходит формирование и дифференцировки эффекторные Тс-лимфоциты покидают лимфатические узлы и мигрируют в зону воспаления. Возможность их возвращения в лимфоидные органы существенно ограничена в связи с потерей в процессе созревания мембранных структур: CCR7,CD62L и cфингозин-1-фосфатного рецептора. Вместе с тем на поверхности Тс-клеток появляется VLA-4 и хемoкиновые рецепторы CXCR3 и CCR5, обеспечивающие их проникновение в воспалительный очаг.
Слайд 25Уничтожение клеток-мишеней Тс-лимфоциты осуществляют преиму-щественно двумя путями: с использованием перфорингранзимового
механизма и через Fas-FasL взаимодействие.
Слайд 26Т –хелперы CD4+ CD25-
T-лимфоциты, главной функцией которых является усиление адаптивного иммунного
ответа.
Активируют Т-киллеры, B-лимфоциты, моноциты, NK-клетки, презентируя им фрагменты чужеродного антигена при прямом контакте, а также гуморально, выделяя цитокины.
Основным фенотипическим признаком Т-хелперов служит наличие на поверхности клетки молекулы CD4.
Т-хелперы распознают антигены при взаимодействии их Т-клеточного рецептора с антигеном, связанным с молекулами главного комплекса гистосовместимости 2 класса (MHC-II).
+ 25-
хелпер
Слайд 27Дифференцировка Т-хелперов
Под влиянием активации в результате изменений структуры хроматина гены
цитокинов становятся доступными для регулирующих сигналов, под влиянием которых выявляют
минимальный уровень экспрессии многих из этих генов. На этом этапе CD4+ Т-клетки обозначаются как Th0-клетки.Помимо IL-2, обеспечивающего пролиферативную экспансию, Но уже в процессе деления CD4+ Т-клеток запускается процесс их дифференцировки на субпопуляции.
Такие субпопуляции называют адаптивными, поскольку они образуются в ходе адаптивного иммунного ответа на антигены, в отличие от естественных субпопуляций, формирующихся в ходе антигеннезависимой дифференцировки Т-клеток.
Ранее других образуются 2 субпопуляции Т-хелперов — Th1 и Th2.
Слайд 30Различие спектра гуморальных продуктов, прежде всего ключевых цитокинов Th1- и
Th2-клеток (соответственно IFNγ и IL-4) определяет основную направленность иммунного ответа
в направлении клеточной или гуморальной защиты.Только соответствие направления дифференцировки Т-хелперов (а следовательно, типа ответа) природе патогена делает эту защиту эффективной.
Слайд 31Среди этих цитокинов выделяют ключевые для Th1- и Th2-клеток, поскольку
они не просто специфичны для них, но и причастны к
выполнению их основных эффекторных функций, индукции дифференцировки клеток этих субпопуляций, самоподдержанию и подавлению развития клеток противоположного типа.Для Th1-клеток таким цитокином
является IFNγ
для Th2-клеток — IL-4.
Слайд 33Факторы запускающую дифференцировку Th1- и Th2-клеток: первый поступает через TCR
и ≪сообщает≫ о распознавании антигена в комплексе с молекулой MHC.
Второй сигнал поставляют цитокины.Развитию Th1-клеток способствуют крайние (очень высокая и очень низкая) дозы антигена и его высокое сродство к рецептору, а развитию Th2-клеток — промежуточные дозы антигена и более низкое его сродство к рецептору.
Слайд 34Th1- лимфоциты
Они активны в отношении внутриклеточных микроорганизмов. Включая пролиферацию наивных
CD8+ Тс- лимфоцитов (IL-2) и активируя макрофаги (IFN-y) они запускают
цитотоксические и противовоспалительные реакции.Активированные макрофаги, продуцирую IL-12 поддерживают Th1 ответ.
При этом IFN-y подавляет формирование Th2- и Th17 – лимфоцитов и направляет В- лимфоциты на формирование IgG-антител.
Слайд 35Th2- лимфоциты
Дифференцировка Th2-лимфоцитов приводит к индукции антипарзиторного иммунитета.
Продукция IL-5 приводит
к развитию эозинофилии.
IL-4 и IL-13 запуск синтеза IgЕ, усиление секреции
слизи эпителиальными клетками и повышение сократительной активности миоцитов.В конечном итоге приводит к ослаблению паразитов и их изгнанию.
IL-4 и IL-10 блокирует функции Th1- и Th17 – лимфоцитов.
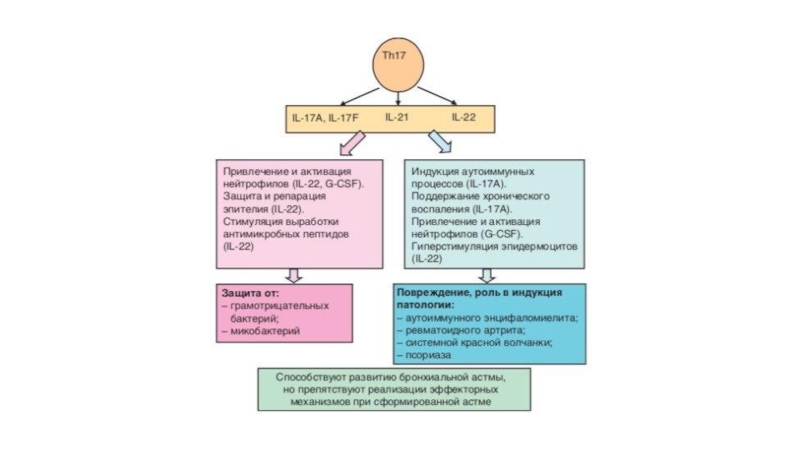
Слайд 36Th-17 лимфоциты
Образование Th17-клеток преимущественно направлено против ряда внеклеточных микроорганизмов (бактерий
и грибов) и сопровождается включением выраженной воспалительной реакции.
Продуцируемый этими
клетками IL-17 стимулирует созревание и хемотаксис нейтрофильных лейкоцитов и моноцитов. IL-22 действует на клетки эпителия, вызывая его гиперплазию и синтез антибактериальных протеинов, вызывает потерю массы тела, атрофию тимуса, нейтрофильный лейкоцитоз, усиливает образование в печени фибриногена и сывороточного амилоида A.
Защитные эффекты Th17-лимфоцитов установлены в отношении Klebsiella pneumoniae, Bordetella pertussis Mycoplasma pneumoniae, Pneumocystis carinii, Candida albicans, Mycobacterium tuberculosis (привлечение Th1 клеток).
Способность давать выраженную воспалительную реакцию определила участие клеток в аутоиммунных процессах.
Слайд 39iTreg- лимфоциты
Еще одна субпопуляция, развивающаяся из наивных CD4 T-клеток iTreg.
Она занимает особое место, так как не является хелперной.
iTreg
отличаются также от натуральных Treg, образующихся в тимусе. Их базовый фенотип (CD4+ CD25+ Foxp3+) совпадает, но iTreg формируются только во вторичных лимфоидных органах в период развития иммунного ответа. Их супрессорная функция реализует через секрецию TGF-B и IL-10, IL-35 обеспечивает самоподдержание.
Слайд 41Естественные регуляторные Т-клетки (Тreg). Они выполняют супрессорные функции, и их
главная задача — предотвращение развития аутоиммунных процессов.
У человека регуляторные T-клетки
имеют мембранный фенотип СD4+CD25hiСTLA-4+GITR+PD-1+.Регуляторные Т-лимфоциты эмигрируют из тимуса в составе популяции зрелых Т-клеток.
CD4+CD25hi Т-лимфоциты составляют 5% от числа тимоцитов и 3–5% от числа периферических лимфоцитов (5–7% от числа CD4+ Т-клеток), т.е. 0,02–0,06×109 клеток на 1 литр крови.
Экспрессия белка FOXP3 регистрируется на несколько большем (10–12%) числе Т-лимфоци-тов крови.
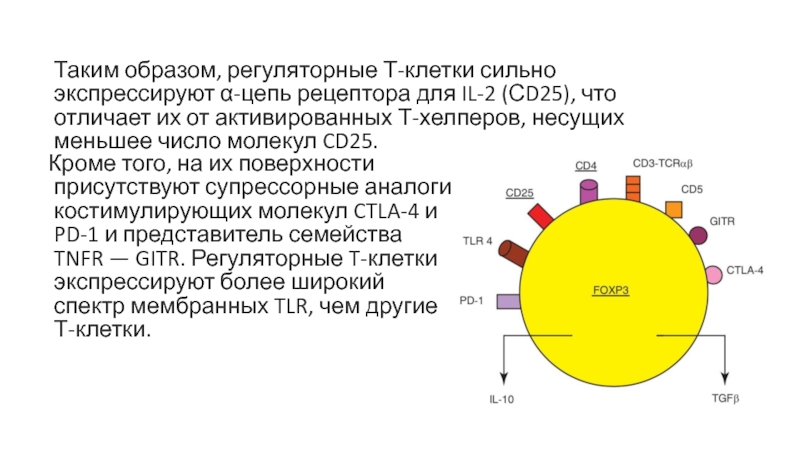
Слайд 42Кроме того, на их поверхности присутствуют супрессорные аналоги костимулирующих молекул
CTLA-4 и PD-1 и представитель семейства TNFR — GITR. Регуляторные
T-клетки экспрессируют более широкий спектр мембранных TLR, чем другие Т-клетки.Таким образом, регуляторные Т-клетки сильно экспрессируют α-цепь рецептора для IL-2 (СD25), что отличает их от активированных Т-хелперов, несущих меньшее число молекул CD25.
Слайд 43Показано, что супрессорная активность CD4+ регуляторных T-клеток связана с транскрипционным
фактором FОХР3 ( скурфин).
мутации гена FOXP3 сопровождаются утратой регуляторными T-клетками
супрессорной активности, а трансдукция гена FOXP3 в CD4+ CD25- клетки приводит к появлению у них супрессорной активности, усилению экспрессии CD25 и CTLA-4.В то же время FOXP3 в норме экспрессируется в некоторых CD4+CD25-Т-клетках, также проявляющих супрессорную активность.
Слайд 44Развитие Т-регуляторных клеток
Естественные регуляторные T-клетки развиваются преимущественно в тимусе.
Необычность их дифференцировки состоит в приобретении ими супрессорных свойств, определяемых
экспрессией гена FOXP3, а также сохранением способности распознавать аутоантигены с высокой степенью сродства (т.е. эти клетки не проходят отрицательной селекции).Первое проявление дифференцировки состоит в экспрессии высокоаффинного рецептора для IL-2, индуцируемой при взаимодействии с эпителиальными клетками кортикальной зоны (т.е. во время положительной селекции).
Дифференцировочный сигнал вырабатывается при взаимодействии Notch-3, экспрессируемого тимоцитами, с его лигандом Jagged 1/2 эпителиальных клеток.
При действии IL-2, секретируемого зрелыми CD4+CD8- Т-лимфоцитами и стромальными клетками, на IL-2R тимоцитов индуцируется (при участии STAT5) экспрессия гена FOXP3.
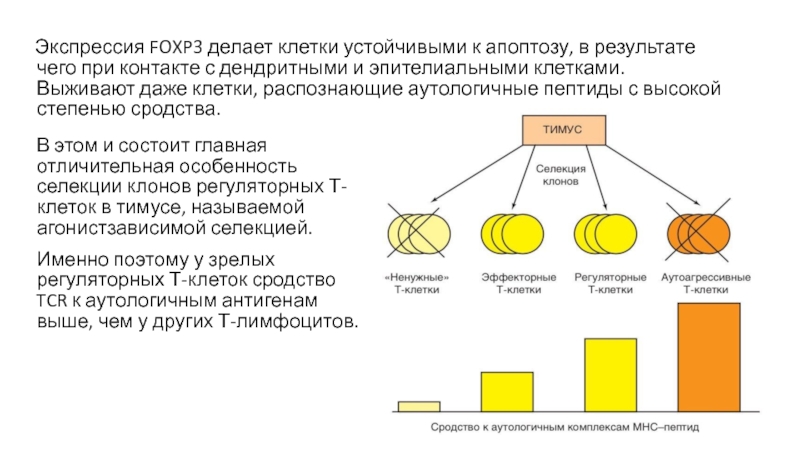
Слайд 46 Экспрессия FOXP3 делает клетки устойчивыми к апоптозу, в результате
чего при контакте с дендритными и эпителиальными клетками. Выживают даже
клетки, распознающие аутологичные пептиды с высокой степенью сродства.В этом и состоит главная отличительная особенность селекции клонов регуляторных Т-клеток в тимусе, называемой агонистзависимой селекцией.
Именно поэтому у зрелых регуляторных Т-клеток сродство TCR к аутологичным антигенам выше, чем у других Т-лимфоцитов.
Слайд 47Функциональные особенности этих клеток гарантируют подавление активности аутреактивных эффекторных клеток,
избежавших негативной селекции при развитии.
По завершении дифференцировки регуляторные Т-клетки
начинают экспрессировать мембранные молекулы, важные для выполнения их функций (например, CTLA4, PD-1, GITR).Кроме того, регуляторные Т-лимфоциты приобретают способность вырабатывать суперссорные цитокины (IL-10, трансформирующй фактор роста β).
Слайд 48В-лимфоциты
Основное свойство В-лимфоцитов — экспрессия иммуноглобулинового рецептора для распознавания антигенов
— BCR. На поверхности зрелой В-клетки содержится около 150 000
комплексов BCR.На мембране зрелой наивной В-клетки, содержатся иммуноглобулины классов IgM и IgD.
BCR входит также ряд молекул, относящихсяк суперсемейству иммуноглобулинов: гетеродимеры, содержащие полипептидные цепи Igα (CD79a) и Igβ (СD79b) участвующие в передаче сигнала о связывании антигена внутрь клетки;
CD19, CD21 (рецептор для комплемента CR2) и CD81, взаимодействии с антигеном между ними и В-клеточным рецептором устанавливается связь, и они вносят существенный вклад в усиление активационного сигнала, поступающего в клетку от рецептора.
Слайд 49Так, В-клетки несут на поверхности молекулы MHC I и II
класса, костимулирующие молекулы CD40, CD86, а при активации —CD80. Благодаря
экспрессии этих молекул В-лимфоциты могут выполнять роль ≪профессиональных≫ АПК.В-клетки экспрессируют молекулы адгезии позволяющие им мигрировать из сосудов и перемещаться в тканях.
Присутствие на их поверхности Fc-рецепторов (FcγRIIВ — CD32) и уже упомянутых рецепторов для комплемента (СR2) в регуляции активности В-клеток играет большую роль, чем для выполнения ими эффекторных функций.
В-клетки экспрессируют многочисленные рецепторы для цитокинов, из которых наиболее важны рецепторы для IL-4, IL-5, IL-6, IL-2, IL-1, IL-10 и некоторых других.
На их поверхности присутствуют рецепторы для цитокинов семейства TNF: BAFF— BAFF-R, BCMS, TAC-1, а также APRIL— HSPG. Эти цитокины защищают В-клетки от развития апоптоза и выполняют гомеостатическую функцию, поддерживая численность этих клеток на постоянном уровне.
На В-лимфоцитах представлены рецепторы для хемокинов: например, CXCR4 (для SDF-1), CXCR5 (для BLC, служащего основным хемоаттрактантом для наивных В-клеток), CCR3 (для эотаксинов), CCR6 (для LARC).
Слайд 51Основное событие дифференцировки В-клеток — формирование BCR, а точнее, лежащая
в его основе перестройка V-генов иммуноглобулинов.
Выделяют несколько стадий развития В-лимфоцитов:
про-В, пре-В, незрелые В и зрелые наивные В-клетки. Стадии про-В- и пре-В-клеток в свою очередь подразделяют на подстадии I и II (соответственно, ранние и поздние) На стадии про-В-II перестраиваются гены Н-цепей. На стадии пре-В ≪проверяется≫ правильность прошедшей реаранжировки и перестраиваются гены L-цепей.
На стадии незрелой В-клетки белковый продукт перестроенных генов иммуноглобулинов экспрессируется на мембране клетки в виде мембранного IgM,на стадии зрелой В-клетки к нему присоединяется IgD.
Слайд 52Перестройку V-генов в В-клетках контролирует микроокружение, индуцирующее экспрессию в них
дифференцировочных факторов. Развитие лимфоцитов в направлении В-клеток направляют факторы E2A,
EBF и Pax5.Экспрессию Рах5 рассматривают как ключевой маркер обособления В-линии. Рах5 имеет прямое отношение к включению реаранжировки V-генов в В-клетках и экспрессии молекулы CD19.
Фактор EBF отвечает за экспрессию гена корецептора Igα — наиболее раннего белкового маркера В-лимфоцитов, появляющегося уже на стадии про-В-I. Затем на поверхности В-клетки экспрессируется молекула CD19.
На стадии про-В-II экспрессируются гены RAG1 и RAG2, продукты которых отвечают за включение процесса реаранжировки V-генов, а также ген, кодирующий фермент TdT, обеспечивающий нематричное добавление нуклеотидов при D-J рекомбинации.
Слайд 54Первым типом Н-цепейкоторые появляется на поверхности, является IgM. Стадию, на
которой на поверхности В-клетки присутствуют только IgM, называют стадией незрелой
В-клетки.Завершающее событие в созревании В-лимфоцита — экспрессия на его поверхности IgD .
Кроме того, при созревании В2-лимфоциты экспрессируют мембранные молекулы СD21 и СD23
Поскольку успешная перестройка каждого V-гена блокирует перестройку аллельных генов все молекулы иммуноглобулина, присутствующие на поверхности В-клетки, идентичны по изотипу L-цепей и по структуре V-генов. Это обусловливает одинаковую специфичность рецепторных иммуноглобулинов В-клетки.
Поскольку перестройка V-генов происходит в каждой клетке автономно, все созревающие В-лимфоциты уникальны по специфичности их рецепторов.
Слайд 56Установлено, что 55–75% В-клеток, образующихся в костном мозгу, специфичны к
собственным антигенам организма — аутоантигенам. Уже в костном мозгу значительная
часть новообразованных В-клеток распознает аутоантигены. Однако незрелые В-клетки не активируются при связывании их BCR с антигеном.Распознавание аутоантигенов служит сигналом к ≪редактированию≫ генов BCR. Этот процесс заключается в повторной перестройке V-генов с вовлечением сегментов, не задействованных в предыдущей реаранжировке. При успешном редактировании В-клеткатеряет аутореактивность. Если же этого не происходит, клетки выбраковываются путем апоптоза или подвергается очередным этапам селекции в периферическом отделе иммунной системы
Слайд 57Отрицательная селекция В-лимфоцитов в костном мозгу: реакции незрелых В-клеток на
распознавание аутоантигенов — индукция анергии, редактирование V-генов и апоптоз
Слайд 59Стадии
T1. Фенотип В-клеток на стадии Т1 —IgMhi IgD-/lo CD23-
CD21lo CD24hi.. В-клетки получают через BCR-сигнал, обеспечивающий их выживание, без
участия антигенов (положительная селекция).Т2 и Т3. характеризующиеся фенотипом IgMhi IgDhi CD21int СD23+ и IgMlo IgDhi CD21int СD23+. На этих этапах выживаемость клеток и их пролиферацию регулируют сигналы, поступающих через BCR и рецепторов для BAFF. Они приводят к экспрессии транскрипционных факторов NFκB.
Особенность Т2 В-клеток —низкая экспрессия рецепторов для BAFF. В результате В-клетки, связавшие антиген, не получают дополнительного сигнала через BAFF-рецепторы и подвергаются апоптозу.
Усиленная экспрессия рецепторов для BAFF на стадии Т2 В-клеток приводит к индукции аутоиммунных процессов.
Слайд 60Несмотря на ≪щадящий≫ режим селекции, на этом этапе сохраняется лишь
10–30% В-клеток, вышедших из костного мозга, общие же потери В-клеток
в процессе их развития превышают 95%.Экспрессия хемокинового рецептора CXCR5 позволяет выжившим клеткам мигрировать в фолликулы по градиенту хемокина CXCL13 (BLC).
После завершения переходной стадии развития В-клеток на их поверхности устанавливается нормальная экспрессия рецепторов для BAFF/APRIL и в ответ на связывание BCR с антигеном они не гибнут, а активируются и пролиферируют.
Выжившие клетки представляют собой зрелые наивные В-лимфоциты, в совокупности образующие антигенраспознающий репертуар В-лимфоцитов, необходимый для обеспечения развития гуморального адаптивного иммунного ответа.
Слайд 63В1-клетки
В1-клетки локализуются преимущественно в серозных полостях — брюшной и плевральной.
Небольшое количество В1-лимфоцитов, преимущественно клетки, секретирующие антитела, выявляют в селезенке,
где на их долю приходится 1–5% от числа В-клеток. Некоторые В1-клетки мигрируют (через сальник) в слизистую оболочку кишечника и брыжеечные лимфоузлы (до 50% IgA-продуцентов в лимфоидной ткани кишечника — В1-клетки).Выделяют 2 субпопуляции В1-клеток. Основной дифференциальный признак при этом — экспрессия мембранной молекулы СD5 (известной как один из маркеров Т-клеток). В1а-клетки одновременно несут на поверхности молекулыIgM и CD5. CD5 отсутствует на всех остальных В-лимфоцитах, в том числе на В1b-клетках, в остальном очень схожих с В1а-клетками. Для В1-клетокхарактерен ≪активированный фенотип≫, что проявляется в экспрессии наих поверхности костимулирующих молекул СD80 и СD86. Это свойство обеспечивает способность В1-лимфоцитов выполнять функции АПК.
Слайд 64B1а- и B1b-клетки экспрессируют BCR, содержащий мембранную форму IgM. Известны
исключения: описано переключение IgM на IgA в lamina propria кишечника.
Перестроенные V-гены мембранного IgM В1а-клеток не содержат N-вставок.Разнообразие V-генов В1-клеток существенно ниже, чем у В2-клеток. Это связано с различиями в условиях развития: В1а-клетки в онтогенезе появляются раньше других субпопуляций — еще до рождения. Они развиваются в печени плода при участии IL-5 и IL-10 из клеток-предшественников, отличных от таковых у обычных В-клеток. Еще в эмбриональном периоде В1-клетки мигрируют в серозные полости, где они существуют в течение всей жизни организма.
В1-клетки способны к самоподдержанию путем очень медленной пролиферации, восполняющей убыль клеток, погибающих по механизму апоптоза.
Слайд 65Обе разновидности В1-клеток могут дифференцироваться в антителообразующие клетки без стимуляции
антигеном. При этом они секретируют преимущественно IgM-антитела (в кишечнике —
также IgA). Большинство этих антител специфично к собственным белкам организма; многие из них полиспецифичны. Эти антитела имеют низкое сродство к антигенам, включая аутоантигены, и не способны вызвать повреждение тканей.Примерно половина сывороточного IgMсекретируется В1-клетками.
Естественные антитела, продуцируемые В1а-лимфоцитами, часто специфичны к микробным антигенам и опсонизируют патогены, играя важную роль в реакциях врожденного иммунитета.
Слайд 66В2-лимфоциты
В2-клетки , локализующиеся преимущественно в селезенке, костном мозгу, лимфоузлах, пейеровых
бляшках и отдельных фолликулах лимфоидной ткани кишечника.
Гистологическая единица, являющаяся
местом сосредоточения В2-клеток — лимфоидный фолликул. Эти клетки составляют подавляющее большинство циркулирующих В-лимфоцитов и играют основную роль в гуморальном иммунном ответеСлайд 67B-клетки маргинальной зоны (MZB)
Они локализуются почти исключительно в маргинальной зоне
селезенки, отделяющей белую пульпу от красной.
Фенотипически эти клетки более
сходны с В2-, чем с В1-клетками. Они происходят от тех же костномозговых клеток-предшественников. Основной мембранный иммуноглобулин MZB-клеток — IgM, экспрессируемый сильнее, чем на В2-клетках.В то же время IgD присутствует на мембране в очень малом количестве. Эти клетки сходны по своему фенотипу с активированными В-лимфоцитами.
На них присутcтвуют молекулы CD69, CD25, CD38, в малом количестве CD23. Обращает на себя внимание наличие молекулы CD1d, участвующей в презентации липидных антигенов.
Слайд 68Отделение линии MZB-клеток от общей линии В2-клеток происходит на переходной
стадии транзиторных клеток (Т3), когда будущие MZB-клетки ослабляют экспрессию не
IgM (как В2-клетки), а IgD и утрачивают молекулу CD23.На MZB-лимфоцитах не экспрессируется хемокиновый рецептор CXCR5, позволяющий клеткам мигрировать в фолликулы.
Ключевой фактор дифференцировки MZB-клеток — Notсh-2. Под влиянием сфингозин-1-фосфата и при участии молекул адгезии LFA-1 и VLA-4 они мигрируют в маргинальные зоны селезенки.
MZB-клетки не участвуют в рециркуляции, но осуществляют ≪челночные≫ миграции до лимфоидных фолликулов и обратно, получая информацию об антигенах, поступающих в селезенку с кровью. Срок жизни MZB-лимфоцитов сопоставим со сроком жизни организма. Снижение численности MZB-клеток, вызываемое повреждающими факторами, достаточно быстро устраняется.
Слайд 69MZB-клетки участвуют в гуморальном иммунном ответе на возбудители, поступающие в
кровоток.
Они осуществляют тимуснезависимый иммунный ответ на инкапсулированные патогены.
Благодаря
сильной экспрессии молекул MHC-II и костимулирующих молекул MZB-клетки обладают выраженной способностью к взаимодействию с Т-хелперами, однако их участие в тимусзависимом иммунном ответе изучено плохо.При ответе на антигены MZB-клетки дифференцируются в короткоживущие антителообразующие клетки. V-гены MZB-клеток редко затрагиваются мутациями, что характерно для развития плазматических клеток вне зародышевых центров. В этих клетках не происходит переключения классов иммуноглобулинов и даже MZB-клетки памяти несут на своей поверхности IgM, а не IgG. IgM+ клетки памяти преобладают в маргинальной зоне селезенки человека.