Слайд 1 Химическая связь и межмолекулярное взаимодействие
Анализ химической связи в многоатомных
молекулах
Локализация и гибридизация орбиталей
Локализованные молекулярные орбитали (ЛМО) – МО, построенные
из канонических МО ϕj с помощью ортогонального преобразования φi =∑Аijϕj, при условии, что для каждой пары электронов i и j:
∫∫ φi2 (1/4πε0rij) φj2 = min
Молекула метана СН4 (минимальный базис канонических МО) :
↑↓ ϕ1= a(C2s) + b(1sH1+1s H2+1s H3+1s H4)
↑↓ ϕ2= a(C2px)+ b (1sH1+1sH2-1sH3-1sH4)
↑↓ ϕ3= a(C2py)+ b (1sH1-1sH2+1sH3-1sH4)
↑↓ ϕ4= a(C2pz)+ b (1sH1-1sH2-1sH3+1sH4)
Локализованные на связях С-Н двухцентровые МО :
φ1=(а/2)[ C2s+ C2px+ C2py+ C2pz]+ b1sH1
φ2=(а/2)[ C2s+ C2px - C2py - C2pz]+ b1sH1
φ3=(а/2)[ C2s - C2px + C2py- C2pz]+ b1sH1
φ4=(а/2)[ C2s - C2px - C2py+ C2pz]+ b1sH1.
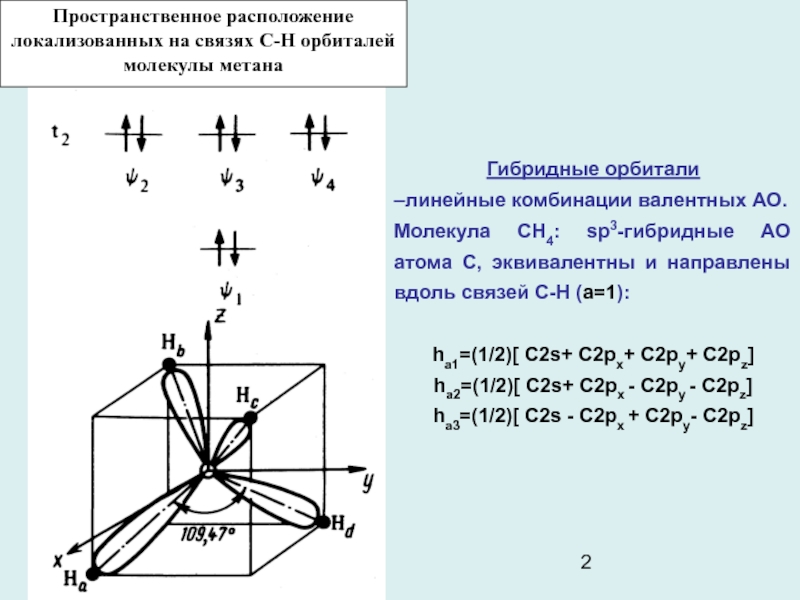
Слайд 2
Пространственное расположение локализованных на связях С-Н орбиталей молекулы метана
Гибридные орбитали
–линейные комбинации валентных АО.
Молекула СН4: sp3-гибридные АО атома С,
эквивалентны и направлены вдоль связей С-Н (а=1):
hа1=(1/2)[ C2s+ C2px+ C2py+ C2pz]
hа2=(1/2)[ C2s+ C2px - C2py - C2pz]
hа3=(1/2)[ C2s - C2px + C2py- C2pz]
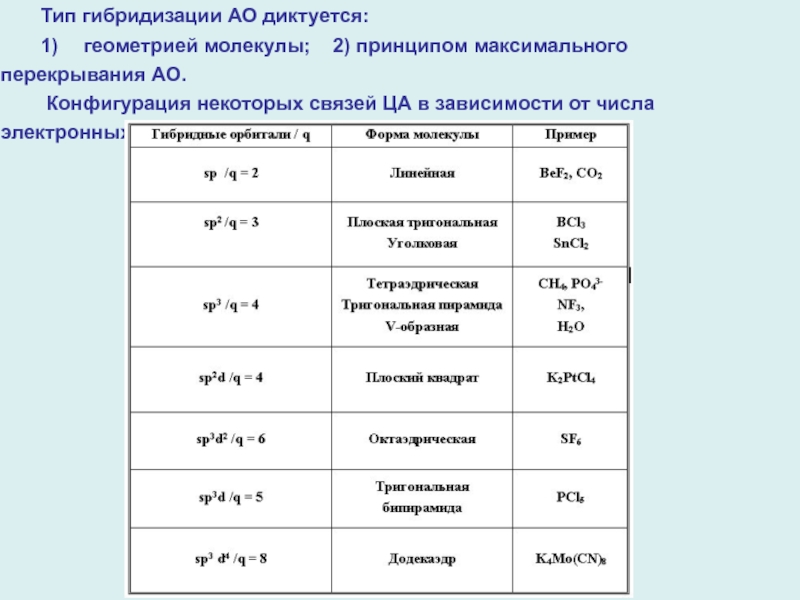
Слайд 3 Тип гибридизации АО диктуется:
1) геометрией молекулы; 2) принципом
максимального перекрывания АО.
Конфигурация некоторых связей ЦА в зависимости от числа
электронных пар q на его валентных орбиталях
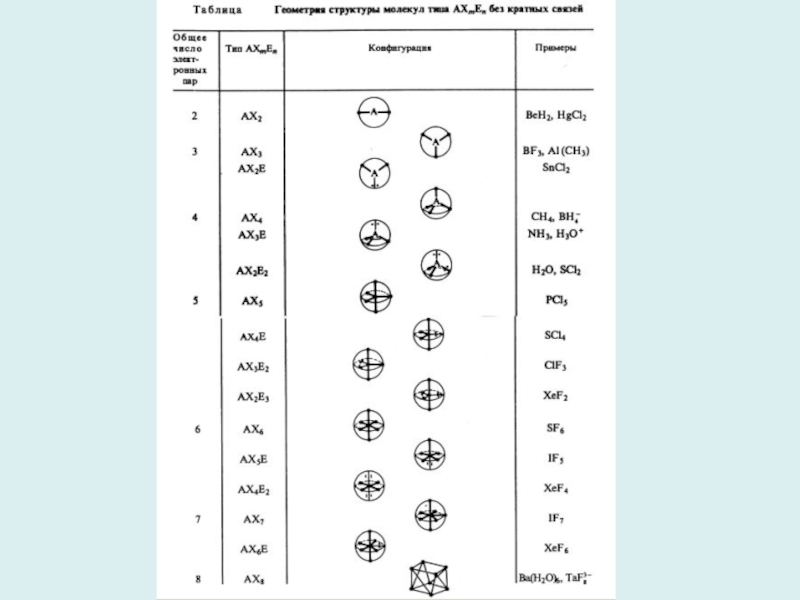
Слайд 5Модель отталкивания электронных пар Гиллеспи
приложима только к соединениям непереходных
элементов.
Основные идеи:
1.Конфигурация связей многовалентных атомов определяется числом электронных пар
на связывающих и несвязывающих МО их валентных оболочек;
2.Ориентация облаков плотности электронных пар, описываемых валентными орбиталями, определяется их максимальным взаимным отталкиванием.
Правила для модели Гиллеспи:
а) Неподеленная электронная пара занимает больший объем, чем связывающая пара ординарной связи.
б) Сила отталкивания электронных пар в данной валентной оболочке понижается в следующем порядке: Е-Е, Е-Х, Х-Х (Е - неподеленная электронная пара, Х - связывающая электронная пара).
в) В координационных соединениях объем связывающей электронной пары уменьшается с увеличением электроотрицательности лиганда.
г) Электронные пары двойной или тройной связей занимают больший объем, чем электронная пара ординарной связи.
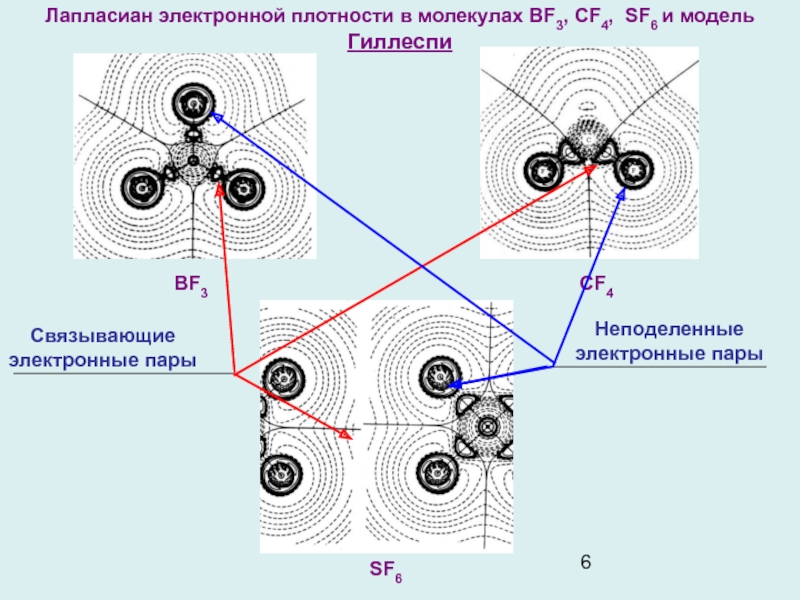
Слайд 6Лапласиан электронной плотности в молекулах BF3, CF4, SF6 и модель
Гиллеспи
SF6
CF4
BF3
Связывающие
электронные пары
Неподеленные
электронные пары
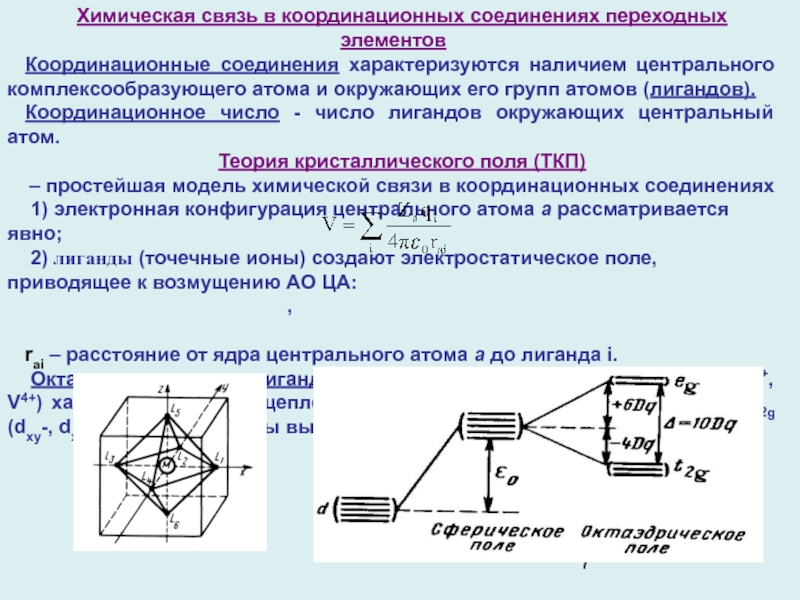
Слайд 7Химическая связь в координационных соединениях переходных элементов
Координационные соединения характеризуются наличием
центрального комплексообразующего атома и окружающих его групп атомов (лигандов).
Координационное число
- число лигандов окружающих центральный атом.
Теория кристаллического поля (ТКП)
– простейшая модель химической связи в координационных соединениях
1) электронная конфигурация центрального атома a рассматривается явно;
2) лиганды (точечные ионы) создают электростатическое поле, приводящее к возмущению АО ЦА:
,
rai – расстояние от ядра центрального атома а до лиганда i.
Октаэдрическое поле лигандов, ЦА с один электроном в d-оболочке (Ti3+, V4+) характеризуется расщеплением d-уровня на трижды вырожденный t2g (dxy-, dxz-, dyz АО ) и дважды вырожденный еg уровень (dx2-y2 и dz2).:
ε0 - энергия 5-ти кратно вырожденного d-уровня в отсутствии поля
Слайд 8
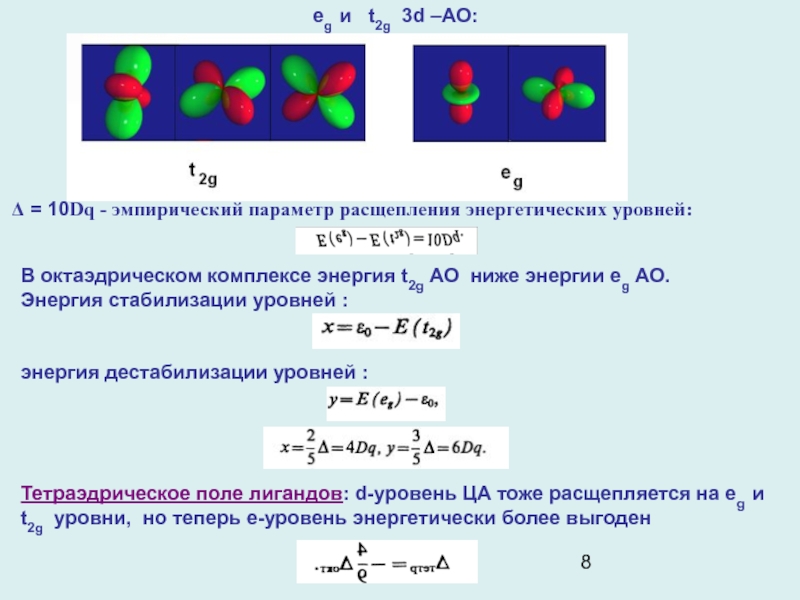
eg и t2g 3d –АО:
Δ = 10Dq - эмпирический
параметр расщепления энергетических уровней:
В октаэдрическом комплексе энергия t2g АО
ниже энергии еg АО.
Энергия стабилизации уровней :
энергия дестабилизации уровней :
Тетраэдрическое поле лигандов: d-уровень ЦА тоже расщепляется на eg и t2g уровни, но теперь e-уровень энергетически более выгоден
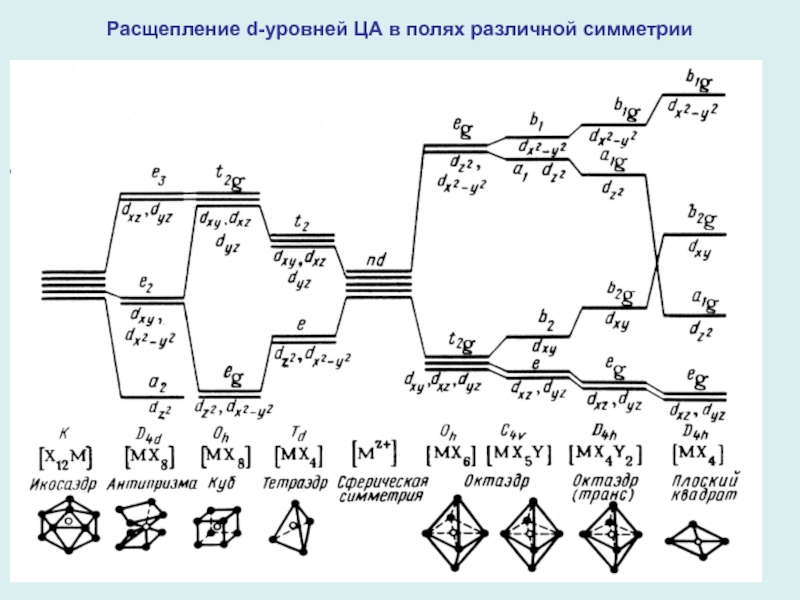
Слайд 9Расщепление d-уровней ЦА в полях различной симметрии
Слайд 10Спектрохимический ряд. Величина 10Dq для различных ЦА постоянна и возрастает
в следующем ряду лигандов:
Ру - пиридин; En - этилендиамин.
Комплексы сильного
и слабого полей лигандов
Оптимальная электронная конфигурация комплекса зависит от величины электростатического поля лигандов и определяется двумя тенденциями:
1) стремлением электронов образовать полностью заполненную оболочку;
2) тенденцией к образованию электронной конфигурации с максимальной мультиплетностью
Численно величина поля лигандов характеризуется значением параметра 10Dq.
Сильное поле лигандов - высокое значение 10Dq → образование низкоспиновых комплексов (энергией электрон-электронного отталкивания можно пренебречь).
Слабое поле лигандов - низкое значение 10Dq → образование высокоспиновых комплексов (энергия электрон-электронного отталкивания велика).
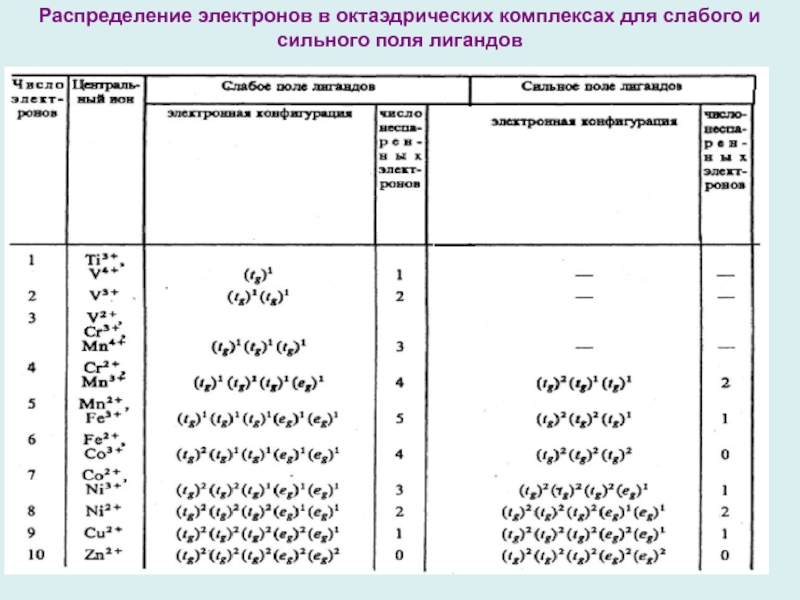
Слайд 11Октаэдрическое поле лигандов:
- Для электронных конфигураций d1 , d2
, d3, d8, d9, d10 есть только один способ размещения
электронов на t2g и eg-уровнях,
- Для d4-, d5-, d6-, d7-электронных конфигураций – два способа, соответствующих сильному и слабому полям лигандов.
Тетраэдрическое поле лигандов слабее октаэдрического и низкоспиновые комплексы не образуются.
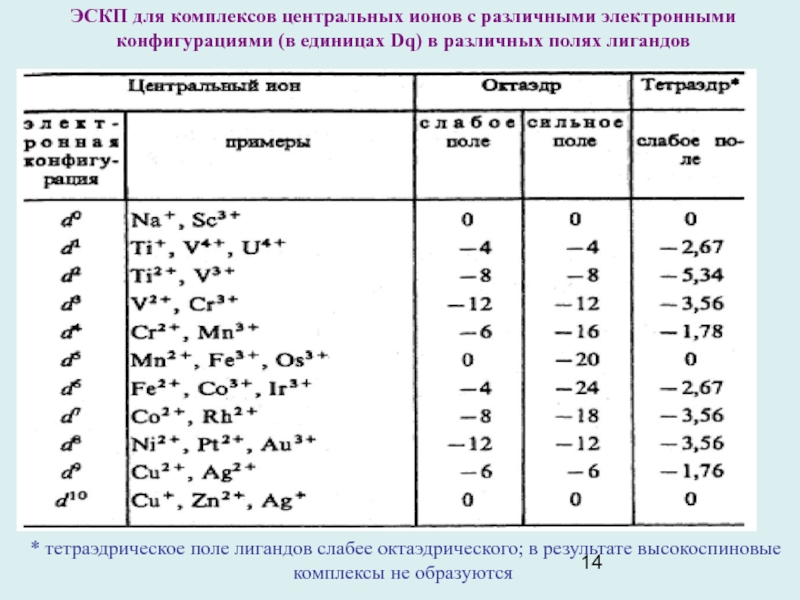
Энергия стабилизации кристаллическим полем (ЭСКП) служит для объяснения предпочтительности разных типов координации в зависимости от электронной конфигурации ЦА. ЭСКП оценивается по отношению к нерасщепленному электронному 3d уровню в поле лигандов сферической симметрии.
ТКП неприменима к π-комплексам, к донорно-акцепторным связям, к анализу деталей связывания в комплексах.
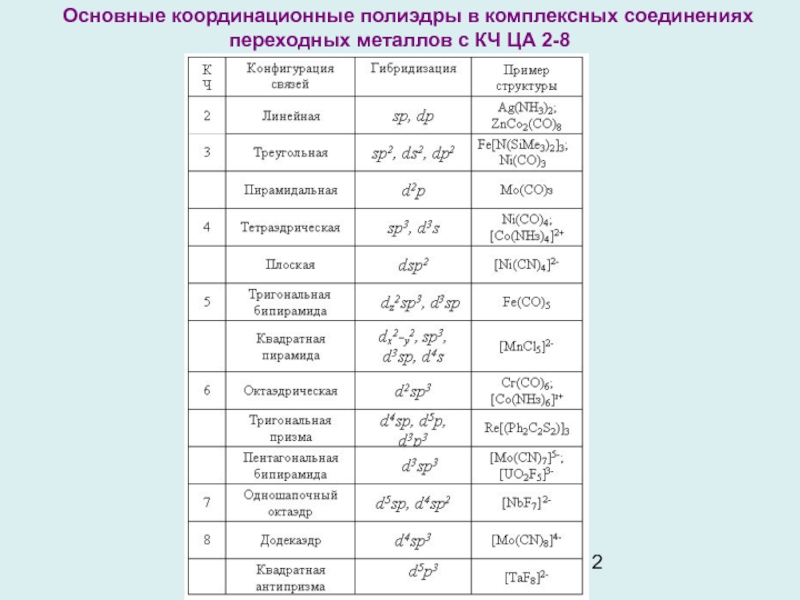
Слайд 12Основные координационные полиэдры в комплексных соединениях переходных металлов с КЧ
ЦА 2-8
Слайд 13Распределение электронов в октаэдрических комплексах для слабого и сильного поля
лигандов
Слайд 14ЭСКП для комплексов центральных ионов с различными электронными конфигурациями (в
единицах Dq) в различных полях лигандов
* тетраэдрическое поле лигандов
слабее октаэдрического; в результате высокоспиновые комплексы не образуются
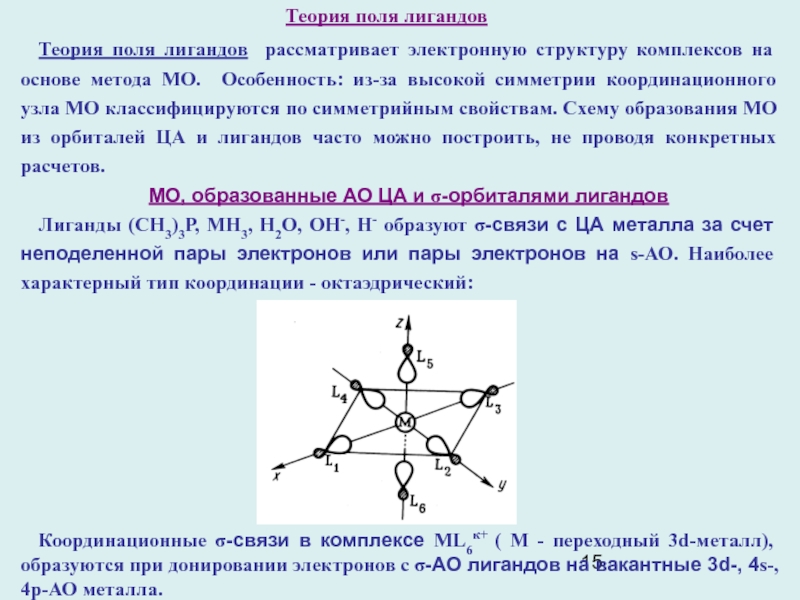
Слайд 15Теория поля лигандов
Теория поля лигандов рассматривает электронную структуру комплексов на
основе метода МО. Особенность: из-за высокой симметрии координационного узла МО
классифицируются по симметрийным свойствам. Схему образования МО из орбиталей ЦА и лигандов часто можно построить, не проводя конкретных расчетов.
МО, образованные АО ЦА и σ-орбиталями лигандов
Лиганды (СН3)3Р, МН3, Н2О, ОН-, Н- образуют σ-связи с ЦА металла за счет неподеленной пары электронов или пары электронов на s-АО. Наиболее характерный тип координации - октаэдрический:
Координационные σ-связи в комплексе ML6к+ ( М - переходный 3d-металл), образуются при донировании электронов с σ-АО лигандов на вакантные 3d-, 4s-, 4p-АО металла.
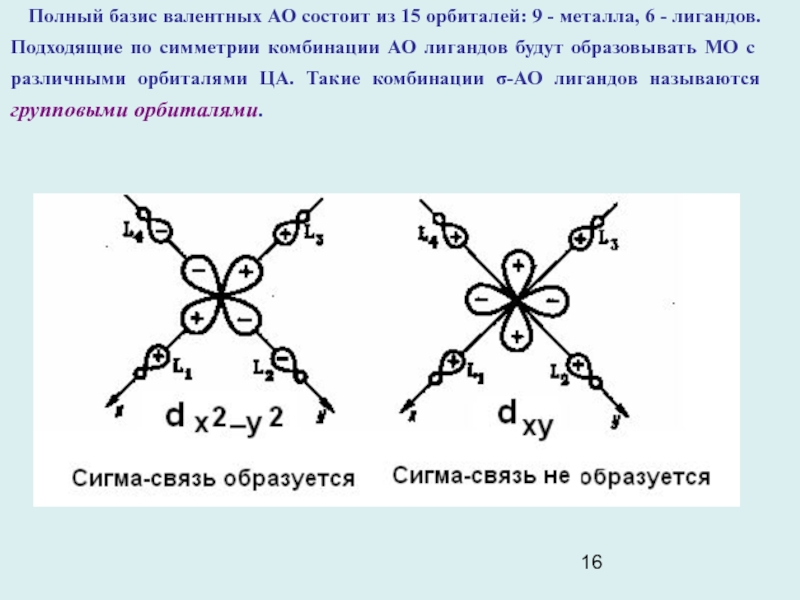
Слайд 16Полный базис валентных АО состоит из 15 орбиталей: 9 -
металла, 6 - лигандов. Подходящие по симметрии комбинации АО лигандов
будут образовывать МО с различными орбиталями ЦА. Такие комбинации σ-АО лигандов называются групповыми орбиталями.
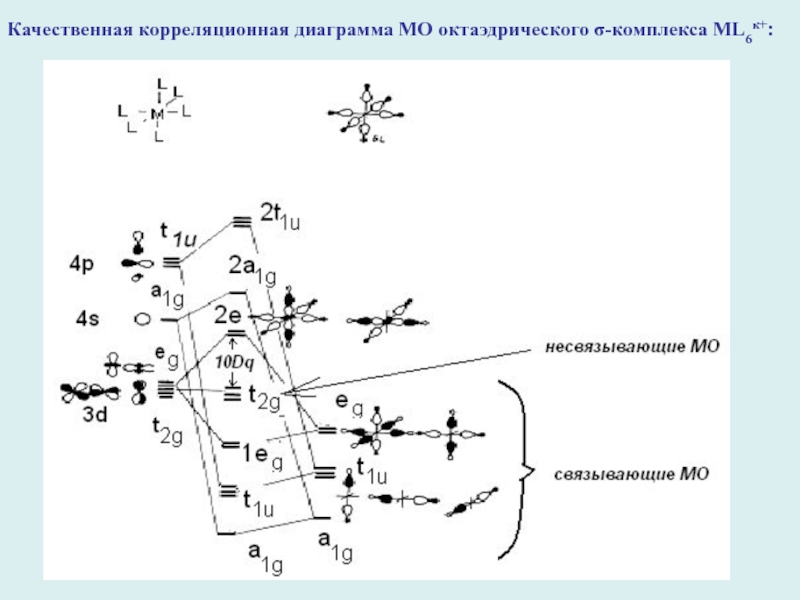
Слайд 17Качественная корреляционная диаграмма МО октаэдрического σ-комплекса ML6к+:
Слайд 18Вывод: в октаэдрическом имеется шесть связывающих валентных МО (a1g, tu1,
1eg) и три несвязывающих (t2g) МО, на которых можно разместить
18 электронов.
Правило 18 электронов: в устойчивых комплексах переходных металлов МLn общее число электронов на связях M-L и несвязывающих электронов центрального атома равно 18.
Отклонения : плоские тетракоординированные и трикоординированные комплексы переходных металлов устойчивы при 16-электронной координации и т.д.
Эффект Яна-Теллера
Приближение Борна-Оппенгеймера позволяет разделить движение электронов и ядер. Однако когда ППЭ, отвечающие различным электронным состояниям, настолько близки (или даже касаются друг друга), электронные состояния в результате ядерного движения смешиваются (вырождение состояний). Возникают вибронные (объединенные электронно-ядерные) состояния и электронное движение уже более неотделимо от ядерного.
Слайд 19Системы, где волновая функция вырождена (например, октаэдрические и плоские комплексы
d-элементов), структурно неустойчивы: всегда существуют деформации ядерной конфигурации, понижающие ее
симметрию и снимающие вырождение (эффект Яна-Теллера).
Структурные деформации координационных полиэдров из-за эффекта Яна-Теллера могут быть статическими или динамическими. В первом случае структура стабилизируется за счет понижения симметрии. Во втором искажение мало, структуры занимают неглубокие минимумы на ППЭ системы и совершают быстрые переходы между несколькими эквивалентными ядерными конфигурациями (вырожденное динамическое равновесие).
Пример статического эффекта Яна-Теллера - октаэдрические комплексы иона Сu2+. Два равноценных способа разместить 9 эл-нов на t2g- и еg-АО :
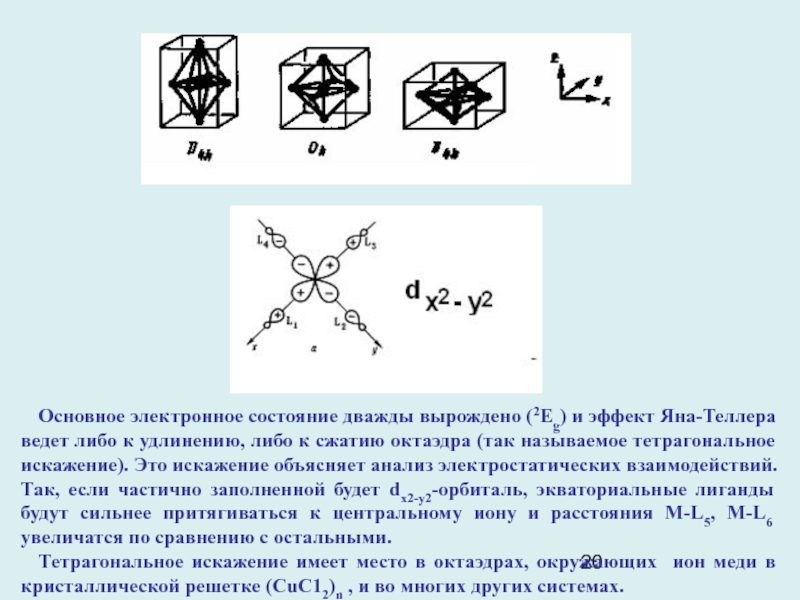
Слайд 20Основное электронное состояние дважды вырождено (2Eg) и эффект Яна-Теллера ведет
либо к удлинению, либо к сжатию октаэдра (так называемое тетрагональное
искажение). Это искажение объясняет анализ электростатических взаимодействий. Так, если частично заполненной будет dx2-y2-орбиталь, экваториальные лиганды будут сильнее притягиваться к центральному иону и расстояния М-L5, М-L6 увеличатся по сравнению с остальными.
Тетрагональное искажение имеет место в октаэдрах, окружающих ион меди в кристаллической решетке (СuС12)n , и во многих других системах.
Слайд 21Валентные орбитали ЦА и групповые орбитали лигандов
октаэдрическом комплексе ML6 (связывающие
комбинации)
Слайд 22В.Г. Цирельсон «Химическая связь и
межмолекулярные взаимодействия».
В.Г. Цирельсон, М.Ф. Бобров
«Квантовая химия молекул», & 12.3 – 12.6
В.Г. Цирельсон, М.Ф. Бобров
«Квантовая химия атома».