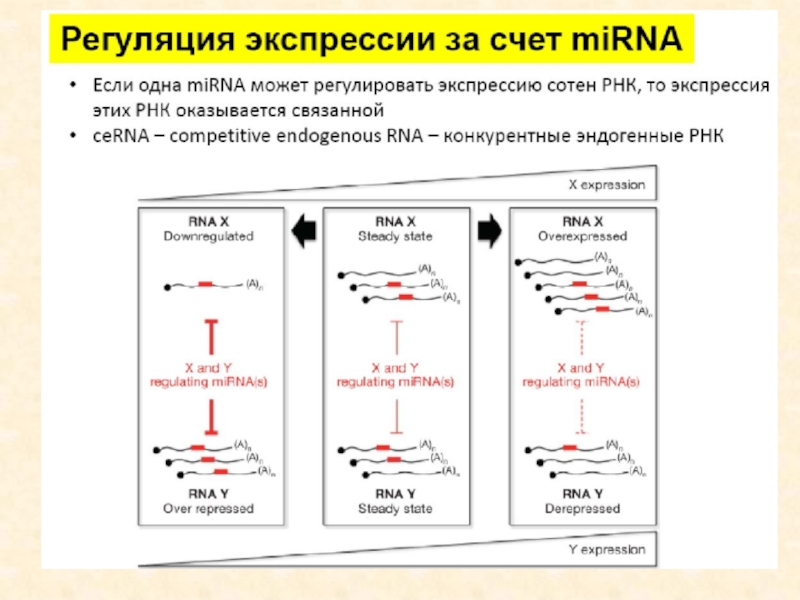
Слайд 1МАЛЫЕ ИНТЕРФЕРРИРУЮЩИЕ РНК
лекция
Слайд 2микроРНК – недавно открытый класс малых некодирующих РНК, которые регулируют
экспрессию белков через узнавание специфических мРНК. Открытие таких молекул является
одним из главных научных достижений последних лет. Со времени первого описания более 28 тыс. микроРНК (для более 200 видов) зарегистрировано в базе данных miRBase (http://www.mirbase.org/).
Малые интерферирующие РНК вовлечены в такие ключевые биологические процессы, как
- развитие,
- дифференциация,
- апоптоз и
- пролиферация.
Они играют важную роль в
- контроле генной экспрессии,
- эпигенетической модификации и
- регуляции активности гетерохроматина эукариот.
Хотя микроРНК и связанные с ними белки оказались одним из наиболее обильных рибонуклеопротеидных комплексов клетки, экспрессия некоторых из них ограничена немногочисленными клеточными типами или специфическими условиями окружающей среды. Поэтому для идентификации таких микроРНК были разработаны специальные вычислительные подходы in silico.
Слайд 3Чтобы дополнить экспериментальные методы идентификации генов микроРНК, были разработаны вычислительные
подходы in silico. Они основываются на разных принципах:
- поиске
гомологии с известными генами микроРНК,
- исследовании окружения известных генов микроРНК, и
- идентификации консервативных генных сегментов, которые выпадают из предсказанных белок-кодирующих регионов и потенциально могут формировать структуры типа стебель-петля.
Потенциальные мРНК мишени могут быть идентифицированы с помощью методов биоинформатики (таких как MiRanda и PicTar) и экспериментальной биологии, включающих иммунопреципитацию мРНК в комплексах сайленсинга, а также секвенирование.
Слайд 4Со времени первого описания более 10 тыс. микроРНК (для более
100 видов) зарегистрировано в базе данных miRBase (ftp://mirbase.org/pub/mirbase/).
Показано, что
микроРНК регулируют по крайней мере 10% генов C. elegans. В геноме человека обнаружено >2000 генов микроРНК, контролирующих работу более 60% белок-кодирующих генов (большинство из которых являются факторами развития и транскрпции).
Аномальная экспрессия генов микроРНК может быть причиной болезней человека, сильных фенотипических изменений и летального исхода.
Открыты стресс-индуцированные микроРНК, появляющиеся в ответ на специфические условия.
Слайд 5Сведения по микроРНК паразитических червей получены для 17 видов нематод,
11 видов трематод и 8 видов цестод. В частности, данные
по геномике, транскриптомике и биоинформатике шистосом - Shistosoma mansoni, S. japonicum и кровяной шистосомы S. haematobium - предполагают наличие системы сайленсинга через микроРНК по крайней мере у двух первых видов. При этом характер экспрессии генов, участвующих в интерференции РНК, существенно отличается на разных стадиях развития паразитов.
У нематоды сосновой древесины Bursaphelenchus xylophilus микроРНК вероятно может принимать участие в экологической адаптации и регуляции поведения нематоды.
Самая ранняя экспрессия микроРНК - сразу после оплодотворения, до слияния пронуклеусов, и до первого дробления зиготы, т.е. на стадии развития, долгое время считавшейся стадией транскрипционного покоя, обнаружена у свиной аскариды Ascaris suum.
Слайд 6История изучения интерференции РНК началась в 1998 г., когда Крейг
Меллоу и Эндрю Файер опубликовали статью в журнале Nature с
данными о том, что молекулы двуцепочечных РНК способны подавлять экспрессию генов у почвенной нематоды Caenorhabditis elegans. За это открытие в 2006 г. им была присуждена Нобелевская премия в области физиологии и медицины. Первое описание аналогичного явления у растений дано группой Д. Болкомба в статье журнала Science (Hamilton, Baulcombe, 1999).
Механизм подавления экспрессии генов (сайленсинг) с помощью таких РНК у животных был назван РНК-интерференцией, у грибов это явление получило название "подавление" транскрипции, а у растений – "посттрансляционный сайленсинг генов". По определению Л.И. Корочкина (2006), РНК-интерференция – это механизм формирования и наследственной передачи специфического функционального состояния генома.
РНК-интерференция обеспечивает возможность появления множественных фенотипов, поскольку связана с изменением экспрессии ядерной ДНК. Полагают, что первоначально этот механизм мог сформироваться как защита клеток хозяина против внедрения чужеродных генетических последовательностей вирусной природы и транспозонов. К настоящему времени данный способ регуляции экспрессии генов обнаружен во всех крупных таксонах, включая вирусы, грибы, растения, позвоночных и беспозвоночных, и даже однин одноклеточный организм – зеленую водоросль Chlamydomonas reinhardtii.

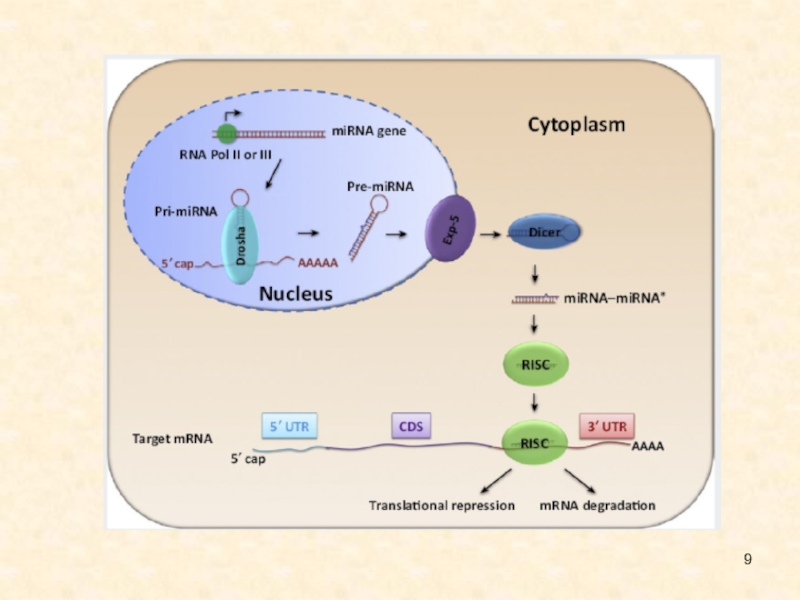
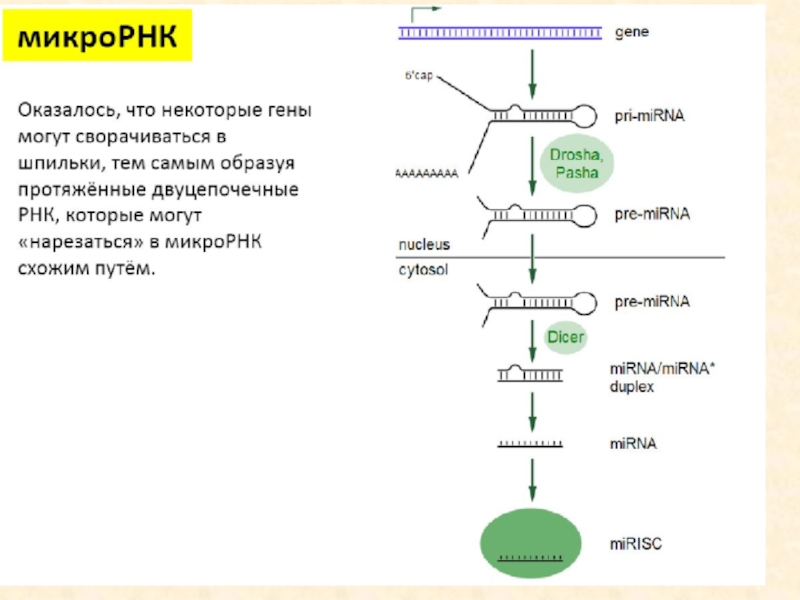
Слайд 7Биогенез
Хотя зрелые микроРНК состоят всего из 22 нуклеотидов, их биогенез
является достаточно сложным. Первичные транскрипты представляют собой относительно крупные молекулы,
содержащие характерные структуры типа стебель-петля, которые процессируются в ядре ферментом Drosha и белком Pasha, специфически связывающимся с двуцепочечной РНК. Продукт Drosha представляет собой примерно 65 нуклеотидную спираль, называемую пре-микроРНК Пре-микроРНК экспортируются в цитоплазму с помощью особого белкового комплекса Exportin, где разрезаются ферментом Dicer. В результате образуются зрелые микроРНК, которые являются РНК-дуплексами длиной около 22 нуклеотидов. Показано, что они могут служить праймерами для синтеза новых, вторичных молекул, что приводит к амплификации сигнала. Одна нить дуплекса микроРНК, называемая направляющей miR нитью, селективно наносится на белок аргонавт (AGO). В итоге формируется РНК индуцированный комплекс сайленсинга (RISC), который может связаться и репрессировать мРНК мишени, содержащие сайты, комплементарные микроРНК. Другая нить, получившая название спутника/пассажира, деградирует во время активизации RISC. У животных микроРНК обычно имеют неполное спаривание с мРНК-мишенью, поэтому они могут ингибировать транскрипцию многих генов, в мРНК которых имеются гомологичные последовательности.

Слайд 8Филогения.
Широкое распространение компонентов РНК-интерференции среди эукариотических организмов различной степени филогенетического
родства предполагает наличие функциональной системы РНК-интерференции у общего предка всех
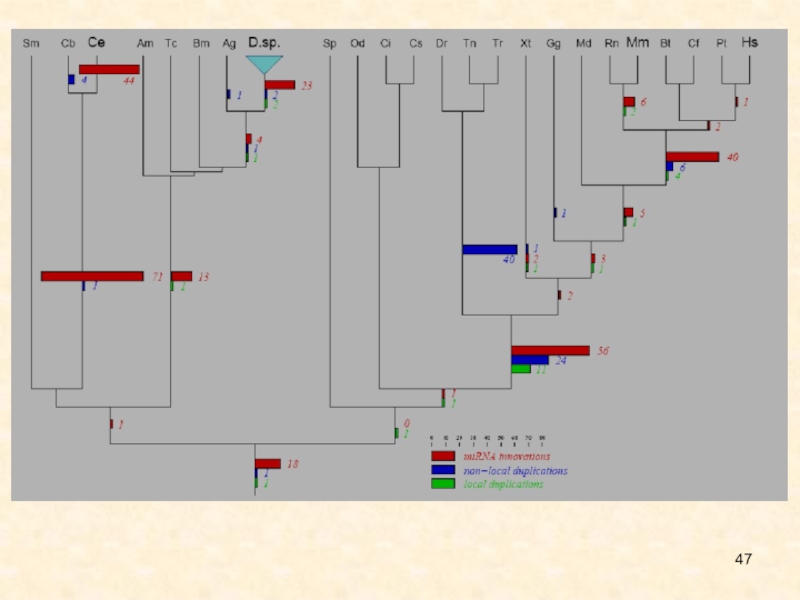
эукариот, т.е. эта система, вероятно, сформировалась сотни миллионов лет назад. Широкомасштабное сравнительное исследование, включающее филогенетический анализ всех известных семейств микроРНК животных, позволило надежно идентифицировать кластеры микроРНК, которые произошли от общего транскрипта. Идентифицировали три эпизода инноваций микроРНК, которые соответствуют основным инновациям развития животных организмов. Первую волну инноваций представляет класс примерно из 20 микроРНК, который является общим для протостом и деутеростом и может быть связан с появлением билатеральности. Вторая волна инноваций связана с позвоночными, а третья – с плацентарными млекопитающими. Кроме того, обнаружена ожидаемая экспансия микроРНК, обусловленная геномными дупликациями у ранних позвоночных и анцестральных телеостов. Нелокальные дупликации у предка позвоночных предшествовали локальным (тандемным), ведущим к образованию множества предковых кластеров микроРНК. Инновации микроРНК, тандемные и нелокальные дупликации генов микроРНК распределены в филогении Metazoa неравномерно.

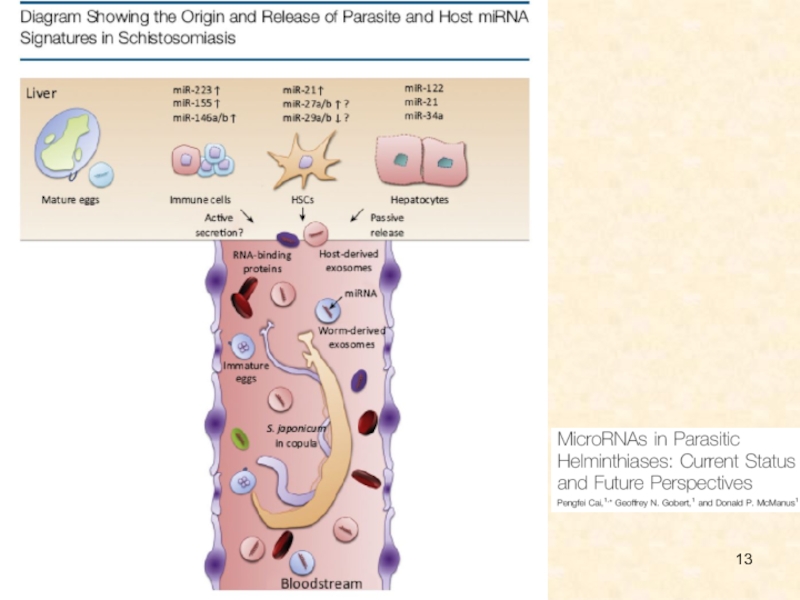
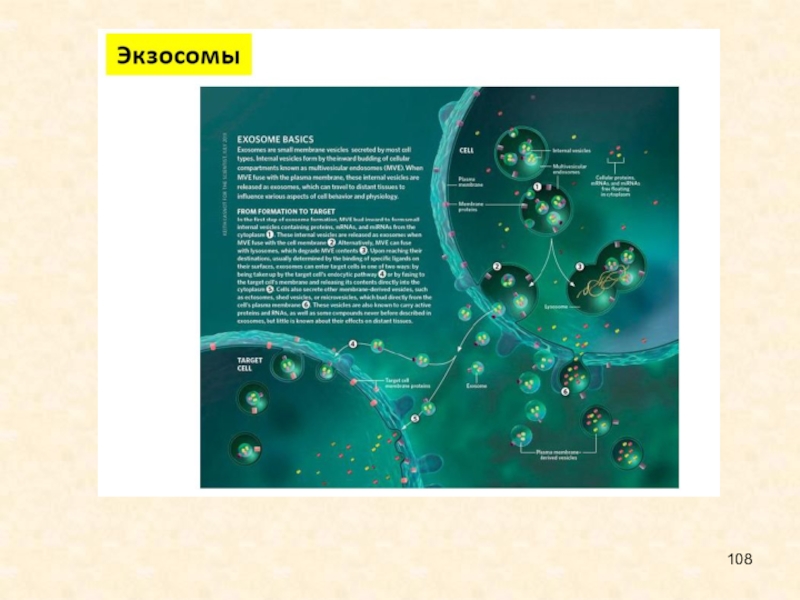
Слайд 10В системе паразит-хозяин и хозяин-патоген, РНК-интерференция имеет особый интерес для
исследования коэволюционных взаимодействий. Паразиты активно выпускают экзосомы и другие внеклеточные
структуры, содержащие специфические белки, РНК, а иногда – геномную ДНК. Слияние внеклеточных структур паразита и хозяина действует, как канал паразитохозяинного взаимодействия. Внеклеточные везикулы принимают участие в распространении патогена и регуляции иммунного ответа хозяина; у O. viverrini, например, они индуцируют провоспалительные и онкогенные фенотипы холангиоцитов человека.
Слайд 11
Сложный жизненный цикл паразитических видов требует наличия надежных механизмов, обеспечивающих
нормальное развитие при постоянном изменении окружающей среды. Функцию посредника между
поступающими сигналами и адекватным ответом организма могут выполнять молекулы малых интерферирующих РНК. микроРНК обладают большим потенциалом в качестве терапевтических и диагностических мишеней для контроля паразитарных заболеваний человека и животных. Например, показано, что изменения профиля микроРНК строго связаны с субтипами внутрипеченочной холангиокарциномы
Слайд 12Большое внимание привлекают недавно обнаруженные микроРНК, циркулирующие вне клеток, которые
при болезнях печени могут пассивно высвобождаться в процессе некроза клетки,
или активно секретироваться в везикулярные структуры (например, экзосомы). Эти микроРНК стабильны в биологических жидкостях, таких как моча, сыворотка и плазма крови. Получены свидетельства того, что уровни miR-192 и miR-21 в сыворотке больных могут быть биомаркерами холангиокарциномы, индуцированной O. viverrini.
Слайд 14микроРНК обладают большим потенциалом в качестве терапевтических и диагностических мишеней
для контроля паразитарных заболеваний человека и животных. Например, показано, что
изменения профиля микроРНК строго связаны с субтипами внутрипеченочной холангиокарциномы. Большое внимание привлекают недавно обнаруженные микроРНК, циркулирующие вне клеток, которые при болезнях печени могут пассивно высвобождаться в процессе некроза клетки, или активно секретироваться в везикулярные структуры (например, экзосомы). Эти микроРНК стабильны в биологических жидкостях, таких как моча, сыворотка и плазма крови. Показано, что уровни miR-192 и miR-21 в сыворотке больных могут быть биомаркерами холангиокарциномы, индуцированной O. viverrini.
Слайд 15Лечение
Известно несколько микроРНК, которые имеют либо повышенную (miR-18, miR-224), либо
пониженную (miR-199, miR-195, miR-200 и miR-125) экспрессию при раке
печени человека. Одним из наиболее изученных и интересных в плане диагностики и лечения видом микроРНК являются miR-122. miR-122 является консервативной специфической микроРНК, составляющей около 70% от клонированных микроРНК печени взрослых мышей.
Антисенс-опосредованное ингибирование miR-122 у мышей приводит к индукции генов, которые, как правило, репрессированы в печени взрослых особей, предполагая, что эта микроРНК имеет важное значение для поддержания терминально дифференцированной программы экспрессии генов гепатоцитов. Удаление генов miR-122 у мышей приводит к гепатостеатозу, гепатиту и развитию опухолей, напоминающих холангиокарциному, а поставки miR-122 в холангиокарциному мышей, напротив, существенно ингибируют образование опухолей, предполагая для miR-122 важные функции в поддержании гомеостаза печени.
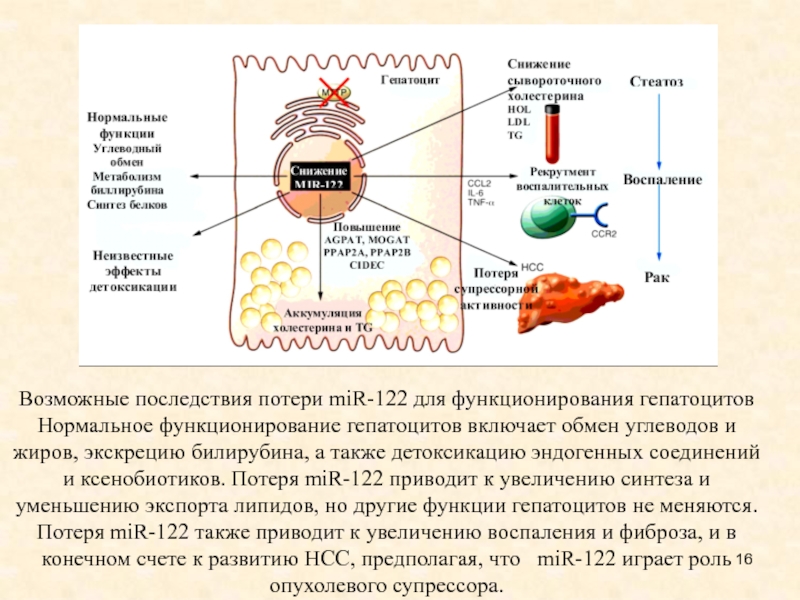
Слайд 16Возможные последствия потери miR-122 для функционирования гепатоцитов Нормальное функционирование гепатоцитов
включает обмен углеводов и жиров, экскрецию билирубина, а также детоксикацию
эндогенных соединений и ксенобиотиков. Потеря miR-122 приводит к увеличению синтеза и уменьшению экспорта липидов, но другие функции гепатоцитов не меняются. Потеря miR-122 также приводит к увеличению воспаления и фиброза, и в конечном счете к развитию НСС, предполагая, что miR-122 играет роль опухолевого супрессора.
Слайд 17Примечательно, что miR-122 играет неканоническую роль в жизненном цикле вируса
гепатита С; через взаимодействие с двумя участками, расположенными на
5'-конце геномной РНК вируса, miR-122 выполняет функции, необходимые для его репликации. Внутривенное введение специальных антисенс-miR-122 олигонуклеотидов (олигонуклеотидов, комплементарных 5'-концу miR-122) снижает вирусную нагрузку у HCV-инфицированных шимпанзе. Этот терапевтический подход в настоящее время находится на стадии клинических исследований для HCV в организме человека.
Слайд 18микроРНК могут обеспечить новые лекарства, направленные на лечение паразитарных заболеваний.
Для этого необходимо разрешить две основных проблемы.
Одна из них
заключается в том, что эффект РНК-интерференции, запускаемой эндогенными или экзогенными малыми интерферирующими РНК, является кратковременным и дозозависимым. Различными работами показано, что пик деградации РНК мишени приходится на 36-48 часов после интродукции малых интерферирующих РНК. Эффект можно продлить повторной доставкой. Количество доставляемых молекул может быть ключевым, так как использование слишком малых или слишком больших доз минимизирует эффект интерференции. Кроме того, синтетические РНК для использования в терапии определенным образом модифицируются, чтобы придать стабильность, эффективность и специфичность, а также, чтобы уменьшить иммуностимулирующие эффекты.
Другая проблема терапии с помощью интерферирующей РНК заключается в необходимости развития эффективных систем прямой доставки малых интерферирующих РНК в ткани-мишени. Следовательно, клиническое использование такой терапии будет зависеть, по крайней мере, частично от наличия безопасных и эффективных систем доставки, которые представляют первостепенную важность для успеха будущей терапии болезней человека, в том числе тех, которые вызваны паразитарными инвазиями. Эффективная доставка включает широкий диапазон стратегий, от инъекций "naked" молекул малых интерферирующих РНК до недавно разработанных систем доставки этих молекул в наночастицах, комплексированных с поликатионами. Так как все эти технологии новые, их продолжают совершенствовать и развивать.

Слайд 19Недавно, чтобы доказать биологическую важность енолазы, был проведен первый эксперимент
по сайленсингу гена этого белка у С. sinensis посредством РНК-интерференции.
Полагают, что такой подход в будущем найдет применение для идентификации функциональных генов С. sinensis.
Интересно, что нокдаун экспрессии катапсина L и B, опосредованный РНК-интерференцией предохраняет от вновь эксцистированных личинок F. hepatica, а вакцина с катепсином L1 дает частичную защиту против инфекции этой трематоды и последующего развития патологии.
Выяснение генной регуляции, основанной на микроРНК, станет весомым вкладом для анализа биологических основ антигенной изменчивости и иммунного уклонения для паразитов, а также разработки антипаразитарных препаратов нового поколения.
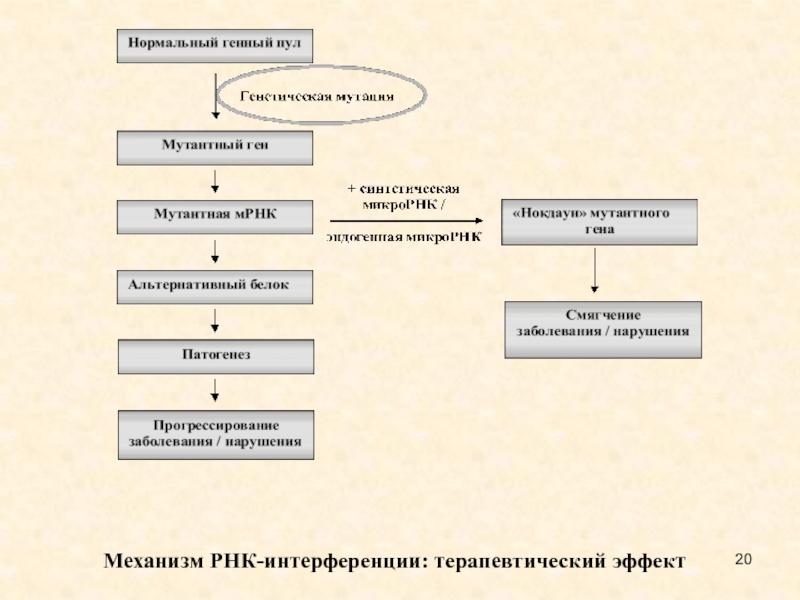
Слайд 20Механизм РНК-интерференции: терапевтический эффект
Слайд 21Феномен малых РНК
Задавшись целью получить сорт петуний, который обладал
бы более яркими бордовыми лепестками, генетики ввели в ее клетки
ген, отвечающий за синтез красного пигмента. К удивлению ученых, многие цветы, вместо того, чтобы усилить окраску, вовсе теряли пигмент и получались белыми.
С этого и других похожих наблюдений, сделанных в начале 90-х годов, и началась история малых РНК.
Слайд 22В другом эксперименте биологи, изучавшие генетическую регуляцию у одного из
самых популярных в последнее время модельных организмов – круглого червя
Caenorhabditis elegans, пытались усилить работу определенных генов путем введения в клетки червя дополнительных копий таких генов (в виде ДНК). И снова, вместо усиления выраженности (экспрессии) данного гена, ученые наблюдали противоположный эффект: его полное "замолкание".
Слайд 23Длительное время никто не мог объяснить происходившие феномены, рассматривая их
как артефакты. И лишь спустя годы удалось установить, что во
всех подобных случаях в клетках подопытных организмов появлялись большие количества так называемых "малых" РНК. К еще большему удивлению привело исследование структуры таких молекул. Оказалось, что эти РНК являются копией отдельных участков тех самых генов (ДНК), которые вводились в клетку, и активность которых подавлялась.
Решение парадокса малых РНК началось с детального изучения их структуры, биологических характеристик и путей их превращения (метаболизма) в клетках различных организмов.
Слайд 24РНК-интерференция
В 1998 году Craig C. Mello и Andrew Fire опубликовали
статью в Nature, в которой говорилось, что двуцепочечные РНК (дцРНК)
способны подавлять экспрессию генов. Позже выяснилось, что действующее начало в этом процессе- короткие одноцепочечные РНК. Механизм подавления экспрессии генов с помощью этих РНК у животных назван
РНК-интерференцией, у грибов – подавлением транскрипции, а у растений – посттранскрипционным сайленсингом. В 2006 году за это открытие получена Нобелевская премия.
Слайд 25РНК-интерференция - это механизм формирования и наследственной передачи специфического функционального
состояния генома. РНК-интерференция обеспечивает возможность появления множественных фенотипов, поскольку связана
с изменением обычной экспрессии ядерной ДНК.
Полагают, что первоначально этот механизм мог сформироваться как защита клеток хозяина против внедрения чужеродных генетических последовательностей вирусной природы и транспозонов.
К настоящему времени данный способ регуляции экспрессии генов обнаружен во всех крупных таксонах эукариот, включая вирусы, грибы, растения, позвоночных и беспозвоночных, и даже одного одноклеточного организма - зеленой водоросли Chlamydomonas reinhardtii.
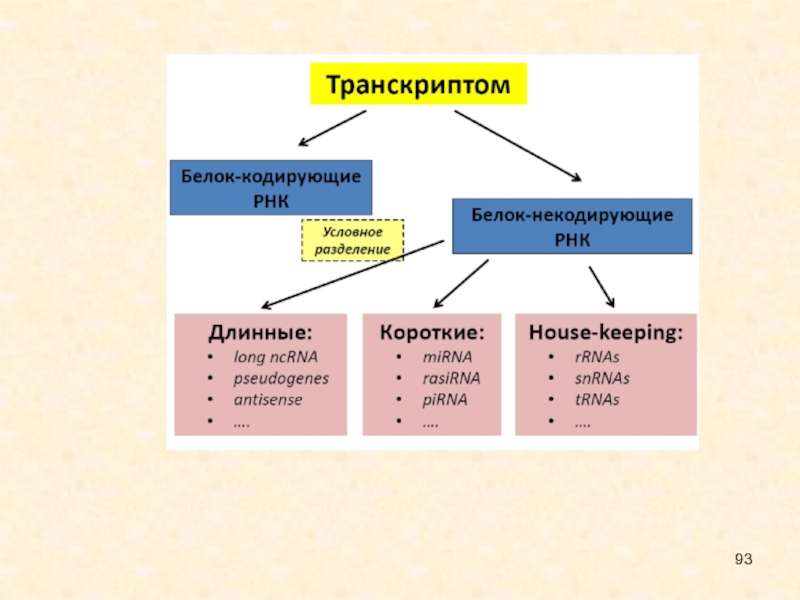
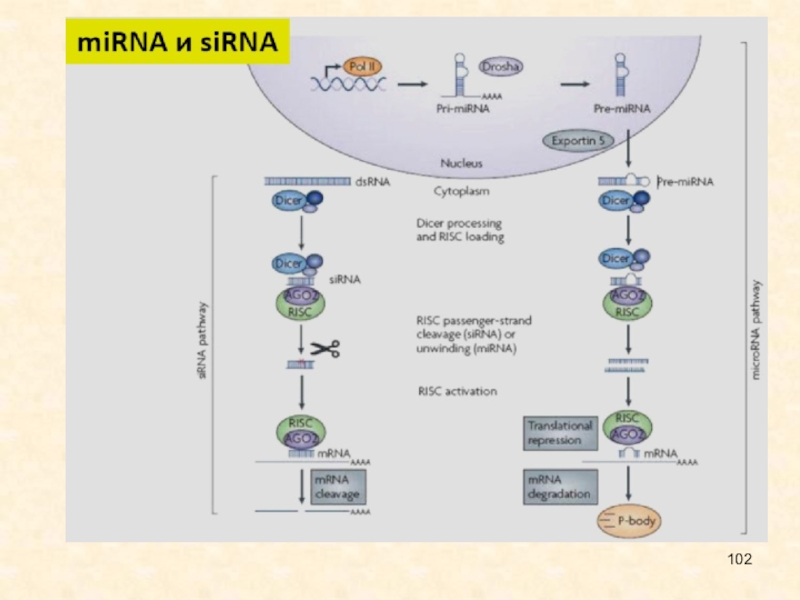
Слайд 26Малые интерферирующие РНК являются некодирующими одноцепочечными короткими молекулами (21-26 нуклеотидов
длиной). Выделяют два типа этих молекул, отличающихся по происхождению и
функциям.
Малые интерферирующие РНК, siRNA, происходят из протяженной двуцепочечной РНК; обычно запускают интерференцию для деградации матричной РНК (мРНК), а также модификации хроматина.
МикроРНК, miRNA, образуются в результате двухступенчатого созревания из первичных транскриптов, содержат инвертированные повторы и шпилечные структуры; вызывают трансляционную репрессию, иногда - деградацию мРНК.
Слайд 27Полагают, что РНК-интерференция являются ключевым механизмом генной регуляции на уровне
посттранскрипционного контроля. Это определяет огромные потенциальные перспективы таких молекул, для
использования в разных областях медицины и биотехнологии.
В частности, рассматриваются различные стратегии применения РНК-интерференции в борьбе против вируса иммунодефицита человека, для лечения онкологических заболеваний и заболеваний генетической этиологии. В геноме человека обнаружено около 1000 генов микроРНК, контролирующих работу не менее трети генов и определяющих профиль клеточной дифференцировки или злокачественной трансформации. Изучение роли малых РНК в абиотическом стрессе позволило предположить, что у растений новые виды малых РНК могут быть эволюционным путем адаптации к экстремальным условиям окружающей среды.
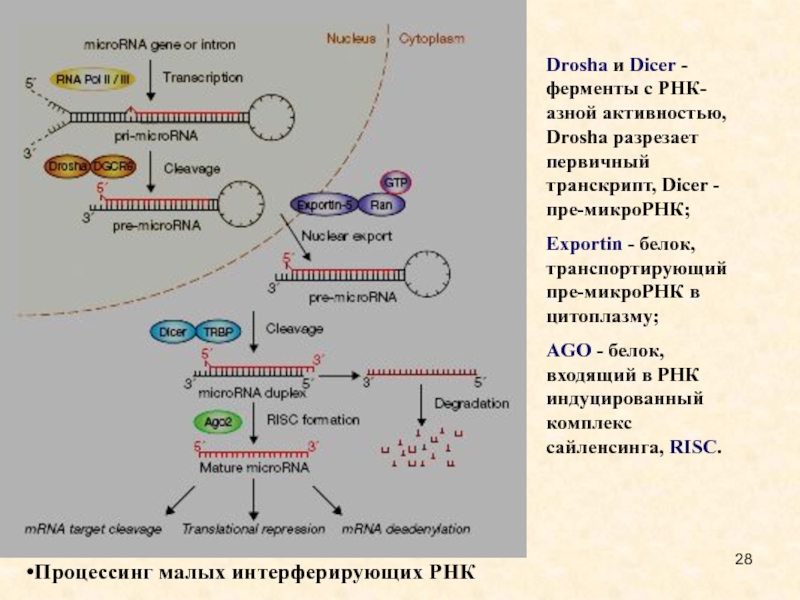
Слайд 28Процессинг малых интерферирующих РНК
Drosha и Dicer - ферменты с РНК-азной
активностью, Drosha разрезает первичный транскрипт, Dicer - пре-микроРНК;
Exportin - белок,
транспортирующий пре-микроРНК в цитоплазму;
AGO - белок, входящий в РНК индуцированный комплекс сайленсинга, RISC.
Слайд 29Значение открытия интерферирующих РНК
1. Защита от вирусов
2. Обеспечивание геномной стабильности
через поддержание сайленсинга мобильных элементов
3. Репрессия белкового синтеза и регуляция
развития организма
4. Конденсация хроматина и супрессия транскрипции
5. Открытие новых экспериментальных подходов для специфичной репрессии генов
6. Будущее использование в генной терапии
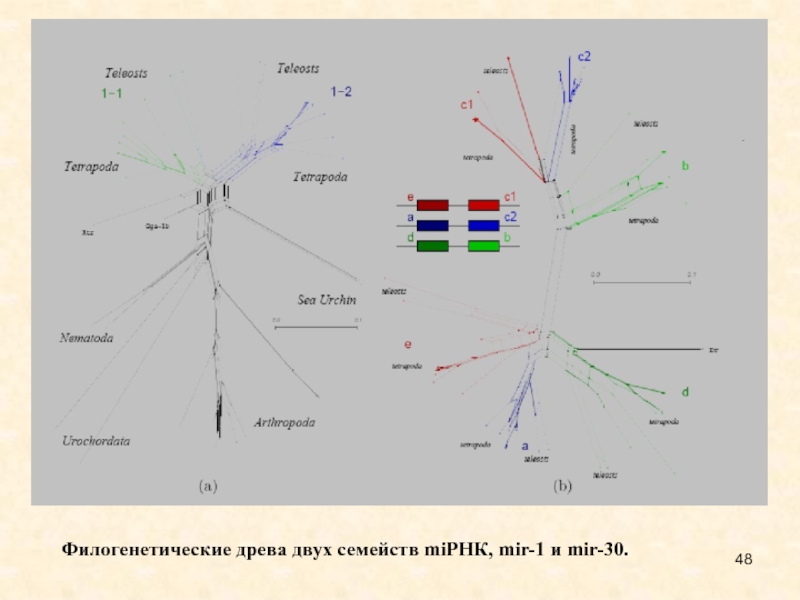
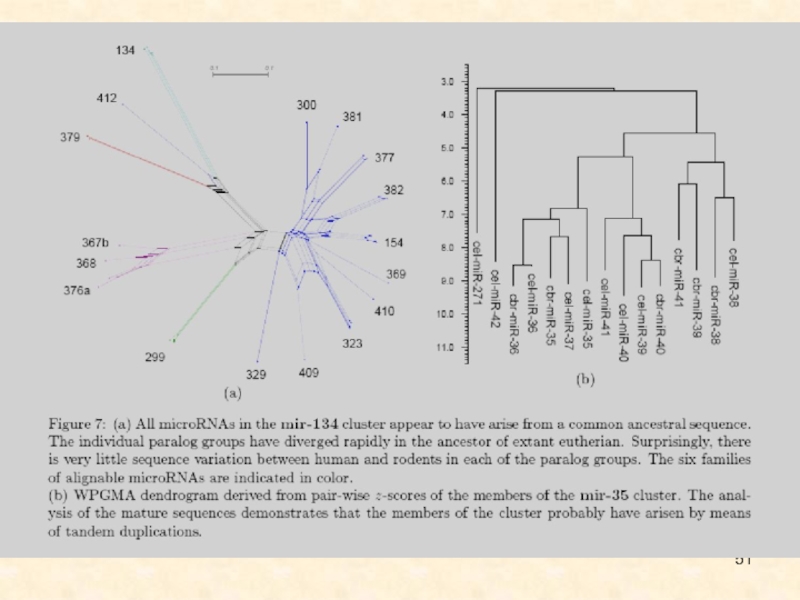
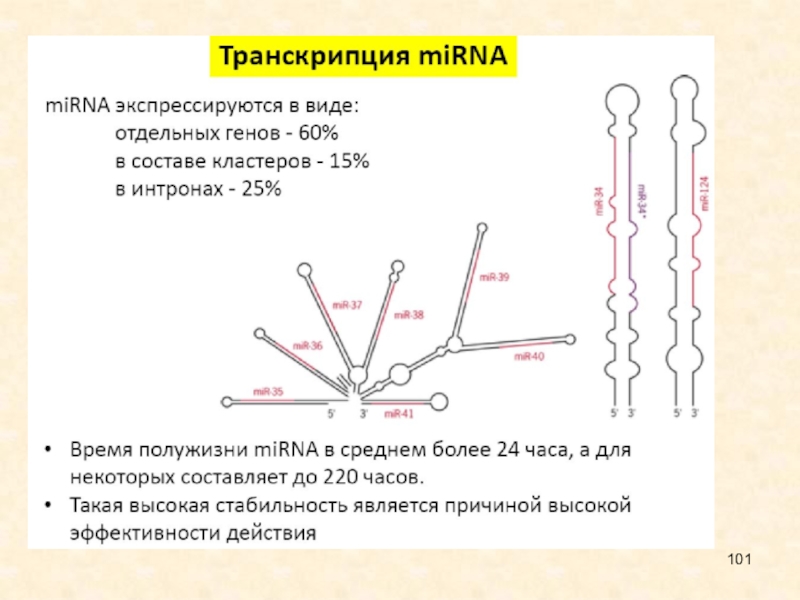
Слайд 48Филогенетические древа двух семейств miРНК, mir-1 и mir-30.
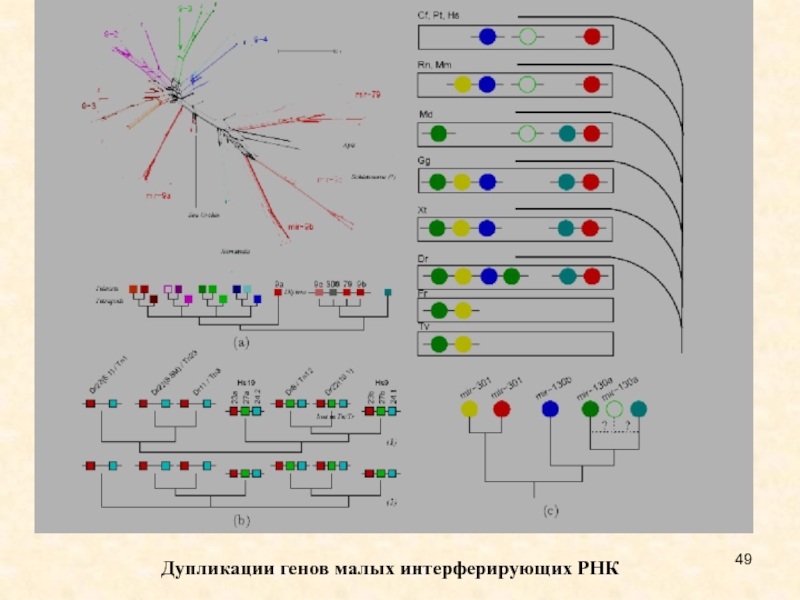
Слайд 49Дупликации генов малых интерферирующих РНК
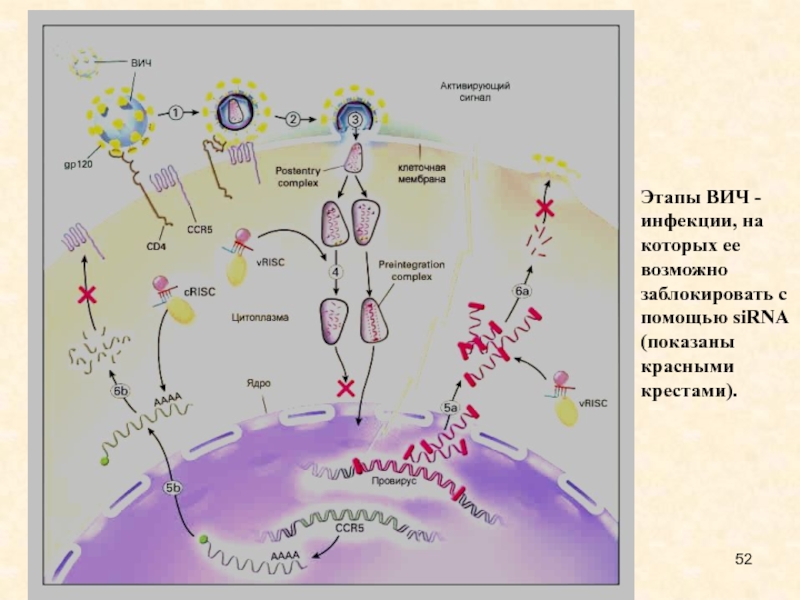
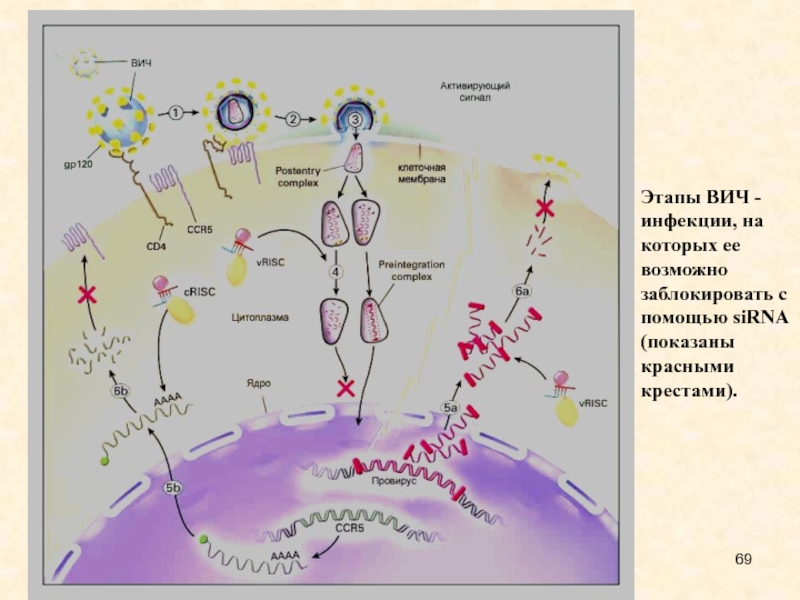
Слайд 52Этапы ВИЧ - инфекции, на которых ее возможно заблокировать с
помощью siRNA (показаны красными крестами).
Слайд 53Старение и канцерогенез
Как и любой эпигенетический фактор, siRNA влияют на
экспрессию генов, которые заставляет "молчать". Сейчас появляются работы, в которых
описаны эксперименты по выключению генов, ассоциированных с опухолями. Гены выключают (knock-down) именно с помощью siRNA. Например, китайские ученые с помощью siRNA выключили ген транскрипционного фактора 4 (TCF4), активность которого служит причиной синдрома Pitt-Hopkins (очень редкое генетическое заболевание, характеризующееся умственной отсталостью и эпизодами гипервентиляции и апноэ) и других умственных заболеваний. В данной работе проводилось изучение роли TCF4 в клетках рака желудка. Эктопическая экспрессия TCF4 снижает рост клеток в линиях клеток рака желудка, выключение гена TCF4 с помощью siRNA повышает миграцию клеток. Таким образом, можно сделать вывод, что эпигенетическое выключение (сайленсинг) гена TCF4 играет важную роль в образовании и развитии опухоли.
Слайд 54
Согласно исследованиям siRNA участвует в выключении гена HDAC4, что вызывает
ингибирование роста раковой опухоли толстой кишки, апоптоз и повышение транскрипции
р21. HDAC4 - это гистоновая деацетилаза, которая является тканеспецифичной, подавляет дифференцировку клеток и ее экспрессия подавлена в процессе дифференцировки клеток. В работе показано, что HDAC4 является важным регулятором пролиферации клеток толстой кишки (что имеет значение при раковом процессе), а ее в свою очередь регулируют siRNA.
Слайд 55Существенный недостаток предполагаемой siRNA - терапии у человека - ее
кратковременность. Ведь siRNA действуют не на сами гены (ДНК), а
только лишь на их продукты - мРНК, и у человека нет той системы усиления сигнала, о которая присуща растениям. Кроме того, двухцепочечные молекулы siRNA чрезвычайно неустойчивы и недолговечны, поэтому эффект терапии закончится, как только они разрушатся и будут выведены из клетки. Для того, чтобы продлить терапию, придется вводить все новые siRNA.
Но самым главным препятствием на пути разработки лекарств из siRNA являются сложности с их доставкой в нужные клетки внутри целого организма (их называют клетками-мишенями).
И все же разработка лекарств, несмотря на всю свою значимость, - не самая главное из предполагаемых "занятий" siRNA. Самым важным направлением в использовании их свойств считают бурно развивающуюся в последнее время функциональную геномику. После описания геномов многих животных и человека перед наукой встала очередная глобальная задача: выяснить роль каждого гена. Одним из основных инструментов, применяемых генетиками для решения этого вопроса, является "выключение" гена. Действительно, чтобы хотя бы в первом приближении оценить функцию гена, нужно посмотреть, как поведет себя клетка без него, какие биохимические процессы при этом нарушатся.
Вот здесь - то siRNA явились для генетиков неоценимым подарком. Если раньше на поиски удачного способа блокировки гена и приведение его в действие требовалось от нескольких месяцев до года, то с помощью метода siRNA практически с любым геном любого организма, последовательность нуклеотидов которого известна, эту процедуру можно проделать в 1-2 недели, при этом значительно повысив специфичность блокирования.

Слайд 56Сложный жизненный цикл паразитических видов требует наличия надежных механизмов обеспечивающих
нормальное развитие при постоянном изменении окружающей среды. Функцию посредника между
поступающими сигналами и адекватным ответом организма могут выполнять молекулы малых интерферирующих РНК.
За последние двадцать лет сотни таких молекул идентифицированы у Caenorhabditis elegans и других паразитических видов, их функции изучаются, рассматриваются возможности применения этих молекул для лечения паразитарных заболеваний.
Слайд 58Нерешенные вопросы:
Как осуществляются функции siRNA, каковы их молекулярные детали?
Откуда, например, может появляться та необходимая для запуска реакции РНК
- интерференции молекула двухцепочечной РНК? Если она создается в клетке намеренно, то какие ферменты отвечают за ее создание?
Какие свойства сигнализируют о том, что молекула одноцепочечной РНК "не своя" или ошибочная и подлежит уничтожению?
Каковы особенности функционирования системы siRNA у разных организмов, и почему они возникли именно в таком виде?
Как появляются siRNA в клетке млекопитающих, у которых пока не выявлены ферменты, ответственные за достраивание второй цепочки siRNA?
Слайд 61Длина siRNA 21-25 п.н., они образуются из дцРНК. Источником таких
РНК могут быть вирусные инфекции, введенные в геном генетические конструкции,
длинные шпильки в составе транскриптов и двунаправленная транскрипция мобильных элементов.
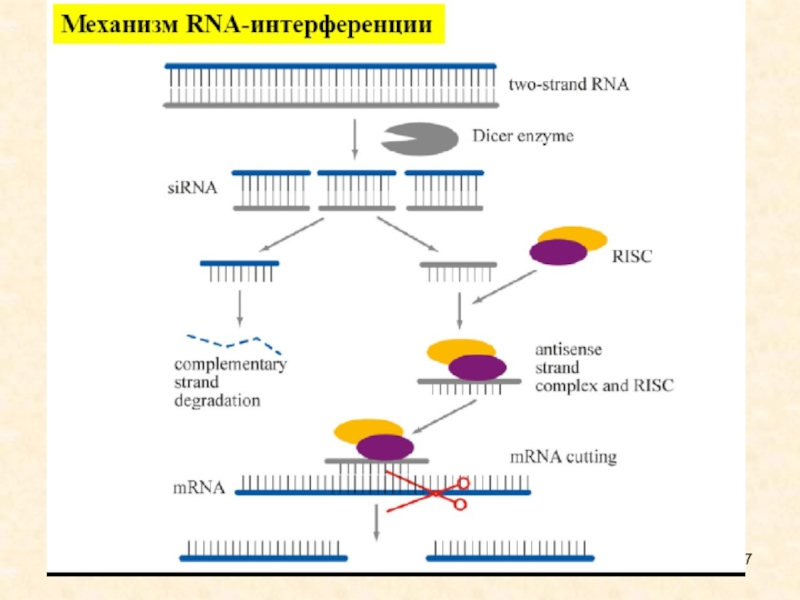
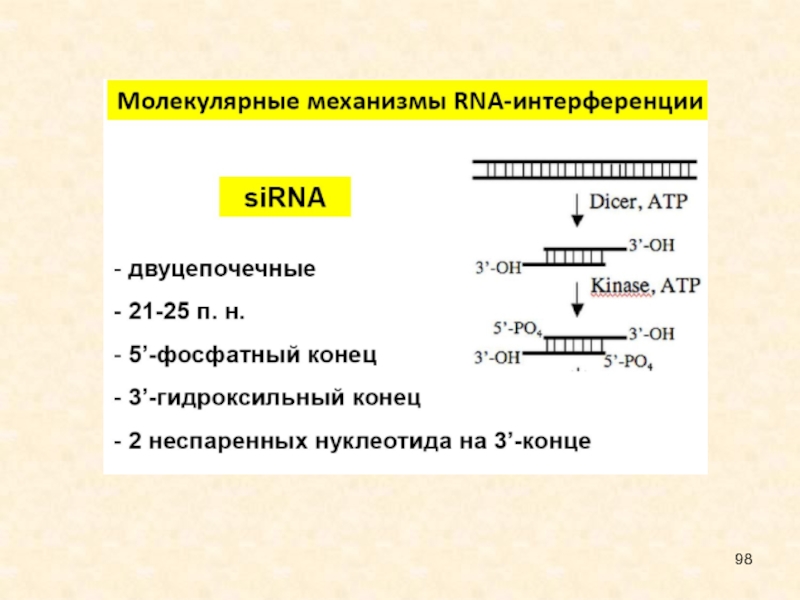
дцРНК нарезаются РНКазой Dicer на фрагменты длиной 21-25 п.н. с выступающими на 2 нуклеотида 3'-концами, после чего
одна из цепей входит в состав RISC и направляет разрезание гомологичных РНК. В составе RISC присутствуют siRNA, соответствующие как плюс-, так и минус- цепям дцРНК.
siRNA не имеют собственных генов и представляют собой фрагменты более длинных РНК. siRNA направляют разрезание РНК-мишени, поскольку полностью ей комплементарны.
У растений, грибов и нематод в процесс подавления экспрессии генов вовлечены РНК-зависимые РНК-полимеразы, для которой siRNA служат еще и праймерами (затравками для синтеза новой РНК). Образовавшаяся дцРНК нарезается Dicer, образуются новые siRNA, которые являются вторичными. Таким образом происходит амплификация сигнала.
Слайд 63
Геном некоторых из вирусов состоит из ДНК, у некоторых же
- из РНК, причем, РНК у вирусов может быть как
одно-, так и двуцепочечной. Сам процесс разрезания чужеродной (вирусной) мРНК в этом случае происходит так же, как было описано выше, то есть путем активации комплекса ферментов RISC. Однако для большей эффективности растения и насекомые изобрели своеобразный путь усиления защитного действия siRNA. Присоединяясь к цепи мРНК, участок siRNA может с помощью комплекса ферментов DICER сначала достроить вторую цепочку мРНК, а затем разрезать ее в разных местах, создавая таким образом разнообразные "вторичные" siRNA. Они, в свою очередь, формируют RISC и проводят мРНК через все стадии, о которых шла речь выше, вплоть до ее полного уничтожения. Такие "вторичные" молекулы смогут специфично связываться не только с тем участком вирусной мРНК, к которому была направлена "первичная" молекула, но также и с другими участками, что резко усиливает эффективность клеточной защиты.
Таким образом, у растений и низших животных организмов siRNA являются важным звеном своеобразного "внутриклеточного иммунитета ", позволяющего распознавать и быстро уничтожать чужую РНК. В том случае, если в клетку проник РНК - содержащий вирус, такая система защиты не даст ему размножиться. Если же вирус содержит ДНК, система siRNA будет мешать ему производить вирусные белки (так как необходимая для этого мРНК будет распознаваться и разрезаться), и с помощью этой стратегии замедлит его распространение по организму.

Слайд 65У млекопитающих же, в отличие от насекомых и растений, работает
и другая система защиты. При попадании в "зрелую" (дифференцированную) клетку
млекопитающего чужой РНК, длина которой больше 30 п.н., клетка начинает синтез интерферона. Интерферон, связываясь со специфическими рецепторами на клеточной поверхности, способен стимулировать в клетке целую группу генов. В результате в клетке синтезируется несколько видов ферментов, которые тормозят синтез белков и расщепляют вирусные РНК. Кроме того, интерферон может действовать и на соседние, еще не зараженные клетки, блокируя тем самым возможное распространение вируса.
Как можно заметить, обе системы во многом схожи: у них общая цель и "методы" работы. Даже сами названия "interferon" и "(RNA) interference" происходят от общего корня. Но есть у них и одно очень существенное различие: если интерферон при первых признаках вторжения просто "замораживает" работу клетки, не позволяя (на всякий случай) производство многих, в том числе и "невиновных" белков в клетке, то система siRNA отличается чрезвычайной разборчивостью: каждая siRNA будет распознавать и уничтожать только свою, специфическую мРНК. Замена всего лишь одного нуклеотида внутри siRNA ведет к резкому снижению эффекта интерференции. Ни один из блокаторов генов, известных до сих пор, не обладает такой исключительной специфичностью по отношению к своему гену-мишени.

Слайд 66
Открытие РНК-интерференции дало новую надежду в борьбе со СПИДом и
онкологическими заболеваниями. Возможно, применяя терапию siRNA вместе с традиционной антивирусной
терапией, можно достичь эффекта потенцирования, когда два воздействия приводят к более выраженному лечебному эффекту, чем простая сумма каждого из них, применяемого по отдельности.
Для того, чтобы использовать механизм siRNA - интерференции в клетках млекопитающих, внутрь клеток нужно ввести уже готовые двухцепочечные молекулы siRNA. Оптимальный размер таких синтетических siRNA при этом составляет те же 21-28 нуклеотидов. Если увеличить ее длину - клетки ответят выработкой интерферона и снижением синтеза белка. Синтетические siRNA могут попасть как в зараженные, так и в здоровые клетки, и снижение выработки белков в незараженных клетках будет крайне нежелательным. С другой стороны, если попытаться применять siRNA меньшие, чем 21 нуклеотид, резко снижается специфичность ее связывания с нужной мРНК и способность к формированию комплекса RISC.
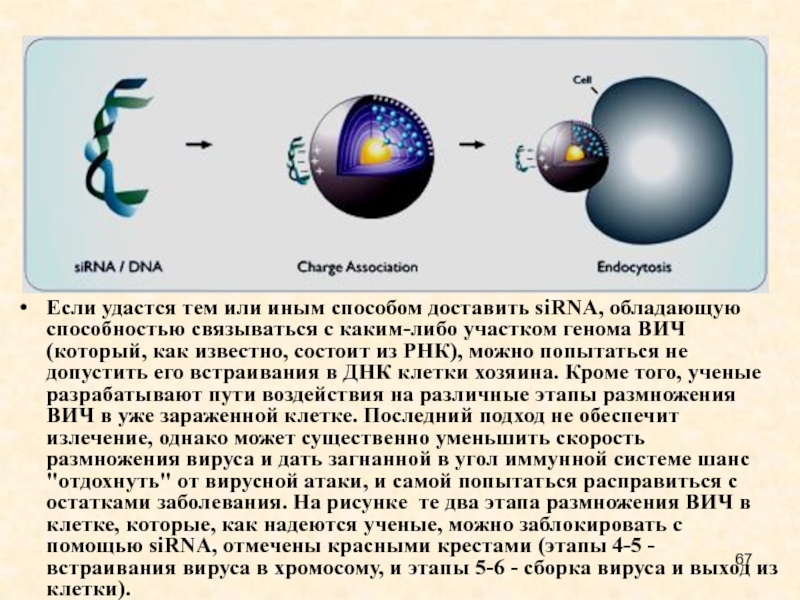
Слайд 67Если удастся тем или иным способом доставить siRNA, обладающую способностью
связываться с каким-либо участком генома ВИЧ (который, как известно, состоит
из РНК), можно попытаться не допустить его встраивания в ДНК клетки хозяина. Кроме того, ученые разрабатывают пути воздействия на различные этапы размножения ВИЧ в уже зараженной клетке. Последний подход не обеспечит излечение, однако может существенно уменьшить скорость размножения вируса и дать загнанной в угол иммунной системе шанс "отдохнуть" от вирусной атаки, и самой попытаться расправиться с остатками заболевания. На рисунке те два этапа размножения ВИЧ в клетке, которые, как надеются ученые, можно заблокировать с помощью siRNA, отмечены красными крестами (этапы 4-5 - встраивания вируса в хромосому, и этапы 5-6 - сборка вируса и выход из клетки).
Слайд 68На сегодняшний день, правда, все вышесказанное относится лишь к области
теории. На практике терапия siRNA встречается с затруднениями, обойти которые
ученым пока не удается. Например, в случае антивирусной терапии именно высокая специфичность siRNA может сыграть злую шутку: как известно, вирусы обладают способностью быстро мутировать, т.е. изменять состав своих нуклеотидов. Особенно преуспел в этом ВИЧ, частота изменений которого такова, что у человека, заразившегося одним подтипом вируса, через несколько лет может быть выделен абсолютно непохожий на него подтип. В этом случае измененный штамм ВИЧ автоматически станет нечувствительным к siRNA, подобранной в начале терапии.
Слайд 69Этапы ВИЧ - инфекции, на которых ее возможно заблокировать с
помощью siRNA (показаны красными крестами).
Слайд 70Старение и канцерогенез
Как и любой эпигенетический фактор, siRNA влияют на
экспрессию генов, которые заставляет "молчать". Сейчас появляются работы, в которых
описаны эксперименты по выключению генов, ассоциированных с опухолями. Гены выключают (knock-down) именно с помощью siRNA. Например, китайские ученые с помощью siRNA выключили ген транскрипционного фактора 4 (TCF4), активность которого служит причиной синдрома Pitt-Hopkins (очень редкое генетическое заболевание, характеризующееся умственной отсталостью и эпизодами гипервентиляции и апноэ) и других умственных заболеваний. В данной работе проводилось изучение роли TCF4 в клетках рака желудка. Эктопическая экспрессия TCF4 снижает рост клеток в линиях клеток рака желудка, выключение гена TCF4 с помощью siRNA повышает миграцию клеток. Таким образом, можно сделать вывод, что эпигенетическое выключение (сайленсинг) гена TCF4 играет важную роль в образовании и развитии опухоли.
Слайд 71
Согласно исследованиям siRNA участвует в выключении гена HDAC4, что вызывает
ингибирование роста раковой опухоли толстой кишки, апоптоз и повышение транскрипции
р21. HDAC4 - это гистоновая деацетилаза, которая является тканеспецифичной, подавляет дифференцировку клеток и ее экспрессия подавлена в течение процесса дифференцировки клеток. В работе показано, что HDAC4 является важным регулятором пролиферации клеток толстой кишки (что имеет значение при раковом процессе), а ее в свою очередь регулируют siRNA.
Слайд 72В Японии проводились исследования рака простаты. Репликативное старение клеток- это
барьер против неконтролируемого деления и канцерогенеза. Короткоживущие делящиеся клетки (TAC)
являются частью популяции клеток простаты, из которой и образуется опухоль. Японские ученые изучали причины, по которым эти клетки преодолевают старение. В клетки простаты в культуре были трасфецированы junB siRNA. В этих клетках наблюдается повышенный уровень экспрессии p53, p21, p16 и pRb, выявляемый при старении. Клетки в культуре, которые показали пониженный уровень p16, использовались для следующего этапа. Повторная трансфекция siRNA в TAC позволила клеткам избежать старения при инактивации p16/pRb. Кроме того сайленсинг прото-онкогена junB с помощью junB siRNA вызывает инвазию клеток. На основании этого был сделан вывод, что junB является энхансерным элементом для p16 и способствует клеточному старению, препятствующему малигнизации (озлокачествлению)TAC. Таким образом, junB является регулятором канцерогенеза в простате и может быть целью для терапевтического воздействия. А регулировать его активность можно с помощью siRNA.

Слайд 73Подобных исследований проводится огромное множество. В настоящее время siRNA- это
не только объект, но и инструмент в руках исследователя- врача,
биолога, онколога, геронтолога. Исследование связи siRNA с онкологическими заболеваниями, с экспрессией возраст-ассоциированных генов- это важнейшая задача для науки. Прошло совсем немного времени с момента открытия siRNA, а сколько появилось интересных исследований и публикаций, связанных с ними. Можно не сомневаться, что их изучение станет одним из шагов человечества к победе над раком и старением...
Слайд 74Science назвал малые РНК самым главным научным достижением 2002 года.
В статье С. Григоровича подробно описано современное представление о механизме
функционирования малых РНК в клетках, рассматриваются перспективы их применения как новой, весьма эффективной лабораторной методики и как потенциального способа терапии.
Слайд 75"Иммунная система" внутри клетки
Один из ответов на вопрос о
необходимости РНК - интерференции в клетке напрашивается сам собой: с
помощью siRNA клетка может защищать себя от проникновения вирусов.
Присоединяясь к цепи мРНК, участок siRNA может с помощью комплекса ферментов, называемого DICER, сначала достроить вторую цепочку мРНК, а затем разрезать ее в разных местах, создавая таким образом разнообразные "вторичные" siRNA. Они, в свою очередь, формируют RISC и проводят мРНК через все стадии, о которых шла речь выше, вплоть до ее полного уничтожения. Такие "вторичные" молекулы смогут специфично связываться не только с тем участком вирусной мРНК, к которому была направлена "первичная" молекула, но также и с другими участками, что резко усиливает эффективность клеточной защиты.
Таким образом, у растений и низших животных организмов siRNA являются важным звеном своеобразного "внутриклеточного иммунитета", позволяющего распознавать и быстро уничтожать чужую РНК. В том случае, если в клетку проник РНК - содержащий вирус, такая система защиты не даст ему размножиться. Если же вирус содержит ДНК, система siRNA будет мешать ему производить вирусные белки (так как необходимая для этого мРНК будет распознаваться и разрезаться), и с помощью этой стратегии замедлит его распространение по организму.

Слайд 76У млекопитающих же, в отличие от насекомых и растений, работает
и другая система защиты. При попадании в "зрелую" (дифференцированную) клетку
млекопитающего чужой РНК, длина которой больше 30 нуклеотидов, клетка начинает синтез интерферона. Интерферон, связываясь со специфическими рецепторами на клеточной поверхности, способен стимулировать в клетке целую группу генов. В результате в клетке синтезируется несколько видов ферментов, которые тормозят синтез белков и расщепляют вирусные РНК. Кроме того, интерферон может действовать и на соседние, еще не зараженные клетки, блокируя тем самым возможное распространение вируса.
Как можно заметить, обе системы во многом схожи: у них общая цель и "методы" работы. Даже сами названия "interferon" и "(RNA) interference" происходят от общего корня. Но есть у них и одно очень существенное различие: если интерферон при первых признаках вторжения просто "замораживает" работу клетки, не позволяя (на всякий случай) производство многих, в том числе и "невиновных" белков в клетке, то система siRNA отличается чрезвычайной разборчивостью: каждая siRNA будет распознавать и уничтожать только свою, специфическую мРНК. Замена всего лишь одного нуклеотида внутри siRNA ведет к резкому снижению эффекта интерференции.
ни один из блокаторов генов, известных до сих пор, не обладает такой исключительной специфичностью по отношению к своему гену-мишени.
о siRNA. Их открытие интересно тем, что дает новую надежду в борьбе с вирусами, в том числе СПИДа, а также с теми, кого подозревают в соучастии при развитии рака. Высокая специфичность и эффективность вкупе с низкой токсичностью будут здесь как нельзя кстати. Как ожидается, применяя терапию siRNA вместе с традиционной антивирусной терапией, можно достичь эффекта потенцирования, когда два воздействия приводят к более выраженному лечебному эффекту, чем простая сумма каждого из них, применяемого по отдельности.

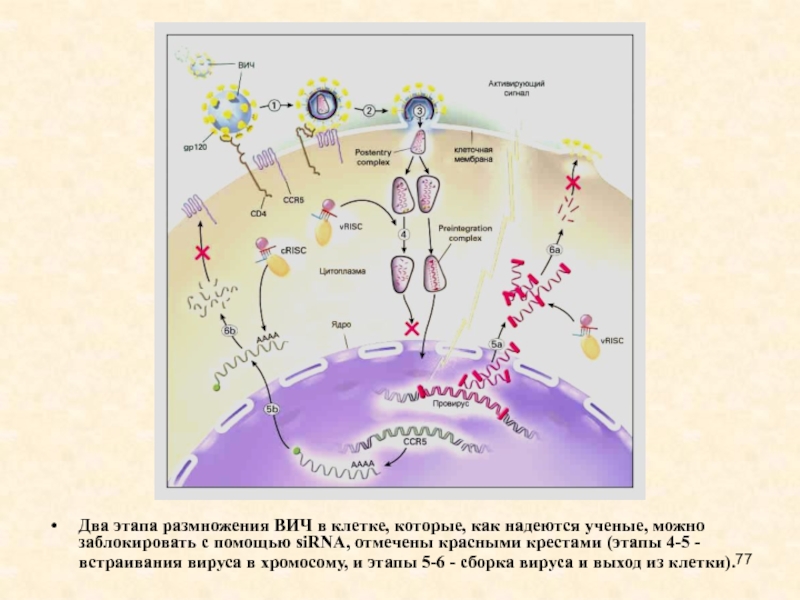
Слайд 77Два этапа размножения ВИЧ в клетке, которые, как надеются ученые,
можно заблокировать с помощью siRNA, отмечены красными крестами (этапы 4-5
- встраивания вируса в хромосому, и этапы 5-6 - сборка вируса и выход из клетки).
Слайд 78Они, оказывается, были созданы, чтобы защитить нас ... от нас
самих.
Дело в том, что геном любого многоклеточного организма включает
в себя множество элементов, которые когда-то были привнесены в него в процессе эволюции извне, например как результат встраивания вируса. Из всего материала, содержащегося в наших хромосомах, 34% приходится на долю элементов, называемых LINEs и SINEs (соответственно, Long и Short Interspersed Nuclear Elements ), о функциях которых известно только то, что они могут по временам копировать себя и перемещаться с одного места хромосомы на другое; те участки ДНК, которые достались нам от ретровирусов (8% генома) и транспозоны (3%) также способны менять свое место в геноме. На их фоне всего лишь 2 (два(!)) процента собственно генов, кодирующих наши клеточные белки, кажутся такой же маловажной деталью, как и siRNA среди огромного разнообразия своих больших "сестер".
LINEs, SINEs, остатки вирусной ДНК и транспозоны, за свою способность к перемещениям именуемые подвижными, или мобильными элементами генома, представляют значительную опасность для наших хромосом. "Чужие среди своих", они при определенных обстоятельствах могут поднять бунт и привести к внутриклеточному хаосу. Некоторые из них - остатки вирусов, или протоонкогены - способны при "включении" вызывать рак; мобильные элементы, размножаясь и перемещаясь, меняют структуру хромосом, что может привести к мутациям. Например, у плодовой мушки дрозофилы более 80% спонтанных мутаций возникают именно из-за "хулиганского" поведения ее собственных мобильных элементов. Их перемещения внутри генома так индивидуальны и непредсказуемы, что положение некоторых из них может служить "молекулярным паспортом", точно определяющим личность хозяина, что уже используется на практике.
Понятно, что каждому организму необходимо было разработать систему жесткого контроля за поведением мобильных элементов. Как раз эту "надзирательскую" функцию, как полагают ученые, и выполняет система внутриклеточных siRNA. На модели все того же C. elegans, например, было показано, что отключение генов, кодирующих некоторые из малых РНК, ведет к активизации перемещений мобильных элементов в его хромосомах и, соответственно, к повышению уровня мутаций.

Слайд 79Кроме того, ошибки в развитии органов и тканей при отключении
генов, кодирующих систему siRNA у подопытных животных, а также ее
активность в "незрелых" клетках указывают на то, что механизм РНК - интерференции активно участвует в регуляции программы "созревания" клеток и, как следствие, может играть одну из ключевых ролей в формировании целостного организма.
Еще одна из предполагаемых нормальных функций siRNA - отслеживание неправильно обработанных копий других типов РНК в клетке.
Наконец, в 2002 году исследователи неожиданно выяснили, что действие siRNA может не ограничиваться только лишь временным выключением генов не уровне РНК. Имеются показания, что в некоторых случаях siRNA, видимо, воздействует прямо на ДНК, изменяя структуру хроматина и способствуя длительному "замолканию" одних, и, возможно, активизации других генов.
Как осуществляются все эти функции siRNA, каковы их молекулярные детали? Откуда, например, может появляться та необходимая для запуска реакции РНК - интерференции молекула двухцепочечной РНК? Если она создается в клетке намеренно, то какие ферменты отвечают за ее создание? Какие свойства сигнализируют о том, что молекула одноцепочечной РНК "не своя" или ошибочная и подлежит уничтожению? Каковы особенности функционирования системы siRNA у разных организмов, и почему они возникли именно в таком виде? Как появляются siRNA в клетке млекопитающих, у которых пока не выявлены ферменты, ответственные за достраивание второй цепочки siRNA?
На эти и многие другие вопросы ответов пока нет.

Слайд 80Вопросы без ответов
Существенный недостаток предполагаемой siRNA - терапии у
человека - ее кратковременность. Ведь siRNA действуют не на сами
гены (ДНК), а только лишь на их продукты - мРНК, и у человека нет той системы усиления сигнала, о которая присуща растениям. Кроме того, двухцепочечные молекулы siRNA чрезвычайно неустойчивы и недолговечны, поэтому эффект терапии закончится, как только они разрушатся и будут выведены из клетки. Для того, чтобы продлить терапию, придется вводить все новые siRNA.
Но самым главным препятствием на пути разработки лекарств из siRNA являются сложности с их доставкой в нужные клетки внутри целого организма (их называют клетками-мишенями).
И все же разработка лекарств, несмотря на всю свою значимость, - не самая главное из предполагаемых "занятий" siRNA. Самым важным направлением в использовании их свойств считают бурно развивающуюся в последнее время функциональную геномику. После описания геномов многих животных и человека перед наукой встала очередная глобальная задача: выяснить роль каждого гена. Одним из основных инструментов, применяемых генетиками для решения этого вопроса, является "выключение" гена. Действительно, чтобы хотя бы в первом приближении оценить функцию гена, нужно посмотреть, как поведет себя клетка без него, какие биохимические процессы при этом нарушатся.
Вот здесь - то siRNA явились для генетиков неоценимым подарком. Если раньше на поиски удачного способа блокировки гена и приведение его в действие требовалось от нескольких месяцев до года, то с помощью метода siRNA практически с любым геном любого организма, последовательность нуклеотидов которого известна, эту процедуру можно проделать в 1-2 недели, при этом значительно повысив специфичность блокирования.

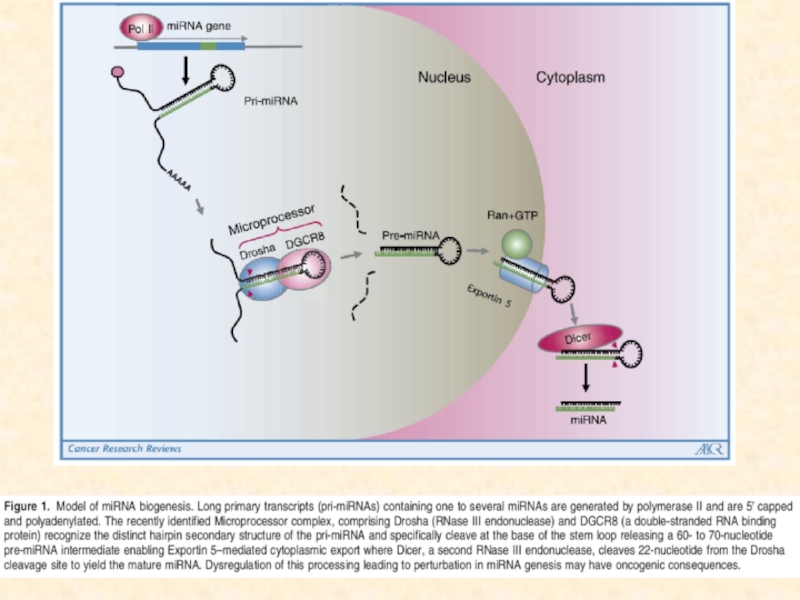
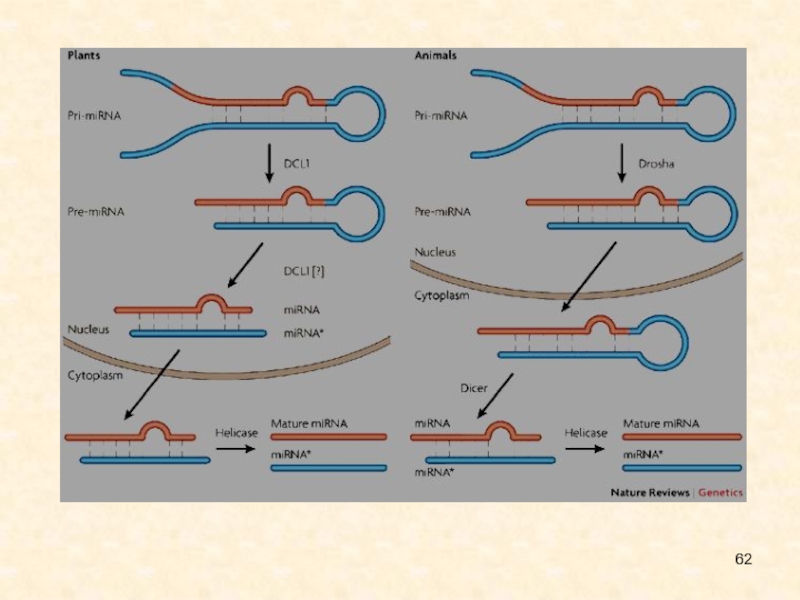
Слайд 81Mature microRNAs (miRNAs) are short (22-nucleotide), non-coding ssRNAs that repress
mRNAs post-transcriptionally by binding to partially complementary sites, called miRNA
binding sites, in their target mRNAs. In animals, miRNA-mediated repression is often relatively weak, whereas transcription-factor-mediated repression can be much stronger.
Mature miRNAs are cleaved from 70-nucleotide hairpin structures, called precursor miRNAs (pre-mRNAs), by the enzyme dicer. Pre-miRNAs are in turn excised from a primary miRNA (pri-mRNA) transcript by the enzyme drosha. Pri-miRNAs are typically transcribed by RNA polymerase II104 and seem to possess promoter and enhancer elements that are similar to those of protein-coding genes (for example, Refs 105, 106). They can be thousands of nucleotides long and contain multiple pre-miRNAs. In some cases, however, pre-miRNAs are contained in introns of protein-coding genes and are excised by the splicing machinery. In metazoans, pre-mRNAs are exported into the cytoplasm where they are processed into mature miRNAs, whereas in plants, miRNA maturation occurs within the nucleus. miRNAs are grouped into families on the basis of their target recognition motifs (Box 3).
The predominant regulatory effect of miRNAs is to repress their target mRNAs; mechanisms for this include translational repression, mRNA cleavage, mRNA deadenylation or alteration of mRNA stability (reviewed in Ref. 107, 126). miRNA-mediated cleavage of mRNAs seems to be the exception in animals. By contrast, it is believed to be the dominant regulatory mode in plants. DCL1, dicer-like 1; miRNA*, the rapidly decaying strand that is complementary to the mature miRNA.

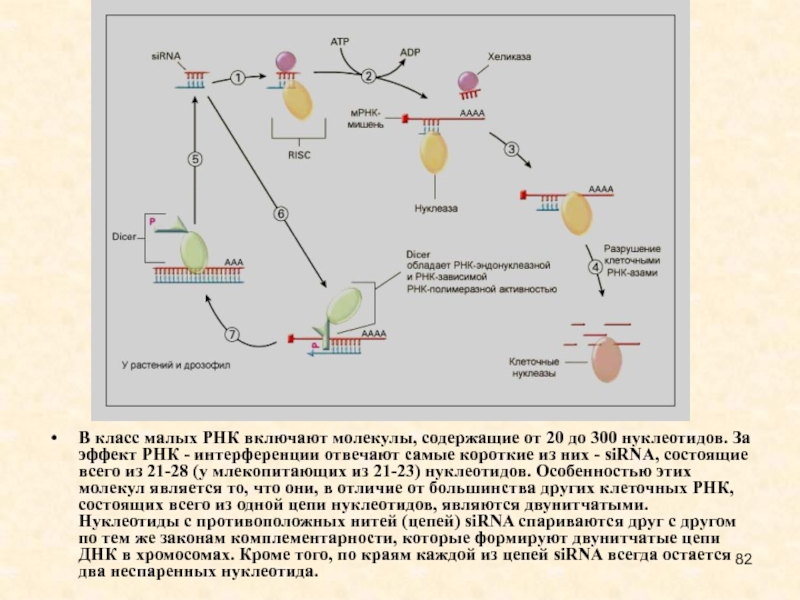
Слайд 82В класс малых РНК включают молекулы, содержащие от 20 до
300 нуклеотидов. За эффект РНК - интерференции отвечают самые короткие
из них - siRNA, состоящие всего из 21-28 (у млекопитающих из 21-23) нуклеотидов. Особенностью этих молекул является то, что они, в отличие от большинства других клеточных РНК, состоящих всего из одной цепи нуклеотидов, являются двунитчатыми. Нуклеотиды с противоположных нитей (цепей) siRNA спариваются друг с другом по тем же законам комплементарности, которые формируют двунитчатые цепи ДНК в хромосомах. Кроме того, по краям каждой из цепей siRNA всегда остается два неспаренных нуклеотида.
Слайд 84Малые интерферирующие РНК (siRNA)
Слайд 85Подавление экспрессии может происходить на уровне транскрипции или посттранскрипционно. Оказалось,
что во всех случаях необходим сходный набор белков и короткие
(21-32 п.н.) РНК.
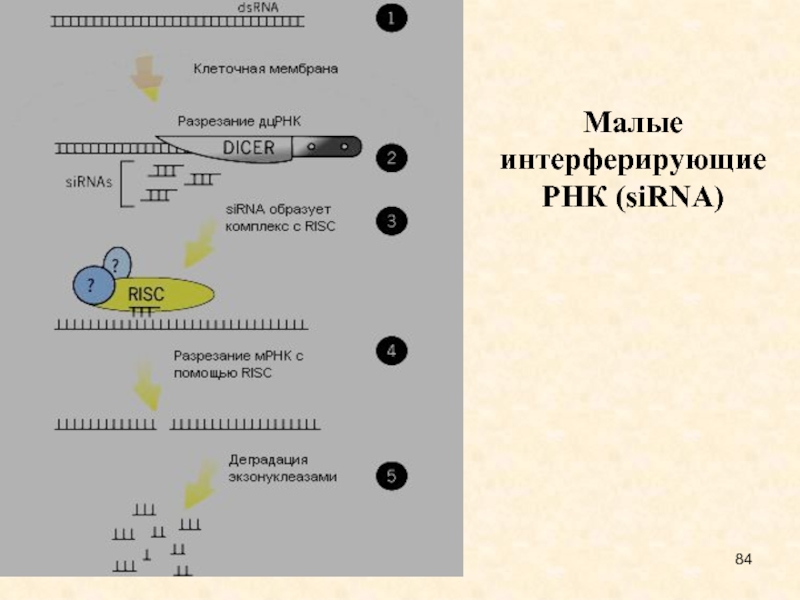
siRNA регулируют активность генов двумя способами. Они направляют разрезание РНК-мишеней. Это явление получило название "подавление" (quelling) у грибов, "посттрансляционный сайленсинг генов" у растений и "РНК-интерференция" у животных. В этих процессах участвуют siRNA длиной 21-23 п.н.
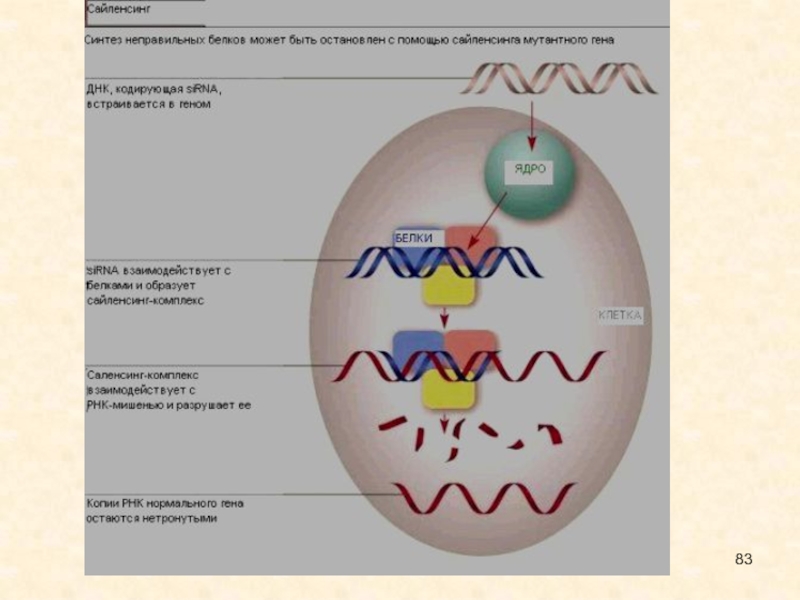
Другой тип воздействия- siRNA способны подавлять транскрипцию генов, содержащих гомологичные siRNA-последовательности. Это явление было названо транскрипционным сайленсингом генов(TGS) и обнаружено у дрожжей, растений и животных. siRNA направляют модификации гистонов и метилирование ДНК, что приводит к образованию гетерохроматина и репрессии транскрипции. Лучше всего TGS изучен у дрожжей S.pombe, обнаружено, что у них siRNA встраиваются в похожий на RISC белковый комплекс, названный RITS. В его случае,как и в случае RISC, siRNA взаимодействует с белком семейства AGO. Вероятно, siRNA способна направлять этот комплекс к гену, который содержит гомологичный siRNA фрагмент. После этого белки RITS рекрутируют метилтрансферазы , в результате чего в локусе, кодирующем ген-мишень siRNA, формируется гетерохроматин, и активная экспрессия гена прекращается.

Слайд 86
Понятно, что с первого взгляда малые РНК, состоящие всего из
нескольких десятков нуклеотидов, могли показаться просто мусором, остатками от своих
"больших братьев". И даже несмотря на то, что роль отдельных малых молекул РНК в процессах превращения информационных РНК (сплайсинге), а также при упаковке нитей нуклеиновых кислот, была доказана ранее, истинным "хитом" в биологии малые РНК стали только лишь с открытием своей способности подавлять экспрессию генов у животных.
Эффект "гашения" экспрессии определенных генов малыми РНК получил название РНК-интерференции, а молекулы, вызывающие его, назвали siRNA (small interfering RiboNucleic Acids - малые интерферирующие рибонуклеиновые кислоты
С открытием siRNA - интерференции стало ясно, что этот феномен может иметь огромное практическое значение
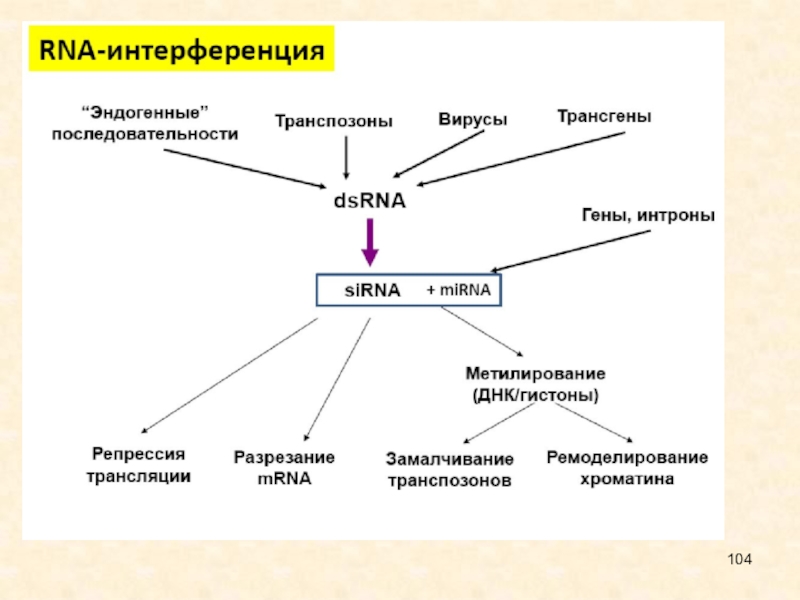
Слайд 87Роль в клеточных процессах
siRNA вовлечены в защиту клетки от
вирусов,
репрессию трансгенов,
регуляцию некоторых генов и
формирование центромерного гетерохроматина.
Важная
функция siRNA-подавление экспрессии мобильных генетических элементов.
Описаны эксперименты по выключению генов, ассоциированных с опухолями.
Такое подавление может происходить как на уровне транскрипции, так и посттранскрипционно.
Эффект "гашения" экспрессии определенных генов малыми РНК получил название РНК-интерференции, а молекулы, вызывающие его, назвали siRNA (small interfering RiboNucleic Acids - малые интерферирующие рибонуклеиновые кислоты
В 1998 году Craig C. Mello и Andrew Fire опубликовали статью в Nature
в которой говорилось, что двуцепочечные РНК (дцРНК) способны подавлять экспрессию генов.
Слайд 88Роль в клеточных процессах
siRNA вовлечены в защиту клетки от
вирусов,
репрессию трансгенов,
регуляцию некоторых генов и
формирование центромерного гетерохроматина.
Важная
функция siRNA-подавление экспрессии мобильных генетических элементов.
Описаны эксперименты по выключению генов, ассоциированных с опухолями.
Такое подавление может происходить как на уровне транскрипции, так и посттранскрипционно.
Слайд 120Andrew Z. Fire
Craig C. Mello
Нобелевская премия
по физиологии
и медицине
2006 год
"RNA interference – gene silencing by double-stranded
RNA"
Слайд 121Предположение Fire & Mello:
Двуцепочечные РНК (dsRNA)
– запускающий механизм (триггер)
системы интерференции РНК.
Слайд 122Интерференция РНК
– это замолкание (сайленсинг) генов, обеспечиваемое двуцепочечными молекулами
РНК (dsРНК).
Явление интерференции РНК открыто в 1998 г. у
Nematoda (Fire et al., 1998)
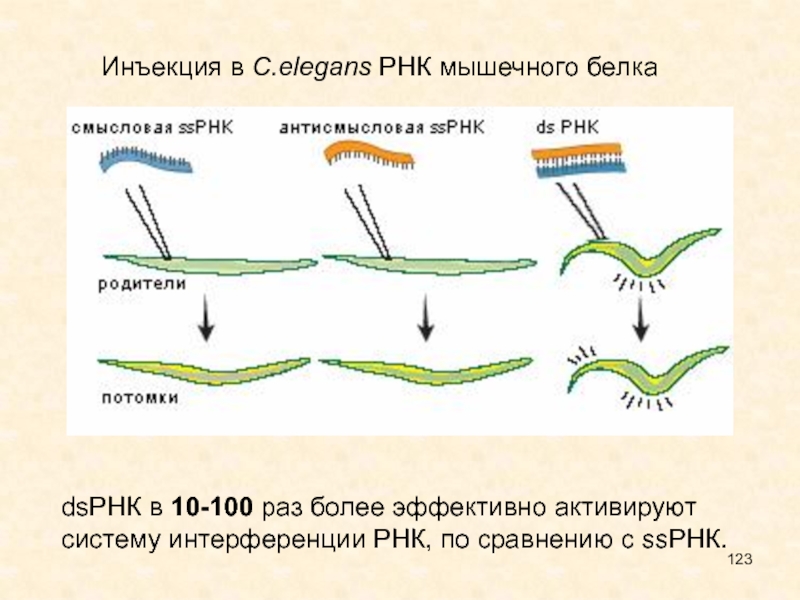
Слайд 123dsРНК в 10-100 раз более эффективно активируют систему интерференции РНК,
по сравнению с ssРНК.
Инъекция в C.elegans РНК мышечного белка
Слайд 124Fire A., Xu S.Q., Montgomery M.K., Kostas S.A., Driver S.E.,
Mello C.C. Potent and specific genetic interference by double-stranded RNA
in Caenorhabditis elegans. Nature 391, 806–811 (1998).
Эффект генетического сайленсинга
посредством интерференции РНК:
распространяется в тканях организма (!)
наследуется (!!!)
Слайд 125Механизм интерференции РНК
при исследовании интерференции РНК у
растений обнаружены короткие молекулы РНК, маркирующие ген, подверженный сайленсингу;
в условиях in vitro воспроизведены биохимические реакции интерференции РНК.
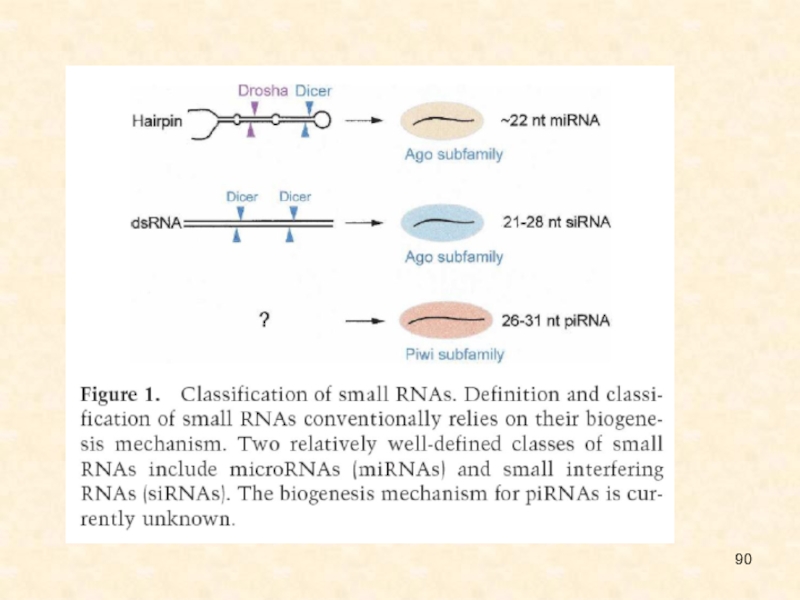
Малые интерферирующие РНК (siRNAs – short interfering RNAs) – класс 21-22 нуклеотидных двуцепочечных РНК, образующихся из более длинных двуцепочечных РНК.
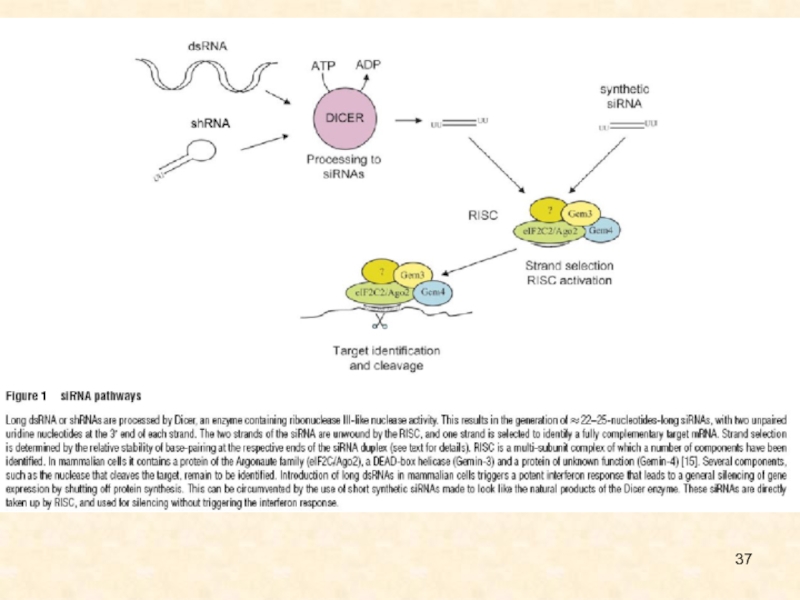
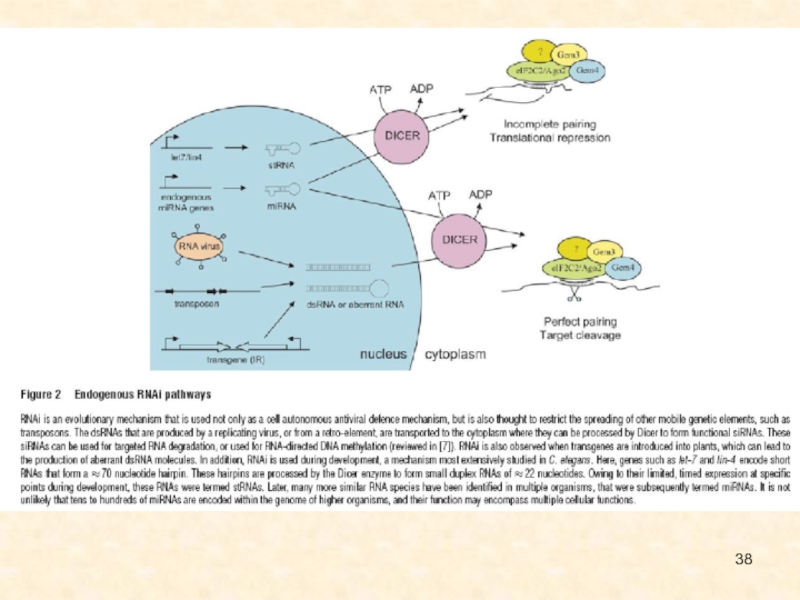
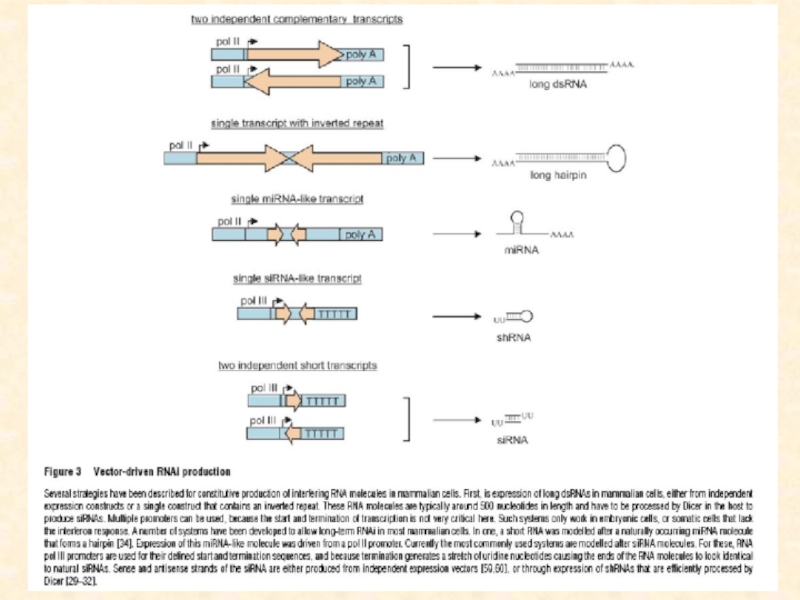
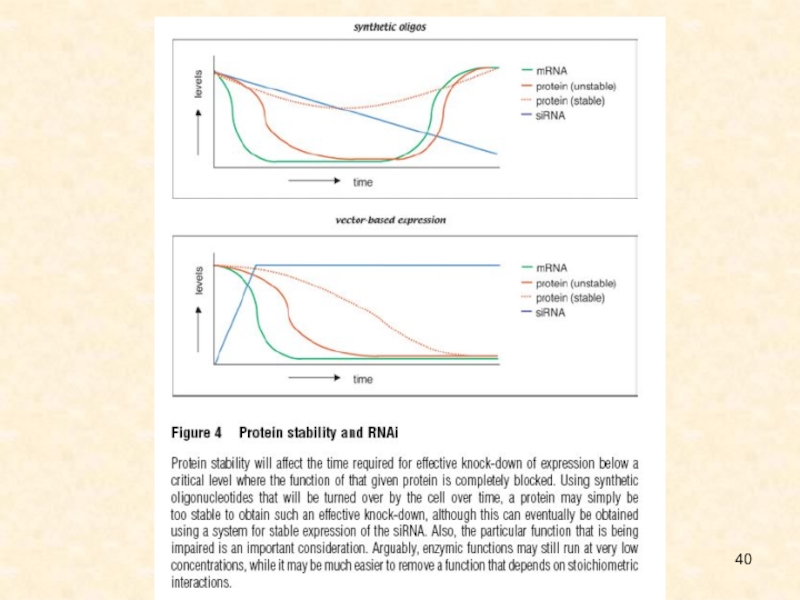
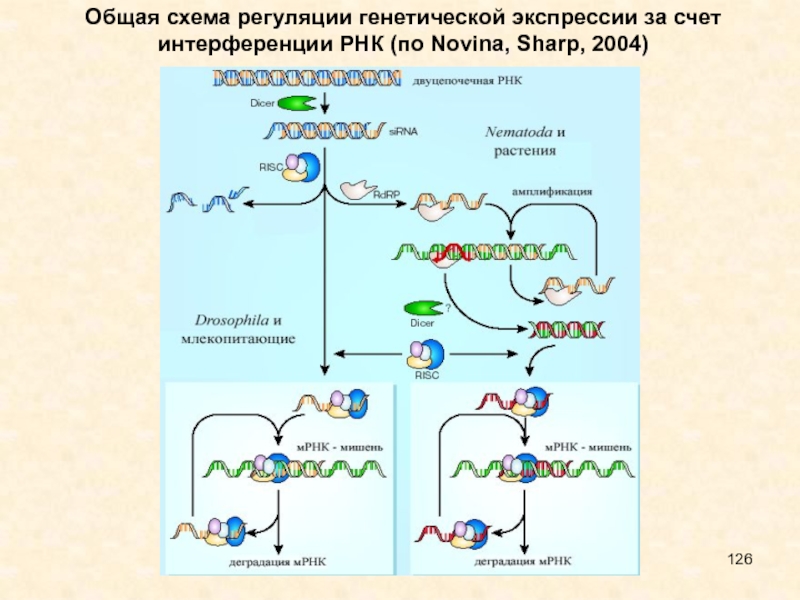
Слайд 126Общая схема регуляции генетической экспрессии за счет интерференции РНК (по
Novina, Sharp, 2004)
Слайд 127Функции siРНК
Сайленсинг мобильных генетических элементов;
Сайленсинг гетерохроматиновых повторов;
Сайленсинг генетического материала
вирусного происхождения;
Ограничение степени экспрессии гена в определенных тканях.
Слайд 128При выделение фракций коротких РНК (19-25 нуклеотидов)
из различных организмов обнаружен еще один класс малых РНК –
микроРНК.
МикроРНК (miRNAs - micro RNAs) – класс 19-25 нуклеотидных одноцепочечных РНК, закодированных в уникальных генах геномов многоклеточных организмов.
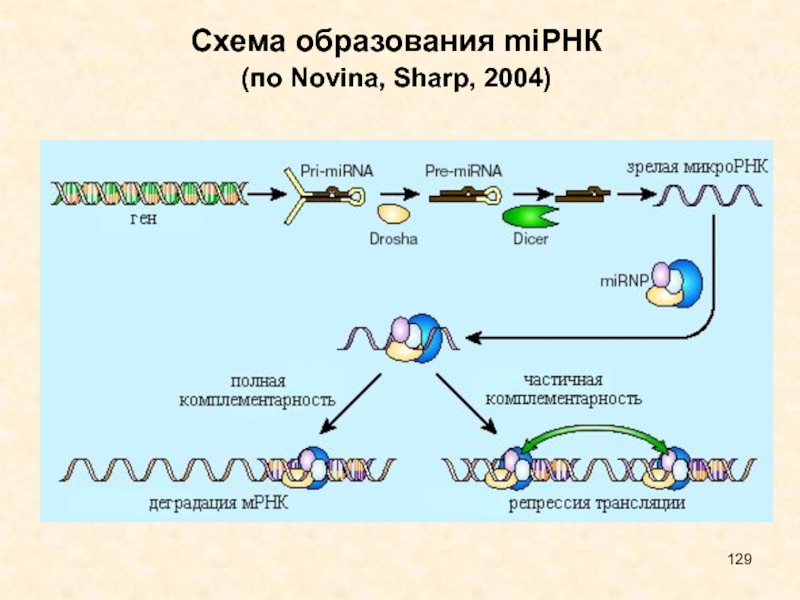
Слайд 129Схема образования miРНК
(по Novina, Sharp, 2004)
Слайд 130Функция miРНК
Обеспечивают сайленсинг различных генов, обычно, за счет частично комплементарного
связывания с мРНК, в результате которого блокируется ее трансляция.
один
тип miРНК может регулировать трансляцию мРНК более 100 различных генов;
степень ингибирования зависит от количества связывающихся miРНК (в 3’UTR мРНК содержится несколько сайтов связывания).
Слайд 131
Продукт dsРНК, закодированных в уникальных генах геномов многоклеточных организмов (>1%
от всех генов у человека);
мРНК может не разрушаться;
Один тип miРНК
регулирует разные гены.
Продукт dsРНК, образующихся в результате транскрипции транспозонов, гетерохроматиновых повторов или генетического материала вирусного происхождения ;
мРНК разрушается;
Один тип siРНК обычно регулирует только один тип мРНК.
miРНК
siРНК
Отличия miРНК и siРНК
Слайд 132 созданы библиотеки коротких РНК и ДНК-векторов, кодирующих короткие РНК,
мишенями которых является около 8000 генов генома человека;
внедряется в
практику терапевтическое применение синтетических коротких РНК для целенаправленного подавления генетической экспрессии при некоторых заболеваниях.
Слайд 133
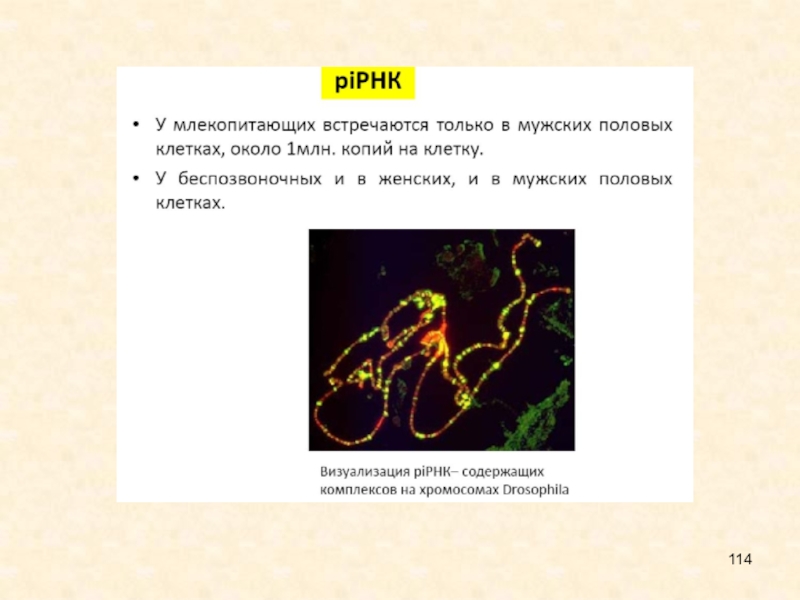
piРНК
•По предварительным оценкам, у млекопитающих сотни тысяч видов. У
мыши уже известно более 50000 уникальных последовательностей piРНК, у Drosophila
более 13000
•Кодируются в кластерах на протяжении всего генома
•У млекопитающих встречаются только в мужских половых клетках, около 1млн. копий на клетку. У беспозвоночных и в женских, и в мужских половых клетках.
Визуализация piРНК– содержащих комплексов на хромосомах Drosophila piРНК
Слайд 134
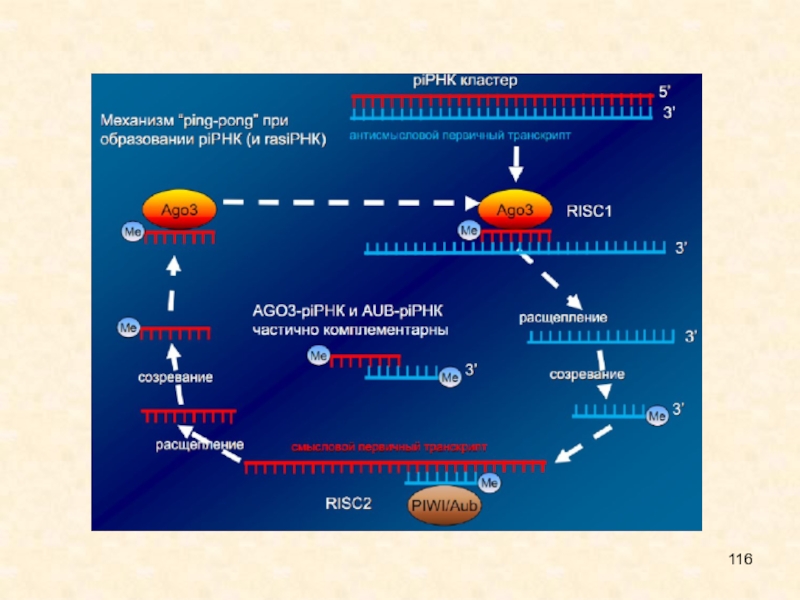
Главная функция piРНК — подавление активности мигрирующих генетических элементов.
•piРНК
активны только во время эмбриогенеза, когда непредсказуемые перетасовки генома особенно
опасны и могут привести к гибели зародыша
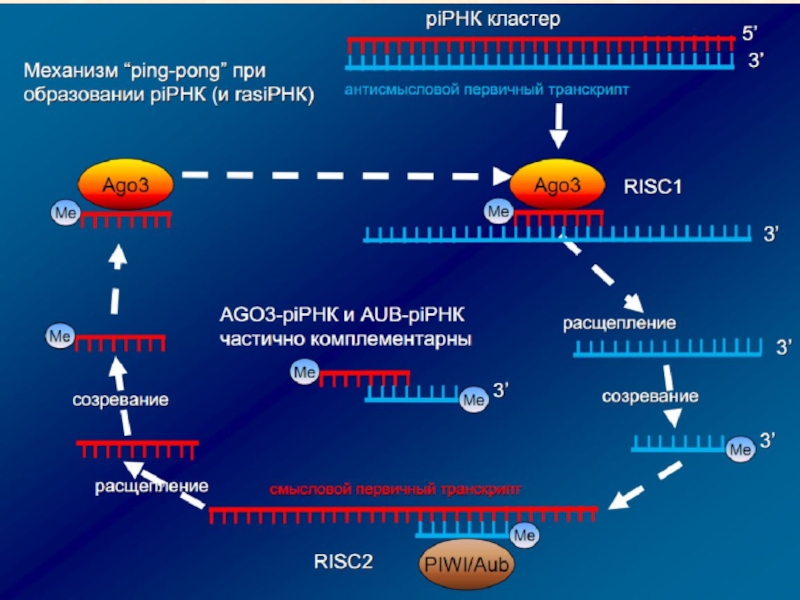
•Один из предполагаемых механизмов биогенеза –”Ping Pong” (не у всех объектов объектов):
•Первичные piРНК узнают комплементарные им мишени (транскрипты с транспозонов и других повторов) и их комплекс привлекает белки Piwi.
•Piwi расщепляет мишень в позиции 10 н. от 5’ конца первичной piРНК, образуется вторичная piРНК, которая включается в Piwi.
Слайд 135
Один из предполагаемых механизмов биогенеза –”Ping Pong” (не у всех
объектов объектов):
• Первичные piРНК узнают комплементарные им мишени (транскрипты
с транспозонов и других повторов) и их комплекс привлекает белки Piwi.
• Piwi расщепляет мишень в позиции 10 н. от 5’ конца первичной piРНК, образуется вторичная piРНК, которая включается в Piwi.
Слайд 137rasiРНК Repeat associated small interfering RNA
Одноцепочечные короткие РНК -
24- 29 нук.
•Выявлены у Drosophila и некоторых одноклеточных эукариот.
У млекопитающих до сих пор не обнаружены.
•Предполагается участие в формировании клеток зародышевого пути.
•Предполагаемый предшественник – дцРНК, образующаяся в результате транскрипции с обеих цепей повторенных элементов генома. Биогенез не требует участия Dicer, но требуется белок Ago3 (Argonaute, Piwi и Piwi- подобный белок Aub (от Aubergine –мутация у Drosophila), у растений нет Piwi белков, но есть rasiРНК, образующиеся с участием Dcl-белков.
•Мутации белков Piwi, ассоциированных с rasiРНК у Drosophila, приводят к стерильности и отсутствию формирования клеток зародышевого пути у особей обоего пола.
•Возможно, являются разновидностью piРНК
rasiРНК Repeat associated small interfering RNA
Слайд 138
Псевдогены и miRNA
• В нормальных образцах и рака простаты
найдена прямая корреляция экспрессии между PTEN и PTENP1
• Локус
PTENP1 селективно теряется при раке
•3’ UTR PTENP1 проявляет активность опухолевого супрессора
“PTEN is a functionally haploinsufficient tumour suppressor gene”.
miR-17 miR-21 miR-214 miR-19 miR-26
Слайд 139Псевдогены и miRNA
Консервативность подтвержденных сайтов связывания miRNA в генах
связанных с раком
Слайд 140
Функция вторичной структуры РНК:
Структурная Рибосомальная РНК
Ферментативная Рибозимы
Транспортная
тРНК
Регуляторная Разные РНК
Слайд 141
Антисмысловая регуляция вовлечена в различные клеточные процессы :
Транскрипция
Процессинг РНК
и транспорт
Стабильность РНК и трансляция
Геномный импринтинг и инактивация
Х хромосомы
Модификации ДНК и хроматина
Метилирование генома
Альтернативные: инициация транскрипции, сплайсинг, полиаденилирование, терминация.
РНК редактирование
РНК интерференция
Слайд 142
Парой смысловой-антисмысловой транскрипты называется пара чьи последовательности мРНК комплементарны.
Цис-антисмысловой
транскрипт экспрессируется в одном геномном локусе со смысловым транскриптом.
Транс-антисмысловой
транскрипт экспрессируется с другого геномного локуса чем смысловой транскрипт.
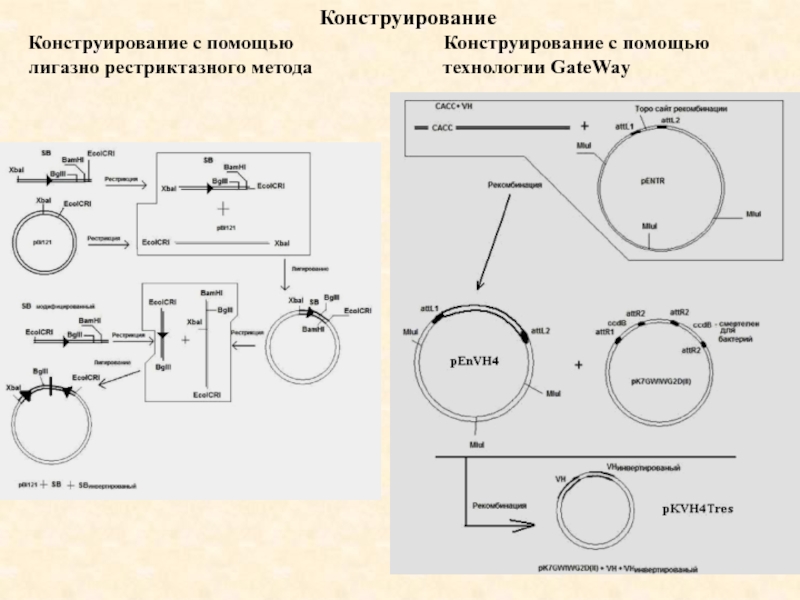
Слайд 143Конструирование
Конструирование с помощью
Конструирование с
помощью
лигазно рестриктазного метода технологии GateWay
Слайд 144Выводы
• 1) Разработаны схемы генетических конструкций кодирующих
противовирусный и противовироидный dsRNA
супрессоры.
• 2) Получены генетические конструкции:
• 3) Получены растения N.tabacum, несущие
конструкцию pBiSBJ1III.
Показано, что в клетках растений-трансформантов присутствуют
siRNA, комплементарные генетической конструкции.
pBiSBJ1III – конструкция, содержащая фрагмент кодирующий
dsRNA супрессор вирусов картофеля X, Y, S, M, вируса
погремковости табака и вируса скрученности листьев
картофеля;
pkVHtres - конструкция содержащая фрагмент кодирующий
dsRNA комплементарную участкам РНК вироида
веретеновидности клубней картофеля;
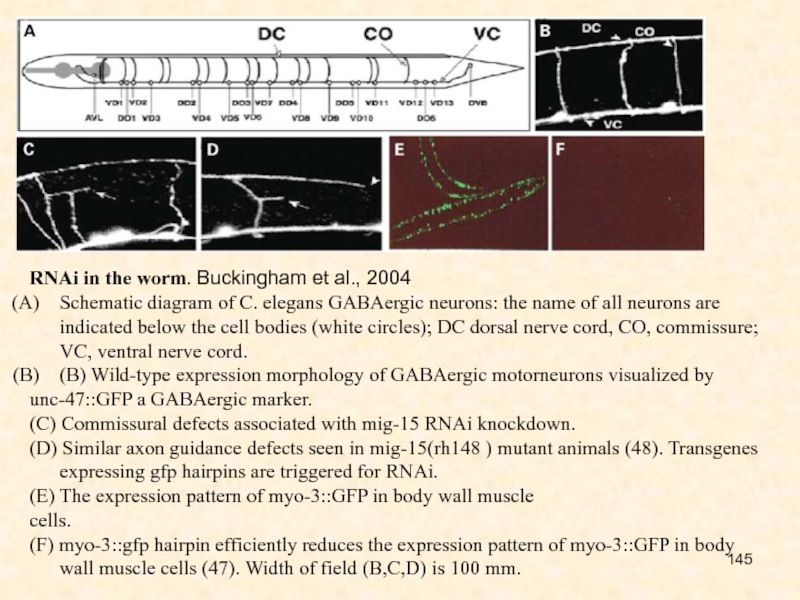
Слайд 145RNAi in the worm. Buckingham et al., 2004
Schematic diagram of
C. elegans GABAergic neurons: the name of all neurons are
indicated below the cell bodies (white circles); DC dorsal nerve cord, CO, commissure; VC, ventral nerve cord.
(B) Wild-type expression morphology of GABAergic motorneurons visualized by
unc-47::GFP a GABAergic marker.
(C) Commissural defects associated with mig-15 RNAi knockdown.
(D) Similar axon guidance defects seen in mig-15(rh148 ) mutant animals (48). Transgenes expressing gfp hairpins are triggered for RNAi.
(E) The expression pattern of myo-3::GFP in body wall muscle
cells.
(F) myo-3::gfp hairpin efficiently reduces the expression pattern of myo-3::GFP in body wall muscle cells (47). Width of field (B,C,D) is 100 mm.
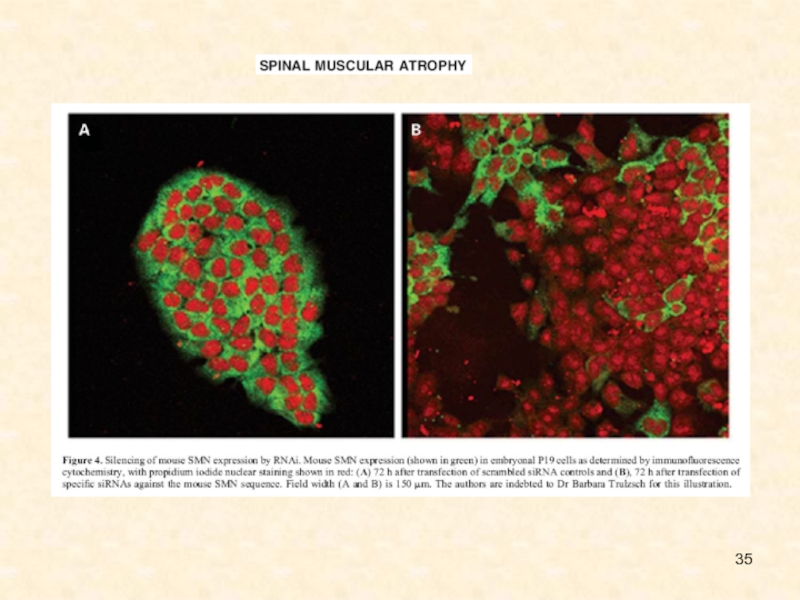
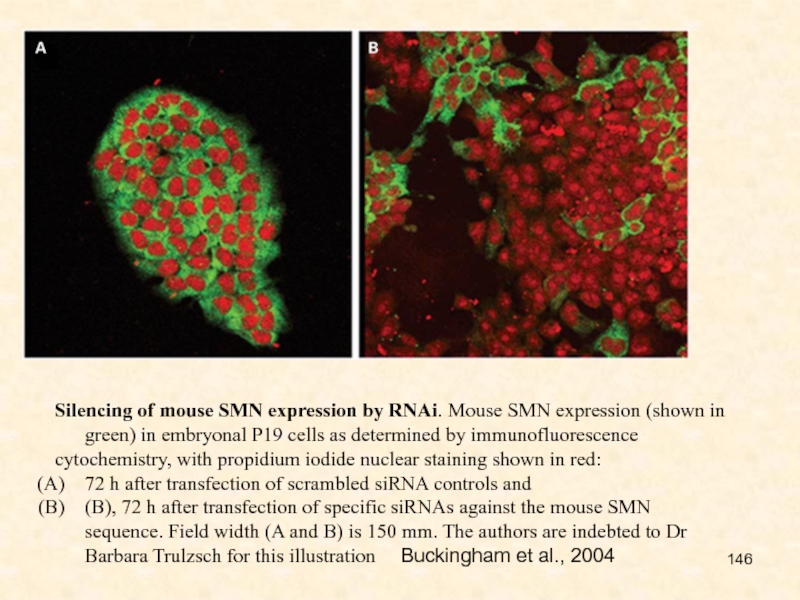
Слайд 146Silencing of mouse SMN expression by RNAi. Mouse SMN expression
(shown in green) in embryonal P19 cells as determined by
immunofluorescence
cytochemistry, with propidium iodide nuclear staining shown in red:
72 h after transfection of scrambled siRNA controls and
(B), 72 h after transfection of specific siRNAs against the mouse SMN sequence. Field width (A and B) is 150 mm. The authors are indebted to Dr Barbara Trulzsch for this illustration Buckingham et al., 2004