Слайд 2Транскрипционная активность клеток женского гаметофита
На начальном этапе в зародышевом мешке
все ядра
транскрипционно активны в равной мере.
По мере созревания женского
гаметофита транскрипционная активность яйцеклетки уменьшалась, достигая минимума в прогамной фазе.
Содержание в яйцеклетке поли(А)РНК также было исчезающе мало. Это означает, что яйцеклетка не накапливает транскрипты впрок.
Синергиды и антиподы в зрелом зародышевом мешке транскрипционно активны и мало отличаются по этому признаку от соматических клеток.
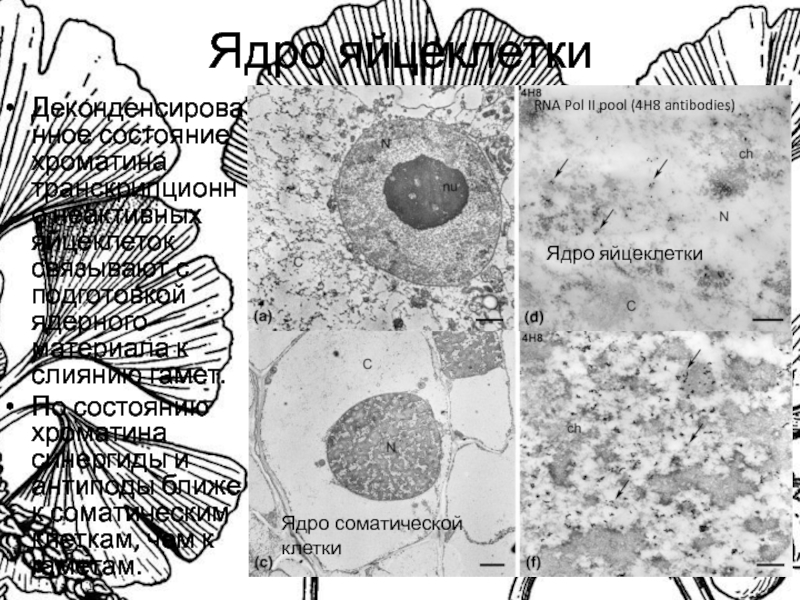
Слайд 3Ядро яйцеклетки
Деконденсированное состояние хроматина транскрипционно неактивных яйцеклеток связывают с подготовкой
ядерного материала к слиянию гамет.
По состоянию хроматина синергиды и
антиподы ближе к соматическим клеткам, чем к гаметам.
RNA Pol II pool (4H8 antibodies)
Ядро яйцеклетки
Ядро соматической клетки
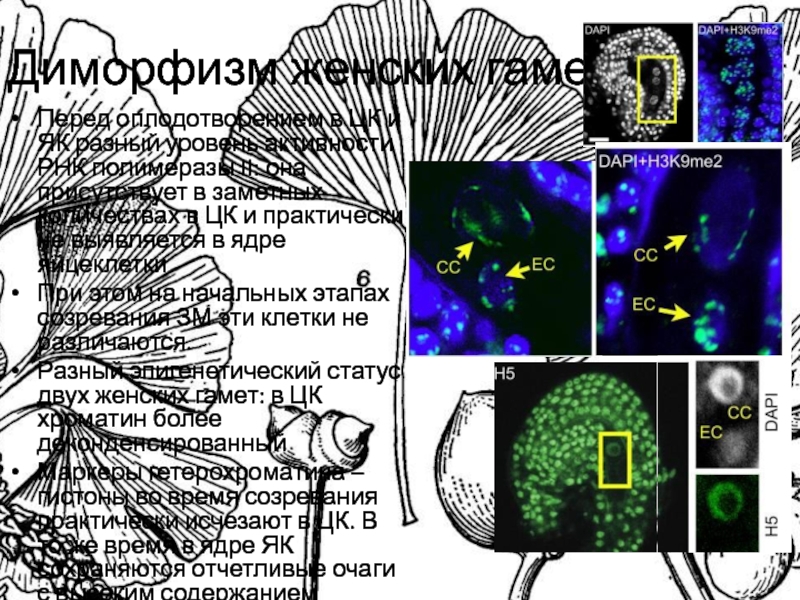
Слайд 4Диморфизм женских гамет
Перед оплодотворением в ЦК и ЯК разный уровень
активности РНК полимеразы II: она присутствует в заметных количествах в
ЦК и практически не выявляется в ядре яйцеклетки
При этом на начальных этапах созревания ЗМ эти клетки не различаются.
Разный эпигенетический статус двух женских гамет: в ЦК хроматин более деконденсированный
Маркеры гетерохроматина – гистоны во время созревания практически исчезают в ЦК. В то же время в ядре ЯК сохраняются отчетливые очаги с высоким содержанием маркеров.
Слайд 5Вспомним, что…
Структуру хроматина и его транскрипционную способность в клетках растений
и животных детерминируют процессы модификации гистонов и метилирования ДНК
В обеих
женских гаметах Arabidopsis, как и в спермиях, отсутствует большинство канонических соматических вариантов гистона H3. В ЯК выявляется только HTR5, а в ЦК – HTR3,HTR8 и HTR14.
Анализ ядра зиготы Arabidopsis показал, что вскоре после оплодотворения из хроматина удаляются отцовские и материнские варианты гистона H3.
Вслед за этим начинается синтез H3 de novo и формируется набор вариантов этого гистона, характерный для соматических клеток. Эти процессы свидетельствуют о возможном репрограммировании генома зиготы с целью ограничить передачу потомству эпигенетической информации.
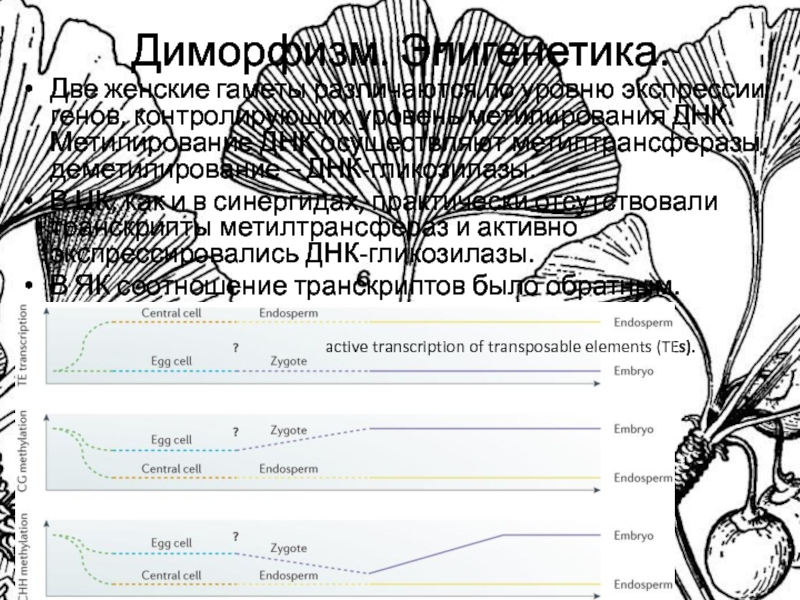
Слайд 6Диморфизм. Эпигенетика.
Две женские гаметы различаются по уровню экспрессии генов, контролирующих
уровень метилирования ДНК. Метилирование ДНК осуществляют метилтрансферазы, деметилирование – ДНК-гликозилазы.
В
ЦК, как и в синергидах, практически отсутствовали транскрипты метилтрансфераз и активно экспрессировались ДНК-гликозилазы.
В ЯК соотношение транскриптов было обратным.
active transcription of transposable elements (TEs).
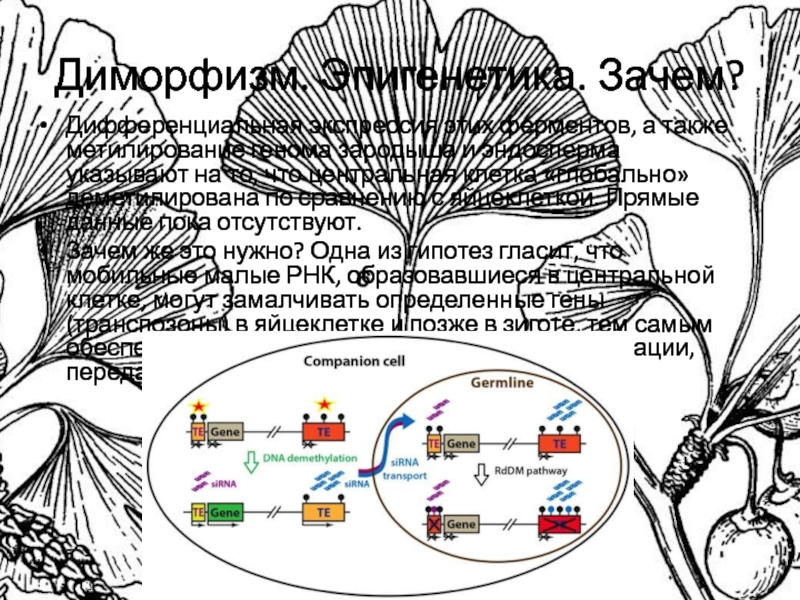
Слайд 7Диморфизм. Эпигенетика. Зачем?
Дифференциальная экспрессия этих ферментов, а также метилирование генома
зародыша и эндосперма указывают на то, что центральная клетка «глобально»
деметилирована по сравнению с яйцеклеткой. Прямые данные пока отсутствуют.
Зачем же это нужно? Одна из гипотез гласит, что мобильные малые РНК, образовавшиеся в центральной клетке, могут замалчивать определенные гены (транспозоны) в яйцеклетке и позже в зиготе, тем самым обеспечивая стабильность генетической информации, передаваемой потомству.
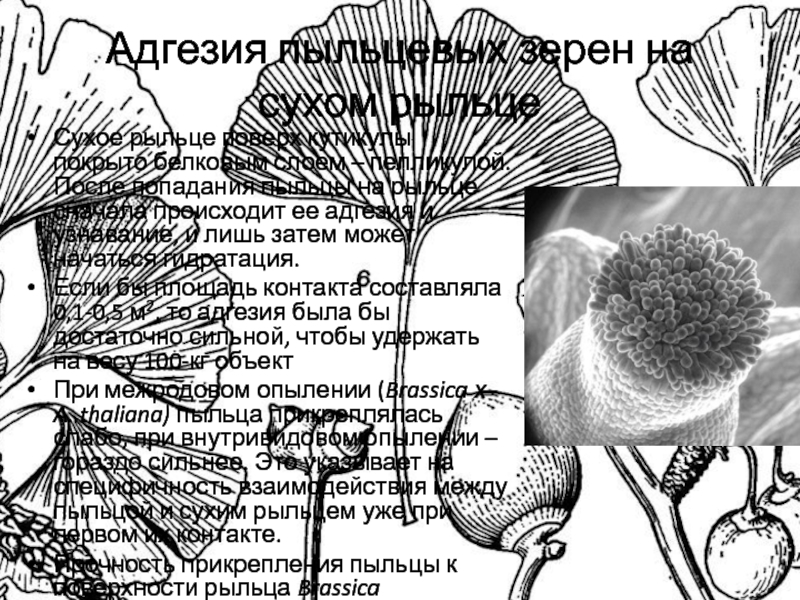
Слайд 9Адгезия пыльцевых зерен на сухом рыльце
Сухое рыльце поверх кутикулы покрыто
белковым слоем – пелликулой. После попадания пыльцы на рыльце сначала
происходит ее адгезия и узнавание, и лишь затем может начаться гидратация.
Если бы площадь контакта составляла 0,1-0,5 м2, то адгезия была бы достаточно сильной, чтобы удержать на весу 100-кг объект
При межродовом опылении (Brassica х A. thaliana) пыльца прикреплялась слабо, при внутривидовом опылении – гораздо сильнее. Это указывает на специфичность взаимодействия между пыльцой и сухим рыльцем уже при первом их контакте.
Прочность прикрепления пыльцы к поверхности рыльца Brassica постепенно возрастала, достигая максимума примерно через 30 мин
Слайд 10На первом этапе - экзина
Экзина является одним из главных факторов,
влияющих на прикрепление пыльцы Arabidopsis к рыльцу
Выделенная экзина не теряет
способности прикрепляться
Мутанты с дефектной экзиной не могут прикрепляться
Постепенное усиление взаимодействия между пыльцевым зерном и папиллой рыльца требует участия поверхностных белков и липидов обеих сторон.
Со стороны пыльцевого зерна – это компоненты трифины, со стороны рыльца – белки пелликулы.
Слайд 11Основание… foot
Белки и липиды трифины и пелликулы объединяются и образуют
зону контакта – «основание» (foot), на котором развиваются процессы узнавания
и, в случае совместимого опыления, происходит гидратация пыльцевого зерна.
В ходе этого процесса папиллярная клетка активно транспортирует через зону контакта не только воду, но и кальций, бор и другие необходимые для запуска активации компоненты.
Less adherent pollen
Слайд 12На втором этапе - трифина
Ключевая роль липидов в гидратации пыльцы
Arabidopsis была показана в экспериментах с мутантами eceriferum (cer), у
которых нарушен синтез длинноцепочечных липидов и практически отсутствует трифина; такая пыльца стерильна.
Этот дефект был полностью компенсирован, если опыление происходило при высокой влажности или после добавления на рыльце очищенных триглицеридов.
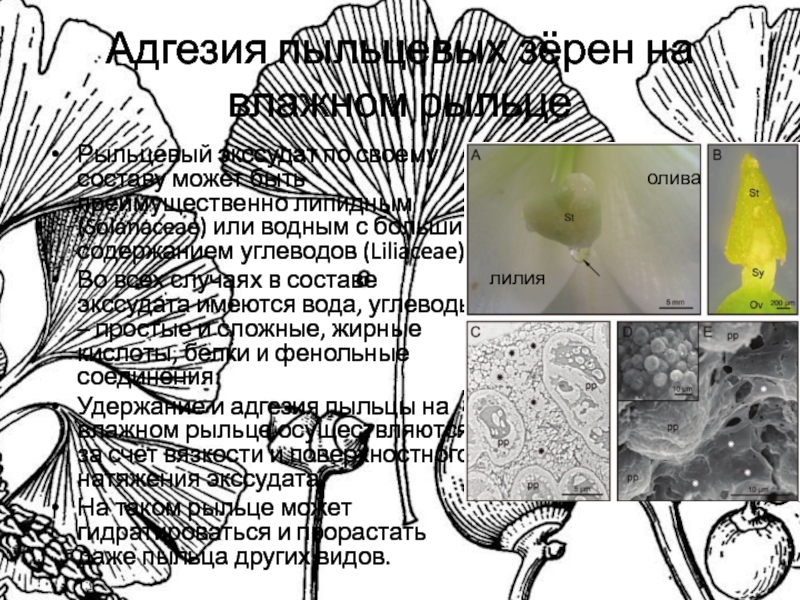
Слайд 13Адгезия пыльцевых зёрен на влажном рыльце
Рыльцевый экссудат по своему составу
может быть преимущественно липидным (Solanaceae) или водным с большим содержанием
углеводов (Liliaceae).
Во всех случаях в составе экссудата имеются вода, углеводы – простые и сложные, жирные кислоты, белки и фенольные соединения.
Удержание и адгезия пыльцы на влажном рыльце осуществляются за счет вязкости и поверхностного натяжения экссудата.
На таком рыльце может гидратироваться и прорастать даже пыльца других видов.
лилия
олива
Слайд 14Ana Maria Sanchez et al. Plant Cell 2004;16:S98-S106
©2004 by American
Society of Plant Biologists
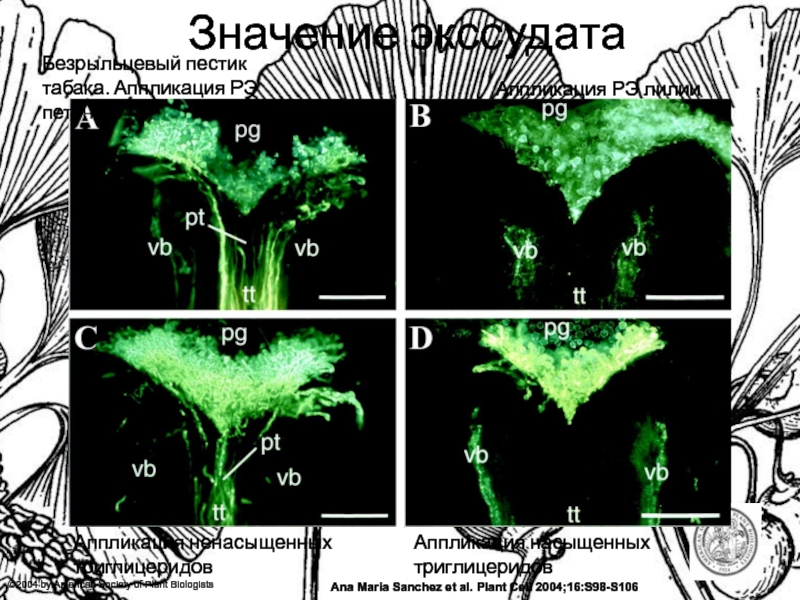
Значение экссудата
Безрыльцевый пестик табака. Аппликация РЭ петунии
Аппликация
РЭ лилии
Аппликация ненасыщенных триглицеридов
Аппликация насыщенных триглицеридов
Слайд 15Ещё про экссудат
Экссудат синтезируется и секретируется специализированными секреторными клетками поверхности
рыльца.
Он может скапливаться на рыльце в кратере, как у некоторых
бобовых, или располагаться на поверхности купола, как у лилии.
Экссудат у Solanaceae двухфазный: гидрофобная фаза (верхний слой) обогащена липидами, а под ней располагается гидрофильная фаза – очень тонкий водный слой. Пыльцевое зерно проваливается сквозь верхний слой и устанавливает непосредственный контакт с клетками рыльца.
Слайд 16Белки экссудата
Белки экссудата проявляют заметную катаболическую способность.
метаболизм
энергетика
защита
Слайд 17Белки экссудата
Самую крупную группу белков в экссудате лилии составляют O-гликозилгидролазы.
Их мишенью могут быть арабиногалактановые белки и пектины – главные
компоненты экссудата. Это позволяет говорить о важной роли полисахаридного катаболизма в снабжении прорастающей пыльцы питательными веществами.
Вторую группу гидролаз составляют протеолитические ферменты, которые могут участвовать в процессах адгезии и узнавания пыльцы на рыльце.
Третью группу гидролаз образуют липазы, которые могут участвовать в гидратации пыльцы, модифицируя состав липидов на границе трифины пыльцевого зерна и рыльцевого экссудата.
В экссудате обнаружены также хорошо известные компоненты сигнальных систем – рецептор-подобные киназы (лилия и олива) и 14-3-3- белок (олива).
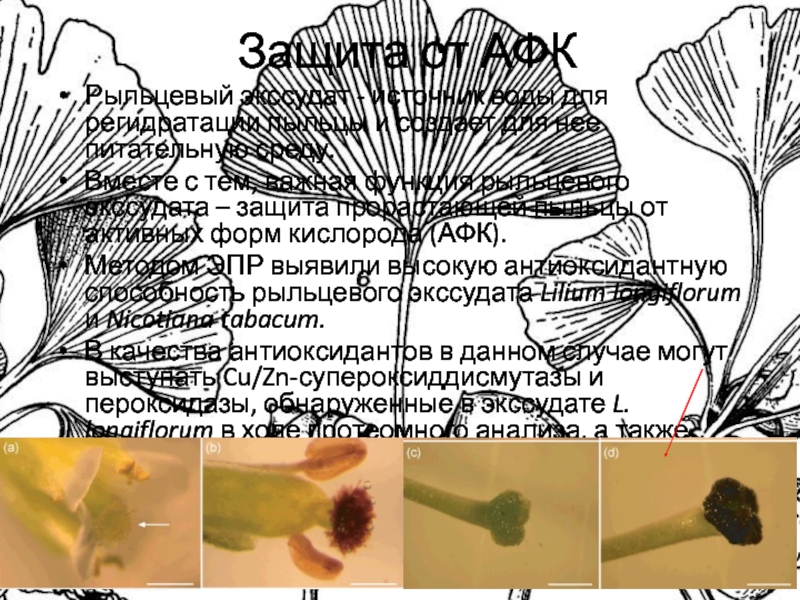
Слайд 18Защита от АФК
Рыльцевый экссудат - источник воды для регидратации пыльцы
и создает для нее питательную среду.
Вместе с тем, важная
функция рыльцевого экссудата – защита прорастающей пыльцы от активных форм кислорода (АФК).
Методом ЭПР выявили высокую антиоксидантную способность рыльцевого экссудата Lilium longiflorum и Nicotiana tabacum.
В качества антиоксидантов в данном случае могут выступать Cu/Zn-супероксиддисмутазы и пероксидазы, обнаруженные в экссудате L. longiflorum в ходе протеомного анализа, а также фенольные соединения.
Слайд 19Женский контроль
Прорастание пыльцы на рыльце пестика и рост пыльцевой трубки
in vivo контролируется клетками спорофита и женского гаметофита.
Они могут
способствовать движению гамет к яйцеклетке или, наоборот, препятствовать этому, предотвращая полиспермию или прорастание несовместимой пыльцы.
В конечном итоге выбор – за женщиной… точнее, за женским гаметофитом.
Слайд 20Как наблюдать прорастание in vivo?
Раньше – на скучных срезах фиксированных
препаратов.
Теперь – с помощью интравитальной двухфотонной микроскопии.
За счет
длинноволнового возбуждения флуорофоров в двухфотонной микроскопии обеспечивается глубокое проникновение лазерного луча в толщу тканей и высокое разрешение глубинных оптических срезов, недоступное традиционным методам.
Alice Y. Cheung et al. J. Exp. Bot. 2010;61:1907-1915
Слайд 21Alice Y. Cheung et al. J. Exp. Bot. 2010;61:1907-1915
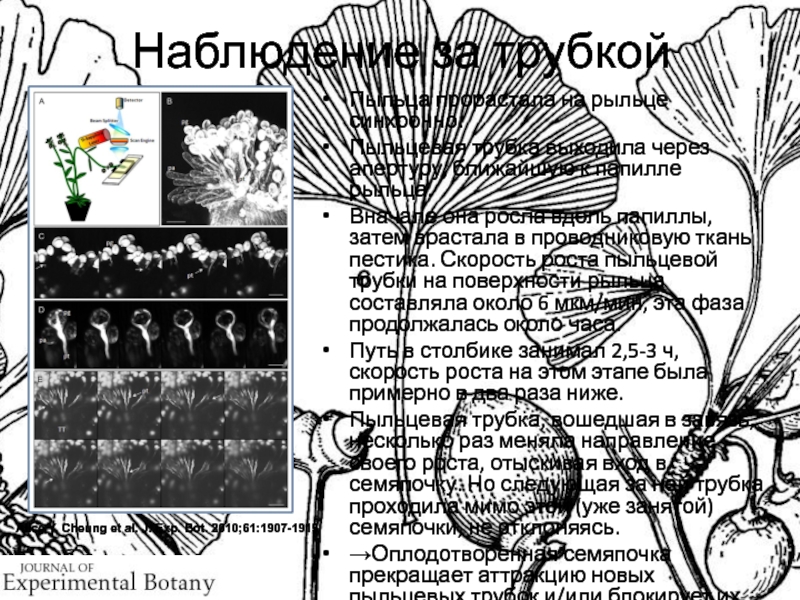
Наблюдение за
трубкой
Пыльца прорастала на рыльце синхронно.
Пыльцевая трубка выходила через апертуру,
ближайшую к папилле рыльца.
Вначале она росла вдоль папиллы, затем врастала в проводниковую ткань пестика. Скорость роста пыльцевой трубки на поверхности рыльца составляла около 6 мкм/мин, эта фаза продолжалась около часа.
Путь в столбике занимал 2,5-3 ч, скорость роста на этом этапе была примерно в два раза ниже.
Пыльцевая трубка, вошедшая в завязь, несколько раз меняла направление своего роста, отыскивая вход в семяпочку. Но следующая за ней трубка проходила мимо этой (уже занятой) семяпочки, не отклоняясь.
→Оплодотворенная семяпочка прекращает аттракцию новых пыльцевых трубок и/или блокирует их приближение.
Слайд 22Вспоминаем: пектины важны для механики…
Важную роль в регуляции прорастания пыльцы
и роста пыльцевой трубки играет модификация пектинов. Гомогалактуронаны синтезируются в
аппарате Гольджи и поступают в клеточную стенку в высокометилированной форме. Здесь может происходить их деэтерификация с помощью пектинметилэстераз.
При этом открываются карбоксильные группы, способные связывать Ca2+. Он сшивает соседние молекулы, образуя пектатный гель. Тем самым снижается пластичность клеточной стенки, она становится более жесткой.
Слайд 23Но не только…
Модификация пектинов нужна не только для изменения механических
свойств клеточной стенки.
У покрытосеменных растений низкоэтерифицированные пектины участвуют в
процессе адгезии пыльцевой трубки к проводниковой ткани столбика!
Слайд 24Что нужно, чтобы приклеиться?
Компоненты внеклеточного матрикса, извлеченного из столбика, наносили
на нитроцеллюлозную мембрану. Когда такую мембрану помещали в чашку с
суспензией проросшей пыльцы, пыльцевые трубки, прилипшие к поверхности мембраны, ускоряли свой рост.
Адгезивные свойства внеклеточного матрикса в этих условиях проявлялись при наличии двух компонентов: пектина и небольшого (9 кДа) цистеин-богатого белка адгезина (SCA, Stigma/stylar Cysteine-rich Adhesion).
Этот белок связывается, с одной стороны, с пектином матрикса, а, с другой стороны – с неизвестным партнером в стенке трубки (возможно, это также пектин).
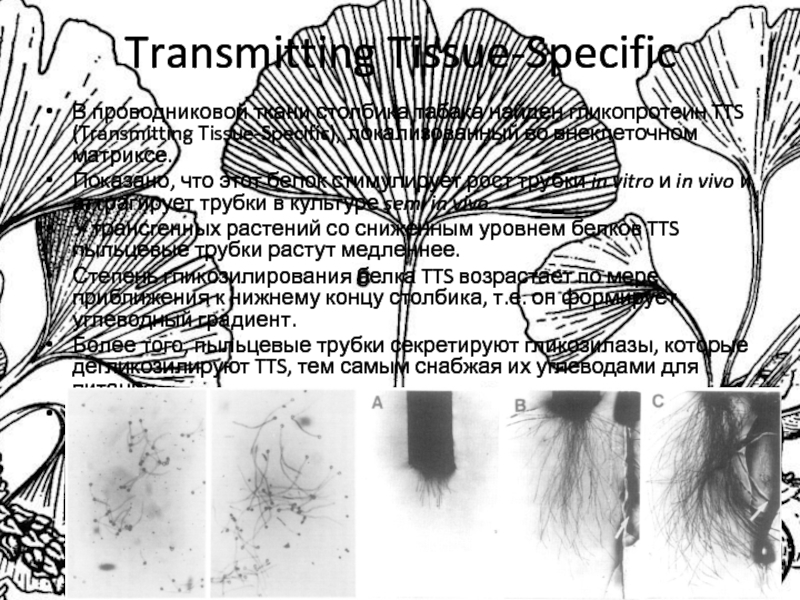
Слайд 25Transmitting Tissue-Specific
В проводниковой ткани столбика табака найден гликопротеин TTS (Transmitting
Tissue-Specific), локализованный во внеклеточном матриксе.
Показано, что этот белок стимулирует рост
трубки in vitro и in vivo и аттрагирует трубки в культуре semi in vivo.
У трансгенных растений со сниженным уровнем белков TTS пыльцевые трубки растут медленнее.
Степень гликозилирования белка TTS возрастает по мере приближения к нижнему концу столбика, т.е. он формирует углеводный градиент.
Более того, пыльцевые трубки секретируют гликозилазы, которые дегликозилируют TTS, тем самым снабжая их углеводами для питания
TTS – арабиногалактановый белок.
Слайд 26Распределение АГБ (промоторный анализ с GFP и GUS)
Описана картина дифференциальной
экспрессии ряда арабиногалактановых белков на всем пути следования пыльцевой трубки.
AGP1 экспрессируется в проводниковой ткани столбика, а
AGP15 – во всех тканях столбика, кроме проводниковой.
AGP23 приурочен к мужскому гаметофиту.
Слайд 27Сигнал или еда?
Белки внеклеточного матрикса служат в качестве аттрагирующего, адгезивного
и/или питательного субстрата для растущей пыльцевой трубки.
Проводниковая ткань пестика обеспечивает
питание пыльцевой трубки и контролирует скорость и направление ее роста.
Более того, рост в окружении тканей пестика может изменять физиологию пыльцевой трубки.
Локализация транскриптов показана методом FISH-гибридизации (Pereira et al., 2015)
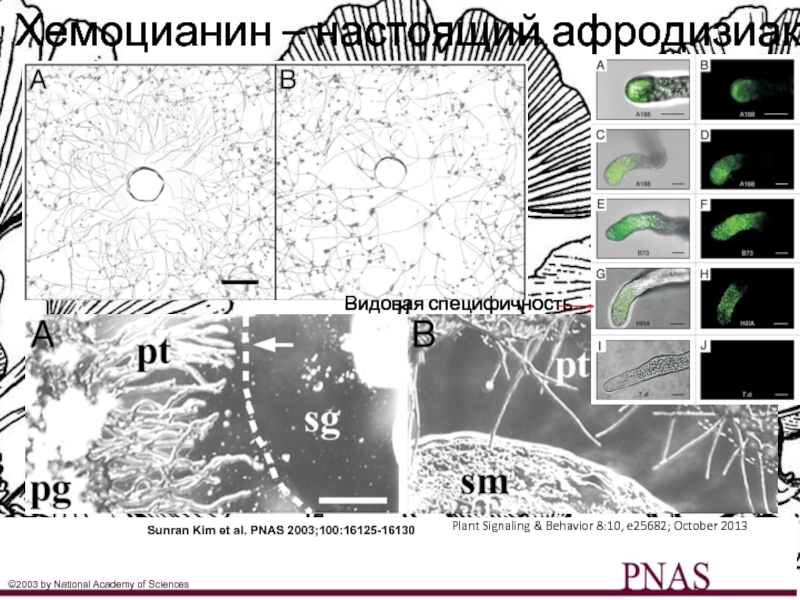
Слайд 28Sunran Kim et al. PNAS 2003;100:16125-16130
©2003 by National Academy of
Sciences
Хемоцианин – настоящий афродизиак
Plant Signaling & Behavior 8:10, e25682; October
2013
Видовая специфичность
Слайд 29«Приручение» мужского гаметофита
Трубка Torenia fournieri во время роста в столбике
приобретала способность реагировать на поздние аттрактанты: трубки, растущие in vitro,
становились компетентными к действию аттрактантов лишь после того, как они прорастали сквозь экспланты пестика.
Таким образом, контактируя с проводниковой тканью, пыльцевая трубка научилась узнавать сигналы, подаваемые женским гаметофитом.
Растущая пыльцевая трубка, в свою очередь, выделяет вещества, модулирующие внеклеточный матрикс, например, полигалактуроназы и ингибиторы пектинметилэстераз.
Слайд 30После опыления пестик тоже меняется
Опыление индуцирует в пестике разнообразные процессы,
затрагивающие как ткани спорофита, так и женский гаметофит.
Подготовка встречи
гамет и оплодотворения
Запуск старения органов цветка (накопление этилена)
Опыление активирует экспрессию генов АЦК-синтазы и АЦК-оксидазы, контролирующих биосинтез этилена
Слайд 31Для чего нужен этилен в пестике?
У орхидных мРНК АЦК-оксидазы накапливается
во всех клетках пестика, у табака и петунии – преимущественно
в проводниковой ткани.
Пока не похоже, что этот гормон необходим для оплодотворения. Ингибирование синтеза или действия этилена не влияет на рост пыльцевых трубок табака. Нечувствительные к этилену мутанты Arabidopsis и табака сохраняют фертильность.
Как полагают, накопление этилена должно подготовить развитие плодов и семян.
Мутанты по восприятию этиленового сигнала демонстрируют временной сдвиг запуска старения пестика.
Нет этилена
Конст. ответ на этилен
Слайд 32Потенциал действия в пестике?!
Природа сигналов, опосредующих влияние мужского гаметофита на
состояние тканей и клеток пестика, может быть как химической, так
и электрической.
Опыление индуцировало серию из 10-15 потенциалов действия, которые стимулировали временную активацию дыхания завязи.
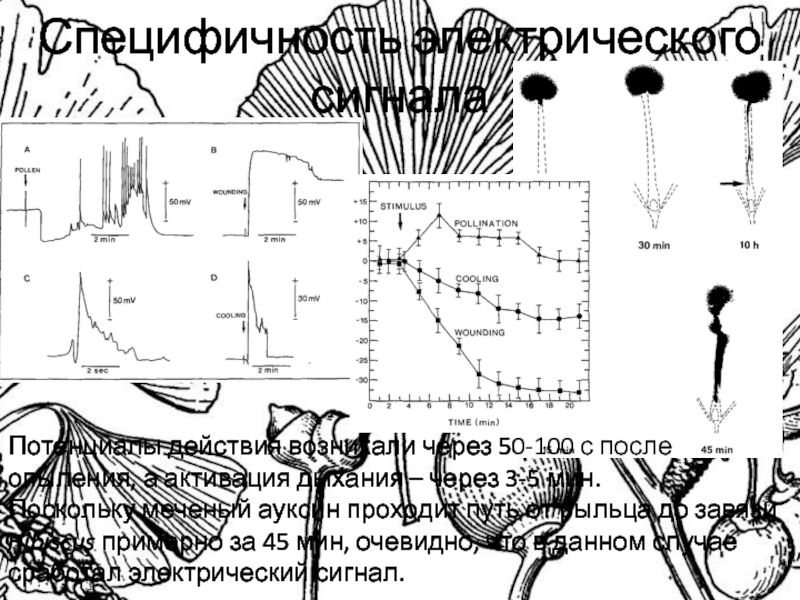
Слайд 33Специфичность электрического сигнала
Потенциалы действия возникали через 50-100 с после опыления,
а активация дыхания – через 3-5 мин.
Поскольку меченый ауксин
проходит путь от рыльца до завязи Hibiscus примерно за 45 мин, очевидно, что в данном случае сработал электрический сигнал.
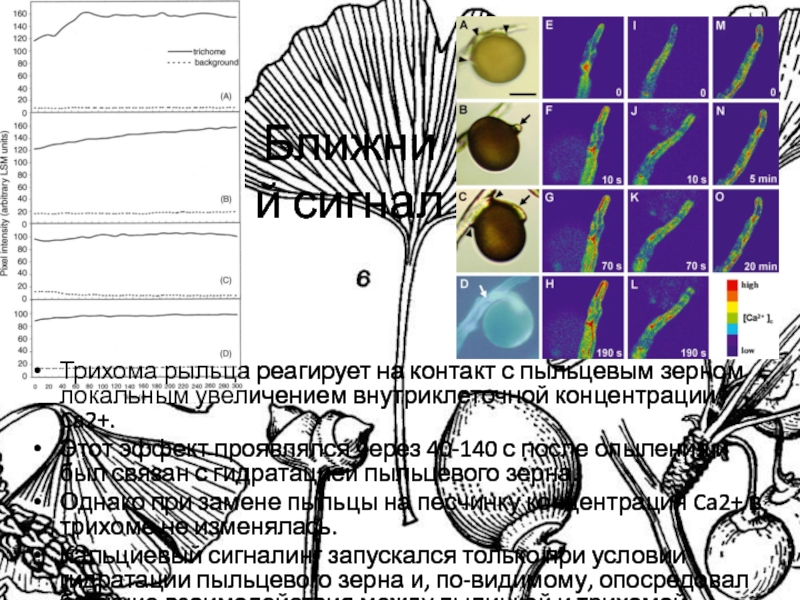
Слайд 34Ближний сигнал
Трихома рыльца реагирует на контакт с пыльцевым зерном локальным
увеличением внутриклеточной концентрации Ca2+.
Этот эффект проявлялся через 40-140 с
после опыления и был связан с гидратацией пыльцевого зерна.
Однако при замене пыльцы на песчинку концентрация Ca2+ в трихоме не изменялась.
Кальциевый сигналинг запускался только при условии гидратации пыльцевого зерна и, по-видимому, опосредовал ближние взаимодействия между пылинкой и трихомой.
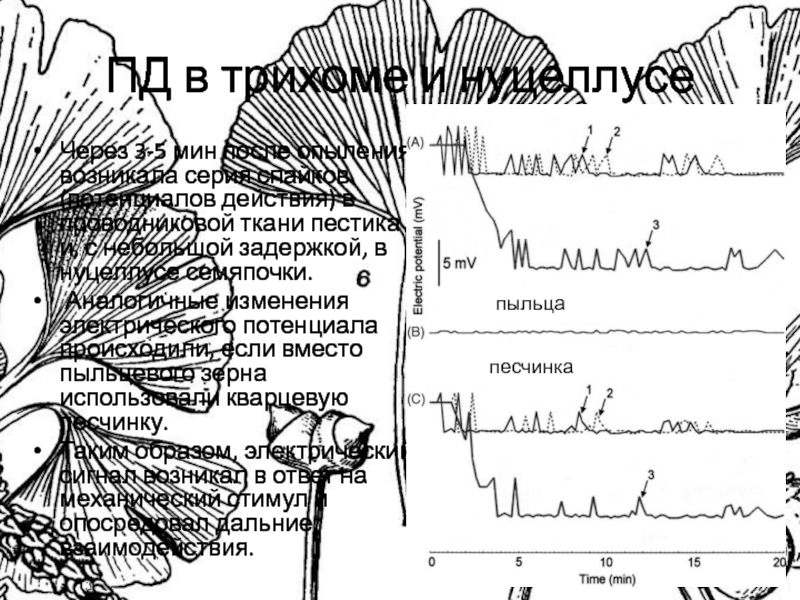
Слайд 35ПД в трихоме и нуцеллусе
Через 3-5 мин после опыления возникала
серия спайков (потенциалов действия) в проводниковой ткани пестика и, с
небольшой задержкой, в нуцеллусе семяпочки.
Аналогичные изменения электрического потенциала происходили, если вместо пыльцевого зерна использовали кварцевую песчинку.
Таким образом, электрический сигнал возникал в ответ на механический стимул и опосредовал дальние взаимодействия.
пыльца
песчинка