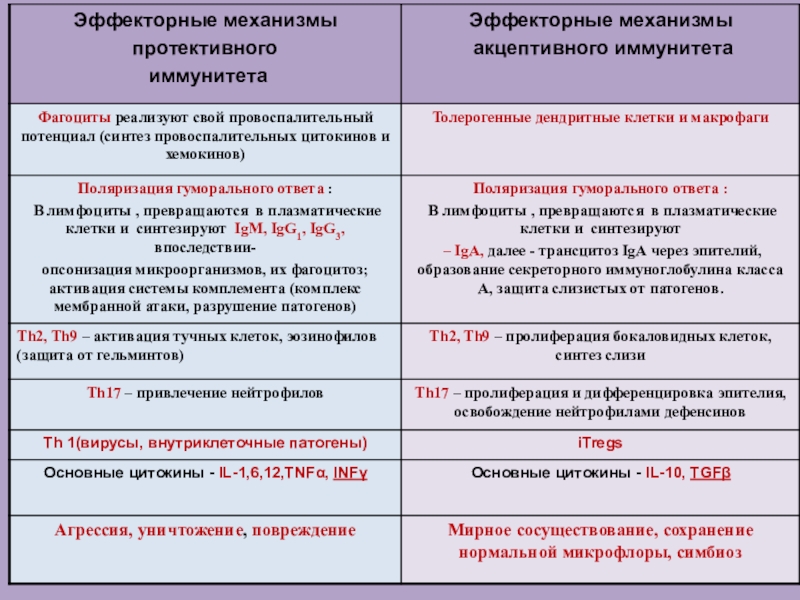
Слайд 2Компартменты иммунной системы
Иммунная система расположена повсеместно в организме и решает
основную задачу – поддержание антигенного постоянства макроорганизма на протяжении всей
его жизни.
В составе иммунной системы выделяют ряд различных анатомических компартментов, каждый из которых специально адаптирован для осуществления иммунного ответа на конкретные антигены, наиболее часто встречающиеся в данном компартменте.
Общими компартметами, в которых развивается иммунный ответ на проникающие в ткани организма или в кровь антигены, является система лимфатических узлов и селезенка.
Другим не менее важными компартментом является иммунная система, ассоциированная со слизистыми оболочками (MALT), в которой развивается иммунный ответ на большое число антигенов, преимущественно проникающих в организма через эти барьерные ткани.
Слайд 3Компартменты иммунной системы
Третьим – не менее важным компартментом - является
иммунная система, асоциированная с кожей (SALT, skin associated lymphoid tissue),
отвечающая на антигены, проникающие через эту барьерную ткань.
Четвертым компартменом иммунной системы являются полости тела –перитонеальная и плевральная.
Механизмы иммунной защиты во всех перечисленных компартментах имеют как общие закономерности, так и отличительные особенности.
В каждом компартменте развиваются иммунные ответы, которые осуществляются лимфоцитами, рециркулирующими именно в эти компартменты с помощью механизма взаимодействия молекул хоминга на лимфоцитах и адрессинов конкретной ткани.
Слайд 4Компартменты иммунной системы и феномен хоминга лимфоцитов
Градиент хемокинов и экспрессия
хемокиновых рецепторов –важный механизм передвижения клеток в различные компартменты иммунной
системы.
Отмена экспрессии рецепторов хемокинов –важный этап в создании резидентных популяций клеток.
Феномен хомминга: лимфоциты всегда возвращаются в те компартменты, где они были активированы антигеном, с помощью экспрессии рецепторов хоминга , которые связываются с лигандами, называемыми аддресинами.
Аддресины являются специфическими молекулами для каждого компартмента.
Экспрессия на поверхности лимфоцитов молекул хоминга - специфических адгезивных молекул, позволяет им рециркулировать предпочтительно обратно в ткани, в которых они были впервые активированы:
молекулы CCR7, L-селектин, CXCR+, CCR-5, α4β7/CCR9 обеспечивают хоминг в кишку;
взаимодействие молекул CLA/CCR4(где CLA - кожный лимфоцитарный антиген) – обеспечивает хоминг в кожу.
Слайд 5
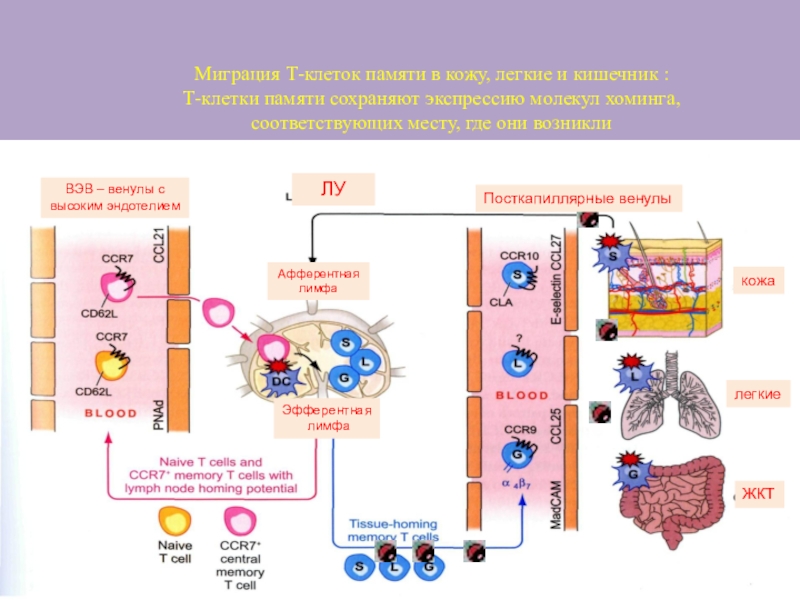
Миграция Т-клеток памяти в кожу, легкие и кишечник :
Т-клетки
памяти сохраняют экспрессию молекул хоминга,
соответствующих месту, где они возникли
ВЭВ
– венулы с
высоким эндотелием
ЛУ
Посткапиллярные венулы
кожа
легкие
ЖКТ
Афферентная
лимфа
Эфферентная
лимфа
Слайд 6Пример концепции компартментализации иммунной системы
Иммунная система слизистых оболочек
Основана на лимфоидной
ткани, связанной со слизистыми оболочками (MALT), включающей лимфоидные ткани кишечника
(GALT), бронхов (BALT) и носоглотки (NALT), а также молочной, слюнных, слезных желез и мочеполовых органов.
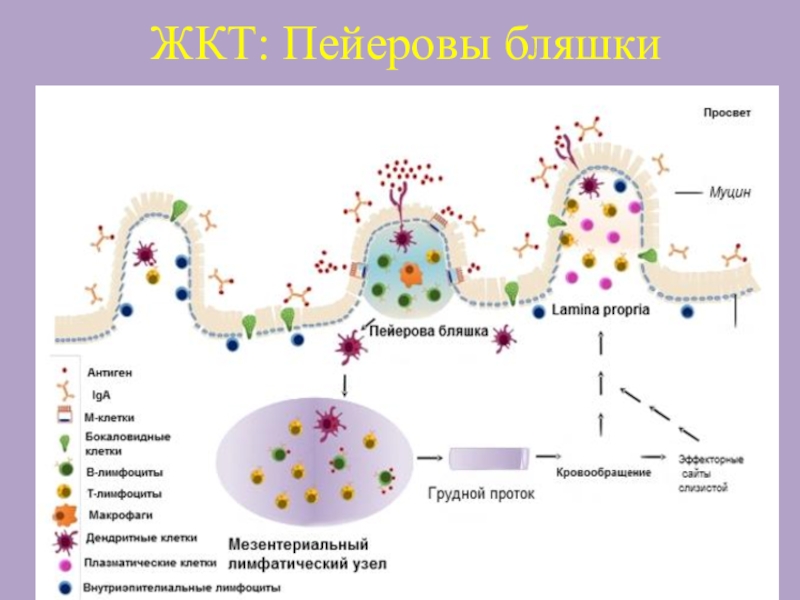
Лучше всего изучена система GALT, которая представлена организованными лимфоидными образованиями, включающими Пейеровы бляшки, аппендикс, мезентериальные лимфоузлы и солитарные лимфоузлы.
Пейеровы бляшки содержат зародышевые центры, представленные преимущественно В-клетками, превращающимися в плазматические клетки, продуцирующие IgA, и зоны, содержащие преимущественно Т-клетки.
Слайд 7Иммунная система слизистых
В отличие от других компартментов слизистые оболочки являются
излюбленным местом входа инфекционных агентов в организм.
Это связано с
их морфологическими особенностями:
слизитые оболочки являются тонкими и проницаемыми барьерами, поскольку они осуществляют такие физиологические функции, как:
газообмен (легкие),
абсорбция пищи (кишка),
сенсорные функции (глаза, нос, рот, глотка),
репродуктивные функции (половая система).
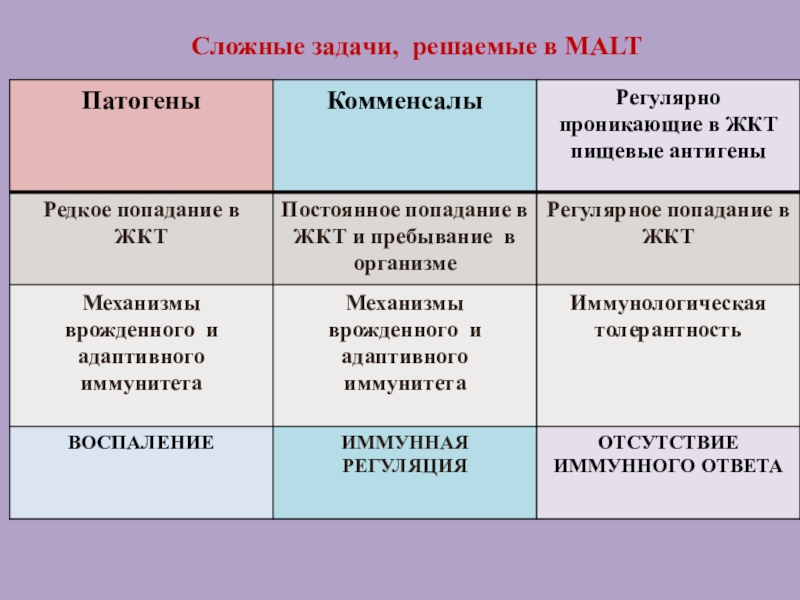
Слайд 8Особенности слизистых оболочек
Слизистая оболочка желудочно -кишечного тракта (ЖКТ) постоянно подвергается
воздействию антигенов пищи. Перед иммунной системой , ассоциированной с ЖКТ,
стоят сложные задачи:
не развивать иммунные ответы на пищевые антигены,
распознавать и элиминировать патогенные бактерии, проникающие в ЖКТ.
Все слизистые оболочки имеют симбиотические отношения с бактериями- комменсалами.
Задача иммунной системы, ассоциированной со слизистыми: не развивать иммунный ответ на бактерии, которые приносят пользу макроорганизму, несмотря на то, что эти бактерии являются носителями генетически чужеродной информации.
Слайд 9И.И.Мечников
«Обильная и разнообразная микрофлора кишечника такой же орган, как печень
и сердце. Она требует тщательной и подробной разработки, так как
в ней могут существовать полезные, вредные и безразличные бактерии»
И.И Мечников
1907 год
В 1907 г. И.И. Мечников писал о том, что многочисленные ассоциации микробов, населяющих кишечник человека, в значительной мере определяют его духовное и физическое здоровье. И. И. Мечников доказал, что кожа и слизистые человека покрыты в виде перчатки биопленкой, состоящей из сотен видов микробов.
Слайд 10Иммунная система, ассоциированная со слизистой ЖКТ
Иммунная система, ассоциированная со
слизистой желудочно-кишечного тракта, называется
GALT –gut-associated lymphoid tissue:
Окологлоточное кольцо.
Пейеровы бляшки
в тонкой кишке.
Аппендикс.
Единичные фолликулы в толстой кишке.
Слайд 12Специализированные М – клетки (Microfold cells)
М-клетки формируют «поверхностный слой иммунной
системы», ассоциированной со слизистой в пределах Пейеровой бляшки.
М-клетки расположены в
эпителиальной выстилке кишечника.
Число М-клеток намного меньше, чем энтероцитов.
М-клетки не способны к синтезу слизи, имеют тонкий поверхностный гликокаликс, это позволяет им прямо контактировать с антигенами в просвете кишки.
М-клетки способны к эндоцитозу и фагоцитозу антигенов из просвета кишки.
После эндоцитоза/фагоцитоза антигенный материал в специальных везикулах транспортируется к базальной поверхности М – клетки.
Этот процесс называется ТРАНСЦИТОЗ.
Слайд 13Специализированные М – клетки
(Microfold cells)
Трансцитоз антигена в везикулах к
базальной поверхности М-клетки заканчивается экзоцитозом антигенного материала из М-клетки в
подслизистом слое.
В пределах Пейеровой бляшки у базальной поверхности всех М-клеток присутствуют лимфоциты и антигенпрезентирующие клетки (АПК).
Антигенпрезентирующие дендритные клетки эндоцитируют антиген, освобождаемый из М-клеток.
Дендритные клетки осуществляют процессинг антигена, захваченного из просвета кишки М-клетками, после этого презентируют антигенные фрагменты в молекулах MHC лимфоцитам.
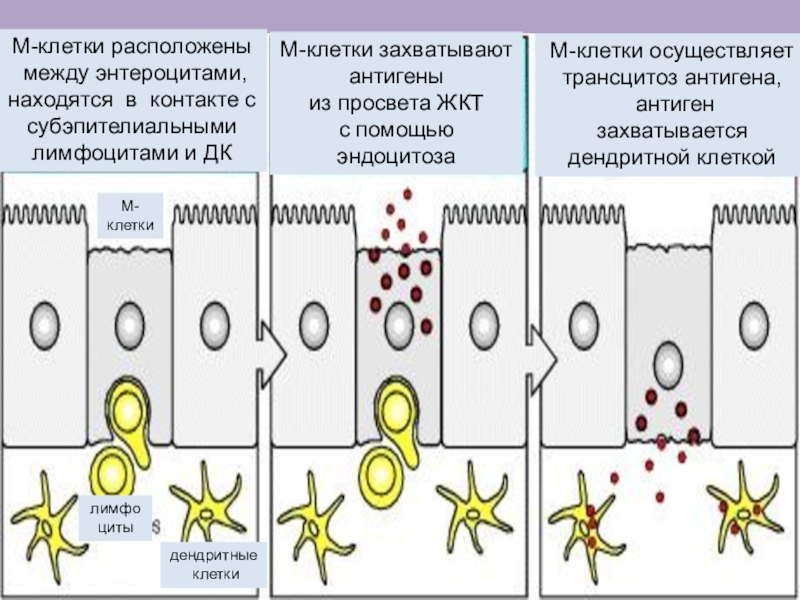
Слайд 14М-клетки расположены
между энтероцитами, находятся в контакте с субэпителиальными
лимфоцитами и
ДК
М-клетки захватывают
антигены
из просвета ЖКТ
с помощью
эндоцитоза
лимфо
циты
дендритные
клетки
М-
клетки
М-клетки осуществляет
трансцитоз
антигена,
антиген
захватывается дендритной клеткой
Слайд 15В MALT присутствуют лимфоциты разных типов
Кроме лимфоцитов, сфокусированных в Пейеровых
бляшках, небольшое число лимфоцитов и плазматических клеток могут мигрировать через
lamina propria стенки кишки.
История жизни этих клеток :
В качестве наивных лимфоцитов они из центральных органов – костного мозга и тимуса - мигрируют в индуктивные органы и ткани.
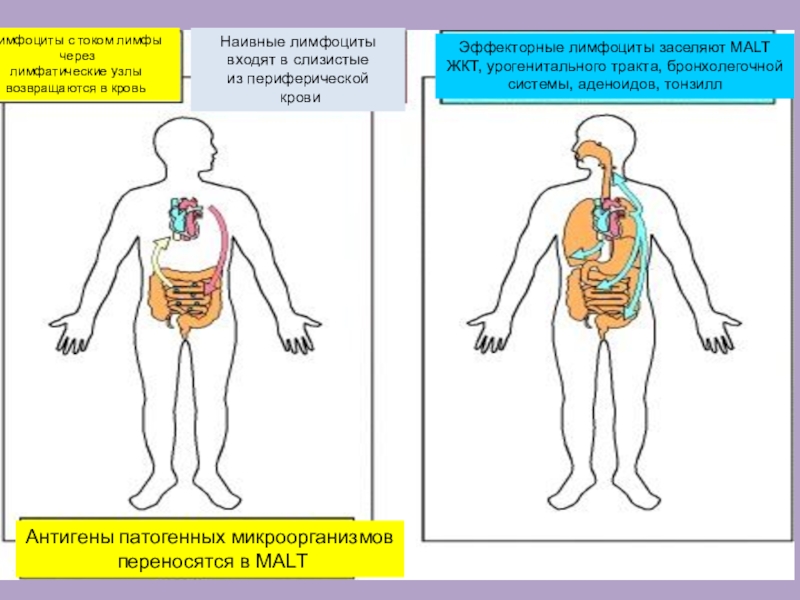
Слайд 16Наивные лимфоциты
входят в слизистые
из периферической
крови
Лимфоциты с током лимфы
через
лимфатические
узлы
возвращаются в кровь
Антигены патогенных микроорганизмов
переносятся в MALT
Эффекторные лимфоциты
заселяют MALT
ЖКТ, урогенитального тракта, бронхолегочной
системы, аденоидов, тонзилл
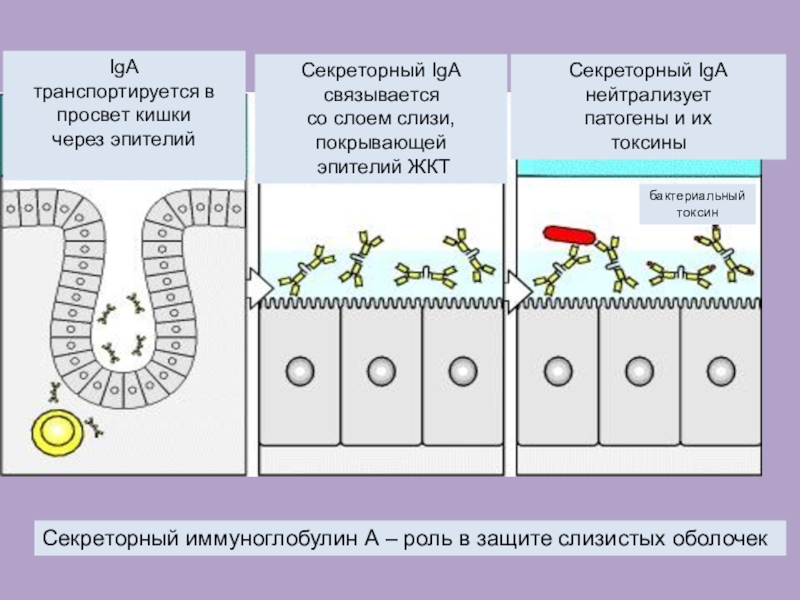
Слайд 17IgA
транспортируется в просвет кишки
через эпителий
Секреторный IgA связывается
со
слоем слизи, покрывающей
эпителий ЖКТ
Секреторный IgA
нейтрализует
патогены и
их
токсины
бактериальный
токсин
Секреторный иммуноглобулин А – роль в защите слизистых оболочек
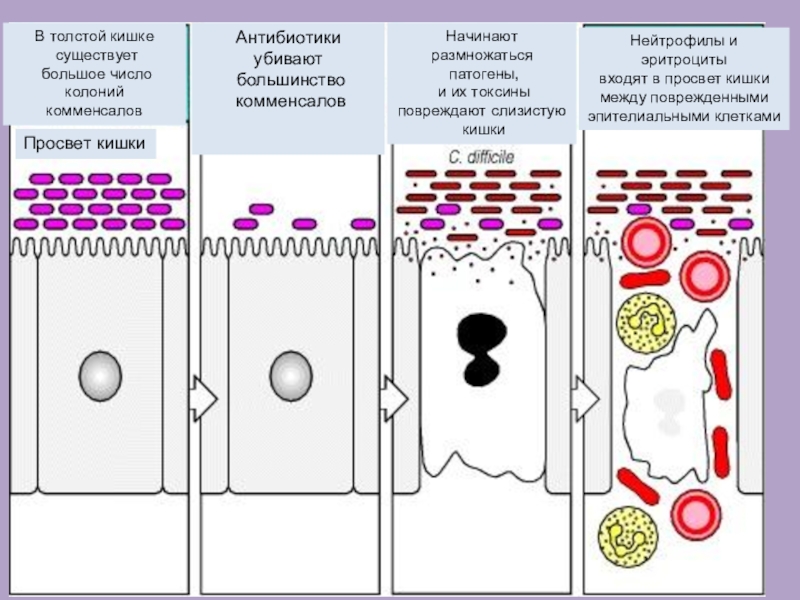
Слайд 18В толстой кишке
существует
большое число колоний
комменсалов
Просвет кишки
Антибиотики убивают
большинство
комменсалов
Начинают размножаться
патогены,
и их токсины
повреждают слизистую
кишки
Нейтрофилы и
эритроциты
входят в просвет кишки
между поврежденными
эпителиальными клетками
Слайд 19
Микробиота нормофлора
Микробиота – эволюционно сложившееся сообщество разнообразных микроорганизмов, населяющих
открытые полости организма человека, определяющее – биохимическое, метаболическое и иммунологическое
равновесие макроорганизма
(T. Rosebury «Microorganisms Indigenous to Man», N.Y.,1962).
Слайд 20Роль микробиоты в развитии иммунной системы
и кишечного эпителия у
детей
Бактерии участвуют в развитии и поверхностной дифференцировке эпителия, в
развитии капиллярной сети ворсинок.
Продукты нормальной микробиоты влияют на созревание иммунной системы ребенка, формирование полноценной GALT.
От продуктов нормальной микрофлоры зависит:
размер Пейеровых бляшек и мезентериальных лимфоузлов.
Развитие в них зародышевых центров.
Интенсивность синтеза иммуноглобулинов.
Слайд 21Микробиота ЖКТ: количественные характеристики
ЖКТ человека заселен огромным количеством микроорганизмов -
около 500 различных видов общей массой
1,5-3,0 кг,
которые по численности приближаются к количеству клеток человеческого организма
Слайд 22Микробиота ЖКТ: количественные характеристики
В ротовой полости количество микроорганизмов невелико и
составляет от 0 до 103 КОЕ на мл содержимого,
быстрое движение
пищевых масс и выделение желчи и сока поджелудочной железы ограничивают размножение бактерий в верхних отделах желудочно-кишечного тракта.
В нижних отделах желудочно-кишечного тракта число микроорганизмов значительно больше.
Слайд 23.
В толстой кишке не наблюдается ни быстрого движения
пищевых масс, ни выделения сока желчи и поджелудочной
железы, поэтому в этом отделе желудочно-кишечного тракта количество бактерий достигает 1013 КОЕ на мл.
Микробиота ЖКТ: количественные характеристики
Слайд 24Распределение видов микроорганизмов в разных
отделах желудочно-кишечного тракта
В верхнем
и среднем отделах тонкой кишки популяция микроорганизмов сравнительно небольшая и
включает преимущественно :
грамположительные аэробные бактерии,
небольшое число анаэробных бактерий,
дрожжи и др. виды
В толстой кишке обитает основная масса анаэробных микроорганизмов.
"Главную популяцию" (около 70 %) составляют анаэробные бактерии - бифидобактерии и бактероиды.
В качестве "сопутствующих" выступают лактобациллы, кишечная палочка, энтерококки.
Слайд 26Симбиоз
Большая часть микрофлоры (микробиоценоза) представляют микроорганизмы, которые сосуществуют
с человеком на основе симбиоза (взаимной выгоды):
Такие микроорганизмы получают
от человека пользу (в виде постоянной температуры и влажности, питательных веществ, защиты от ультрафиолета и так далее).
В то же время эти бактерии сами приносят пользу, синтезируя витамины, расщепляя белки, соперничая с болезнетворными микроорганизмами и выживая их со своей территории.
Все микроорганизмы участвуют во внутрипросветном пищеварении, в частности, переваривание пищевых волокон (целлюлозы), ферментативном расщеплении белков, углеводов, жиров и в процессе обмена веществ.
Основной представитель анаэробной кишечной микрофлоры - бифидобактерии - вырабатывают аминокислоты, белки, витамины В1, В2, В6, В12, викасол, никотиновую и фолиевую кислоты.
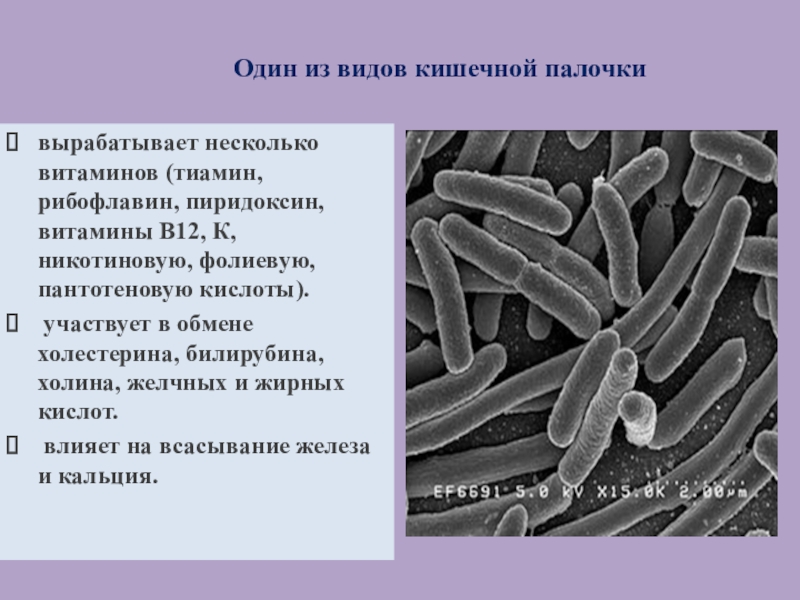
Слайд 27Один из видов кишечной палочки
Один из видов кишечной палочки:
вырабатывает несколько витаминов (тиамин, рибофлавин, пиридоксин, витамины В12, К, никотиновую,
фолиевую, пантотеновую кислоты).
участвует в обмене холестерина, билирубина, холина, желчных и жирных кислот.
влияет на всасывание железа и кальция.
Слайд 28Микроорганизмы в желудочно-кишечном тракте
Продуктами жизнедеятельности молочнокислых бактерий (бифидобактерии, лактобацилл) и
бактероидов являются молочная, уксусная, янтарная, муравьиная кислоты. Это обеспечивает поддержание
показателя внутрикишечного рН 4,0-3,8, благодаря этому тормозится размножение болезнетворных и гнилостных бактерий.
Представители нормальной кишечной микрофлоры вырабатывают вещества с антибактериальной активностью :
бактериокины
короткоцепочечные жирные кислоты
лактоферрин
лизоцим.
Слайд 29Микробиота и иммунитет
Нормальная микробиота представляет собой большое число чужеродных
молекул (антигенов и паттернов), которые способна распознавать иммунная система.
Почему же иммунная система не осуществляет защитные функции в отношении микробиоты и не элиминирует ее?
За 200 миллионов лет совместной коэволюции макроорганизма и микроорганизмов была выработана особая форма иммунного ответа, называемая пероральной толерантностью или акцептивным иммунитетом.
Слайд 30Избыточный бактериальный рост в кишечнике -причины
При различных состояниях, сопровождающихся нарушением
переваривания и всасывания пищи (врожденный дефицит ферментов, панкреатит, глютеновая энтеропатия,
энтериты), не- всосавшиеся питательные вещества служат питательной средой для избыточного размножения бактерий.
Слайд 31Избыточный бактериальный рост в кишечнике -причины
Применение антибиотиков, кортикостероидов, цитостатиков, особенно
у ослабленных и пожилых пациентов, сопровождается изменениями взаимоотношений микрофлоры кишечника
и всего организма.
Псевдомембранозный колит обусловлен избыточным размножением одной из облигатно-анаэробных грамположительных спорообразующих бактерий, обладающей природной устойчивостью к большинству широко применяемых антибиотиков.
Избыточное размножение бактерий в тонкой кишке является дополнительным источником воспаления слизистой оболочки, снижающим вырабатывание ферментов (в наибольшей степени - лактазы) и усугубляющим нарушение переваривания пищи и ее всасывания. Эти изменения обусловливают развитие таких симптомов, как коликоообразные боли в околопупочной области, метеоризм и диарея , потеря массы тела.
Слайд 32УПФ - условно-патогенная флора
Наряду с полезными бактериями у человека
есть «сожители», которые в небольших количествах не приносят существенного вреда,
но при определенных условиях становятся болезнетворными.
Такую часть микробов называют условно-патогенной микрофлорой.
К условно-патогенным микроорганизмам желудочно-кишечного тракта относится практически все семейство Enterobacteriaceae.
К ним относятся клебсиелла пневмония, энтеробактеры (аэрогенес и клоацеа), цитробактер фреунди, протеи.
Предельно допустимой нормой для семейства энтеробактерий в ЖКТ является показатель в 1000 микробных единиц.
Слайд 34Человек- «термостат с питательной средой для микроорганизмов» ???
Генофонд микрофлоры в
организме человека включает более 600 тысяч генов, то в 24
раза превышает генофонд самого человека, насчитывающего 25 000 функционирующих генов.
Слайд 35Все микроорганизмы в ЖКТ- «ЧУЖОЕ» или «СВОЕ»?
На всех слизистых
оболочках живут бактерии – комменсалы.
Иммунная система, ассоциированная со слизистыми оболочками
(MALT), постоянно решает вопрос: к каким микроорганизмам нужно поддерживать толерантность, на какие микроорганизмы следует развивать иммунный ответ.
Мукозальная иммунная система должна постоянно балансировать –соблюдать равновесие и решать развивать или не развивать иммунный ответ - в зависимости от того:
является ли антиген патогенным или не является;
достигли ли представители УПФ пороговой численности или еще пока не достигли.
Слайд 36Иммунная система слизистых оболочек решает сложнейшие задачи
Каким образом иммунная
система слизистых оболочек может развивать прямо противоположные иммунные ответы в
одно и то же время:
Игнорировать ежедневно поступающие в ЖКТ и контактирующие с наружным слоем эпителия антигены (неопасные).
Необходимость своевременного развития сильного воспалительного ответа против потенциально опасных микроорганизмов.
Необходимость процессов тонкой регуляции воспаления с целью недопущения повреждения тканей ЖКТ.
Необходимость поддержания тканевого гомеостаза для успешного осуществления физиологических механизмов в слизистых.
Слайд 37Акцептивный иммунитет и
иммунитет слизистых к патогенам
Акцептивный иммунитет: форма иммунитета,
обеспечивающая симбиозные взаимоотношения микроорганизмов и организма-хозяина. Толерантность к симбиотическому виду
«чужого»:
Распознавание своего и чужого.
Не элиминация, а сосуществование с чужеродными микроорганизмами - комменсалами.
Иммунитет слизистых оболочек:
Распознавание патогенов и элиминация их.
Развитие воспаления.
Иммунорегуляция с целью исключения разрушения собственных тканей.
Поддержание гомеостаза слизистых оболочек.
Слайд 39Задачи акцептивного иммунитета:
Изоляция бактерий и создание специализированных условий для их
обитания, формирование органов и систем (клетки, органы, ткани).
Создание и постоянное
поддержание иммунологической толерантности к антигенам нормальной микробиоты.
Учет и контроль проживающих микроорганизмов.
Сохранение и передача полезных бактерий своему потомству.
Слайд 40Акцептивный иммунитет:
врожденный и адаптивный
При встрече с любым микроорганизмом будет
происходить активация фагоцитов,
фагоцитоз, активация, реализация провоспалительного потенциала, развитие воспаления.
Каким
образом осуществляются симбионтные взаимоотношения на уровне врожденного иммунитета?
Слайд 41Взаимодействие MAMPs (молекул симбиотических бактерий) – PRR (патогенраспознающих рецепторов) в
слизистых
Основные MAMPs:
ЛПС симбионтных бактерий
пептидогликаны
симбионтных бактерий
Для
функционирования
мукозного барьера наиболее
важны PRR:
TLR и NOD - подобные рецепторы.
Активация TLR и NOD- подобных рецепторов вызывает продукцию:
слизи (синтез муцина) – среда обитания
АБП (дефенсинов –антибиотических пептидов),
sIgA
противовоспалительных цитокинов
Слайд 42Парадоксальная роль антибиотических пептидов
(АПБ) в акцептивном иммунитете –
промикробные свойства
АПБ
оказывают:
Короткодистантный антибактериальный эффект, биохимический барьер в пределах узкой зоны вдоль
эпителия; предохраняют эпителий и препятствуют транслокации бактерий; не работают в биопленках.
Играют важную роль в регуляции состава микробиоты (Schroeder et al., 2011).
Выполняют промикробные функции: ростстимулирующая активность в низких дозах (хемоаттрактантный эффект).
Продукция слизи и антибактериальных пептидов клетками эпителия находится под контролем врожденного и адаптивного иммунитета:
ИЛ-9, ИЛ-13 – продукция слизи;
ИЛ-17, ИЛ-22 – продукция АБП.
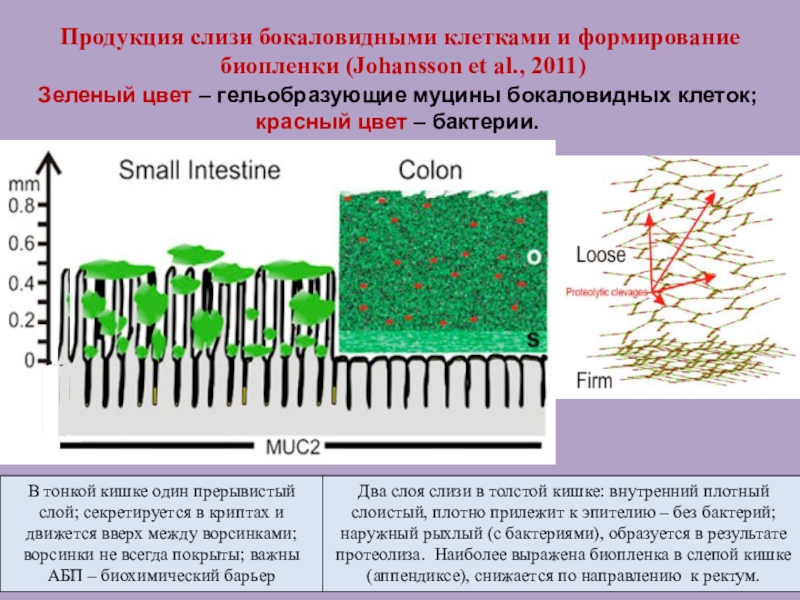
Слайд 43Продукция слизи бокаловидными клетками и формирование
биопленки (Johansson et al.,
2011)
Два слоя слизи в толстой кишке: внутренний плотный слоистый, плотно
прилежит к эпителию – без бактерий; наружный рыхлый (с бактериями), образуется в результате протеолиза. Наиболее выражена биопленка в слепой кишке (аппендиксе), снижается по направлению к ректум.
Зеленый цвет – гельобразующие муцины бокаловидных клеток; красный цвет – бактерии.
В тонкой кишке один прерывистый слой; секретируется в криптах и движется вверх между ворсинками; ворсинки не всегда покрыты; важны АБП – биохимический барьер
Слайд 44Сигналы от патогенов или от комменсалов определяют разные типы реагирования
мукозального иммунитета
Сигналы от нормальной микрофлоры:
MAMPS вызывают синтез противовоспалительных цитокинов (TGFβ).
Нормальная
микробиота – нет повреждения.
Нормальная микробиота – иммунологическая толерантность.
Патогенные микроорганизмы, их токсины –вызывают повреждение эпителия слизистых.
PAMPS+DAMPS вызывают синтез провоспалительных цитокинов и хемокинов.
Иммунный ответ.
Элиминация патогенов.
Формирование клеток памяти.
Слайд 45
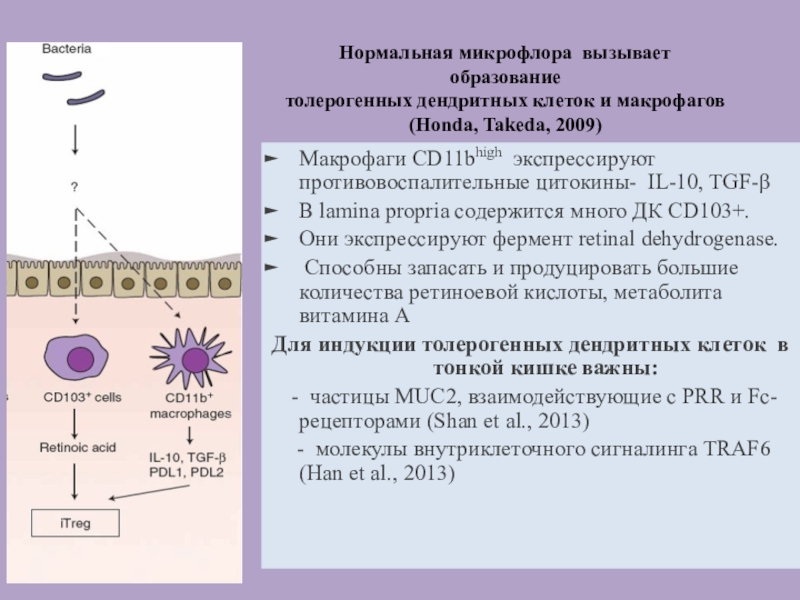
Нормальная микрофлора вызывает
образование
толерогенных дендритных клеток и макрофагов
(Honda, Takeda, 2009)
Макрофаги
CD11bhigh экспрессируют противовоспалительные цитокины- IL-10, TGF-β
В lamina propria содержится много
ДК CD103+.
Они экспрессируют фермент retinal dehydrogenase.
Способны запасать и продуцировать большие количества ретиноевой кислоты, метаболита витамина А
Для индукции толерогенных дендритных клеток в тонкой кишке важны:
- частицы MUC2, взаимодействующие с PRR и Fc-рецепторами (Shan et al., 2013)
- молекулы внутриклеточного сигналинга TRAF6 (Han et al., 2013)
Слайд 46РОЛЬ трансформирующего ростового фактора (TGF β)– доминирующего цитокина в слизистой
кишечника
Совокупность факторов нормальной микрофлоры и клеток врожденного иммунитета слизистой кишечника
создает микроокружение, богатое TGFβ , который является преобладающим регуляторным цитокином.
Синтезируют TGFβ:
клетки эпителия,
CD11b+ макрофаги,
γδT- кл, Tregs.
TGFβ способствует дифференцировке Tregs и созданию толерантности к антигенам нормальной микрофлоры и пищевым антигенам.
Способствуют переключению синтеза антител на IgA, усиливает трансцитоз IgA (путем усиления экспрессии pIgR).
Стабилизирует параметры проницаемости кишечного эпителия.
Подавляет экспрессию TLR на клетках кишечного эпителия.
Ограничивает воспалительные реакции при развитии инфекции.
Универсальный медиатор акцептивного иммунитета.
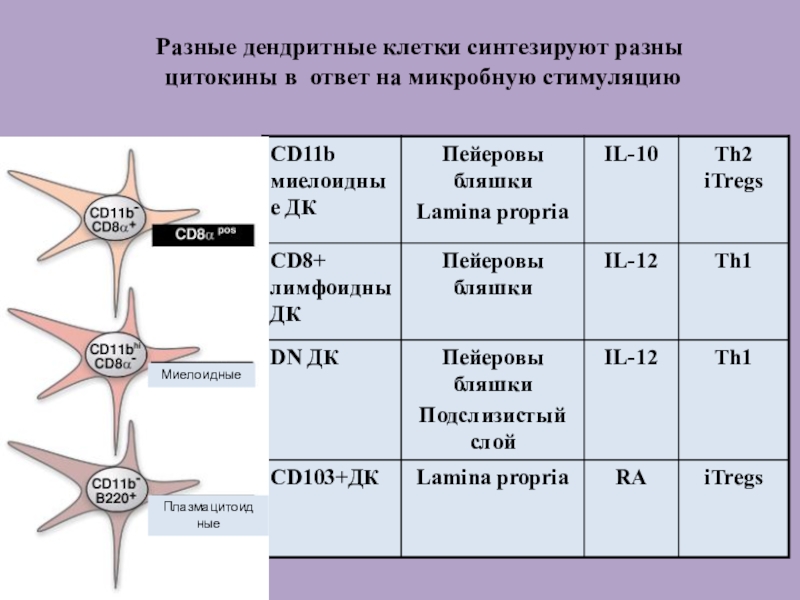
Слайд 47Разные дендритные клетки синтезируют разны
цитокины в ответ на микробную
стимуляцию
Миелоидные
Плазмацитоид
ные
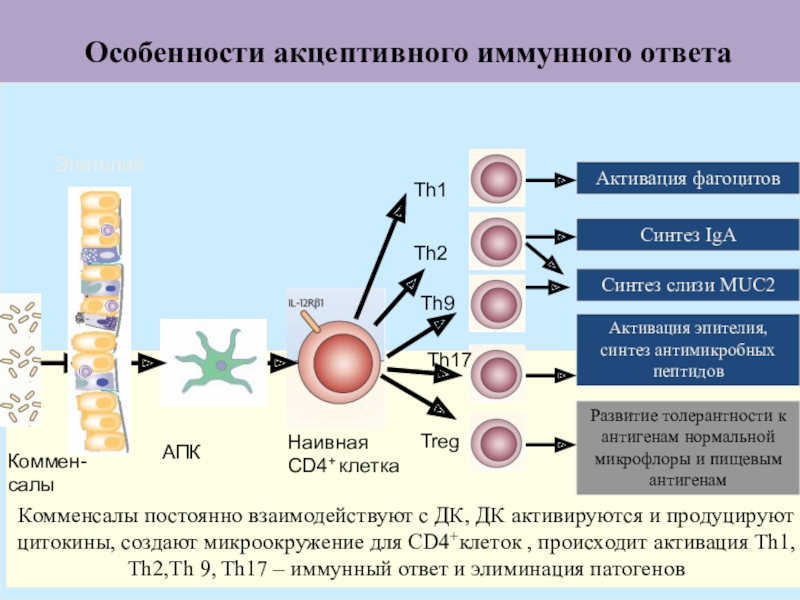
Слайд 48Особенности акцептивного иммунного ответа
Коммен-салы
АПК
Наивная CD4+ клетка
Активация фагоцитов
Синтез IgA
Активация эпителия, синтез
антимикробных пептидов
Развитие толерантности к антигенам нормальной микрофлоры и пищевым антигенам
Th1
Th2
Th9
Treg
Комменсалы
постоянно взаимодействуют с ДК, ДК активируются и продуцируют цитокины, создают микроокружение для CD4+клеток , происходит активация Th1, Th2,Th 9, Th17 – иммунный ответ и элиминация патогенов
Эпителий
Th17
Синтез слизи MUC2
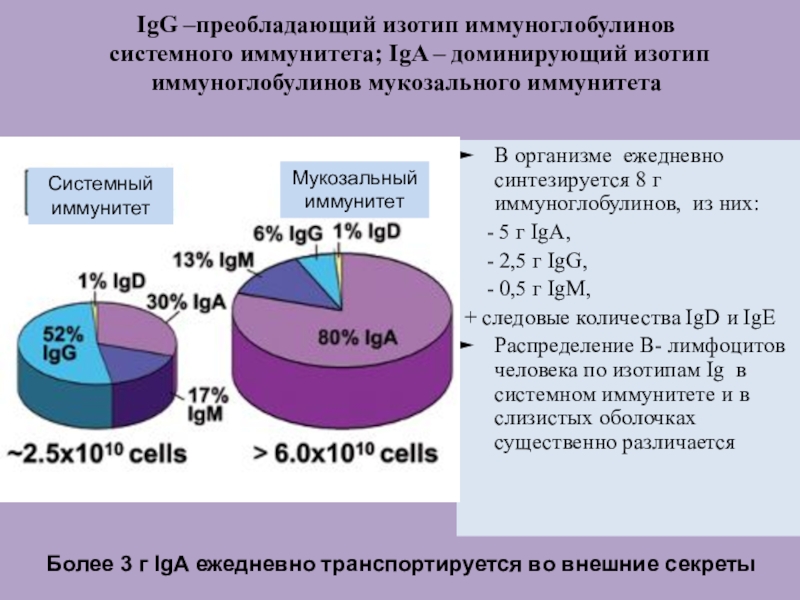
Слайд 49IgG –преобладающий изотип иммуноглобулинов системного иммунитета; IgA – доминирующий изотип
иммуноглобулинов мукозального иммунитета
В организме ежедневно синтезируется 8 г иммуноглобулинов, из
них:
- 5 г IgA,
- 2,5 г IgG,
- 0,5 г IgM,
+ следовые количества IgD и IgE
Распределение В- лимфоцитов человека по изотипам Ig в системном иммунитете и в слизистых оболочках существенно различается
Более 3 г IgA ежедневно транспортируется во внешние секреты
Системный
иммунитет
Мукозальный
иммунитет
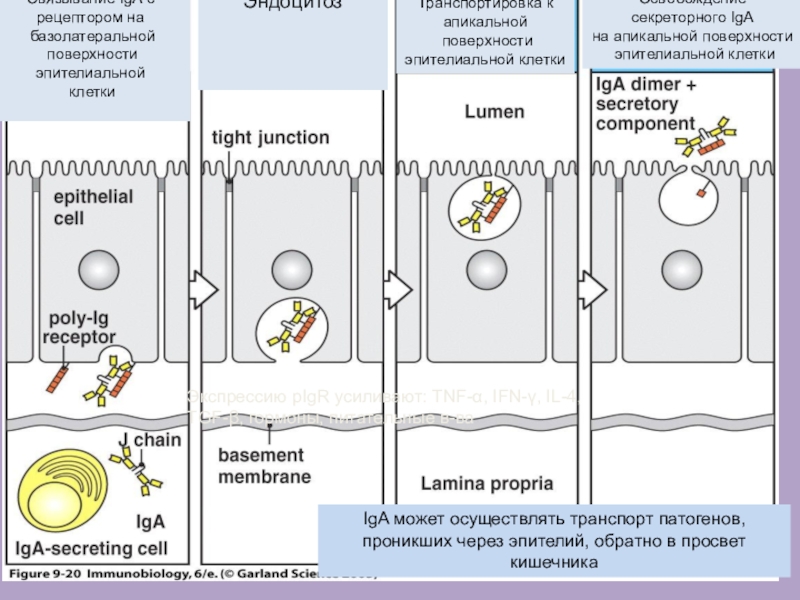
Слайд 50IgA может осуществлять транспорт патогенов, проникших через эпителий, обратно в
просвет кишечника
Экспрессию pIgR усиливают: TNF-α, IFN-γ, IL-4, TGF-β, гормоны, питательные
в-ва
Связывание IgA с
рецептором на
базолатеральной
поверхности эпителиальной
клетки
Эндоцитоз
Транспортировка к
апикальной
поверхности
эпителиальной клетки
Освобождение
секреторного IgA
на апикальной поверхности
эпителиальной клетки
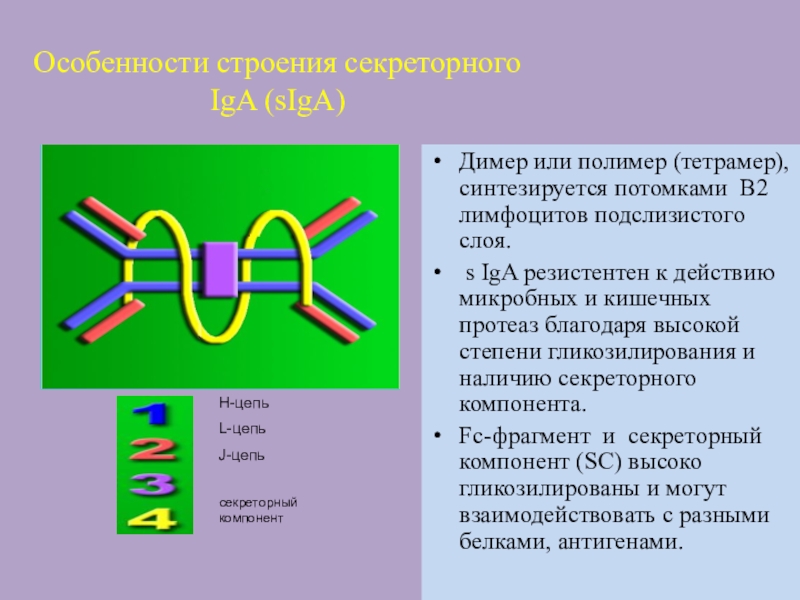
Слайд 51Особенности строения секреторного IgA (sIgA)
Димер или полимер (тетрамер), синтезируется потомками
В2 лимфоцитов подслизистого слоя.
s IgA резистентен к действию
микробных и кишечных протеаз благодаря высокой степени гликозилирования и наличию секреторного компонента.
Fc-фрагмент и секреторный компонент (SC) высоко гликозилированы и могут взаимодействовать с разными белками, антигенами.
H-цепь
L-цепь
J-цепь
секреторный компонент
Слайд 52Роль IgA в формировании биопленки
IgA связывается с низкомолекулярным компонентом муцина
MG2.
IgA связывается с компонентами слизи с помощью высоко гликозилированного
секреторного компонента через углеводные остатки - показано in vivo и in vitro для респираторного (Phalipon et al., 2002) и кишечного эпителия (Boullier et al., 2009).
Иммунное исключение для выведения патогенов (Phalipon et al., 2002).
Иммунное включение – фиксация бактерий в пределах биопленки, не дает им присоединяться к эпителию (Everett et al., 2004) .
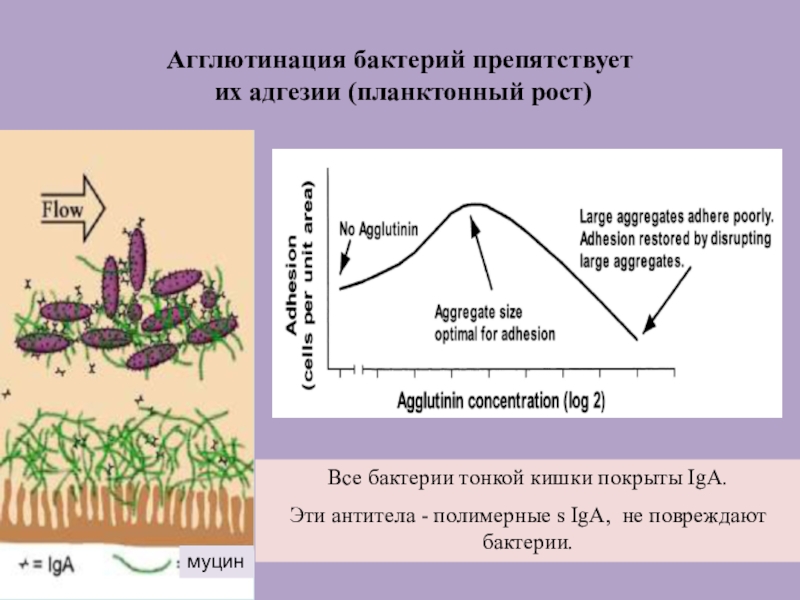
Слайд 53Агглютинация бактерий препятствует
их адгезии (планктонный рост)
Все бактерии тонкой кишки
покрыты IgA.
Эти антитела - полимерные s IgA, не повреждают
бактерии.
муцин
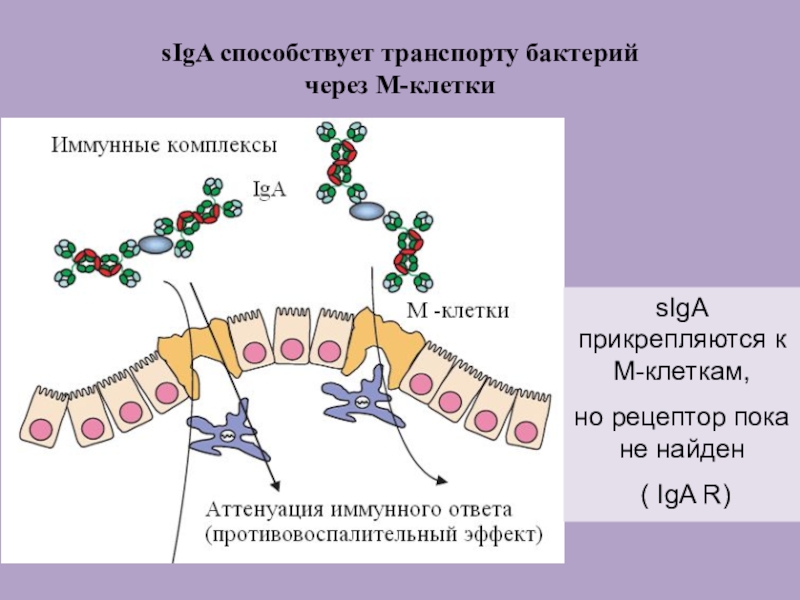
Слайд 54sIgA способствует транспорту бактерий
через М-клетки
sIgA прикрепляются к М-клеткам,
но рецептор пока не найден
( IgA R)
Слайд 55Роль IgA в симбиотических
взаимоотношениях в кишечнике
Учет и контроль микроорганизмов,
определяет состав и количество бактерий, заселяющих определенный биотоп.
Распределение бактерий на
два типа обитания: свободного в виде планктона и фиксированного в виде биопленки.
Барьерная роль – препятствует транслокации бактерий через эпителий (у детей до 2 месяцев нет достаточного количества IgA, и бактерии находятся в лимфатических узлах; затем вытесняются на поверхность эпителия)
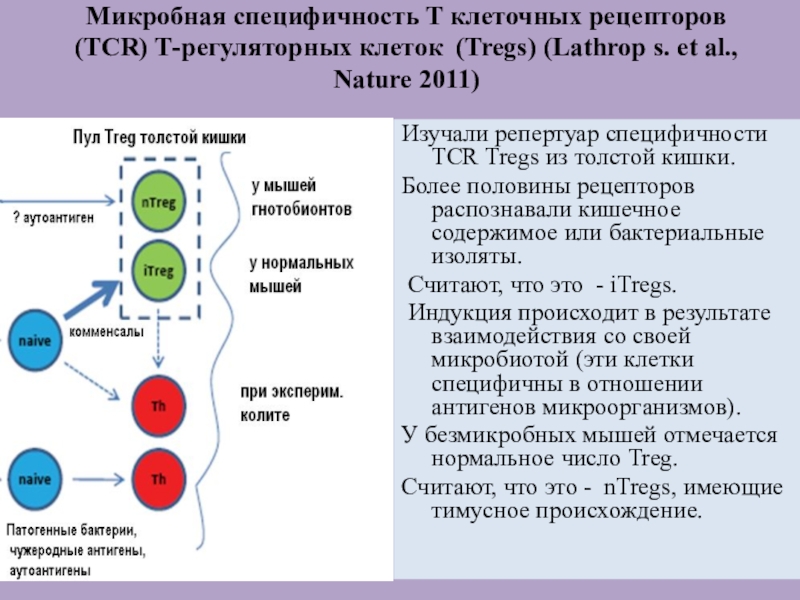
Слайд 56Микробная специфичность Т клеточных рецепторов (TCR) Т-регуляторных клеток (Tregs) (Lathrop
s. et al., Nature 2011)
Изучали репертуар специфичности TCR Tregs из
толстой кишки.
Более половины рецепторов распознавали кишечное содержимое или бактериальные изоляты.
Считают, что это - iTregs.
Индукция происходит в результате взаимодействия со своей микробиотой (эти клетки специфичны в отношении антигенов микроорганизмов).
У безмикробных мышей отмечается нормальное число Treg.
Считают, что это - nTregs, имеющие тимусное происхождение.
Слайд 57Роль Т регуляторных лимфоцитов : тимусных и индуцибельных в поддержании
толерантности к нормальной микрофлоре
Тимусные Т-регуляторные клетки создают толерантность к антигенам
нормальной микрофлоры(Cebula et al., 2013
К каждому виду нормальной микробиоты создается и постоянно поддерживается особая форма специфического иммунного ответа с образованием Tregs, Th2 и Th17.
Тимусные Т-регуляторные клетки специфичны к чужеродным антигенам.
Рецепторы (TCR) тимусных Т регуляторных лимфоцитов – специфичны к антигенам микробиоты.
nTregs (тимусные) составляют большинство Tregs кишечной ткани и их репертуар зависит от состава микробиоты.
iTregs поддерживают толерантность к АГ
нормальной микрофлоре и пищевым антигенам
(Josefowicz et al., 2012)
Блокада образования iTregs у мышей вызывает:
Нарушение толерантности к антигенам нормальной микробиоты и пищи.
Развитие аллергического воспаления в гастроинтестинальном тракте и легких (усиление продукции Th2 цитокинов, повышение уровней IgЕ в сыворотке крови).
Изменения состава нормобиоты : в норме соотношение Firmicutes/bacteroides=2,6 ;
У мышей с дефицитом iTregs, это соотношение =1,5.

Слайд 58
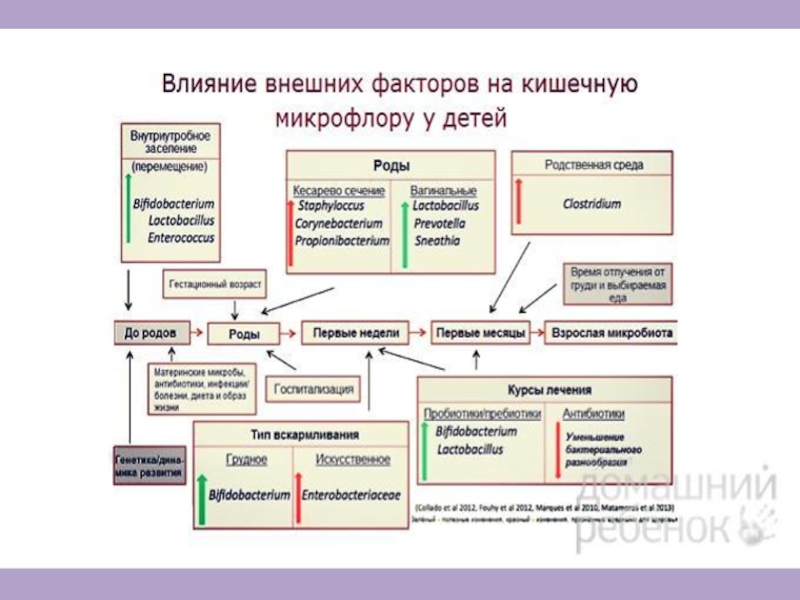
Роль иммунной системы в сохранении микробиоты и передаче потомству
Организм ребенка
стерилен до рождения (в норме)
Микробиота матери передается при родах
После
родов заселение ребёнка микрофлорой продолжается благодаря контакту со средой и кормлению грудью.
Передача симбионтов через молоко: 105-107 бактерий ежедневно
Микробиома молока – самостоятельный биоценоз (Cabrera-Rubio et al., 2012)
Есть значительная разница между микрофлорой детей, вскармливаемых грудью, по сравнению с детьми на искусственном вскармливании (Azad, et al. 2013; Guaraldi & Salvatori 2012).
Полезные бактерии напрямую доставляются с грудным молоком в кишечник ребёнка, а олигосахариды из грудного молока поддерживают рост этих бактерий.
Разница в кишечной микрофлоре у детей-искусственников может обосновать риски для здоровья, связанные с кормлением смесью.
Колики новорожденных могут быть связаны с высоким уровнем протобактерий в кишечнике ребёнка
Слайд 60Молоко программирует создание
кишечного микробиоценоза и развитие
иммунной системы ребенка
(Chirico et al., 2008)
Иммунные клетки матери:
Число
клеток - до 1 млн в мл, с молоком поступает 8-80 млн. клеток ежедневно,
Макрофаги - 85%,
Лимфоциты 10%,
Нейтрофилы
Натуральные киллеры
T клетки и В клетки памяти
Плазматические клетки.
Иммуноглобулин IgA: до 1 г/л.
А также:
Цитокины, гормоны, ростовые факторы, ферменты, муцины, пребиотики (олигосахариды, bifidus factor), лактоферрин, белки-переносчики и т.д.