Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Металлы :
Содержание
- 1. Металлы :
- 2. Мета́ллы — группа элементов в виде простых веществ, обладающих характерными металлическими свойствами,
- 3. Большинство открытых на сегодняшний момент химических элементов
- 4. .Как было сказано ранее, атомы металлов имеют
- 5. Практически все металлы в нормальном состоянии –
- 6. Все металлы в компактном состоянии хорошо проводят
- 7. Практически все металлы пластичные и ковкие. На
- 8. Важной характеристикой металлов является их плотность. В
- 9. Отличительной чертой металлов является наличие металлического блеска,
- 10. Сплавы – это материалы, имеющие металлические свойства
- 11. Среди металлов традиционно выделяют несколько групп. Входящие
- 12. Металлы (кроме золота, платины, серебра) взаимодействуют с
- 13. - Щелочные и щелочноземельные металлы взаимодействуют с
- 14. Существуют несколько основных способов получения металлов.Восстановление:— из
- 15. Многие металлы широко распространены в природе. Так,
- 16. В природе металлы встречаются в различном виде:—
- 17. Коррозия металлов – это процесс разрушения металлов
- 18. Способы устранения и защиты металлов от коррозии:1.Нанесение
- 19. Таким образом, металлы – удивительные вещества, уникальные
- 20. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Мета́ллы — группа элементов в виде простых веществ, обладающих характерными металлическими свойствами, например высокие тепло- и электропроводность, положительный
Слайд 3Большинство открытых на сегодняшний момент химических элементов – металлы. От
неметаллов в периодической системе металлы обычно отделены ступенчатой линией от
водорода до оганесона. В периодической системе металлы поделены на следующие группы:Щёлочные (6 элементов : Li, Na, K, Rb, Cs, Fr )
Щёлочноземельные (4 элемента: Ca, Sr, Ba, Ra, иногда Mg и Be )
Переходные (38 элементов , включая Cu, Hg, Zn, Ni, Co, Fe, Mn и другие)
Лёгкие (7 элементов: Al, Ga, In, Sn, Tl, Pb, Bi )
Полуметаллы: B, Si, Ge, As, Sb, Te, Po
14 металлов, а так же лантан La находятся в группе лантаноиды: Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu; А так же 14 в группе актиноиды: Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr. Таким образом, к металлам принадлежат больше 90 химических элементов, преимущественно B-группы , а так же несколько элементов А-группы. Существуют также элементы, обладающие как металлическими, так и неметаллическими свойствами.
Слайд 4.
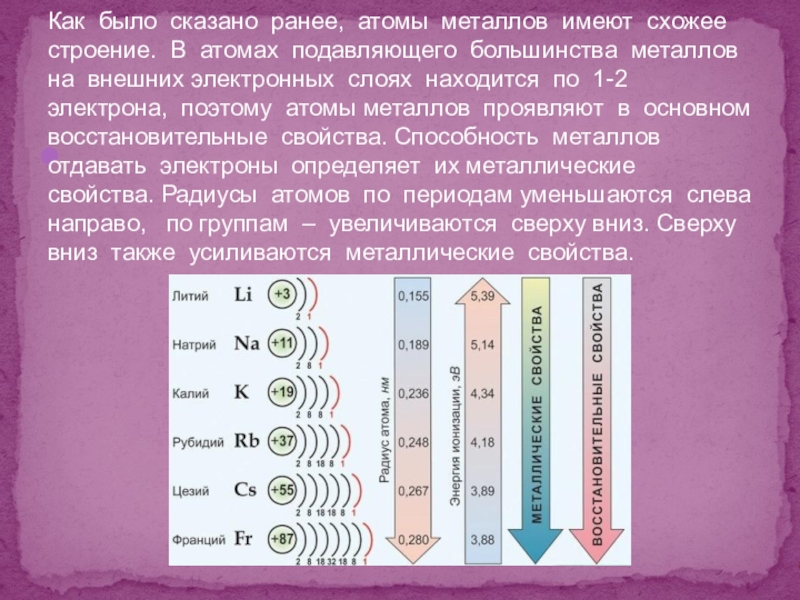
Как было сказано ранее, атомы металлов имеют схожее строение. В
атомах подавляющего большинства металлов на внешних электронных слоях находится по
1-2 электрона, поэтому атомы металлов проявляют в основном восстановительные свойства. Способность металлов отдавать электроны определяет их металлические свойства. Радиусы атомов по периодам уменьшаются слева направо, по группам – увеличиваются сверху вниз. Сверху вниз также усиливаются металлические свойства.Слайд 5Практически все металлы в нормальном состоянии – твёрдые вещества( Кроме
ртути – она жидкая), при этом твёрдость у каждого из
них различна. Самыми твёрдыми металлами считаются хром и титан.Все металлы обладают собственной электро- и теплопроводностью, блеском, цветом, температурой плавления, а так же плотностью и твёрдостью.
Физические свойства
Слайд 6Все металлы в компактном состоянии хорошо проводят электрический ток и
тепло, Эти свойства обусловлены наличием в металлах свободных электронов. Серебро,
медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий. Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла. Наименьшая теплопроводность — у висмута и ртути.Слайд 7Практически все металлы пластичные и ковкие. На практике их пластичность
проявляется в том, что при определённом усилии они изгибаются или
растягиваются. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самым пластичным металлом является золото, из которого изготавливают тончайшие пластинки и проволоки, а самым хрупким металлом является сурьма, который крошится при малейшем механическом воздействии.Слайд 8Важной характеристикой металлов является их плотность. В зависимости от плотности, металлы
делят на лёгкие и тяжёлые. Самым лёгким металлом является литий, а самым твёрдым
– осмий.Так же одними из характеристик металлов являются их магнитные свойства. Притягиваются к магнитам лишь некоторые из них, такие как железо, кобальт, никель и некоторые редкоземельные элементы. Такие металлы как медь, алюминий, свинец, серебро и золото к магниту не притягиваются, а некоторые даже отталкиваются от него.
Слайд 9Отличительной чертой металлов является наличие металлического блеска, высокая электропроводность, способность
издавать колокольный звук. Все металлы растворяются в воде, однако одни
реагируют с водой бурно, например щелочные металлы, при этом выделяется из воды водород и образуется раствор гидроксида, а другие реагируют лишь с малым переходом частиц в воду(например, серебро).Слайд 10Сплавы – это материалы, имеющие металлические свойства и состоящие из
двух или большего числа химических элементов, из которых хотя бы
один является металлом. Он и широко используются в промышленной металлургии. Добавляя в определённом количестве примеси других металлов и неметаллов, можно получить многие тысячи материалов с самыми разнообразными свойствами, в том числе и такими, каких нет ни у одного из составляющих сплав элементов. Вот самые известные и распространённые примеры сплавов:- Сталь. Сталью называется сплав железа с углеродом, которого может содержаться не более 2%. Так же туда могут входить такие элементы как хром, ванадий, никель.
- Чугун. Сплав железа с 2-4% углерода, в который ещё добавляется кремний, называется чугуном. Он широко используется, например в отливании крышек для люков, арматуры и т.д.
- Латунь – сплав цинка и меди.
- Бронза - сплав меди с оловом, кремнием, алюминием или бериллием.
- Лёгкие сплавы. Основными металлами легких сплавов служат алюминий, магний, титан и бериллий. Однако сплавы на основе алюминия и магния не могут применяться в условиях высокой температуры и в агрессивных средах.
- Алюминиевые сплавы. К ним относятся литейные сплавы (Al – Si), сплавы для литья под давлением (Al – Mg) и самозакаливающиеся сплавы повышенной прочности (Al – Cu). Алюминиевые сплавы экономичны, легкодоступны, прочны при низких температурах и легко обрабатываемы.
Из всех сплавов самым распространённым является сталь.
Сплавы металлов
Слайд 11Среди металлов традиционно выделяют несколько групп. Входящие в их состав
представители характеризуются отличной от других металлов химической активностью. Такими группами
являются:- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами I А группы периодической системы);
- щелочноземельные металлы (кальций, стронций, барий, радий).
Химические свойства
Слайд 12Металлы (кроме золота, платины, серебра) взаимодействуют с кислородом, образуя различные
оксиды:
2Mg+O2→2MgO. Взаимодействуют с галогенами, образуя галогениды металлов. Типичной реакцией является
получение поваренной соли:2Na+Cl2→2NaCl
Взаимодействуют с серой, образуя сульфиды металлов:
Zn+S→ZnS.
Слайд 13- Щелочные и щелочноземельные металлы взаимодействуют с водой при обычных
условиях, образуя растворимое в воде основание (щёлочь) и водород. При этом
некоторые металлы средней активности реагируют с водой при повышенной температуре, образуя оксид металла и водород.- Mеталлы, стоящие в ряду активности левее водорода, взаимодействуют с растворами кислот, образуя соль и водород.
2Al+3H2SO4→Al2(SO4)3+3Н2.
- Металлы реагируют с солями менее активных металлов в растворе, образуя соль более активного металла и менее активный металл в свободном виде.
Реакции со сложными веществами
Слайд 14Существуют несколько основных способов получения металлов.
Восстановление:
— из их оксидов углем
или оксидом углерода (II)
ZnО + С = Zn + СО
Fе2О3
+ ЗСО = 2Fе + ЗСО2— водородом
WO3 + 3H2 =W + 3H2O
СоО + Н2 = Со + Н2О
— алюминотермия
4Аl + ЗМnО2 = 2А12О3 + ЗМn
Обжигом сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем):
2ZnS + ЗО2 = 2ZnО + 2SО2
ZnО + С = СО + Zn
Электролизом расплавов солей
СuСl2, — Сu2+ 2Сl
Получение металлов
Слайд 15Многие металлы широко распространены в природе. Так, содержание некоторых металлов
в земной коре следующее:
алюминия — 8,2%
железа — 4,1%
кальция — 4,1%
натрия
— 2,3%магния — 2,3%
калия - 2,1 %
титана — 0,56%
Большое кол-во и магния содержится в морской воде: — 1,05%, — 0,12%.
Нахождение в природе
Слайд 16В природе металлы встречаются в различном виде:
— в самородном состоянии:
серебро , золото , платина , медь , иногда ртуть
—
в виде оксидов: магнетит Fe3O4, гематит Fe2О3 и др.— в виде смешанных оксидов: каолин Аl2O3 • 2SiO2 • 2Н2О, алунит (Na,K)2O • АlО3 • 2SiO2 и др.
— различных солей:
сульфидов: галенит PbS, киноварь НgS,
хлоридов: сильвин КС1, галит NaCl, сильвинит КСl• NаСl, сульфатов: барит ВаSO4, фосфатов: апатит Са3(РО4)2, карбонатов: мел, мрамор СаСО3, магнезит МgСО3.
Многие металлы часто сопутствуют основным природным минералам: скандий входит в состав оловянных, вольфрамовых руд, кадмий — в качестве примеси в цинковые руды, ниобий и тантал — в оловянные.
Железным рудам всегда сопутствуют марганец, никель, кобальт, молибден, титан, германий, ванадий.
Нахождение в природе
Слайд 17Коррозия металлов – это процесс разрушения металлов и их сплавов
из-за воздействия внешней среды. Она возникает из-за того, что при
взаимодействии металлов с веществами воздуха и атмосферными осадками на их поверхности образуется плёнка, состоящая из оксидов, сульфидов, карбонатов и других соединений. В народе её принято называть словом ржавчина.В результате коррозии ухудшаются многие свойства изделий: уменьшаются их прочность, пластичность, блеск, снижается электропроводность и т. д.
Коррозиячто это и как с ней бороться
Слайд 18Способы устранения и защиты металлов от коррозии:
1.Нанесение защитных покрытий.
Металлическое изделие
покрывают другими металлами (никелирование, хромирование, цинкование, лужение — покрытие оловом).
2.Применение
сплавов, стойких к коррозии. Детали машин, аппаратов, инструменты и предметы быта изготовляют из нержавеющей стали, содержащей специальные легирующие (замедляющие коррозию) добавки: хром, никель и другие металлы.
3.Протекторная защита.
К защищаемой металлической конструкции присоединяют кусок более активного металла (протектор), который разрушается, защищая основной металл. В качестве протектора при защите корпусов судов, трубопроводов, кабелей используют магний, алюминий, цинк.
4.Изменение состава среды.
Для того чтобы предотвратить потери из-за коррозии, проводится специальная обработка электролита или той среды, в которой находится защищаемая металлическая конструкция. Практикуется также введение ингибитора — вещества, замедляющего коррозию.
Коррозиячто это и как с ней бороться