Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
МЕТАЛЛЫ
Содержание
- 1. МЕТАЛЛЫ
- 2. Металлы - вещества, обладающие в обычных условиях
- 3. К металлам относят как собственно металлы (простые
- 4. КЛАССИФИКАЦИЯ МЕТАЛЛОВ Из 110 элементов в
- 5. КЛАССИФИКАЦИЯ МЕТАЛЛОВ Выделяют:- щелочные металлы (Li,
- 6. КЛАССИФИКАЦИЯ МЕТАЛЛОВ Техническая классификация Черные металлы (Fe,
- 7. КЛАССИФИКАЦИЯ МЕТАЛЛОВ Техническая классификация Драгоценные металлы (Au,
- 8. СТРОЕНИЕ МЕТАЛЛОВ Кристаллическая структураБольшинство металлов кристаллизуется в
- 9. Переход из одной структуры в другую (полиморфные
- 10. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ. ЗОННАЯ ТЕОРИЯ ЭЛЕКТРОННОГО СТРОЕНИЯ. Металлическая
- 11. Металлическая связь Схема образования энергетических уровней при увеличении числа взаимодействующих атомов[Глинка, с. 532]
- 12. Металлическая связь Схема образования энергетических уровней при увеличении числа взаимодействующих атомов[Ахметов, с. 115]
- 13. Металлическая связь Возникновение энергетических зон кристалла из энергетических уровней атомов по мере их сближения[Ахметов, с. 115]
- 14. Металлическая связьСхема расположения энергетических зон в металле, изоляторе и полупроводнике [Глинка, с.534]
- 15. ОСОБЕННОСТИ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ МЕТАЛЛОВ 1) высокие электро-
- 16. ОСОБЕННОСТИ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ МЕТАЛЛОВ Физические свойства металлов
- 17. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Металлы – восстановители в
- 18. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ ОкислениеЗащитная пленка (Al, Ti, Cr): Vоксида/ Vметалла>1Металлы неустойчивы на воздухе: Vоксида/ Vметалла
- 19. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Реакции с неметаллами 2Al +
- 20. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Реакции с водой Все металлы с Е0
- 21. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Реакции со щелочами С растворами
- 22. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Реакции с кислотами Большинство металлов
- 23. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Реакции с кислотами окисляющие кислоты
- 24. HNO3
- 25. ПримерыCu + 4HNO3(конц) = Cu(NO3)2 + 2NO2
- 26. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Реакции с солями металлов Металлы
- 27. МЕТАЛЛЫ В ПРИРОДЕ. ПОЛУЧЕНИЕ МЕТАЛЛОВ ИЗ РУД
- 28. Металлы в природеСамородные металлы (Au (112 кг),
- 29. Способы получения металлов из руд Пирометаллургия (с
- 30. СХЕМА ДОМЕННОЙ ПЕЧИ
- 31. Способы получения металлов из руд Металлотермия (восстановители
- 32. Способы получения металлов из руд Гидрометаллургия (получение
- 33. Способы получения металлов из руд Электрометаллургия (получение металлов с помощью электролиза).Электролизом получают щелочные металлы, Al.
- 34. Способы получения металлов из руд Электрометаллургия
- 35. Способы получения металлов из руд Металлы высокой
- 36. КОРРОЗИЯ МЕТАЛЛОВ
- 37. Коррозия - самопроизвольное разрушение металлических материалов из-за
- 38. КЛАССИФИКАЦИЯ КОРРОЗИИ МЕТАЛЛОВ Классификация коррозии металлов определяется
- 39. КЛАССИФИКАЦИЯ КОРРОЗИИ МЕТАЛЛОВ - атмосферная коррозия;- морская коррозия;- подземная
- 40. Газовая коррозия Алюминий – Al(Al2O3) Если снять
- 41. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ В основе коррозии
- 42. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ Механизм коррозии металлов определяется типом агрессивной среды. газовая коррозия: лимитирующая стадия - диффузия.М
- 43. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ Электрохимическая коррозия
- 44. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ Электрохимическая коррозия
- 45. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ В воде
- 46. Пример.Коррозия железа в контакте с медью в
- 47. ЗАЩИТА ОТ КОРРОЗИИ Применение химически стойких сплавов,
- 48. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3К металлам относят как собственно металлы (простые вещества: железо, медь
и т.п.), так и их сплавы (бронза, сталь), металлические соединения
(чугун, низшие карбиды, сульфиды и т.д.), интерметаллиды (соединения металлов друг с другом), органические металлы.Металлы - основа конструкций в разных областях промышленности, науки и техники. Рациональное извлечение металлов из руд, их очистка, получение сплавов и оптимальное использование материалов из них определяется в большей степени знанием закономерностей их строения, физических и химических свойств. Этим определяется необходимость изучения металлов специалистами в области добычи, переработки и использования металлов.
Слайд 4
КЛАССИФИКАЦИЯ МЕТАЛЛОВ
Из 110 элементов в периодической системе - 86 металлы.
По
положению в периодической системе.
s-металлы (все s-элементы, кроме Н и
Не);р-металлы (элементы IIIA группы кроме В, а также Sn, Pb, Sb, Bi, Po);
d- и f-металлы (переходные элементы).
Слайд 5
КЛАССИФИКАЦИЯ МЕТАЛЛОВ
Выделяют:
- щелочные металлы (Li, Na, K, Rb, Cs, Fr);
-
щелочно-земельные (Ca, Sr, Ba, Ra);
- платиновые металлы;
- лантаноиды и актиноиды
(6-AO и 7-AO).- непереходные (валентные электроны на ns- и np- подуровнях);
- переходные (валентные электроны на nd-подуровнях)
Слайд 6
КЛАССИФИКАЦИЯ МЕТАЛЛОВ
Техническая классификация
Черные металлы (Fe, Mn и их сплавы);
Тяжелые цветные
металлы (Cu, Pb, Zn, Ni, Sn). К этой группе примыкают
малые или младшие металлы (Co, Sb, Bi, Hg, Cd).Легкие металлы (ρ < 5 г/см3) (Al, Mg, Ca и т.д.);
Слайд 7
КЛАССИФИКАЦИЯ МЕТАЛЛОВ
Техническая классификация
Драгоценные металлы (Au, Ag, платиновые металлы);
Легирующие металлы (Mn,
Cr, W, Mo, Nb, V и другие);
Редкие металлы (подгруппа Sc
и лантаноиды); Радиоактивные металлы (U, Th, Pu и другие);
Легкоплавкие (Тпл < 8000 C) и тугоплавкие металлы (Тпл > 8000 C).
Слайд 8СТРОЕНИЕ МЕТАЛЛОВ
Кристаллическая структура
Большинство металлов кристаллизуется в одном из трех
структурных типов:
- с кубической объемоцентрированной кристаллической решеткой (пример – α-Fe);
-
с кубической гранецентрированной кристаллической решеткой (пример – Cu);- с гексагональной кристаллической решеткой (пример – Mg).
Слайд 9Переход из одной структуры в другую (полиморфные превращения) требуют Е
1 кДж/моль. При изменении температуры или давления многие металлы
претерпевают полиморфные превращения(примеры – α- и γ-Fe,
«белое» и «серое» Sn).
Слайд 10МЕТАЛЛИЧЕСКАЯ СВЯЗЬ. ЗОННАЯ ТЕОРИЯ ЭЛЕКТРОННОГО СТРОЕНИЯ.
Металлическая связь – химическая
связь, обусловленная взаимодействием "электронного газа" (валентные электроны) в металлах с
остовом положительно заряженных ионов кристаллической решетки.Слайд 11Металлическая связь
Схема образования энергетических уровней при увеличении числа взаимодействующих атомов
[Глинка,
с. 532]
Слайд 12Металлическая связь
Схема образования энергетических уровней при увеличении числа взаимодействующих атомов
[Ахметов,
с. 115]
Слайд 13Металлическая связь
Возникновение энергетических зон кристалла из энергетических уровней атомов по
мере их сближения
[Ахметов, с. 115]
Слайд 14Металлическая связь
Схема расположения энергетических зон в металле, изоляторе и полупроводнике
[Глинка, с.534]
Слайд 15ОСОБЕННОСТИ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ МЕТАЛЛОВ
1) высокие электро- и теплопроводность;
2) пластичность;
3)
металлический блеск и непрозрачность;
4) низкие величины потенциала ионизации (Iион) и
сродства к электрону (А);5) твердые кристаллы (кроме ртути Hg);
6) восстановители в химических реакциях;
положительная степень окисления в химических соединениях.
Слайд 16ОСОБЕННОСТИ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ МЕТАЛЛОВ
Физические свойства металлов меняются в очень
широких пределах. Например, Тпл от –390С (Hg) до 33800С (W);
плотность от 0,5 г/см3 (Li) до 22,5г/см3 (Os).
Слайд 17ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Металлы – восстановители в химических реакциях.
Окисление
Большинство металлов окисляется
кислородом воздуха. Скорость и механизм окисления зависят от природы металла.
2Mg
+ O2 = 2MgO4Li + O2 = 2Li2O
2Na + O2 = Na2O2
2K + O2 = KO2
Слайд 18ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Окисление
Защитная пленка (Al, Ti, Cr):
Vоксида/ Vметалла>1
Металлы неустойчивы
на воздухе:
Vоксида/ Vметалла
Слайд 19ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Реакции с неметаллами
2Al + 3I2 = 2AlI3
2Fe +
3Cl2 = 2FeCl3
Sn + Cl2 = SnCl2
Слайд 20ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Реакции с водой
Все металлы с Е0
водой с выделением водорода (щелочные и щелочно-земельные металлы при обычных
условиях, Fe и Zn – водяным паром при высокой температуре).2Na + 2HOH = 2NaOH + H2
2K + 2HOH 2KOH + H2
Ca + 2HOH Ca(OH)2 + H2
Слайд 21ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Реакции со щелочами
С растворами щелочей реагируют металлы, образующие
растворимые анионные гидроксокомплексы (Be, Al, Zn, Cr, Sn …).
2Al +
2NaOH + 10H2O = 2 Na[Al(OH)4(H2O)2] + 3H22Al + 6NaOH = 2 Na3AlO3 + 3H2
Zn + 2NaOH Na2ZnO2 + H2
Слайд 22ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Реакции с кислотами
Большинство металлов реагируют (окисляются) теми или
иными кислотами.
а) неокисляющие кислоты (окислитель - Н+)
2HCl + Zn =
ZnCl2 + H2HCl + Cu
Слайд 23ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Реакции с кислотами
окисляющие кислоты (окислитель - элемент кислотного
остатка) HNO3, H2SO4(конц) и др.
Cu + 2H2SO4(конц) CuSO4 +
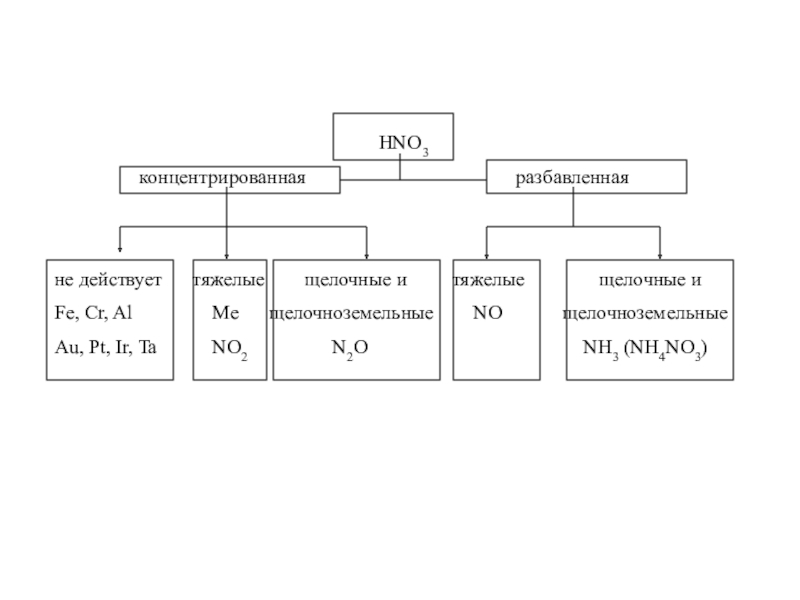
SO2 + H2O Слайд 24HNO3
концентрированная
разбавленная
не действует тяжелые щелочные и тяжелые щелочные и
Fe, Cr, Al Me щелочноземельные NO щелочноземельные
Au, Pt, Ir, Ta NO2 N2O NH3 (NH4NO3)
Слайд 25Примеры
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu +
8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4H2O
Слайд 26ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Реакции с солями металлов
Металлы могут восстанавливать ионы других
металлов
Fe + CuSO4 FeSO4 + Cu
Zn + Pb(CH3COO)2
Zn(CH3COO)2 + Pb Слайд 28Металлы в природе
Самородные металлы (Au (112 кг), Pt, Ag (13,5
т), Cu (420 т), Hg, Sn).
Руды - минералы и горные
породы, содержащие металлы или их соединения и пригодные для промышленного получения металлов (оксиды Fe3O4, CuO; сульфиды ZnS, FeS; карбонаты; сульфаты и др.)Слайд 29Способы получения металлов из руд
Пирометаллургия
(с помощью ОВР при
высоких температурах)
2Fe2O3 + 3C 4Fe + 3CO2
Cu2O + CO 2Cu
+ CO2Восстановители: С, СО, СН4.
Слайд 31Способы получения металлов из руд
Металлотермия
(восстановители - активные металлы:
Al, Ca, Mg…)
Fe2O3 + 2Al = 2Fe + Al2O3 +
QСлайд 32Способы получения металлов из руд
Гидрометаллургия
(получение металлов из растворов
их солей)
CuO + H2SO4 CuSO4 + H2O
CuSO4 электролиз
CuSO4 + Fe FeSO4 + Cu
Гидрометаллургическими методами получают Au, Ag и другие металлы.
Слайд 33Способы получения металлов из руд
Электрометаллургия
(получение металлов с помощью
электролиза).
Электролизом получают щелочные металлы, Al.
Слайд 35Способы получения металлов из руд
Металлы высокой чистоты (содержание примесей
менее 10-8 % ) получают с использованием электролиза, метода зонной
плавки, разложения на нагретой поверхности летучих солей, переплавки в вакууме.Ti(гряз) + 2I2 TiI4(пар)
Ti(чистый) + 2I2
Слайд 37Коррозия - самопроизвольное разрушение металлических материалов из-за физико-химического взаимодействия с
окружающей средой
Мировые потери из-за коррозии 20 млн.т/год.
В сумме косвенные
и прямые убытки от коррозии металлов и затраты на их защиту в промышленно развитых странах достигают 4% национального дохода (Химическая энциклопедия, т.II, с. 953). Слайд 38КЛАССИФИКАЦИЯ КОРРОЗИИ МЕТАЛЛОВ
Классификация коррозии металлов определяется конкретными особенностями среды
и условиями протекания процесса (подводом окислителя, агрегатным состоянием и отводом
продуктов коррозии, возможности пассивации металла и др.).Слайд 39КЛАССИФИКАЦИЯ КОРРОЗИИ МЕТАЛЛОВ
- атмосферная коррозия;
- морская коррозия;
- подземная коррозия;
- биокоррозия ;
- коррозия металлов
в технологических средах;
- коррозия металлов в кислотах, щелочах, органических средах, оборотных
и сточных водах и т.п.- электрохимическая коррозия металлов.
Слайд 40
Газовая коррозия
Алюминий – Al(Al2O3)
Если снять пленку Al2O3 (Al2O3 + 2NaOH
2NaAlO2 + H2O) и обработать солью ртути (Hg(NO3)2) поверхность
для предотвращения образования Al2O3 (образуется амальгама Al, то есть сплав Al и Hg), то коррозия (разрушение конструкции) происходит быстро.4Al + 3O2 2Al2O3
Слайд 41ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ
В основе коррозии металлов - реакция между
материалом и средой или между их компонентами, протекающая на границе
раздела фаз.Чаще всего - это окисление металла. Механизм сложный. Например:
3Fe + 2O2 Fe3O4;
Fe + H2SO4 FeSO4 + H2
Коррозия металлов - самопроизвольный процесс, сопровождающийся понижением G0 системы [конструкционный материал среда].
Слайд 42ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ
Механизм коррозии металлов определяется типом агрессивной среды.
газовая
коррозия: лимитирующая стадия - диффузия.
М
Слайд 43ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ
Электрохимическая коррозия
Электрохимическая коррозия - разрушение
металла в среде электролита с возникновением электрического тока.
М +
Ох Мz+ + Red - суммарный процесс М
Слайд 44ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ
Электрохимическая коррозия связана с возникновением гальванического
элемента.
Активный металл является анодом, отдает электроны и разрушается (образует
или нерастворимые продукты - ржавчину, или переходит в виде ионов в раствор), а менее активный металл или примеси являются катодом и принимают электроны. Под действием окислителей, находящихся в электролите (Н+, растворенный кислород и др.) происходит катодная деполяризация, то есть катод передает электроны, полученные от анода указанным окислителям.
М
Слайд 45ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ МЕТАЛЛОВ
В воде имеются окислители (Ох):
1) растворенный
О2:
О2 + 2Н2О + 4ē 4ОН- (Е0 =
0,40 В) (рН 7);О2 + 4Н+ + 4ē 2Н2О (Е0 = 1,228 - 0,06 рН) (рН7).
О2 может окислять металлы, стоящие до Ag+ в ряду напряжений металлов.
2) ионы Н+:
2Н+ + 2ē 2Н = Н2 (Е0 -0,41 В).
H+ может окислять металлы, стоящие до Cd в ряду напряжений металлов.
3) могут быть другие окислители.
Слайд 46Пример.
Коррозия железа в контакте с медью в присутствии электролита. Процессы
идут при рН = 7.
Продукты анодного и катодного процессов
фиксируются с помощью аналитических реакций: на аноде: Fe2+ + K3[Fe(CN)6] KFe[Fe(CN)6] + 2K+
синий
на катоде: О2 + 2Н2О + 4ē 4ОН- ;
образующиеся ионы ОН- окрашивают фенолфталеин в малиновый цвет.
Слайд 47ЗАЩИТА ОТ КОРРОЗИИ
Применение химически стойких сплавов, повышение коррозионной стойкости
материала;
Стойкие покрытия поверхности металла, предотвращение контакта металла со средой;
Обработка коррозионной
среды, снижение агрессивности среды; электрохимические методы, регулирование Е0 защищаемого изделия в данной среде.










![МЕТАЛЛЫ Металлическая связь Схема образования энергетических уровней при увеличении числа взаимодействующих атомов[Глинка, с. 532] Металлическая связь Схема образования энергетических уровней при увеличении числа взаимодействующих атомов[Глинка, с. 532]](/img/tmb/7/611297/31a6df779074626aca56ecbc4be58d10-800x.jpg)
![МЕТАЛЛЫ Металлическая связь Схема образования энергетических уровней при увеличении числа взаимодействующих атомов[Ахметов, с. 115] Металлическая связь Схема образования энергетических уровней при увеличении числа взаимодействующих атомов[Ахметов, с. 115]](/img/tmb/7/611297/f1125a1249b508c9c576522a66a82a14-800x.jpg)
![МЕТАЛЛЫ Металлическая связь Возникновение энергетических зон кристалла из энергетических уровней атомов по мере их сближения[Ахметов, с. 115] Металлическая связь Возникновение энергетических зон кристалла из энергетических уровней атомов по мере их сближения[Ахметов, с. 115]](/img/tmb/7/611297/ffd98c276bfa91db71f3c7d130882314-800x.jpg)
![МЕТАЛЛЫ Металлическая связьСхема расположения энергетических зон в металле, изоляторе и полупроводнике [Глинка, с.534] Металлическая связьСхема расположения энергетических зон в металле, изоляторе и полупроводнике [Глинка, с.534]](/img/tmb/7/611297/9d1256e235d33bd17e4aa646059cdad6-800x.jpg)