Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Методика изучения растворов и основ электролитической диссоциации в школьном
Содержание
- 1. Методика изучения растворов и основ электролитической диссоциации в школьном
- 2. План лекции1. Место и значение учебного материала
- 3. В курсе химии учащиеся углубляют и расширяют
- 4. Процесс растворенияДля подтверждения физической стороны процесса растворения
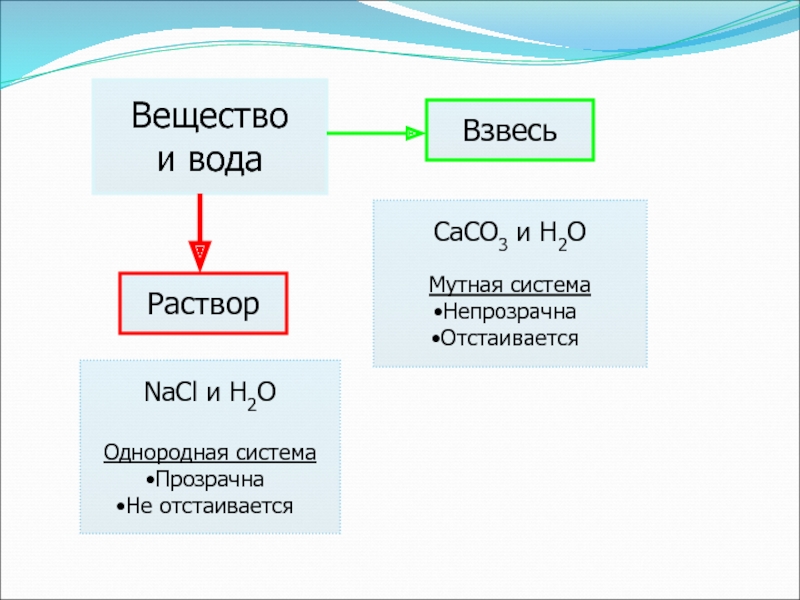
- 5. Веществои водаРастворВзвесьNaCl и H2OОднородная системаПрозрачнаНе отстаиваетсяCaCO3 и H2O Мутная система НепрозрачнаОтстаивается
- 6. Количественные понятияРастворимость вещества показывает, сколько вещества в
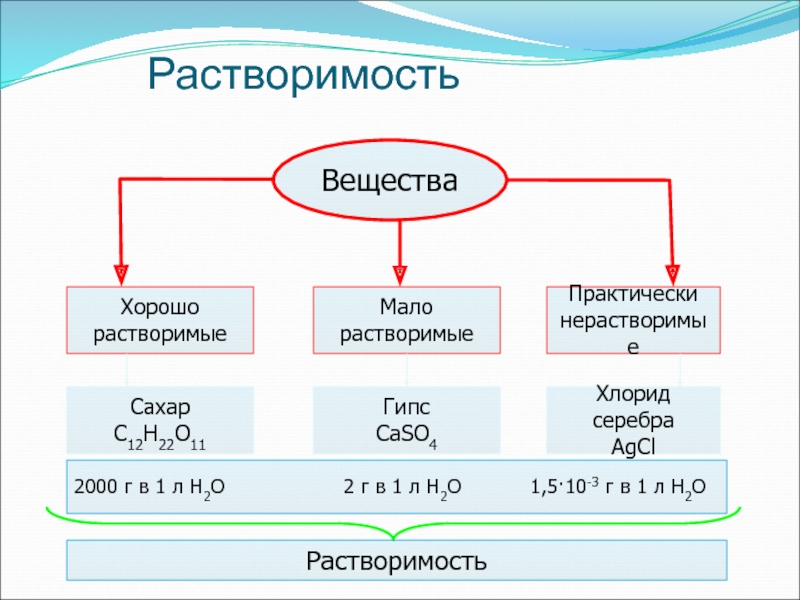
- 7. РастворимостьВеществаХорошо растворимыеМало растворимыеПрактически нерастворимыеСахар С12Н22О11Гипс СаSO4Хлорид серебраAgCl2000
- 8. Различие понятий «Растворимость» и «Массовая доля растворенного вещества»
- 9. Логическим продолжением материала о растворах является тема
- 10. Тема «Электролитическая диссоциация»Эта тема является теоретической основой
- 11. 2. Методические подходы к изучению процессов диссоциации
- 12. Электролиты – это вещества, водные растворы которых
- 13. 2. От особенностей реакций обмена к объяснению
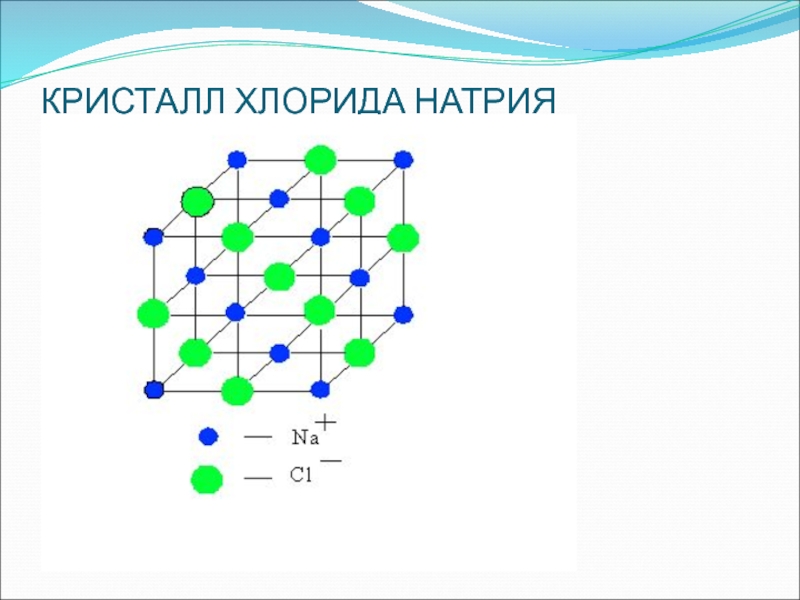
- 14. КРИСТАЛЛ ХЛОРИДА НАТРИЯ
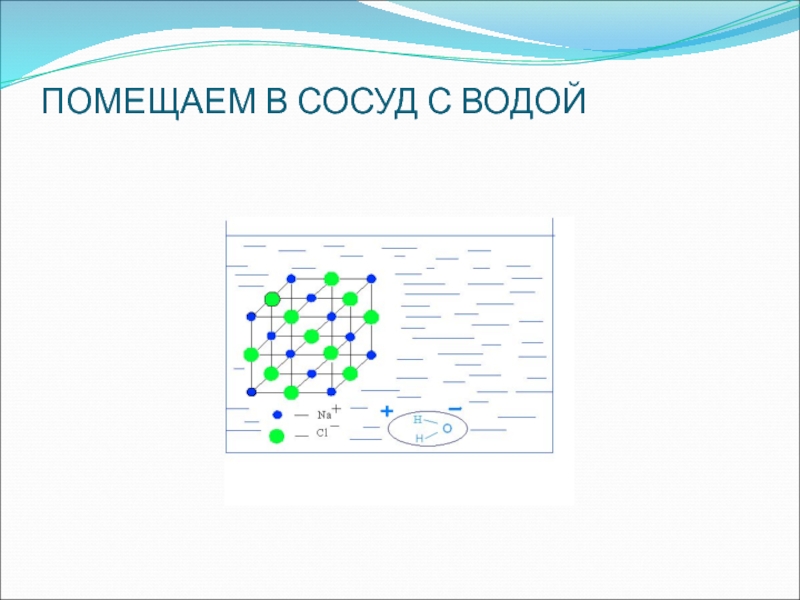
- 15. ПОМЕЩАЕМ В СОСУД С ВОДОЙ
- 16. ДИПОЛИ ВОДЫ ПОДХОДЯТ К ИОНАМ НАТРИЯ
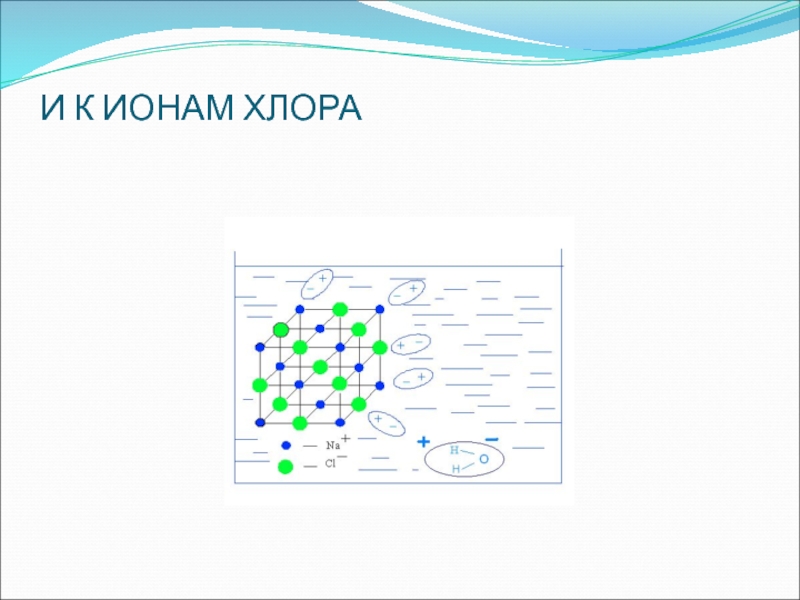
- 17. И К ИОНАМ ХЛОРА
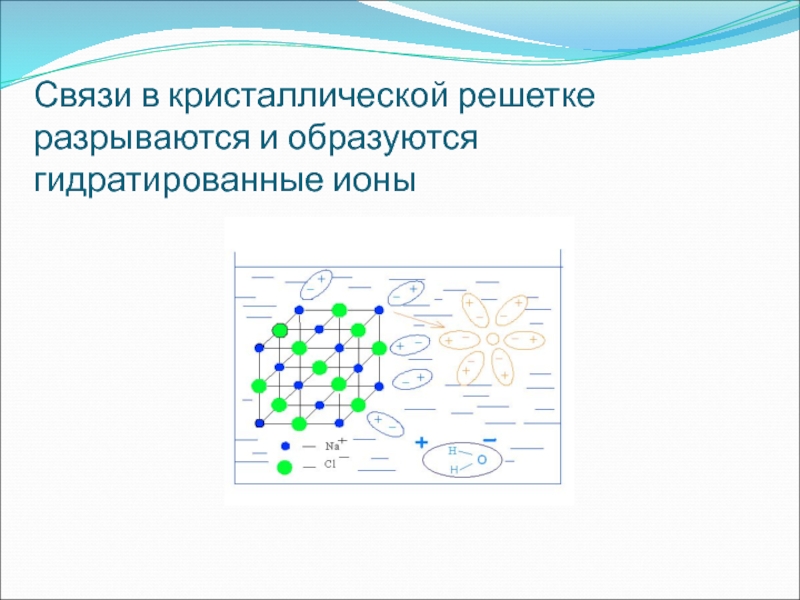
- 18. Связи в кристаллической решетке разрываются и образуются гидратированные ионы
- 19. Вещество в растворе находится в виде гидратированных ионов
- 20. На основе изученного делают выводы:вещества с ионной
- 21. И только после этого кристаллические вещества и
- 22. 3. От различия природы растворителей и процессов
- 23. Роль воды как растворителяЧтобы показать роль воды
- 24. В результате учащиеся приходят к следующим выводам:
- 25. Роль водыВывод: волшебная сила воды заключена в
- 26. В заключение делаются следующие выводы:1., 2. Первые
- 27. 3. Развитие и обобщение знаний учащихся об
- 28. Организовать эту работу можно в пять приемов:1.
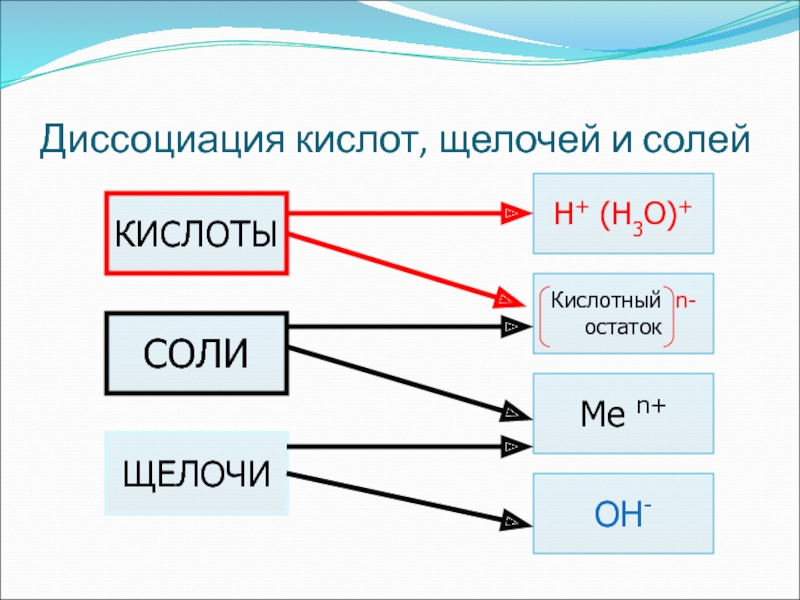
- 29. Диссоциация кислот, щелочей и солейOH-СОЛИЩЕЛОЧИН+ (Н3О)+Кислотный n-остаток Me n+КИСЛОТЫ
- 30. 2. Систематизировать знания о важнейших классах
- 31. 3. Дать определения кислот, оснований, солей
- 32. 4. Изучить реакции ионного обменаИзучение лучше начать
- 33. 5. Рассмотреть химические свойства кислот, оснований,
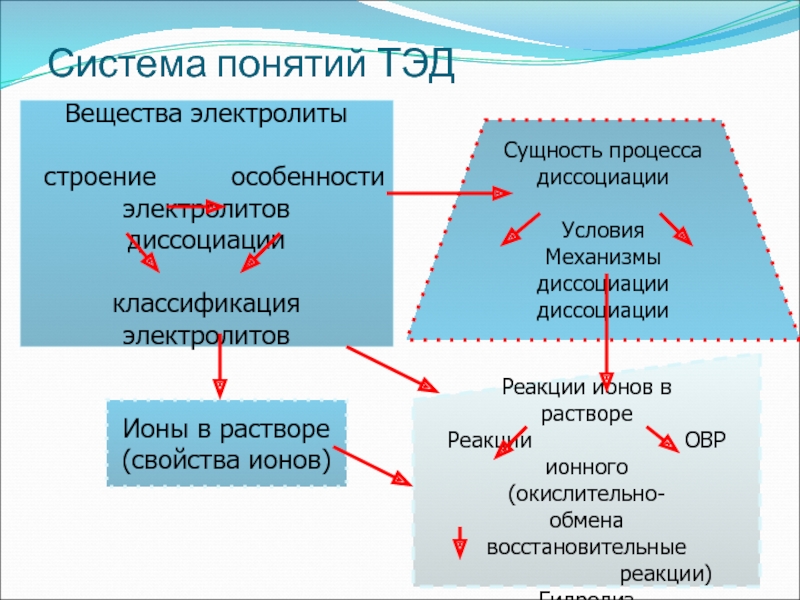
- 34. Система понятий ТЭДВещества электролиты строение
- 35. Вывод:Теория электролитической диссоциации возглавляет курс химии 9
- 36. Благодарю за внимание!
- 37. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2План лекции
1. Место и значение учебного материала о растворах и
ТЭД в школьном курсе химии
2. Методические подходы к изучению процессов
диссоциации электролитов3. Развитие и обобщение знаний учащихся об основных классах неорганических соединений в свете ТЭД
Слайд 3В курсе химии учащиеся углубляют и расширяют знания о воде
и растворах сначала в теме «Вода. Растворы. Основания» 8 класса.
Здесь изучаются химические свойства воды и ее способность растворять многие твердые, жидкие и газообразные вещества. При изучении растворов в 8 классе показывается только физическая сторона процесса растворения, а именно то, что при растворении в результате действия на вещество молекул воды, оно распадается на отдельные частицы1. Место и значение учебного материала о растворах и ТЭД в школьном курсе химии
Слайд 4Процесс растворения
Для подтверждения физической стороны процесса растворения демонстрируется опыт по
диффузии, который объясняется с точки зрения АМУ
О процессе растворения в
8 классе учащиеся должны усвоить следующее: вещества, способные образовать раствор, могут без перемешивания распределяться по всей массе раствора; для этого достаточно растворимое вещество привести в соприкосновение с растворителемСлайд 5Вещество
и вода
Раствор
Взвесь
NaCl и H2O
Однородная система
Прозрачна
Не отстаивается
CaCO3 и H2O
Мутная система
Непрозрачна
Отстаивается
Слайд 6Количественные понятия
Растворимость вещества показывает, сколько вещества в граммах может раствориться
в воде объемом, равным одному литру. Единица растворимости – г/л
Массовая
доля растворенного вещества показывает долю этого вещества, содержащегося в растворе. Она выражается только числом или в %Слайд 7Растворимость
Вещества
Хорошо
растворимые
Мало
растворимые
Практически
нерастворимые
Сахар
С12Н22О11
Гипс
СаSO4
Хлорид серебра
AgCl
2000 г в 1
л Н2О
2 г в 1 л Н2О 1,5·10-3 г в 1 л Н2ОРастворимость
Слайд 9Логическим продолжением материала о растворах является тема «Электролитическая диссоциация»
«Главное её
назначение в том, чтобы учащиеся поняли, как могут происходить не
только образование, но и разрыв химических связей, под влиянием каких факторов это происходит? Как ведут себя в растворе различные вещества?»Л. А. Цветков
Слайд 10Тема «Электролитическая диссоциация»
Эта тема является теоретической основой курса химии 9
класса. Здесь расширяются знания о веществах как электролитах и неэлектролитах,
более глубоко изучается растворение как сложный физико-химический процесс, рассматривается сущность, механизм и условия процесса диссоциации и реакций ионного обменаМатериал темы базируется на знаниях из курса физики о двух видах зарядов ионов, о причинах электрической проводимости, а также на знаниях теории химической связи курса химии VIII класса
Слайд 112. Методические подходы к изучению процессов диссоциации электролитов
Существуют три важнейших
методических подхода к изучению ТЭД:
1. От электрической проводимости растворов электролитов
к рассмотрению механизма диссоциацииОсновная цель изучения в соответствии с этим подходом: дать понятие «электролиты» и «неэлектролиты», установить связь между видом связи в соединениях и электрической проводимостью веществ, между растворимостью веществ и их электрической проводимостью
Слайд 12Электролиты – это вещества, водные растворы которых проводят электрический ток
Неэлектролиты
– это вещества, водные растворы которых не проводят электрический ток
Этот
подход способствует возникновению и закреплению в сознании учащихся широко распространенной «ошибки Фарадея» о том, что причиной электролитической диссоциации является электрический ток. Поэтому применять этот подход методически не целесообразноСлайд 132. От особенностей реакций обмена к объяснению электрической проводимости
Основная цель
этого подхода – предотвратить возможность суждения учащихся об образовании ионов
под влиянием электрического тока (ошибка Фарадея). С этой целью необходимо вначале рассматривать диссоциацию веществ с ионной и ковалентной связью без демонстрации опытов с электрическим током, т. е. сначала с помощью химических, а не физических опытов убедить учащихся в том, что в водном растворе происходит распад соединений с ионной и ковалентной полярной связью на ионыСлайд 20На основе изученного делают выводы:
вещества с ионной и ковалентной полярной
связью под действием полярных молекул воды диссоциируют на гидратированные ионы
свойства
веществ с ионным типом химической связи (солей и щелочей) и ковалентной полярной (кислот) в водных растворах определяются свойствами соответствующих гидратированных ионовСлайд 21И только после этого кристаллические вещества и их растворы испытываются
на электрическую проводимость, после чего делается новый вывод: вещества с
ионной и ковалентной полярной связью (соли, кислоты, щелочи) в водных растворах диссоциируют на ионы, поэтому проводят электрический токЭлектролиты – это вещества, которые в водных растворах или расплавах диссоциируют на ионы, вследствие чего проводят электрический ток
Этот подход требует несколько больше времени, но он методически оправдан
Слайд 223. От различия природы растворителей и процессов растворения веществ с
различными типами и видами химической связи к рассмотрению сущности процесса
диссоциации, его характеристикеПри этом подходе перед рассмотрением ТЭД необходимо подробно остановиться на природе веществ с различными типами и видами химической связи
Выясняется, какие вещества относятся к классу кислот, солей, оснований; что общего в составе всех кислот, оснований, солей; как обнаружить в растворе кислоту, основание и так далее
Слайд 23Роль воды как растворителя
Чтобы показать роль воды как растворителя, задаются
следующие вопросы: Будет ли изменяться окраска индикатора в кислоте, если
ее растворить не в воде, а в другом растворителе, например в ацетоне? Будет ли изменять окраску индикатора сухая щелочь? Будет ли более активный металл вытеснять из соли менее активный, если соль растворена не в воде, а в ацетоне? На каждый вопрос учащиеся делают предположения, которые затем проверяются экспериментальноСлайд 24В результате учащиеся приходят к следующим выводам: кислоты изменяют окраску
индикаторов только в водном растворе, индикатор изменяет окраску только в
водном растворе щелочи, более активный металл может вытеснять менее активный только из водного раствора соли. Неизбежно возникает вопрос «почему?». Для ответа на него рассматривают природу растворителя – воды. Вспоминают строение молекулы воды, тип и вид химической связи в ней, полярность молекул, после чего объясняют механизм диссоциации веществ с ионной связью на примере NaCl и ковалентной полярной связью на примере HClСлайд 25Роль воды
Вывод: волшебная сила воды заключена в значительной полярности ее
молекул в отличие от ацетона, молекула которого малополярна, или бензина,
молекула которого неполярнаПроводится опыт по определению электрической проводимости раствора хлороводорода в воде и в толуоле. Данные опыта служат основой для установления причины изменения свойств веществ при растворении их в воде
Слайд 26В заключение делаются следующие выводы:
1., 2. Первые два те же,
что при подходе № 2
3. Диссоциации веществ с ионной и
ковалентной полярной связью способствует полярность молекул растворителя. Поэтому не только вода, но и другие жидкости, состоящие из полярных молекул (спирт, аммиак и др.) также являются ионизирующими растворителями: соли, щелочи и кислоты, растворимые в этих жидкостях, диссоциируют на ионыЭтот подход также исключает ошибку Фарадея, но является несколько более сложным вследствие того, что учащиеся не знают химическую природу органических растворителей
Слайд 273. Развитие и обобщение знаний учащихся об основных классах неорганических
соединений в свете ТЭД
Особо важное значение ТЭД состоит в
расширении и углублении знаний учащихся о классах неорганических соединений. В ходе изучения этой темы развиваются знания о составе, номенклатуре, строении, характерных свойствах и классификации неорганических соединений. При этом учащиеся должны понимать, как отражается природа веществ различных классов на их свойствах и объяснять сущность многих реакций, происходящих в растворах, с точки зрения ТЭДСлайд 28Организовать эту работу можно в пять приемов:
1. Рассмотреть электролитическую диссоциацию
кислот, оснований и солей
Этот вопрос целесообразно рассматривать на примерах веществ,
которые в дальнейшем будут предметом специального изучения (HNO3, H2SO4, H3PO4, NaOH, Ca(OH)2, KNO3, Na2CO3, NaHCO3, (CuOH)2CO3)Особое внимание надо обратить на усвоение наиболее трудных вопросов: уравнений ступенчатой диссоциации кислот; составление формул кислых солей, их названий
Слайд 302. Систематизировать знания о важнейших классах неорганических соединений в
свете учения о природе химической связи, типах кристаллических решеток
Поскольку этот
материал учащимся знаком, можно организовать самостоятельную работу по заданиям такого рода:1. Приведите примеры диссоциации двух веществ, которые образуют в водном растворе одинаковые: а) катионы; б) анионы
2. Приведите три примера (кислоты, щелочи, соли): а) слабых электролитов; б) сильных электролитов
Проверку осуществить на этом же уроке
Слайд 313. Дать определения кислот, оснований, солей в свете ТЭД
Кислота
– это электролит, диссоциирующий в водном растворе с образованием ионов
гидроксония (водорода)Основание – это электролит, диссоциирующий в водном растворе с образованием гидроксид-ионов
Соль – это электролит, диссоциирующий в водном растворе с образованием положительных ионов Ме+ (или NH4+) и отрицательных ионов кислотных остатков
Слайд 324. Изучить реакции ионного обмена
Изучение лучше начать с объяснения или
повторения понятий обратимых и необратимых реакций, разъяснить на этих примерах
правила составления полных и сокращенных ионных уравнений химических реакций, показав необходимость использования при этом таблицы растворимости. Затем рассматриваются три случая реакций обмена, идущих до концаСлайд 335. Рассмотреть химические свойства кислот, оснований, солей в свете
ТЭД
Эти уроки можно провести в форме семинарских занятий, так как
материал учащимся знаком. Особое внимание на уроке нужно обратить на свойства амфотерных гидроксидов и обязательно провести подтверждающий экспериментВ углубленных классах рассматривается частное свойство солей – гидролиз
В конце темы необходимо провести обобщение, привести в систему все понятия ТЭД
Слайд 34Система понятий ТЭД
Вещества электролиты
строение особенности
электролитов
диссоциации
классификация
электролитов
Сущность процесса
диссоциации
Условия
Механизмыдиссоциации диссоциации
Ионы в растворе
(свойства ионов)
Реакции ионов в
растворе
Реакции ОВР
ионного (окислительно-
обмена восстановительные
реакции)
Гидролиз