Слайд 1МЕТОДЫ ИЗУЧЕНИЯ ГЕНЕТИКИ ЧЕЛОВЕКА
Слайд 2ОСОБЕННОСТИ ЧЕЛОВЕКА КАК ОБЪЕКТА ГЕНЕТИКИ
Слайд 31. гибридологический метод не применим, невозможность экспериментальных браков
2. человек
– существо мало репродуктивное
3. сложный геном
4. разная степень
пенетрантности и экспрессивности генов
5. Различные типы взаимодействия генов
6. проблематична одинаковая продолжительность жизни исследователя и исследуемого
7. отсутствие родословных книг
1. гибридологический метод не применим, невозможность экспериментальных браков
2. человек – существо мало репродуктивное
3. сложный геном
4. разная степень пенетрантности и экспрессивности генов
5. Различные типы взаимодействия генов
6. проблематична одинаковая продолжительность жизни исследователя и исследуемого
7. отсутствие родословных книг
Слайд 4
КЛИНИКО-ГЕНЕАЛОГИЧЕСКИЙ МЕТОД
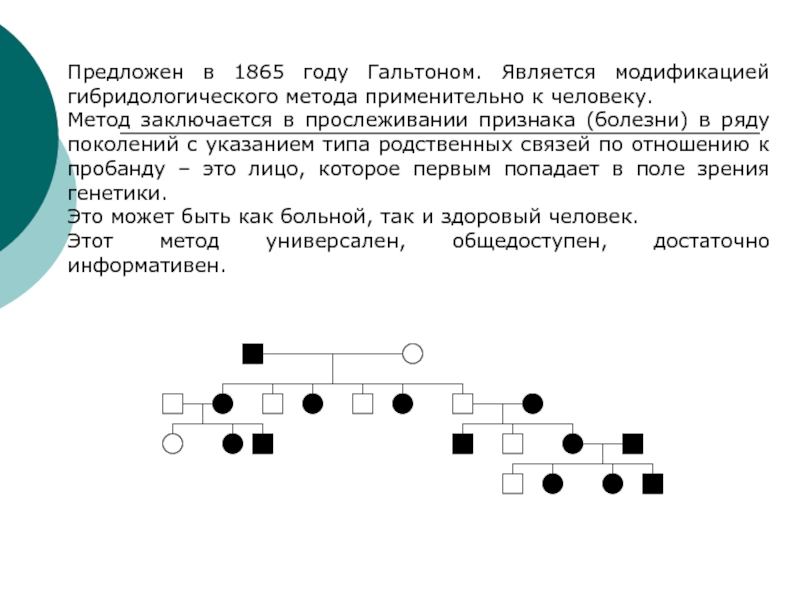
Слайд 5Предложен в 1865 году Гальтоном. Является модификацией гибридологического метода применительно
к человеку.
Метод заключается в прослеживании признака (болезни) в ряду
поколений с указанием типа родственных связей по отношению к пробанду – это лицо, которое первым попадает в поле зрения генетики.
Это может быть как больной, так и здоровый человек.
Этот метод универсален, общедоступен, достаточно информативен.
Этапы метода:
1. сбор генеалогического анамнеза (сведений) о пробанде, его
родственниках (возраст, место жительства, профессия, национальность).
2. сбор клинического анамнеза.
3. составление родословной.
4. анализ родословной. Позволяет отличить фенокопию от наследственных заболеваний, т.е. определить характер признака, а также установить тип и вариант наследования.
Слайд 7
5. определение зиготности (генотипов) всех членов родословной.
6. медико-генетический прогноз –
определение степени риска проявления патологии в потомстве у пробанда.
С помощью этого метода можно определить пенетрантность гена, изучить сцепление генов.
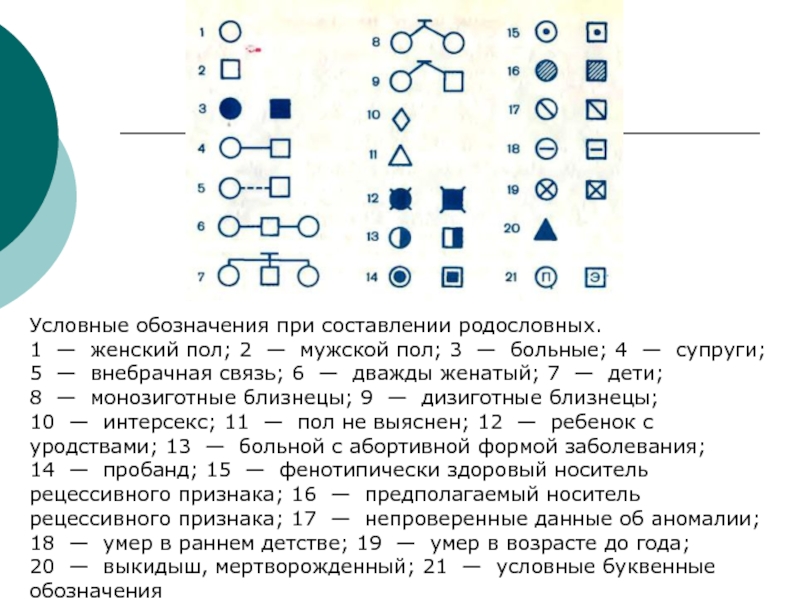
Слайд 8Условные обозначения при составлении родословных.
1 — женский пол; 2 —
мужской пол; 3 — больные; 4 — супруги; 5 —
внебрачная связь; 6 — дважды женатый; 7 — дети; 8 — монозиготные близнецы; 9 — дизиготные близнецы; 10 — интерсекс; 11 — пол не выяснен; 12 — ребенок с уродствами; 13 — больной с абортивной формой заболевания; 14 — пробанд; 15 — фенотипически здоровый носитель рецессивного признака; 16 — предполагаемый носитель рецессивного признака; 17 — непроверенные данные об аномалии; 18 — умер в раннем детстве; 19 — умер в возрасте до года; 20 — выкидыш, мертворожденный; 21 — условные буквенные обозначения
Слайд 9Аутосомное наследование – наследование признаков, контролируемых генами, локализованными в аутосомах.
Нет зависимости от пола: в равной мере болеют и мужчины,
и женщины.
Аутосомное наследование – наследование признаков, контролируемых генами, локализованными в аутосомах. Нет зависимости от пола: в равной мере болеют и мужчины, и женщины.
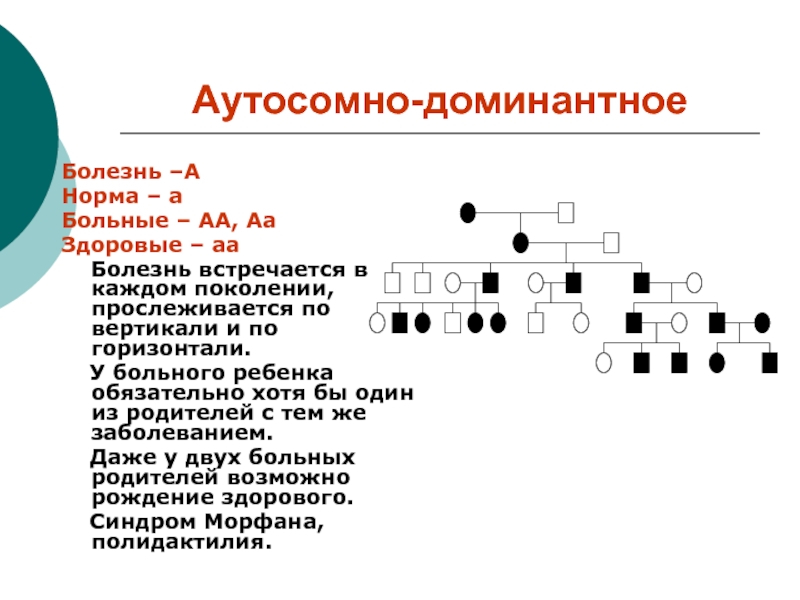
Слайд 10Аутосомно-доминантное
Болезнь –А
Норма – а
Больные – АА, Аа
Здоровые – аа
Болезнь встречается в каждом поколении, прослеживается по вертикали и по
горизонтали.
У больного ребенка обязательно хотя бы один из родителей с тем же заболеванием.
Даже у двух больных родителей возможно рождение здорового.
Синдром Морфана, полидактилия.
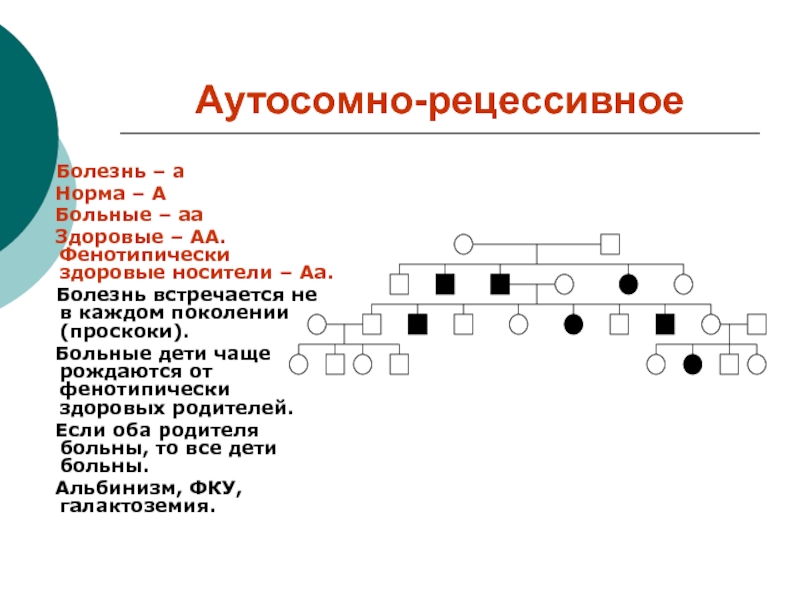
Слайд 11Аутосомно-рецессивное
Болезнь – а
Норма – А
Больные – аа
Здоровые – АА. Фенотипически здоровые
носители – Аа.
Болезнь встречается не в каждом поколении (проскоки).
Больные дети чаще рождаются от фенотипически здоровых родителей.
Если оба родителя больны, то все дети больны.
Альбинизм, ФКУ, галактоземия.
Слайд 12Сцепленное с полом наследование – наследование признаков, гены которых находятся
в половых хромосомах.
Сцепленное с полом наследование – наследование признаков, гены
которых находятся в половых хромосомах.
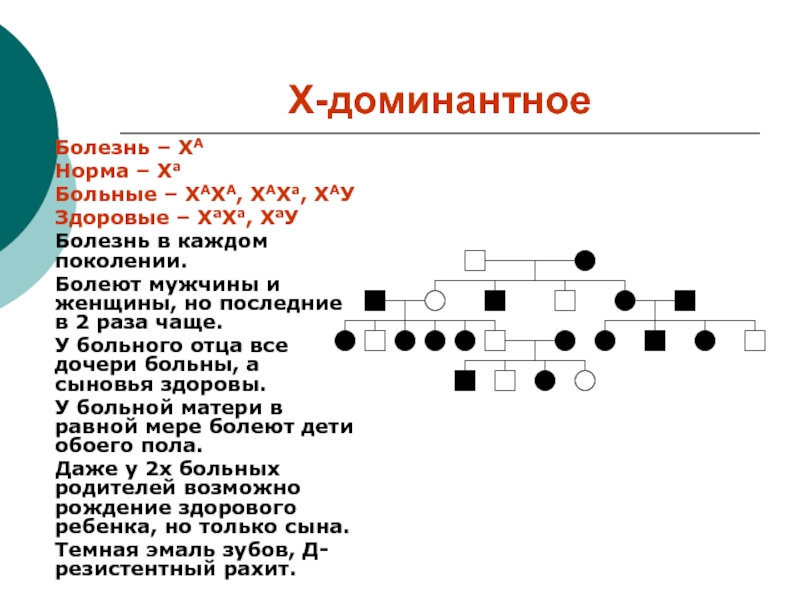
Слайд 13Х-доминантное
Болезнь – ХА
Норма – Ха
Больные – ХАХА, ХАХа, ХАУ
Здоровые
– ХаХа, ХаУ
Болезнь в каждом поколении.
Болеют мужчины и женщины, но
последние в 2 раза чаще.
У больного отца все дочери больны, а сыновья здоровы.
У больной матери в равной мере болеют дети обоего пола.
Даже у 2х больных родителей возможно рождение здорового ребенка, но только сына.
Темная эмаль зубов, Д-резистентный рахит.
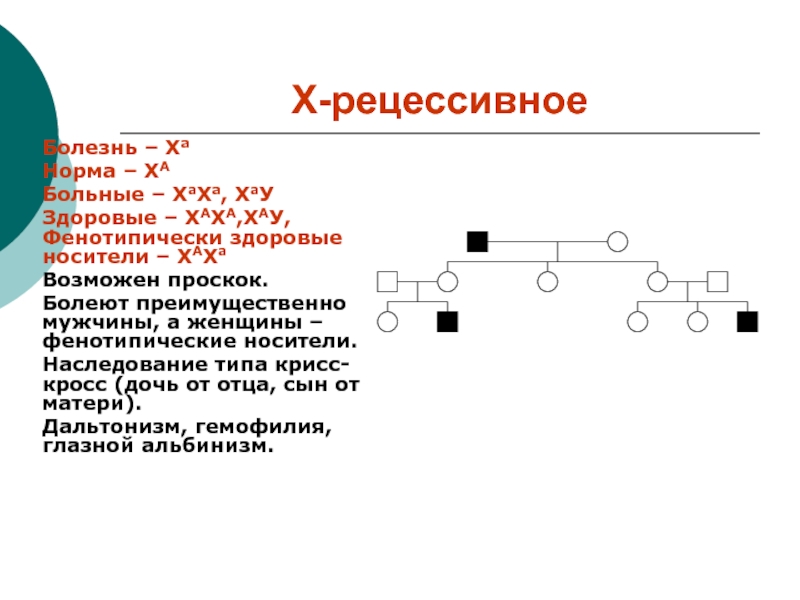
Слайд 14Х-рецессивное
Болезнь – Ха
Норма – ХА
Больные – ХаХа, ХаУ
Здоровые –
ХАХА,ХАУ, Фенотипически здоровые носители – ХАХа
Возможен проскок.
Болеют преимущественно мужчины, а
женщины – фенотипические носители.
Наследование типа крисс-кросс (дочь от отца, сын от матери).
Дальтонизм, гемофилия, глазной альбинизм.
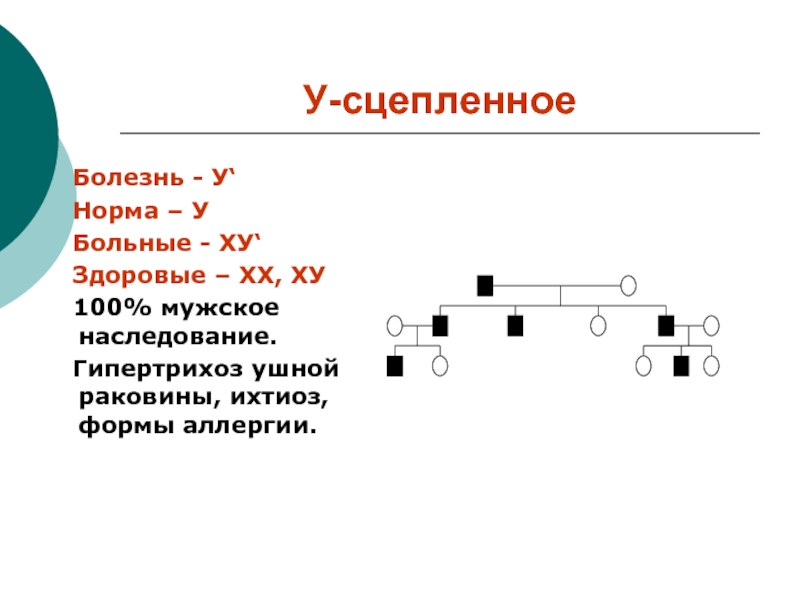
Слайд 15У-сцепленное
Болезнь - У‘
Норма – У
Больные - ХУ‘
Здоровые – ХХ, ХУ
100% мужское наследование.
Гипертрихоз ушной раковины, ихтиоз, формы аллергии.
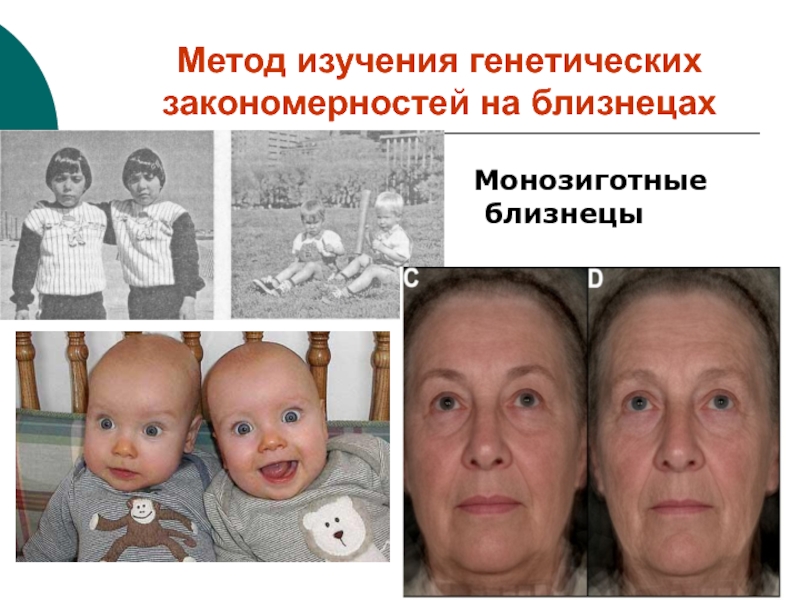
Слайд 19Метод изучения генетических закономерностей на близнецах
Монозиготные близнецы
Слайд 20однояйцевые (монозиготы).
Образуются из 1 зиготы, разделившейся на 2 или
более бластомера, каждый из которых дал начало самостоятельному эмбриону. Они
генетически идентичны. Коэффициент родства = 1.
Слайд 21двуяйцевые (дизиготы).
Развиваются из 2 или нескольких одновременно созревших и
оплодотворенных различными сперматозоидами яйцеклеток. Коэффициент родства = 0,5. генетически похожи
не более, чем обычные братья и сестры, рожденные порознь, но отличаются большим сходством средовых факторов, как пренатальных, так и постнатальных.
Частота рождения близнецов 1-2%, тройни – 1 на 10000-15000. одна треть близнецов – монозиготные.
Слайд 22
Этапы метода:
1. подбор близнецовых пар по изучаемому признаку или заболеванию.
Выборка – репрезентативная, оптимальное соотношение по полу, возрасту, зиготности.
2. разделение
общей выборки на 2 группы – монозигот и дизигот.
Слайд 23Критерии диагностики зиготности близнецов:
А) пол (один или разные)
Б) особенности плаценты
(общая или разные)
В) антигены групп крови системы АВО и резус
– системы (одинаковые или разные)
Г) лейкоцитарные антигены (совпадают или не совпадают гаплотипы системы HLA)
Д) сывороточные белки (совпадают или не совпадают)
Е) особенности дерматоглифики (одинаковые или нет отпечатки пальцев)
Ж) полиморфизм ДНК (есть ли совпадение по всем локусам)
З) метод полисимптомного сходства по призакам, независящим от внешней среды (разрез глаз, форма носа, губ, ушной раковины)
Слайд 24 3. внутрипарное сравнение монозигот и дизигот по
изучаемому признаку.
Если сходство признаков не наблюдается
в парах, то такая пара – конкордантна, если есть различия – дискордантна.
4. формула Хольцингера:
Н = (Смз – Сдз) : (100- Сдз) х 100%
Н – коэффициент наследуемости признака,
С – конкордантность.
Е = 100-Н.
Е – коэффициент влияния среды.
Метод дает возможность оценить соотносительную роль наследственности и среды в развитии конкретного признака, в отношении которого проводится исследование.
Генетическая предрасположенность, которая проявляется в конкретных условиях среды (сахарный диабет).
Н
заболевание обусловлено влиянием главным образом среды.
Слайд 26
Цитогенетический метод
(см. лекцию по кариотипу человека)
Слайд 27Онтогенетический (биохимический).
Используется для диагностики ферментопатий, т.е. заболеваний,
обусловленных нарушениями обмена веществ.
Сущность – определение в биологических
жидкостях (кровь, моча, слюна, амниотическая) начальных (исходных), побочных (нетипичных) и конечных продуктов обмена веществ качественными и количественными методами, а в ряде случаев и определение активности ферментов.
Слайд 28
Метод применяют:
в МГК для диагностики наследственных болезней обмена веществ, прежде
всего ферментопатий, а также для выявления гетерозиготных носителей рецессивных генов
с целью предупреждения рождения больных детей.
в научных целях для изучения молекулярных механизмов межгенных взаимодействий (бомбейский феномен) и для изучения молекулярных механизмов, обусловленных генными мутациями.
для установления времени проявления наследственного явления в онтогенезе.
для изучения полиморфизма и гетерогенности наследственных молекулярных болезней.
Слайд 29Метод биологического моделирования.
Основан на законе гомологических рядов наследственной
изменчивости, установленном Вавиловым в 1920 году.
Исходя из этого
можно предполагать наличие сходных наследственных болезней у животных, протекающих также как у человека.
У собак Х-сцепленная гемофилия, у мышей – альбинизм, у лошадей – мышечная дистрофия.
Вопросы лечения и профилактики наследственных болезней не могут быть решены без исследований на животных.
Этапы:
подбор биологической модели.
постановка эксперимента.
анализ результатов.
Слайд 30Метод генетики соматических клеток.
Это изучение генетических закономерностей
на соматических клетках.
Основные методики:
простое культивирование.
клонирование – получение
клона генетически идентичных клеток.
гибридизация соматических клеток основана на слиянии совместно культивируемых клеток от разных индивидов одного вида или разных видов.
использование селективных сред – селекция соматических клеток с целью получения клеток с заданными свойствами.
Слайд 31В 1960 г. французский ученый Ж. Барский выращивал в культуре
клетки двух линий мышей и обнаружил, что некоторые из них
по своим морфологическим и биохимическим свойствам оказались промежуточными между исходными родительскими клетками. Это были гибридные клетки. Такое спонтанное слияние соматических клеток в культуре ткани происходит довольно редко.
Слайд 32В смешанной культуре разных типов клеток образуются гетерокарионы — клетки,
содержащие два ядра разных клеток в одной цитоплазме. Часть таких
клеток способна размножаться митозом. После митоза из двуядерного гетерокариона образуются две одноядерные клетки, каждая из которых представляет собой синкарион — настоящую гибридную клетку, содержащую хромосомы обеих родительских клеток, то есть происходит объединение двух геномов.
Слайд 33
Гибридизация возможна между клетками не только организмов разных
видов (человек — мышь), но и разных типов (человек —
комар). Синкарионы обычно удается получать при гибридизации в пределах класса. Например, гибридные клетки человека и мыши имеют 43 пары хромосом: 23 — от человека и 20 — от мыши. В дальнейшем происходит постепенное удаление хромосом того организма, клетки которого имеют более медленный темп размножения. У гибридных клеток человека — мыши удаляются хромосомы человека.
Слайд 34
В гибридных клетках функционируют хромосомы как человека, так
и мыши, гены которых детерминируют синтез соответствующих белков. Морфологически можно
отличить каждую из хромосом (дифференциальное окрашивание). Если в гибридной клетке отсутствует какая-либо хромосома и не происходит синтез каких-то белков, то можно предположить, что гены, детерминирующие синтез этих белков, локализованы в ней.
Слайд 35
Таким образом, этот метод позволяет устанавливать группы сцепления
у человека, используя нехватки и транслокации, — выяснять и последовательность
расположения генов, то есть строить генетические карты хромосом человека.
Слайд 36Молекулярно-генетический метод
Для молекулярной диагностики доступны более 500 наследственных заболеваний.
В России диагностируются около 200.
Преимущества ДНК-диагностики:
возможность использовать для
анализа любые клетки и ткани, которые содержат ДНК.
проведение анализа на любой стадии онтогенеза.
Слайд 37Виды ДНК-диагностики
Прямая.
Можно использовать только для наследственных
заболеваний, имеющих клонированные гены с известной нуклеотидной последовательностью. Основная задача
– идентификация мутаций в гене.
Например, делеции при муковисцидозе, при ФКУ.
Преимущества: высокая точность диагностики и отсутствие необходимости анализа всей семьи.
Недостаток: применим только для известной мутации.
Слайд 38
Косвенная.
Используется, если мутации в гене не
найдены или отсутствуют частые мутации.
Диагностика основана
на использовании сцепленных с геном полиморфных маркеров, расположенных на близком расстоянии или внутри гена.
Преимущество: нужно знать только область гена. Недостатки: а) область расположения гена должна быть небольшой, так как рекомбинация может нарушить сцепление признака с маркером,
б) обязательно наличие родителей пробанда, так как нужно определить мутантные аллели и проследить их передачу пробанду,
в) информативность не более 70%.
Слайд 39ПЦР – полимеразная цепная реакция
Метод разработан Кэрри Мюллисом
в 1983 году.
ПЦР – селективная амплификация (клонирование) фрагмента
ДНК in vitro.
ПЦР – модель биологических процессов репликации ДНК.
Слайд 40
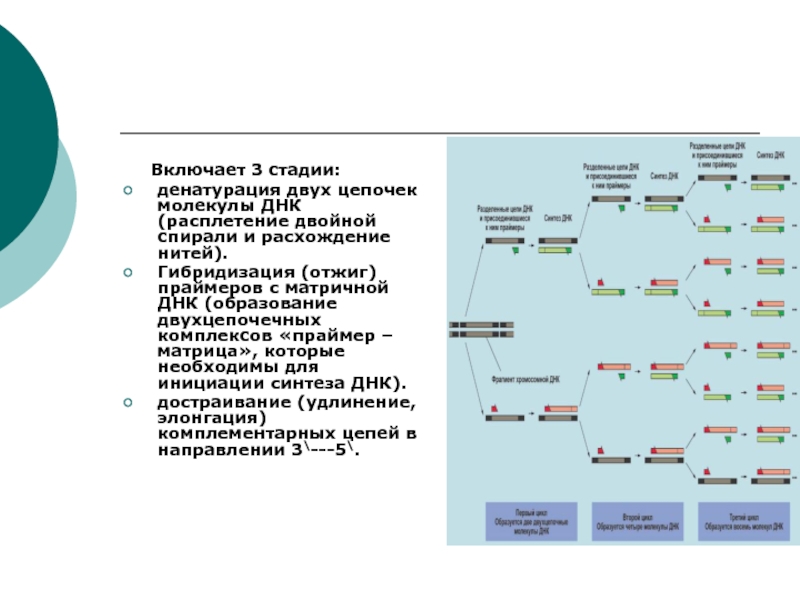
Включает 3 стадии:
денатурация двух цепочек молекулы ДНК (расплетение
двойной спирали и расхождение нитей).
Гибридизация (отжиг) праймеров с матричной ДНК
(образование двухцепочечных комплексов «праймер – матрица», которые необходимы для инициации синтеза ДНК).
достраивание (удлинение, элонгация) комплементарных цепей в направлении 3\---5\.
Слайд 42
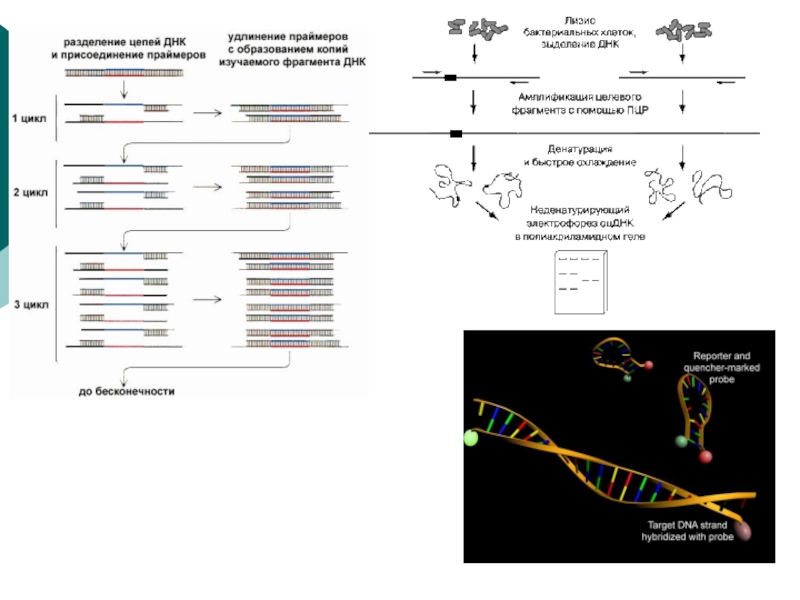
Многократные (циклические) повторы этих стадий приводят к обогащению смеси
молекулами ДНК-мишени, так как в каждом новом цикле в качестве
матрицы выступает не только исходная ДНК, но и ДНК, синтезированная в предыдущих циклах.
Слайд 43Медико-генетическое консультирование.
Для подавляющего большинства наследственных болезней эффективных способов
лечения нет. Поэтому в борьбе с наследственной патологией основная роль
отводится профилактике рождения аномального потомства.
Это в первую очередь наследование тяжелых и плохо подвергающихся лечению наследственных болезней и врожденных пороков развития.
Первая МГК в мире открыта в 1929 году в Москве. Основные принципы работы введены Давиденковым.
Слайд 44Задачи МГК:
ретроспективное и проспективное консультирование семей и больных с наследственной
и врожденной патологией.
пренатальная диагностика врожденных и наследственных заболеваний.
помощь врачам различных
специальностей в постановке диагноза наследственного или врожденного заболевания.
объяснение пациенту и его семье в доступной форме о величине риска иметь больное потомство и оказание им помощи в принятии решения.
социальная помощь адаптации семьи к жизни с больным ребенком.
пропаганда медико-генетических знаний среди населения.
Слайд 45Основные показания для направления в МГК.
наличие сходных заболеваний у нескольких
членов семьи.
первичное бесплодие супругов.
первичное невынашивание беременности.
отставание ребенка в умственном и
физическом развитии.
рождение ребенка с врожденными пороками развития.
кровное родство между супругами.
возраст родителей.
Слайд 46
Наиболее эффективный вид профилактики – проспективное консультирование (консультирование
родительских пар до рождения ребенка или молодых людей до вступления
в брак) и репроспективное консультирование (семей, в которых уже имеется больной ребенок относительно здоровых детей).
МГК можно условно разделить на 3 этапа:
уточнение диагноза заболевания.
определение генетического прогноза для потомства.
знакомство консультирующихся с риском рождения у них больного потомства и выдача рекомендаций.
Слайд 47
Под генетическим риском понимают вероятность проявления определенной аномалии
у самого пациента или его родственников. Общий риск проявления генетически
обусловленных аномалий для популяции европейцев – 3-5%.
Риск, не превышающий 5% - низкий, от 6 до 20% - средний , если риск более 20%, то деторождений не рекомендуют.
Слайд 49
Пренатальная диагностика — дородовая диагностика с целью обнаружения патологии
на стадии внутриутробного развития.
Позволяет обнаружить более 90 %
плодов с синдромом Дауна и синдром Эдвардса около 97 %, более 40 % нарушений развития сердца и др. В случае наличия у плода болезни родители при помощи врача-консультанта тщательно взвешивают возможности современной медицины и свои собственные в плане реабилитации ребёнка. В результате семья принимает решение о судьбе данного ребёнка и решает вопрос о продолжении вынашивания или о прерывании беременности.
Слайд 51
Анализ родословной родителей
Инвазивные (разрушающие) методы пренатальной диагностики
Биопсия хориона
Плацентоцентез (поздняя
биопсия хориона)
Амниоцентез
Неинвазивные (неразрушающие) методы пренатальной диагностики
Скрининг материнских сывороточных факторов
Ультразвуковой
скрининг плода, оболочек и плаценты
Сортинг фетальных клеток
Слайд 52
Амниоцентез — инвазивная процедура, заключающаяся в пункции амниотической оболочки
с целью получения околоплодных вод для последующего лабораторного исследования, амниоредукция
или введения в амниотическую полость лекарственных средств.
Амниоцентез можно выполнять в первом, втором и третьем триместрах беременности (оптимально — в 16-20 недель беременности).
Слайд 53
Классификация амниоцентеза
по времени проведения:
ранний амниоцентез:с 10 по 14-ю
недели
поздний амниоцентез: после 15-й недели беременности.
Слайд 54Показания к амниоцентезу
Пренатальная диагностика врождённых и наследственных заболеваний, основанная на
цитогенетическом и молекулярном анализе амниоцитов.
Амниоредукция (при многоводии).
Интраамниальное введение препаратов для
прерывания беременности во втором триместре.
Оценка состояния плода во втором и третьем триместрах беременности (степень тяжести гемолитической болезни, диагностика внутриутробных инфекций).
Слайд 55
ПРЕДМЕТ ГЕНЕТИКИ ПОПУЛЯЦИИ ЧЕЛОВЕКА, ЕГО ЗНАЧЕНИЕ В МЕДИЦИНЕ.
Слайд 56
Основой популяционной генетики человека стали исследования Четверикова на
природных популяциях. Выделение популяционной генетики человека в самостоятельную науку обусловлено
особенностями вида как объекта генетики и как объекта эволюции.
Популяционная генетика человека изучает генетический состав популяции, его динамику и факторы, влияющие на изменение генетического состава в пространстве и во времени.
Слайд 57
Значение законов популяционной генетики для медицины позволяет:
изучать
направленность и механизмы эволюции человека как биологического вида.
дает научные
основы для объяснения механизмов клинического полиморфизма наследственных и мультифакториальных заболеваний.
позволяет прогнозировать распространение вредных аллелей в популяциях человека и следовательно прогнозировать здоровье популяции в следующих поколениях.
Слайд 58
Структура человеческих популяций.
Популяции человека – это группы людей,
длительное время проживающие на определенной территории и свободно вступающие в
брак. В человеческих популяциях групповые свойства определяются и регулируются не только биологическими факторами, но и социальными.
Слайд 59Классификация человеческих популяций
Популяции делятся на панмиксические (нет ограничений
к свободному размножению) и непанмиксические (существуют ограничения, регулирующие размножение).
По
численности популяции делятся на: большие (более 4000 особей) и малые (менее 4000 особей) – демы и изоляты.
Слайд 60
Популяции из 1500—4000 человек называют демами, численностью до
1500 человек — изолятами.
Для демов и изолятов
типичен относительно низкий естественный прирост населения — соответственно порядка 20% и не более 25% за поколение.
Частота внутригрупповых браков в них составляет 80—90% и свыше 90%, а приток лиц из других групп сохраняется на уровне 1—2% и менее 1%.
В силу высокой частоты внутригрупповых браков члены изолятов, просуществовавших четыре поколения (примерно 100 лет) и более, являются не менее чем троюродными братьями и сестрами (сибсами).
Слайд 61
В настоящее время популяции человека имеют ряд особенностей:
1.
популяции с возрастающей численностью. Для них характерно разрушение брачных изолятов.
2.
Снижается действие естественного отбора.
3. наблюдается сходство условий жизни людей в разных климатических условиях, что устраняет причины расовых различий.
4. происходит замена одних заболеваний другими (меньше инфекционных, а больше – сердечно-сосудистых).
Слайд 62Характеристика популяций человека.
Генетические характеристики.
генетическая гетерогенность популяции, т.е. популяция состоит из
генетически разнородных особей, поддерживается за счет мутационных процессов, рекомбинации при
половом размножении.
генетическое единство и целостность – единый генофонд – совокупность генов всех особей, составляющих данную популяцию. Каждая особь – временный носитель части этого генофонда.
Слайд 63
внутрипопуляционный полиморфизм – наличие в популяции 2х или более фенотипических
форм по признаку, который стойко сохраняется из поколения в поколение.
Его генетической основой являются генетическая гетерогенность и наличие у гена 2х или более аллельных состояний.
Слайд 64
Внутрипопуляционный полиморфизм может быть:
А) гетерозиготный (обусловлен отбором в пользу гетерозигот,
основан на селективном преимуществе гетерозигот над гомозиготами. Например, ФФ –
чаще подвержены малярии, фф – гибнут, Фф- устойчивы.
Б) адаптационный (экологический). Обусловлен селективным преимуществом отдельных генотипов в определенных условиях среды. Например, полиморфизм по группам крови АВО. Он поддерживает численность популяции и ее жизнеспособность в определенных условиях среды.
Слайд 65
Генетическая структура популяции – соотношение частот аллелей и частот генотипов.
Определяется механизмами ее поддерживающими и изменяющими, от их соотношения и
зависит структура.
Поддерживающие механизмы – условия, при которых действует закон Харди-Вайнберга (1908 год): В идеальной популяции частоты генов и генотипов остаются неизменными из поколения в поколение.
Слайд 66
Идеальной считается популяция:
большая численность.
панмиксия (свободное вступление в брак), разрушение брачных
изолятов.
одинаковая вероятность образования и одинаковая жизнеспособность всех типов гамет и
зигот.
отсутствие мутаций.
отсутствие миграций.
отсутствие естественного отбора.
поколения не перекрываются во времени.
Слайд 67p² + 2pq + q² = 1
Математическое выражение закона Харди-Вайнберга
p²
+ 2pq + q² = 1
Слайд 68
Закон утверждает, что если численность популяции диплоидных организмов
настолько велика, что можно пренебречь случайными флуктуациями частот генов (генетико-автоматические
процессы), если в ней отсутствуют мутации, миграция и отбор (по изучаемому гену), то частоты генотипов AA, Aa и aa в популяции остаются одинаковыми из поколения в поколение (после первого) и удовлетворяют соотношениям Харди — Вайнберга: p2(AA): 2pq (Aa): q2(aa), где А и а — аллели несцепленного с полом гена, p — частота аллеля А, q — частота аллеля а.
Слайд 69
Механизмы, изменяющие генетическую структуру популяций.
Популяции –
это открытые системы, для которых характерны процессы, влияющие на их
генофонд и генетическую структуру.
Слайд 70Элементарные эволюционные факторы.
мутационный процесс.
Случайные факторы – основа
генетической гетерогенности, поставляет новые аллели. Мутации доминантные и рецессивные (резерв
наследственной изменчивости, т.к. они накапливаются). Из-за накопления в генофонде популяции рецессивных аллелей, приводящих в гомозиготном состоянии к снижению приспособленности отдельных особей, происходит и снижение приспособленности популяции в целом.
Различие между реально существующей и идеально приспособленной популяцией – генетический груз.
5% наследования идет с генетическими дефектами.
Мутационный груз – мутации, вновь появившиеся.
Сегрегационный груз – сегрегируют из поколения в поколение.
Рекомбинационный груз – на основе рекомбинации генов.
Миграционный груз – передается миграцией особей в популяции.
Слайд 71
2. популяционные волны – для человека
большой роли не играют.
3.миграции – увеличивают гетерозиготность.
Новые аллели в область иммиграции – поток генов.
4. изоляция – приводит к высокой частоте родственных браков и получению инбредного потомства (с пониженной жизнеспособностью).
5. дрейф генов – случайные ненаправленные изменения концентрации аллелей, независящие от селективной ценности. Обусловлены стандартной статистической ошибкой в результате выборки генов. Образуются за счет небольшой стартовой группы – эффект родоначальника или основателя.
6. отбор на выживаемость, действующий до репродуктивного периода.
7. отбор на интенсивность размножения.
8. отбор в пользу гетерозигот против гомозигот.
9. отбор в пользу гомозигот (по резус фактору).
Слайд 72
Показатели генотипов.
20% - селективная ценность генотипа – доля аллелей, передаваемая
из поколения в поколение.
80% - коэффициент отбора – доля аллелей,
устраняемых отбором.
Слайд 73
СПОНТАННЫЙ И ИНДУЦИРОВАННЫЙ МУТАГЕНЕЗ. ЗАЩИТА ГЕНОФОНДА ЧЕЛОВЕКА.
Слайд 74
Мутагенез – это процесс возникновения, формирования и реализации
наследственных нарушений. Он может быть спонтанным и индуцированным.
Слайд 75
Спонтанный – возникновение мутации при обычных физиологических состояниях организма
без дополнительных воздействий какими-либо факторами внешней среды.
Он
зависит от свойств гена, системы генотипа, физиологического состояния организма и колебаний факторов внешней среды.
Слайд 76
Характерная особенность - отсутствие специфичности – возникают в
любых генах, вызывают все виды мутаций.
Мутационный процесс идет
непрерывно, о его интенсивности судят по частоте возникновения мутаций, которую вычисляют на число гамет или зигот на одно поколение.
У человека на 1 гаплоидный набор хромосом за поколение возникает от 1 до 10 новых мутаций. Каждый ген мутирует очень редко, но так как у человека количество генов очень большое, то суммарная частота мутирования всех генов оказывается достаточно высокой.
Слайд 77
Разные гены могут мутировать с разной частотой. Ген гемофилии
проявляется с частотой 3,2х10-5, альбинизма – 2,8х10-5.
Существует несколько гипотез
о причинах спонтанного мутагенеза.
Слайд 78
гипотеза Дубинина, в основе которой лежит влияние
естественного фона радиации, который складывается из космического, земного излучения и
излучения радиоактивных изотопов. Величина естественного фона радиации составляет 0,12-0,23 радиан в год. За счет этого образуется 25% всех спонтанных мутаций (в основном мутации типа пиримидиновых димеров).
Слайд 79
метаболическая гипотеза. Накопление в организме продуктов метаболизма и
их действие на молекулы ДНК, ферменты репарации, мембраны клеток (это
свободные радикалы и соединения азота).
Слайд 80
гипотеза теплового движения атомов («тепловые шумы»), которые возникают
в период редупликации ДНК. Происходит замена или выпадение нуклеотидов.
Слайд 81
В современных условиях все большее значение приобретает индуцированный
мутагенез, характеризующийся направленностью и конкретностью причин. Частота – 10 на
1000 родившихся, а количество различных типов индивидуальных мутаций более 2000. Около 15% их оценивается как доминантные, высока частота хромосомных и геномных мутаций – 46%. По Дубинину частота индуцированных мутаций пропорциональна квадрату дозы мутагенного фактора.
Слайд 82
Антимутационные барьеры эукариот.
Несмотря на наличие огромного количества мутагенных
факторов, организмы в процессе эволюции приспособились защищаться от них, т.е.
у них выработались антимутационные барьеры.
Слайд 83
диплоидность – парность хромосом в диплоидном кариотипе.
наличие дуплицированных (повторяющихся) генов.
вырожденность
генетического кода (одна аминокислота кодируется несколькими триплетами).
мозаичное строение гена (экзо
– интронная структура).
полигенный контроль признака.
механизмы репарации.
А) фотореактивация (световая репарация)
Б) эксцизионная (темновая) репарация.
Слайд 84Антимутационная защита генофонда человека.
Существует 3 варианта решения этой задачи.
технологический. Основан
на создании замкнутых технологических циклов различных вредных производств, препятствующих выбросу
техногенных мутагенов в окружающую среду.
компонентный. Основан на выделении из окружающей среды путем генетического мониторинга различных компонентов и их дезактивация. Генетический мониторинг – испытание на мутагенность и тератогенность веществ из окружающей среды. В настоящий момент изучено около 1% искусственных мутагенов, т.к. это дорогостоящий метод.
компенсационный. Основан на повышении устойчивости генетического аппарата к экстремальным воздействиям путем испытания антимутагенных препаратов.