Слайд 1Методы определения микробной биомассы в почве
И.В. Евдокимов
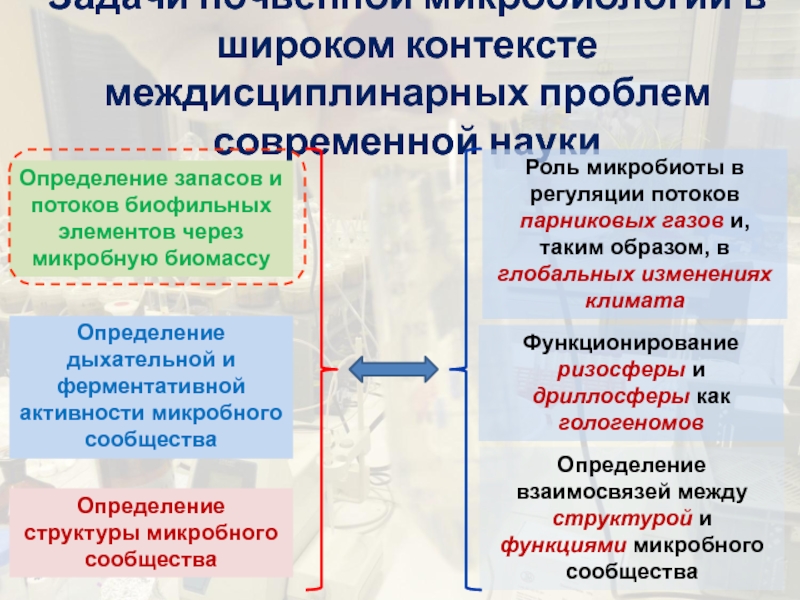
Слайд 2Задачи почвенной микробиологии в широком контексте междисциплинарных проблем современной науки
Определение
взаимосвязей между структурой и функциями микробного сообщества
Функционирование ризосферы и дриллосферы
как гологеномов
Роль микробиоты в регуляции потоков парниковых газов и, таким образом, в глобальных изменениях климата
Определение запасов и потоков биофильных элементов через микробную биомассу
Определение дыхательной и ферментативной активности микробного сообщества
Определение структуры микробного сообщества
Слайд 3Методы определения микробной биомассы– классификация по принципу получения аналитического сигнала
I. Методы, основанные на анализе биомаркеров : PLFA-PLEL (ЖК фосфолипидов),
LPS, гликолипидов, эргостерола, хинонов и др. Анализ ATФ, ДНК и РНК - неспецифических биомаркеров.
II. Биоцидные методы - фумигационный (FI, FE), регидратационный (RI, RE).
III. Методы, основанные на дыхательном отклике микробного сообщества –
субстрат-индуцированного дыхания (СИД, SIR), кинетический ( KSIR).
Слайд 4I. Методы, основанные на анализе биомаркеров
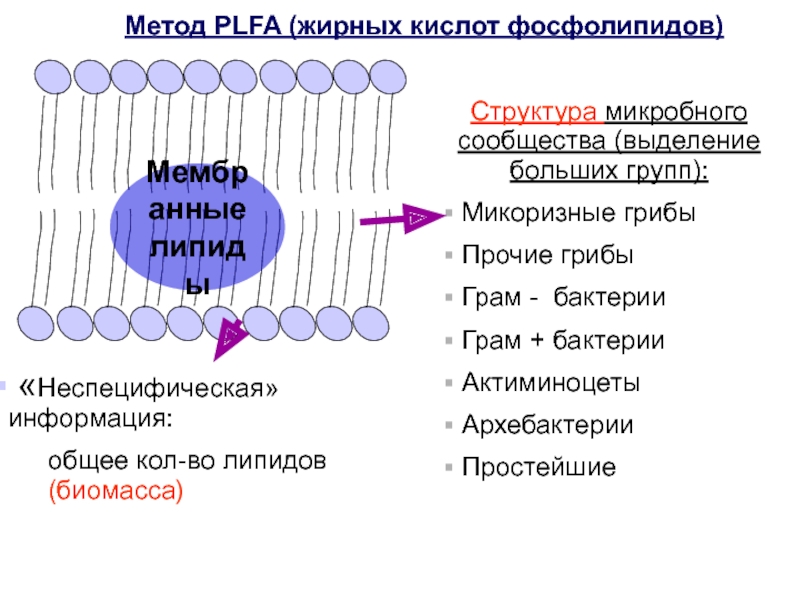
Слайд 5Метод жирных кислот фосфолипидов (ЖКФ) - phospholipid fatty acids (PLFA)
profiling
Принцип метода:
Метод PLFA основан на анализе жирных кислот
фосфолипидов (ЖКФ), входящих в состав мембран. ЖКФ не входят в состав запасных веществ клетки, а после смерти клетки подвергаются быстрому биохимическому разложению под действием внеклеточных ферментов. Это делает PLFA (ЖКФ) отличными маркерными веществами, а полученные по результатам анализов PLFA (ЖКФ) микробные профили могут быть использованы для качественного и количественного анализа микробного сообщества почвы.
Слайд 6Мембранные
липиды
Структура микробного сообщества (выделение больших групп):
Микоризные грибы
Прочие грибы
Грам - бактерии
Грам + бактерии
Актиминоцеты
Архебактерии
Простейшие
«Неспецифическая»
информация:
общее кол-во липидов (биомасса)
Метод PLFA (жирных кислот фосфолипидов)
Слайд 7Маркеры для групп организмов:
Среди наиболее часто используемых кислот (список –
НЕ исчерпывающий) выделяют следующие классы:
SATFA (saturated fatty acids, насыщенные
жирные кислоты)
Как правило, являются маркерами Г+ бактерий.
Исключения:
циклические PLFA (c префиксом Cy)– являются маркерами Г- бактерий;
n14:0, n15:0 - неспецифические (встречаются и у Г+, и у Г-);
Длинноцепочечные (длиннее С20) – маркеры эукариот (простейшие, растения).
Метод PLFA (жирных кислот фосфолипидов)
Слайд 8Маркеры для групп микроорганизмов:
MUFA (mono-unsaturated fatty acids,мононенасыщенные жирные кислоты)
Как правило,
являются маркерами Г- бактерий.
Исключения:
16:1w5 – маркер для арбускулярных микоризых
грибов;
18:1w9 – маркер для сапротрофных грибов.
Метод PLFA (жирных кислот фосфолипидов)
Слайд 9Маркеры для групп микроорганизмов:
PUFA (poly-unsaturated fatty acids, полиненасыщенные жирные кислоты)
Как
правило, являются маркерами для сапротрофных грибов.
Наиболее распространенный в почве
маркер для сапротрофных грибов - 18:2w6,9.
Прочие маркеры:
18:1w7 – маркер для метанотрофов;
10Me18:0, 10Me17:0, 10Me16:0 – маркеры для актиномицетов.
Метод PLFA (жирных кислот фосфолипидов)
Слайд 10Преимущества:
Позволяет «напрямую» применить метод стабильных изотопов (stable isotope probing, SIP)
с целью выявления групп микроорганизмов, ответственных за определенные процессы/последовательности реакций
цикла углерода.
Может быть использован не только для качественного, но и количественного анализа микробной биомассы в почве.
Соотношения между группами PLFA являются хорошими индикаторами стресса в почве.
Недостатки:
Не дает возможности определять микроорганизмы до вида или рода (за исключением актиномицетов).
Необходимость сложных экстракций с токсическими растворителями – по сути дела, это сложный метод органической химии с газохроматографическим окончанием.
Сложность с идентификацией пиков и однозначной привязкой их к стандартам-ЖКФ.
Метод PLFA (жирных кислот фосфолипидов)
Слайд 11Метод PLFA (жирных кислот фосфолипидов) – «отцы-основатели»
Слайд 12Метод PLFA (жирных кислот фосфолипидов) – «отцы-основатели»
Слайд 13Индикаторы стресса по результатам анализа ЖКФ (stress indicators as
determined by PLFA analyses)
Основные индикаторы
Соотношение «грамположительные бактерии/ грамотрицательные
бактерии» (Gram-positive-to-Gram-negative ratio). Соотношение «насыщенные ЖКФ/мононенасыщенные ЖКФ» как аналог данного индекса (SATFA/MUFA ratio as an analogue of that index).
Соотношение trans/cis изомеров (напр., 16:1w7t/16:1w7).
Соотношение «циклические ЖКФ/их моноеновые предшественники» (cyclopropyl PLFA to monoenoic precursors ratio) – напр., в парах cy17:0/16:1w7 и cy19:0/18:1w7.
Вспомогательные индикаторы:
Относительное обилие тех или иных специфических ЖКФ – маркеров микромицетов, бактерий, простейших и т.д. (abundance of specific PLFA – markers of fungi, bacteria, protozoa etc). Соотношение «грибы/бактерии» (fungi/bacteria ratio).
Слайд 14Как это выглядит (стадии экстракции):
Метод PLFA (жирных кислот)
Университет г. Гёттинген,
Германия
Слайд 15Метод PLFA (жирных кислот)
Как это выглядит (стадии дериватизации):
Университет г. Гёттинген,
Германия
Слайд 16Метод PLFA (жирных кислот)
Как это выглядит (оборудование):
Слайд 17Выделение ДНК из почвы
Как это выглядит (I), стадии 1
– 4 :
Слайд 18Выделение ДНК из почвы
Как это выглядит - стадии 5
- 8 (II) :
Слайд 19Выделение ДНК из почвы
Как это выглядит - стадия 8
с дальнейшим определением концентрации ДНК (III) :
Полимеразная цепная реакция, ПЦР
(PCR)
Слайд 21Фумигационный метод
Принцип метода
Почва подвергается воздействию паров фумиганта в течение
24 ч (чаще всего, хлороформа CHCl3 ), а биомасса микроорганизмов,
убитых этой биоцидной обработкой, определяется по приросту (flush) в выделении СО2 при последующей инкубации почвы - метод фумигации инкубации, fumigation-incubation (FI) (Jenkinson & Powlson, 1976), либо по приросту (flush) растворимых соединений углерода (в других вариантах - азота, фосфора или серы) – метод фумигации-экстракции, fumigation-extraction (FE) (Brookes et al., 1985).
Слайд 22Фумигационный метод
Этапы определения методом фумигации (I)
Открытые чашки/стаканчики/сосуды с почвой (навески
20 – 40 г в пересчете на абс.сух.) помещают в
эксикатор, дно которого выстелено фильтровальной бумагой, смоченной в воде. В эксикатор ставят стаканчик с хлороформом, на дно стакана кладут стеклянные бусы для предотвращения образования слишком больших пузырьков хлороформа.
Закрывают эксикатор крышкой, подсоединяют вакуумный насос и вакуумируют до появления пузырьков хлороформа в стаканчике. Желательно, чтобы кипение продолжалось не менее 2 мин.
Отсоединяют насос, изолируют атмосферу внутри эксикатора от внешней атмосферы, оставляют эксикатор в темноте при комнатной температуре на 24 часа.
Открывают эксикатор, удаляют стаканчик с остатками хлороформа. Затем подсоединяют насос и вакуумируют систему в течение нескольких минут, затем открывают краны, заполняя эксикатор обычным воздухом. Повторяют процедуру 4 – 5 раз с целью удаления остатков фумиганта в почве. Вынимают емкости с почвой из эксикатора.
Слайд 23Фумигационный метод
Этапы определения методом фумигации (II)
Делают солевые экстракты (в 0,25
– 0,5 М растворе K2SO4) из почвы, подвергшейся фумигации, анализируют
содержание растворимого С (N, P или S).
Из полученных величин С (N, P или S) в растворе (FE) или выделившемся СО2 (FI) вычитают соответствующие величины, определенные в контрольной почве. Контролем служит свежая почва, не подвергшаяся фумигации.
Рассчитывают величину биомассы по формуле
Cbio = (Fc-Ufc) / kc = flushC / kc
(или по аналогичным формулам для других биофильных элементов),
где Fc – С в фумигированной почве, Ufc – С в контроле, kc – пересчетный коэффициент (conversion factor), flush C – прирост («флаш») растворимого или минерализуемого углерода.
Слайд 24Как это выглядит:
Фумигационный метод
Институт почвенной экологии,
Научн.-иссл. Центр Гельмгольцевского общества,
Нойерберг/Мюнхен, Германия
Университет г. Гёттинген, Германия
Слайд 25Фумигационный метод: «прямая экстракция» (Setia et al., 2012)
Принципиальное отличие от
фумигации-экстракции и фумигации-инкубации:
Замена процедуры экспозиции в парах хлороформа на
экстракцию с эмульсией хлороформа в растворе K2SO4.
Длительность экспозиции 1 ч.
Дозировка хлороформа – 1мл/10 г почвы (возд.-сух вес).
Применяется для анализа С,N и P микробной биомассы в почве.
Слайд 26Фумигационный метод: «прямая экстракция» (Setia et al., 2012)
Преимущества «метода прямой
экстракции» по сравнению с другими вариантами фумигационного метода:
Отсутствие довольно утомительной
и опасной процедуры вакуумирования эксикатора.
Не нужен специальный вакуумный насос, стойкий к органическим растворителям (экономия средств).
Экономия времени при проведении анализов: не нужно тратить сутки на экспозицию; не нужно многократно вакуумировать эксикатор по окончании экспозиции с целью избавления от остаточных концентраций хлороформа в растворе.
Слайд 27Регидратационный метод
Принцип метода
Биоцидная обработка фумигантом (как это делается в
фумигационном методе) заменяется на высушивание почвы при 65 – 70оС
в течение 24 ч. По окончании высушивания прирост (flush) в С и N, вызванный поступлением в почву убитой биомассы микроорганизмов, определяется аналогично методу фумигации-экстракции (FE), или после добавления воды – как в методе фумигации-инкубации (FI) (Благодатский и др., 1987).
Слайд 28Регидратационный метод
Преимущества метода по сравнению с фумигационным:
Не нужно
использовать токсические вещества (фумиганты).
Меньшая трудоемкость, отсутствие манипуляций
с вакуумным эксикатором.
Возможность хранить высушенные пробы длительное время, «накапливая» их для экстракции и анализа на С и N.
Недостатки метода по сравнению с фумигационным:
Большее количество растворенных органических веществ в экстракте, имеющих немикробное происхождение (собственно ПОВ становится более растворимым в результате высушивания).
Нет взаимозаменяемости экстрактов K2SO4 и CaCl2, которая бывает у образцов многих сельскохозяйственных почв при использовании метода FE.
Отсутствие апробации метода на широком ряде почв и экологических условий – этот метод не является «стандартным», общепризнанным методом.
Слайд 29Фумигационный и регидратационный методы
Способы определения пересчетных коэффициентов (I):
Сравнение с
результатами прямого микроскопирования (Jenkinson & Powlson, 1976).
По результатам определения С
или N в биомассе микроорганизмов, выращенных на искусственных средах (Van Veen et al., 1987) - «непрямой метод».
Для kEN – расчет по усредненному значению С:N во “flush” после фумигации (Joergensen & Mueller, 1996) - «непрямой метод».
Слайд 30Фумигационный и регидратационный методы
Способы определения пересчетных коэффициентов (II):
«Прямая калибровка»
с внесением 13C или 14C меченого С субстрата (при определении
kEC) или 15N меченого источника N (при определении kEN) (Brookes et al., 1985; Jenkinson, 1988; Blagodatsky & Yevdokimov, 1998).
Большинство исследователей выбирает простой путь – берут наиболее часто встречающиеся в литературе величины kEC = 0,45 и kEN = 0,54 и считают величины пересчетных коэффициентов постоянными.
Это – главный источник ошибок при применении биоцидных методов!!!
Слайд 31Фумигационный и регидратационный методы
Способы определения пересчетных коэффициентов (III):
«Прямая калибровка»
с изотопами с широким интервалом величин C:N во вносимом субстрате,
либо с широком интервалом величин других факторов (рН, почвенная влажность и т.д.) При этом появляется возможность получить эмпирические уравнения зависимости k от вышеперечисленных экофизиологических факторов.
Слайд 32Фумигационный и регидратационный методы
Способы определения пересчетных коэффициентов (IV):
Примеры таких
эмпирических уравнений:
kEC = 0,2(C/N)0,3
C:N в калибровочном эксперименте колебалось от 3,4
до 36,2, при этом kEC варьировали от 0.18 (при максимальной величине C:N) до 0,62 (при минимальной) (Yevdokimov et al., 2006).
kEN = (4,7 (1 – kEC) + (C/N) kEC) kEC/(C/N) (Blagodatsky & Yevdokimov, 1998).
Общая закономерность: чем выше соотношение C:N, тем ниже пересчетный коэффициент.
Слайд 33Фумигационный метод
Трудности при определении фосфора микробной биомассы в почве:
Необходимо количественно
определить сорбцию Р-содержащих соединений.
Необходимо количественно определить изотопный обмен при определении
пересчетного коэффициента в опытах с радиоактивной меткой азота (32Р и 33Р).
В связи с этим перспективным представляется использование анионно-обменных смол (anion-exchange membranes, AEM).
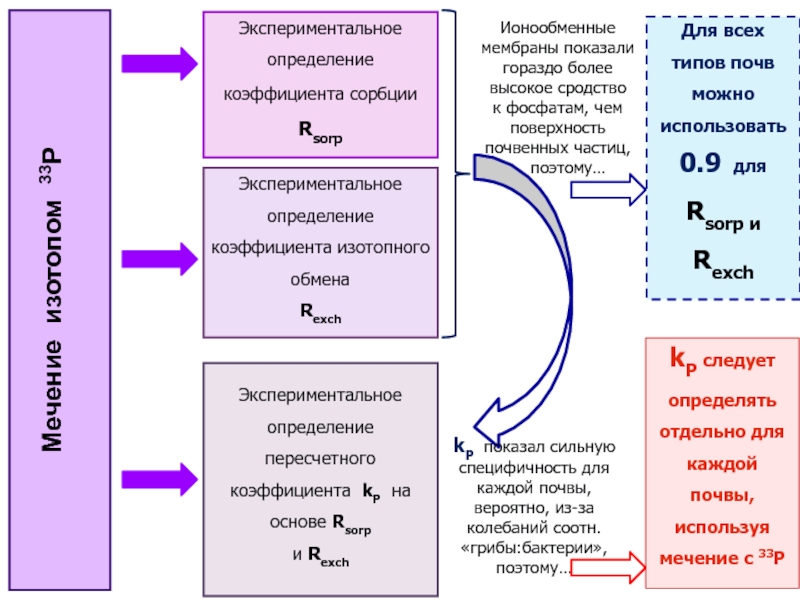
Слайд 34kP следует определять отдельно для каждой почвы, используя мечение с
33P
Для всех типов почв можно использовать
0.9 для
Rsorp и
Rexch
Мечение изотопом 33P
Экспериментальное определение коэффициента сорбции Rsorp
Экспериментальное определение коэффициента изотопного обмена
Rexch
Экспериментальное определение пересчетного коэффициента kP на основе Rsorp
и Rexch
Ионообменные мембраны показали гораздо более высокое сродство
к фосфатам, чем поверхность почвенных частиц,
поэтому…
kP показал сильную специфичность для каждой почвы, вероятно, из-за колебаний соотн. «грибы:бактерии», поэтому…
Слайд 35Буквами показаны существенные различия между почвами при P < 0.05,
определенные по тесту Тьюки (n=3).
Результаты. Извлекаемость 33P после сорбции и
изотопного обмена во время ионообменной процедуры (%); пересчетные коэффициенты для расчета микробного P (+ SE)
Yevdokimov et al., 2016
Слайд 36Фумигационный метод: «прямая экстракция» при определении микробного Р
Слайд 37Фумигационный метод: «прямая экстракция» при определении микробного Р
Слайд 38Использование концентрации ДНК, выделенной из почвы, в качестве индекса общей
микробной биомассы
Semenov et al. (2017) :
Cмик (мкг/г почвы) = FDNA
× dsDNA (мкг/г почвы),
где FDNA – пересчетный коэффициент. Величины пересчетного коэффициента составили:
FDNA = 4,4 – при калибровке по методу фумигации-экстракции (FE)
FDNA = 5,1 – при калибровке по методу СИД (SIR)
Joergensen (2006) :
Cмик (мкг/г почвы) = FPLFA × PLFA (нмоль/г почвы),
где FDNA – пересчетный коэффициент. Величины пересчетного коэффициента составили:
FPLFA = 5,8 – при калибровке по методу фумигации-экстракции (FE)
FDNA = 6,0 – “ – “ -
Слайд 39III. Методы, основанные на определении дыхательного отклика микробного сообщества
Слайд 40Метод субстрат-индуцированного дыхания (СИД) – Substrate induced respiration (SIR)
Принцип метода
В
почву вносят глюкозу и определяют дыхательный отклик микробного сообщества на
внесение легкодоступного субстрата, продолжающийся в течение первых 3 - 4 ч (Anderson & Domsch, 1978). Углерод микробной биомассы рассчитывается с использованием пересчетного коэффициента.
Слайд 41Этапы определения методом СИД (SIR)
В навеску почвы 10 –
40 г вносят раствор глюкозы или сухую глюкозу, перемешанную с
тальком, прокаленным песком или др. инертным веществом. Почву, обогащенную углеродным субстратом, помещают в сосуд/ пластиковую трубку, герметично изолированную от окружающей атмосферы эластичной крышкой или мембраной, и инкубируют в течение нескольких часов в термостатических условиях.
Производят периодическое (каждые 0,5 – 1 ч) определение скорости выделения СО2 из почвы (почвенного дыхания).
Рассчитывают углерод микробной биомассы y (мкг С/ г) по следующей формуле:
y = 40,04x + 0,37 ,
где x – интенсивность дыхания (мкл СO2/( г * ч)) – Anderson & Domsch (1978).
Метод СИД (SIR)
Слайд 42Определение скорости выделения СО2:
Газохроматографическое – анализ производится на газовом
хроматографе - gas chromatograph, GC (вручную или с автоматизированной системой
пробоотбора и измерений).
Методом инфракрасной спектроскопии –анализ производится на инфракрасном газовом анализаторе – infrared gas analyzer (IRGA) (вручную или с автоматизированной системой пробоотбора и измерений). .
Адсорбционным методом - почва помещается в пластиковые стаканчики, стаканчики герметически изолируют в микрокосме с емкостью, содержащей раствор КОН. Измерения проводимости раствора щелочи производятся автоматически через заранее установленные интервалы времени. Уменьшение проводимости пропорционально поглощению СО2 из атмосферы микрокосма.
Метод СИД (SIR)
Слайд 43Метод СИД (SIR)
Преимущества СИД по сравнению с биоцидными методами
Не
нужно использовать токсические вещества (фумиганты), не нужно производить измерения растворимых
соединений С и N.
Меньшая трудоемкость при использовании автоматической установки с IRGA или RESPICOND, возможность использовать большее число повторностей.
Возможность определять микробную биомассу параллельно с базальным дыханием на той же установке.
Недостатки СИД по сравнению с биоцидными методами
Нельзя определить N, P и S в микробной биомассе.
Нельзя определить изотопный состав микробной биомассы.
Слайд 44Метод СИД (SIR)
Пересчетный коэффициент:
Распространенной ошибкой является использование коэффициента 30
для расчетов, в которых величина х уже приведена к размерности
мкг СО2-С/(г * ч). В этом случае происходит занижение расчетной величины микробной биомассы почти вдвое: фактически нужно подставлять пересчетный коэффициент 56.
Слайд 45Важнейшее следствие недоразумений с пересчетными коэффициентами в FE, FI и
SIR:
В ряде публикаций величины микробной биомассы, полученные методом СИД (SIR),
оказывались ниже таковых, полученных фумигационным или регидратационным методами. Это – следствие несовершенства методик определения пересчетных коэффициентов!
На этом основании, а также в связи с тем, что в методе СИД (SIR) определяется дыхательная активность микробного сообщества, некоторые авторы до сих пор утверждают, что метод СИД (SIR) определяет «активную микробную биомассу». Это – ошибка!!! И биоцидные методы, и СИД (SIR) предназначены и откалиброваны для определения одного и того же пула – общей микробной биомассы.
Слайд 46Главная проблема при использовании любых методов определения микробной биомассы в
почве :
Определение пересчетного коэффициента !!!
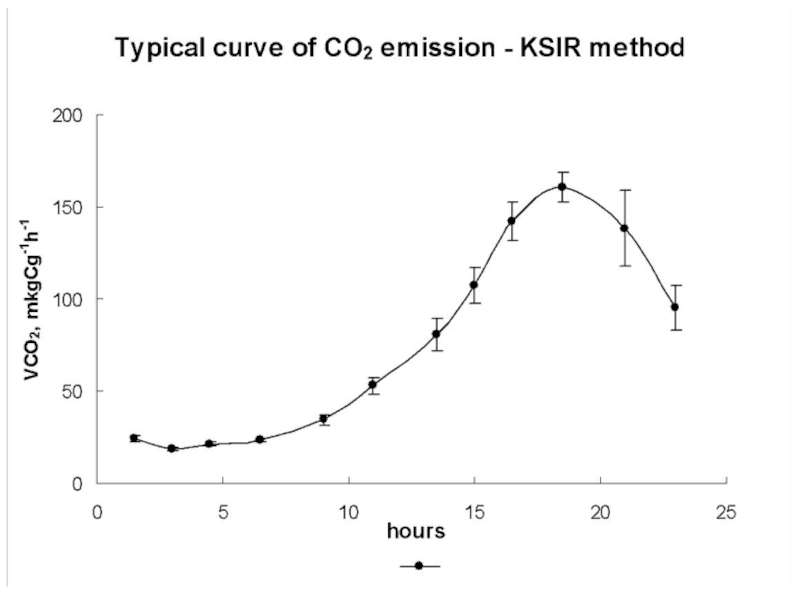
Слайд 47Кинетический метод – kinetics of substrate-induced response (KSIR)
Принцип метода:
В
почву вносят глюкозу и определяют динамику выделения СО2 в течение
16 – 24 ч после внесения легкодоступного субстрата (Panikov & Sizova, 1996). Общая и активная микробная биомасса, а также удельная скорость роста рассчитываются с использованием уравнений экспоненциального роста. Определения скорости выделения СО2 производятся в динамике (оптимально – не реже 1 раза в час) аналогично тому, как это делается в методе СИД (SIR).
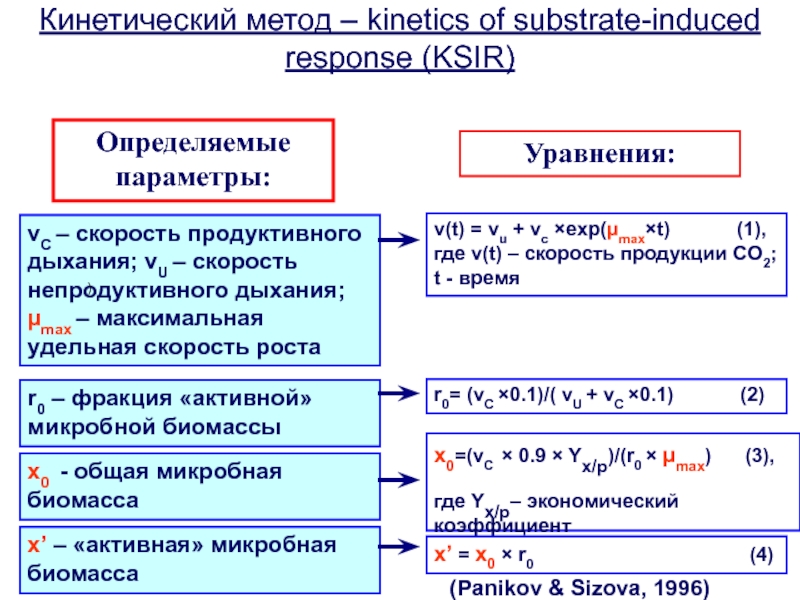
Слайд 48vC – скорость продуктивного дыхания; vU – скорость непродуктивного дыхания;
µmax – максимальная удельная скорость роста
Кинетический метод – kinetics
of substrate-induced response (KSIR)
Определяемые параметры:
Уравнения:
v(t) = vu + vc ×exp(µmax×t) (1), где v(t) – скорость продукции CO2; t - время
(Panikov & Sizova, 1996)
)
r0 – фракция «активной» микробной биомассы
r0= (vC ×0.1)/( vU + vC ×0.1) (2)
x0 - общая микробная биомасса
x0=(vC × 0.9 × Yx/p)/(r0 × µmax) (3),
где Yx/p– экономический коэффициент
x’ = x0 × r0 (4)
x’ – «активная» микробная биомасса
Слайд 50Кинетический метод – kinetics of substrate-induced response (KSIR)
Преимущества KSIR перед
другими методами определения микробной биомассы
Определение не только общей, но
и активной микробной биомассы.
Определение параметров микробной кинетики, что особенно важно при моделировании микробного роста в почве.
Большая чувствительность по сравнению с СИД при определении быстрой динамики микробной биомассы в почве и ризосфере.
Не требуется дополнительных лабораторных манипуляций по сравнению с СИД – кинетику выделения СО2 можно изучать в тех же пробах.
Недостатки KSIR по сравнению с другими методами определения микробной биомассы
Привлечение довольно сложного математического аппарата, высокая трудоемкость расчетов.
Параметры µmax и vc часто бывают скоррелированными между собой – результаты расчетов микробной биомассы поэтому получаются не свободными от субъективизма исследователя.
Использование фиксированных значений коэффициента CN-резистентного дыхания и экономического коэффициента Y.
Отсутствие апробации на широком ряде почв и экосистем.
Слайд 51Как это выглядит (определение на установке с IRGA):
Методы СИД (SIR)
и кинетический (KSIR)
Технический Университет г. Инсбрук, Австрия
Слайд 52Как это выглядит (определение на установке RESPICOND):
Методы СИД (SIR) и
кинетический (KSIR)
Институт почвенной экологии,
Научн.-иссл. центр Гельмгольцевского общества, Нойерберг/Мюнхен, Германия
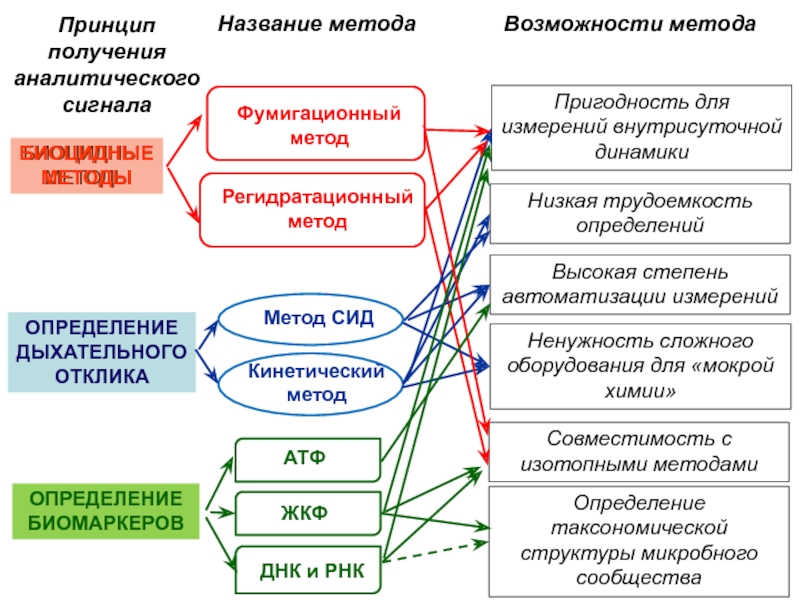
Слайд 53Ненужность сложного оборудования для «мокрой химии»
Совместимость с изотопными методами
Пригодность для
измерений внутрисуточной динамики
Высокая степень автоматизации измерений
Определение таксономической структуры микробного
сообщества
БИОЦИДНЫЕ МЕТОДЫ
Возможности метода
Фумигационный метод
Регидратационный метод
Название метода
Принцип получения аналитического сигнала
БИОЦИДНЫЕ МЕТОДЫ
ОПРЕДЕЛЕНИЕ ДЫХАТЕЛЬНОГО ОТКЛИКА
ОПРЕДЕЛЕНИЕ БИОМАРКЕРОВ
СИД
Метод СИД
СИД
Кинетический
метод
АТФ
ЖКФ
ДНК и РНК
Низкая трудоемкость определений
Слайд 54Илья Витальевич Евдокимов
Контакты:
ilyaevd@rambler.ru
ilyaevd@yahoo.com
Евдокимов И.В. Методы определения биомассы почвенных микроорганизмов
// Russian Journal of Ecosystem Ecology. 2018. Т. 3. №
3. С. 1-20. DOI: 10.21685/2500-0578-2018-3-5, Q4.