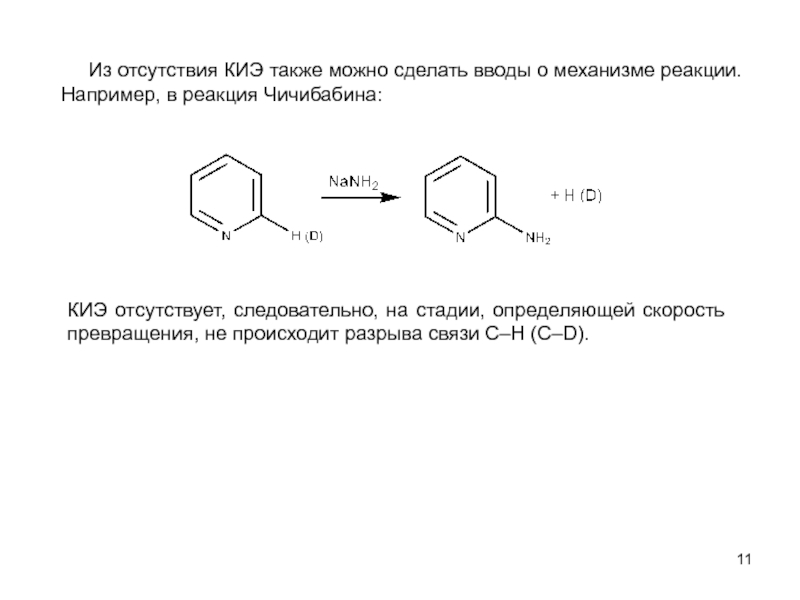
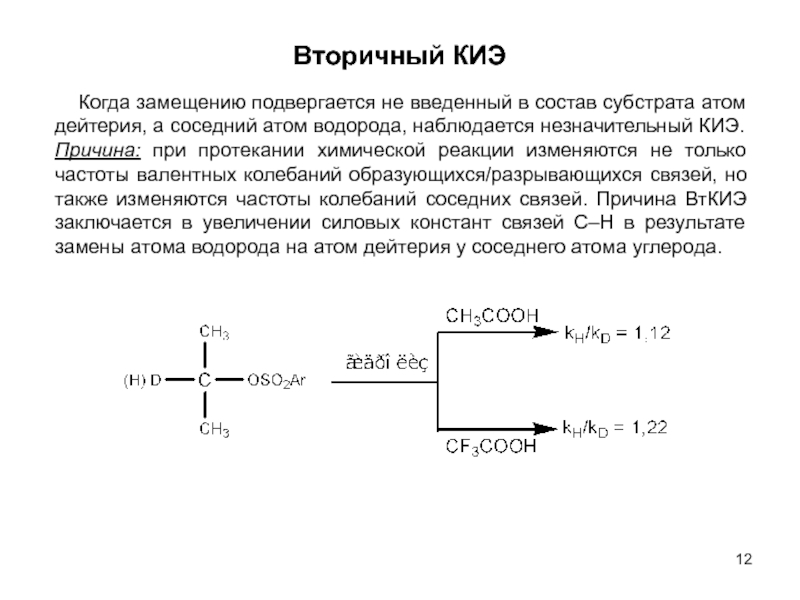
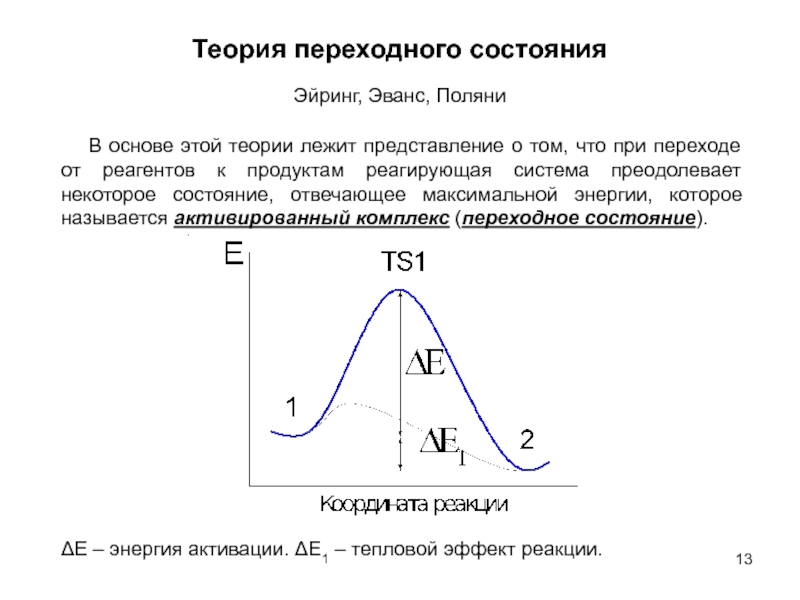
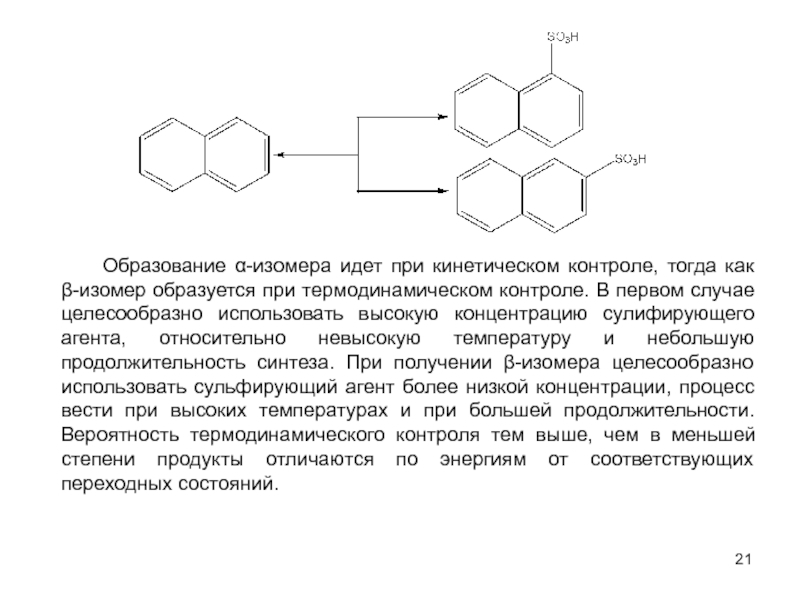
оптимизации производственных процессов получения продуктов;
- классификации органических реакций;
- предсказания механизмов
новых реакций;- синтеза новых соединений.
Предполагаемый механизм реакции следует рассмотреть как более или менее вероятную гипотезу. Этот механизм должен непротиворечиво объяснять все установленные экспериментальные факты, обладать предсказательной силой: на его основе можно было бы прогнозировать поведение реагирующей системы. Если при проверке предложенного механизма получен отрицательный результат, то данный механизм подлежит пересмотру. Если получен положительный результат, то это увеличит правдоподобность данной гипотезы.