Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
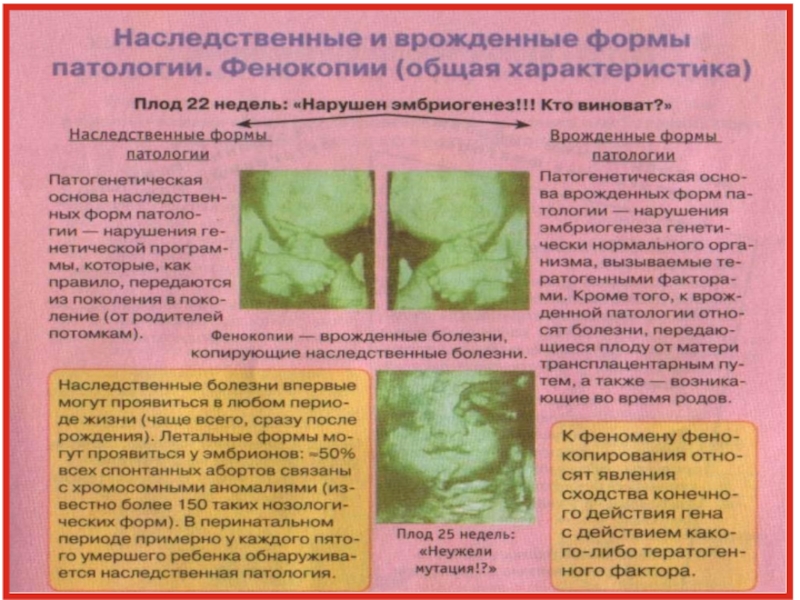
Наследственные и врожденные формы патологии
Содержание
- 1. Наследственные и врожденные формы патологии
- 2. Патогенез наследственных болезней В
- 3. Реализация действия аномального гена Первый
- 4. Болезни, возникающие по первому патогенетическому варианту• гипоальбуминемия
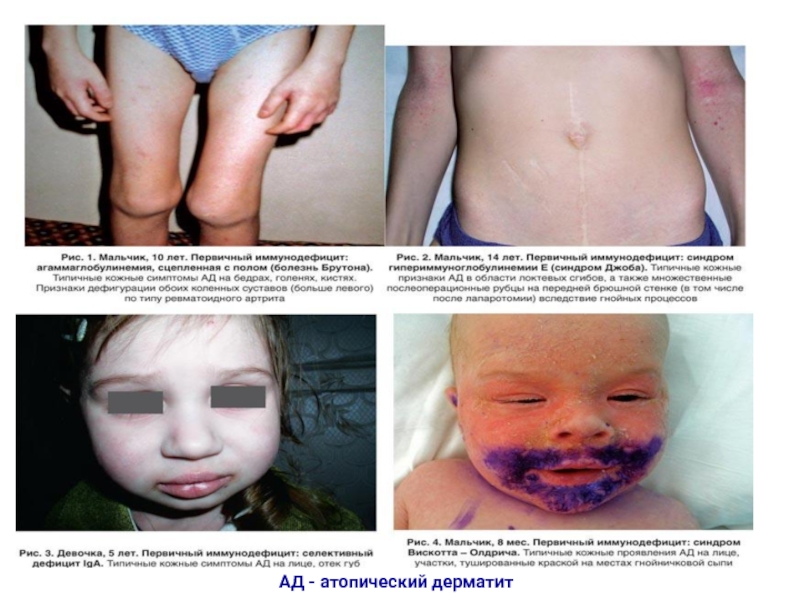
- 5. АД - атопический дерматит
- 6. Дальтонизм (цветовая слепота) – неспособность различать красный
- 7. Многие люди с нарушением цветовосприятия не увидят
- 8. Гемофилия появляется из-за изменения одного гена в
- 9. Гемофилия - связанное с нарушением коагуляции (процессом
- 10. болезнь на сегодняшний день неизлечимаОбычно болезнью страдают
- 11. Реализация действия аномального гена Второй путь:
- 12. Болезни, возникающие по второму патогенетическому путиФенилкетонурия —
- 13. Слайд 13
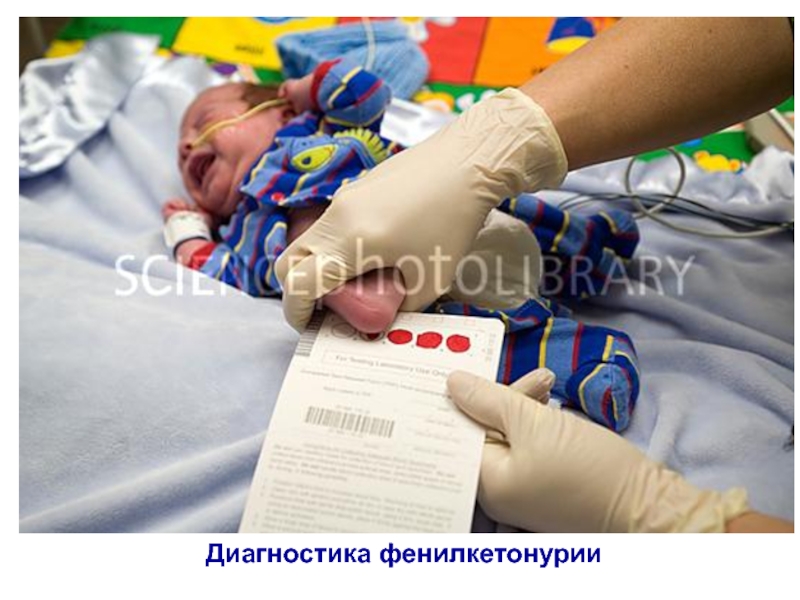
- 14. Диагностика фенилкетонурии
- 15. Слайд 15
- 16. Альбинизм. Причина → недостаток фермента тирозиназы в
- 17. ЛЕЧЕНИЕ БЕЗУСПЕШНО!
- 18. Реализация действия аномального гена
- 19. Серповидно-клеточная анемия синтез патологического S-гемоглобина, отличающегося
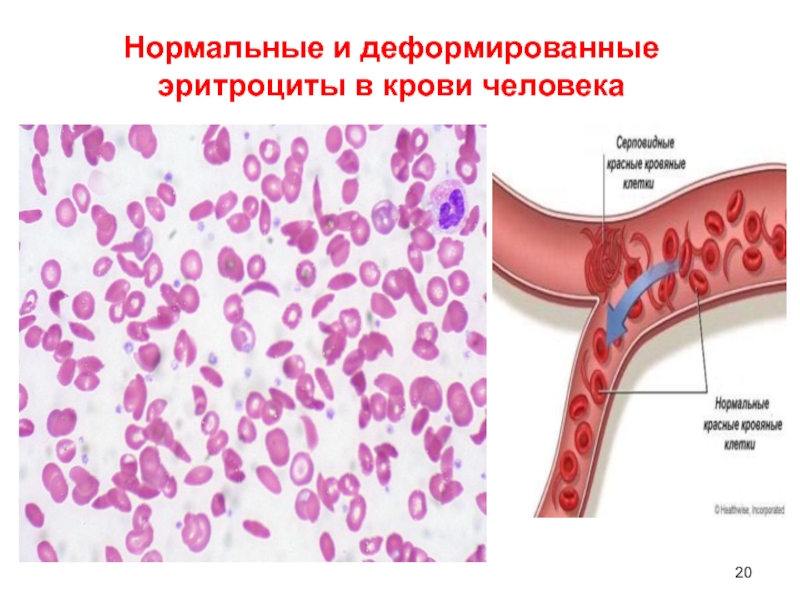
- 20. Нормальные и деформированные эритроциты в крови человека
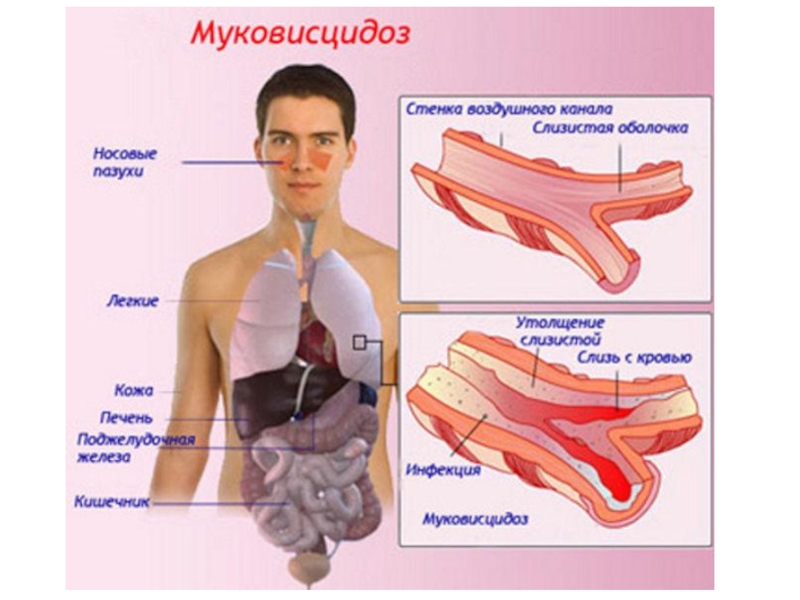
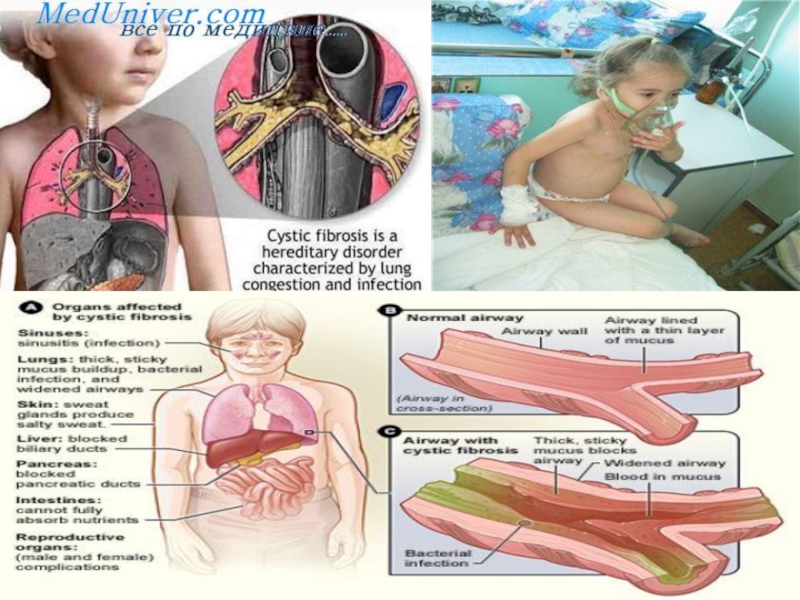
- 21. МуковисцидозКистозный фиброз является одним из самых распространенных
- 22. Патологический ген локализуется в середине длинного плеча
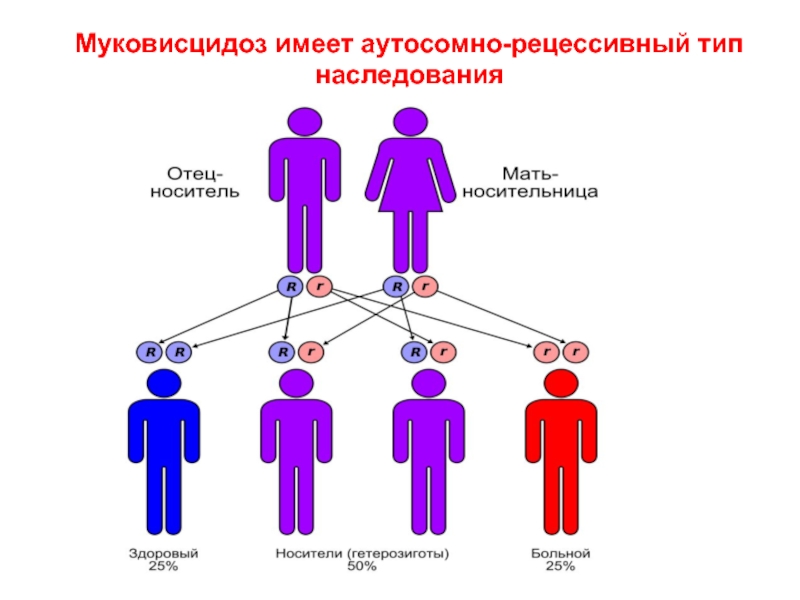
- 23. Муковисцидоз имеет аутосомно-рецессивный тип наследования
- 24. Изменения в поджелудочной железе, органах дыхания, желудочно-кишечном
- 25. Прогноз при муковисцидозе до настоящего времени остается
- 26. Слайд 26
- 27. Слайд 27
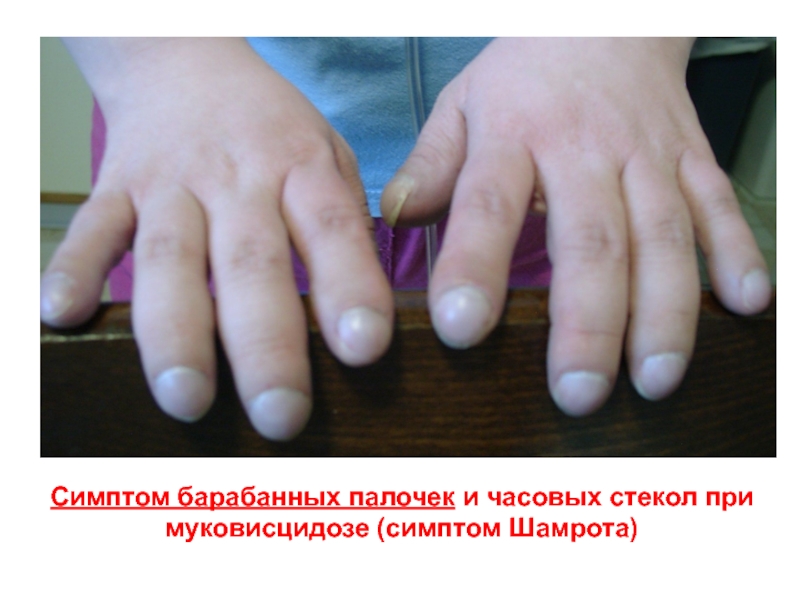
- 28. Симптом барабанных палочек и часовых стекол при муковисцидозе (симптом Шамрота)
- 29. Хромосомные болезни Являются особым видом
- 30. Особенности течения и проявления хромосомных болезнейОбщим для
- 31. Синдром Да́уна (трисомия по 21 хромосоме )
- 32. Слайд 32
- 33. Слайд 33
- 34. На ладони часто обнаруживают поперечную складку Болезнь ДаунаКариотип больного
- 35. Дети разного возраста с характерными чертами синдрома
- 36. Кариотип при транслокационном синдроме Дауна(одна 21-я хромосома
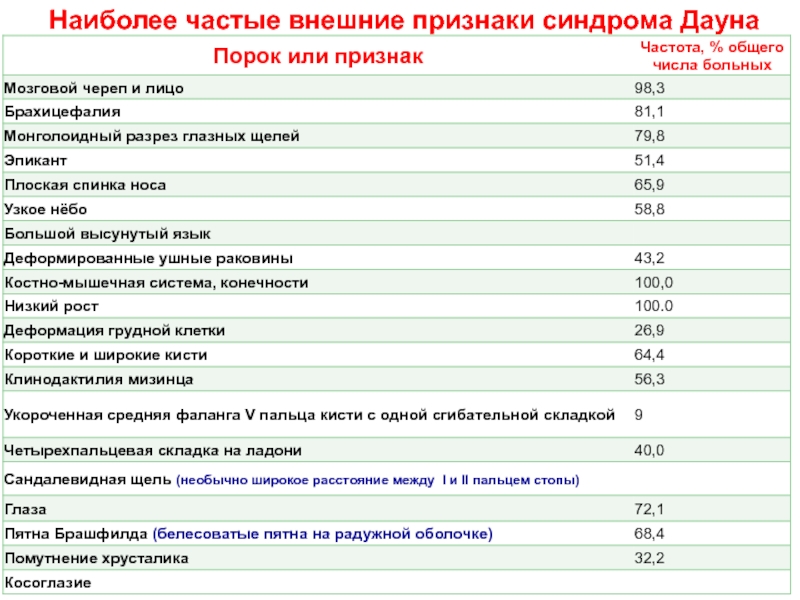
- 37. Наиболее частые внешние признаки синдрома Дауна
- 38. Врождённые пороки внутренних органов, сниженная приспособленность детей
- 39. Диагностика:В периоде внутриутробного развития синдрома Дауна может
- 40. В последнее время внимание генетиков привлечено к
- 41. После выявления этой наследственной формы умственной отсталости
- 42. Речь изобилует повторами, часто встречается своеобразное заикание
- 43. Аномалии соматических хромосом Трисомия
- 44. Синдром Э́двардса (синдром трисомии 18)характеризуется комплексом множественных
- 45. Синдром трисомии 18 (синдром Эдвардса). А —
- 46. Прогноз: Продолжительность жизни детей с синдромом Эдвардса
- 47. Для подтверждения диагноза синдрома Эдвардса и дальнейшего
- 48. Аномалии соматических хромосом Трисомии
- 49. Синдром ПатауЧастота синдрома Патау среди новорождённых равна
- 50. Виды внутрихромосомиых перестроек: 1 — исходная пара
- 51. Синдром трисомии 13 (синдром Патау).А — внешний
- 52. Дети с синдромом Патау рождаются с истинной
- 53. Множественные пороки развития отчетливо заметны и непосредственно
- 54. Внешние аномалии развития многочисленны и патогномоничны для
- 55. В связи с тяжёлыми врождёнными пороками развития
- 56. Другие синдромы врождённых пороков развития (синдромы Меккеля
- 57. Аномалии, связанные с половыми хромосомами
- 58. Синдром дубль-YСиндром XYY характеризуется кариотипом 47, XYY.
- 59. 47, XYY
- 60. 47, XYY
- 61. Синдром КляйнфельтераВстречается у мужчин. Частота 2 на
- 62. Для мужчин с синдромом Клайнфельтера характерны высокий
- 63. Слайд 63
- 64. Слайд 64
- 65. Слайд 65
- 66. Слайд 66
- 67. Синдром Шерешевского Тернера - возникает при слиянии
- 68. Впервые эта болезнь как наследственная была описана
- 69. При синдроме Тернера половые железы обычно представляют
- 70. Для течения постнатального периода характерно общее беспокойство
- 71. Слайд 71
- 72. Слайд 72
- 73. Слайд 73
- 74. Слайд 74
- 75. Прогноз для жизни при с. Ш.-Т. благоприятный,
- 76. Синдром трисомии X. Встречается у женщин (1:1000),
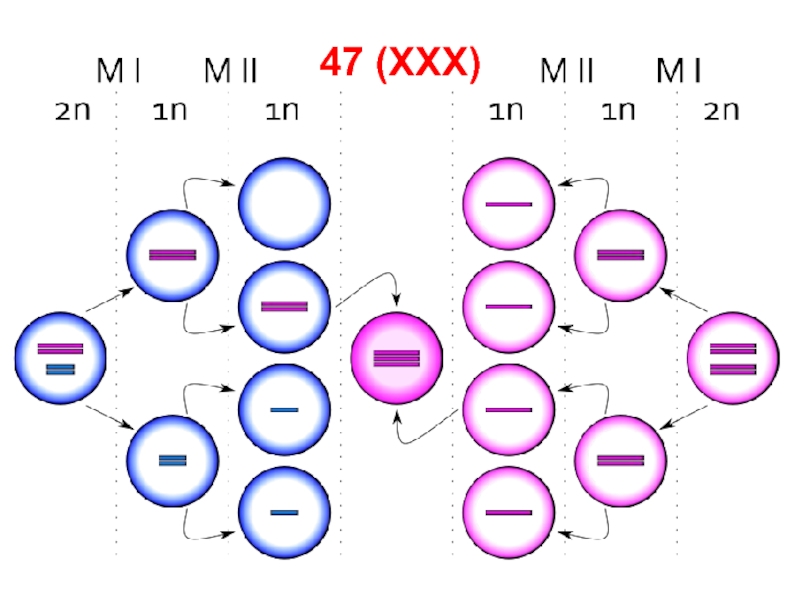
- 77. 47 (XXX)
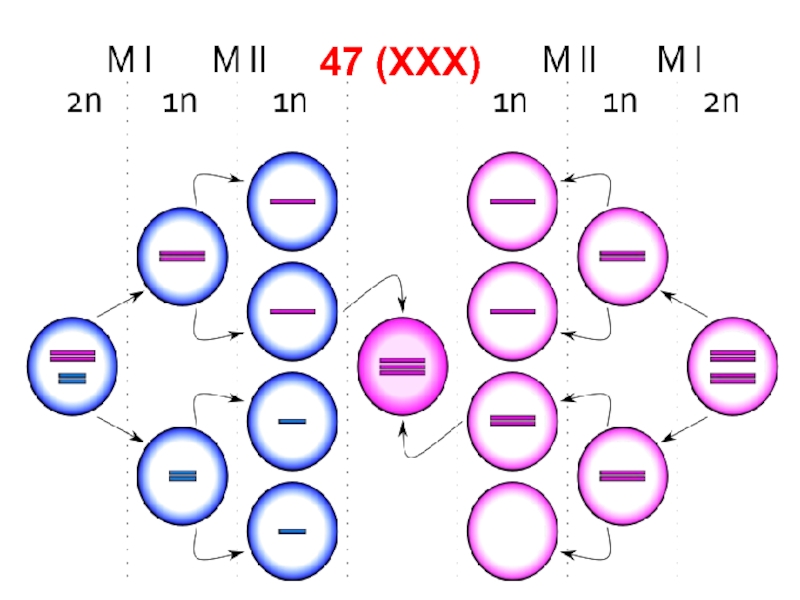
- 78. 47 (XXX)
- 79. Слайд 79
- 80. Ядро клетки самки. Наверху: при помощи FISH
- 81. Аномалии хромосом
- 82. Синдром Кошачьего крика - объясняется частичной моносомией.Развивается
- 83. Слайд 83
- 84. Слайд 84
- 85. Подходы в борьбе с наследственными болезнями
- 86. Спасибо за внимание!
- 87. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Наследственные и врожденные формы патологии
Кафедра специальной психологии КГПУ
к.м.н., доц. Бардецкая
Я.В.
Слайд 2Патогенез наследственных болезней
В результате мутаций образуется
аномальный ген с измененным кодом.
! ! Реализация действия аномального гена — завершающее звено патогенеза наследственных болезней. ! Различают три основных пути реализации действия аномального гена, образовавшегося вследствие мутаций.
Слайд 3Реализация действия аномального гена
Первый путь: аномальный ген,
утративший код синтеза структурного или функционально важного белка ► прекращение синтеза
информационной РНК►прекращение синтеза белка►нарушение жизнедеятельности ►наследственная болезнь.
Слайд 4Болезни, возникающие по первому патогенетическому варианту
• гипоальбуминемия — ↓ количества
альбуминов в крови, что предрасполагает к пастозности, наследуется как аутосомно-рецессивный
признак;• гипофибриногенемия — ↓ количества фибриногена в крови, что ведет к нарушению свертывания крови и кровоточивости, наследуется по аутосомно-рецессивному типу;
• а-, гипогаммаглобулинемия — ⇓ количества γ-глобулинов, снижение резистентности к бактериальным инфекциям, наследование рецессивное, сцепленное с Х-хромосомой и др.
Слайд 6Дальтонизм (цветовая слепота) – неспособность различать красный и зелёный цвет,
красный и синий или синий и зелёный. Сцепленное с Х-хромосомой.
Мутация в генах, кодирующих фоторецепторы, вызывают нарушение восприятия цвета.
В настоящее время дальтонизм неизлечим.
Однако разработана технология лечения дальтонизма за счет внедрения в клетки сетчатки недостающих генов с помощью методов генной инженерии с использованием в качестве вектора вирусных частиц.
В 2009г. в Nature появилась публикация об успешном испытании этой технологии на обезьянах, многие из которых от природы плохо различают цвета.
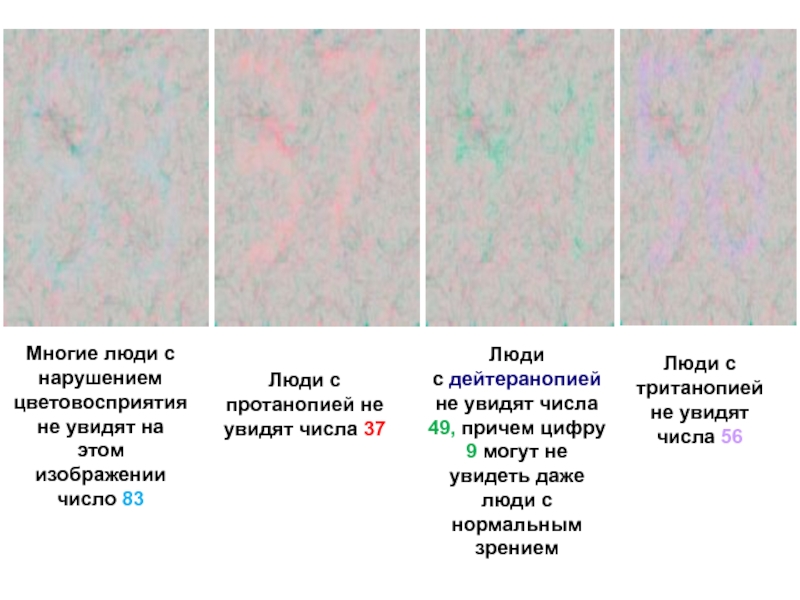
Слайд 7Многие люди с нарушением цветовосприятия не увидят на этом изображении
число 83
Люди с протанопией не увидят числа 37
Люди с дейтеранопией не увидят
числа 49, причем цифру 9 могут не увидеть даже люди с нормальным зрениемЛюди с тританопией не увидят числа 56
Слайд 8Гемофилия появляется из-за изменения одного гена в хромосоме X. Различают
три типа гемофилии (A, B, C).
Гемофилия А (рецессивная мутация в
X-хромосоме) вызвана генетическим дефектом, отсутствием в крови необходимого белка — фактора VIII (антигемофильного глобулина). Такая гемофилия считается классической, она встречается наиболее часто, у 80-85 % больных гемофилией. Тяжёлые кровотечения при травмах и операциях наблюдаются при уровне VIII фактора — 5-20 %.Гемофилия B вызвана дефектным фактором крови IX (рецессивная мутация в X-хромосоме). Нарушено образование вторичной коагуляционной пробки.
Гемофилия С («болезнь Розенталя») вызвана дефектным фактором крови XI (аутосомно-рецессивная мутация), известна в основном у евреев-ашкеназов. В настоящее время гемофилия С исключена из классификации, т.к. ее клинические проявления значительно отличаются от А и В.
Слайд 9Гемофилия - связанное с нарушением коагуляции (процессом свёртывания крови).
При этом
заболевании возникают кровоизлияния в суставы, мышцы и внутренние органы, как
спонтанные, так и в результате травмы или хирургического вмешательства.При гемофилии резко возрастает опасность гибели пациента от кровоизлияния в мозг и другие жизненно важные органы, даже при незначительной травме.
Больные с тяжёлой формой гемофилии подвергаются инвалидизации вследствие частых кровоизлияний в суставы (гемартрозы) и мышечные ткани (гематомы).
Гемофилия относится к геморрагическим диатезам, обусловленным нарушением плазменного звена гемостаза (коагулопатия).
Слайд 10болезнь на сегодняшний день неизлечима
Обычно болезнью страдают мужчины (наследование, сцепленное
с полом), женщины же выступают как носительницы гемофилии, которые сами
ей обычно не болеют, но могут родить больных сыновей или дочерей-носительниц.Слайд 11Реализация действия аномального гена
Второй путь: аномальный ген, утративший
код нормальной программы синтеза фермента ► прекращение синтеза информационной РНК
► прекращение синтеза фермента ► нарушение жизнедеятельности ► наследственная болезнь.Слайд 12Болезни, возникающие по второму патогенетическому пути
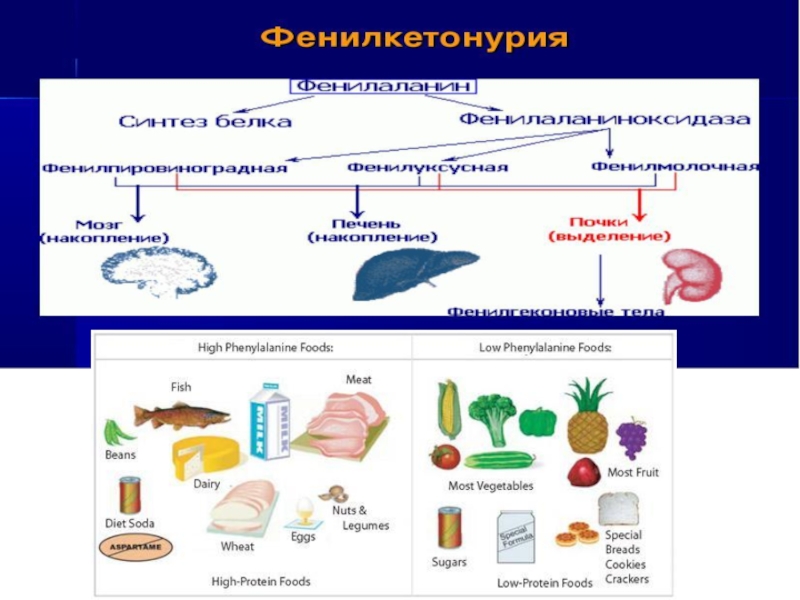
Фенилкетонурия — наиболее частая форма
возникает в результате мутации структурного гена, кодирующего биосинтез фенилаланингидроксилазы. Фермент
отсутствует в печени, что блокирует превращение фенилаланина в тирозин. Концентрация фенилаланина в крови после рождения резко повышается. Высокая концентрация фенилаланина обусловливает токсическое поражение мозга, поскольку ингибируется транспорт аминокислот в нейроны ► ►развивается идиотия.Слайд 16Альбинизм. Причина → недостаток фермента тирозиназы в меланоцитах — клетках,
синтезирующих пигмент меланин. При отсутствии меланина кожа приобретает молочно-белый цвет
с белесым оволосением, наблюдается светобоязнь, снижение остроты зрения.Альбинизм - нарушение аминокислотного метаболизма. Врождённое отсутствие пигмента кожи, волос, радужной и пигментной оболочек глаза.
Они имеют повышенную чувствительность к солнечному свету, который вызывает у них воспалительные заболевания кожи.
Слайд 18 Реализация действия аномального гена
Третий путь ⇒
аномальный ген с патологическим кодом ► синтез патологической информационной РНК
►синтез патологического белка ►нарушениежизнедеятельности ►наследственная болезнь.Слайд 19Серповидно-клеточная анемия синтез патологического S-гемоглобина, отличающегося от нормального Hb
тем, что в 6-м положении β-полипептидной цепи Hb вместо глютаминовой
кислоты находится валин молекулы S-гемоглобина становятся электронейтральными и легко образуют комплексы, особенно при нехватке кислорода;
эти комплексы (тактоиды) деформируют эритроциты, которые вследствие этого приобретают серповидную форму и легко подвергаются гемолизу.
Слайд 21Муковисцидоз
Кистозный фиброз является одним из самых распространенных моногенных заболеваний в
Европе (1 на 2500 новорожденных). Наследуется по аутосомно-рецессивному типу.
Муковисцидоз
- это системное наследственное заболевание, обусловленное мутацией гена трансмембранного регулятора муковисцидоза и характеризующееся поражением желез внешней секреции, тяжёлыми нарушениями функций органов дыхания и желудочно-кишечного тракта.Слайд 22Патологический ген локализуется в середине длинного плеча 7-й хромосомы.
Если
оба родителя гетерозиготны, то риск рождения больного муковисцидозом ребенка составляет
25 %. По данным исследований частота гетерозиготного носительства патологического гена равна 2—5 %.Следствием мутации гена является нарушение структуры и функции белка, получившего название муковисцидозного трансмембранного регулятора проводимости (МВТП).
Следствием этого является сгущение секретов желез внешней секреции, затруднение эвакуации секрета и изменение его физико-химических свойств, что, в свою очередь, и обуславливает клиническую картину заболевания.
Слайд 24Изменения в поджелудочной железе, органах дыхания, желудочно-кишечном тракте регистрируются уже
во внутриутробном периоде и с возрастом пациента неуклонно нарастают.
Выделение
вязкого секрета экзокринными железами приводит к затруднению оттока и застою с последующим расширением выводных протоков желез, атрофией железистой ткани и развитием прогрессирующего фиброза. Активность ферментов кишечника и поджелудочной железы значительно снижена.
Наряду с формированием склероза в органах имеет место нарушение функций фибробластов. Установлено, что фибробласты больных муковисцидозом продуцируют цилиарный фактор, или М-фактор, который обладает антицилиарной активностью — он нарушает работу ресничек эпителия.
Слайд 25Прогноз при муковисцидозе до настоящего времени остается серьёзным.
Летальность составляет 50—60
%, среди детей раннего возраста — выше.
Поздняя диагностика заболевания
и неадекватная терапия значительно ухудшают прогноз. В настоящее время возможна диагностика данного заболевания на ранних сроках беременности, поэтому большое значение приобретает медико-генетическое консультирование семей, в которых есть больные муковисцидозом.
Слайд 29
Хромосомные болезни
Являются особым видом наследственной патологии, связанной с повреждением
их структуры (хромосомными мутациями) или нарушением их количества (геномные мутации).
!!!Структурные аномалии хромосом встречаются реже и обычно приводят к более тяжелым (большинство смертельны), по сравнению с количественными изменениями хромосом, последствиям.
Мутации в гаметах приводят к развитию полных форм хромосомных болезней, когда изменения кариотипа выявляются во всех клетках организма.
Мутации в соматических клетках на ранних этапах эмбриогенеза приводят к развитию мозаицизма: часть клеток организма имеет нормальный кариотип, а другая часть — аномальный.
Слайд 30Особенности течения и проявления хромосомных болезней
Общим для всех форм хромосомных
болезней является множественность поражения: черепно-лицевые дисморфии, врожденные пороки развития внутренних
органов, замедление роста и развития, задержка психического развития. При хромосомных болезнях наблюдается от 30 до 80 различных отклонений от нормы, касающихся физического и психического развития.Клиническое сопоставление полных и мозаичных форм показывает, что мозаичные формы протекают легче, что объясняется присутствием нормальных клеток, частично компенсирующих генный дисбаланс абберантных форм.
Аутосомные болезни протекают тяжелее, чем аномалии по половым хромосомам. Это связано с различной генотипической активностью хромосом: Y-хромосома несет мало генов, а одна из X-хромосом у женщин находится в неактивном состоянии.
Проявления одних и тех же форм хромосомных болезней сильно варьируют: от летального эффекта до незначительных отклонений.
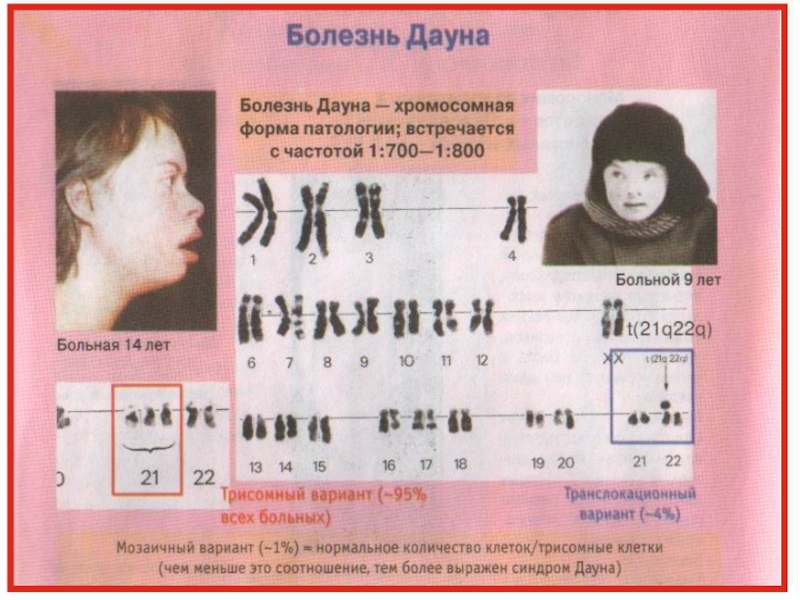
Слайд 31Синдром Да́уна (трисомия по 21 хромосоме ) — одна из
форм геномной патологии, при которой чаще всего кариотип представлен 47
хромосомами вместо нормальных 46, поскольку хромосомы 21-й пары, вместо нормальных двух, представлены тремя копиями.Существует ещё две формы данного синдрома: транслокация хромосомы 21 на другие хромосомы (чаще на 15, реже на 14, ещё реже на 22 и Y-хромосому) — 4 % случаев, и мозаичный вариант синдрома — 5 %.
Синдром получил название в честь английского врача Джона Дауна (John Down), впервые описавшего его в 1866 году.
Связь между происхождением врождённого синдрома и изменением количества хромосом была выявлена только в 1959 году французским генетиком Жеромом Леженом.
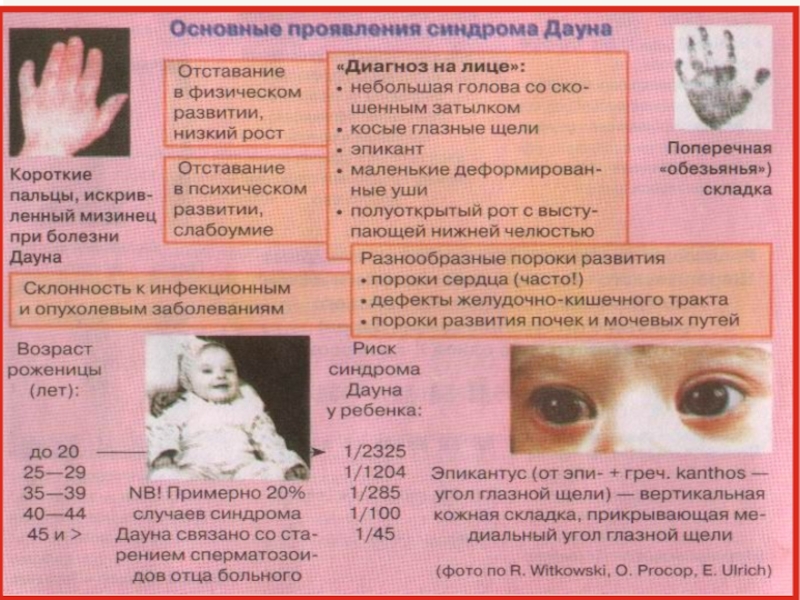
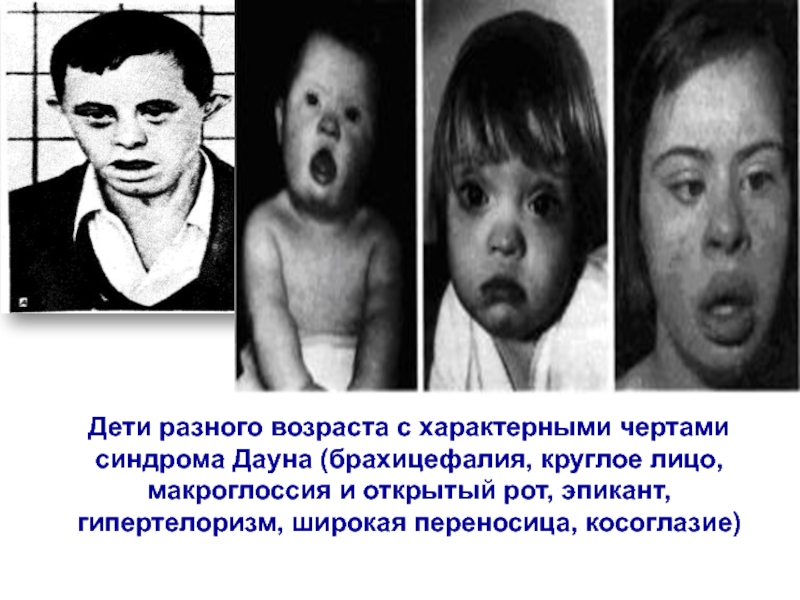
Слайд 35Дети разного возраста с характерными чертами синдрома Дауна (брахицефалия, круглое
лицо, макроглоссия и открытый рот, эпикант, гипертелоризм, широкая переносица, косоглазие)
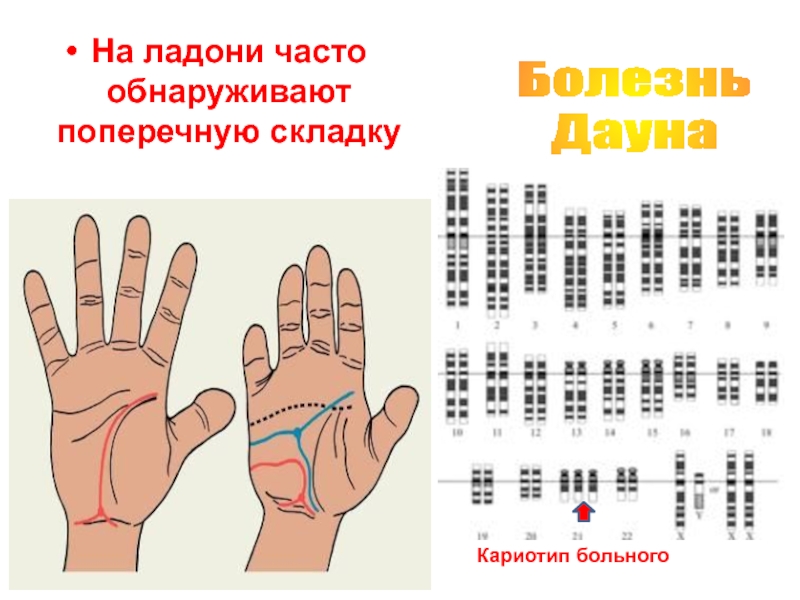
Слайд 36Кариотип при транслокационном синдроме Дауна
(одна 21-я хромосома присоединена к 15-й
хромосоме — указано стрелкой)
Женщина с синдромом Дауна в возрасте 38
летСлайд 38Врождённые пороки внутренних органов, сниженная приспособленность детей с синдромом Дауна
часто приводят к летальному исходу в первые 5 лет. Следствием
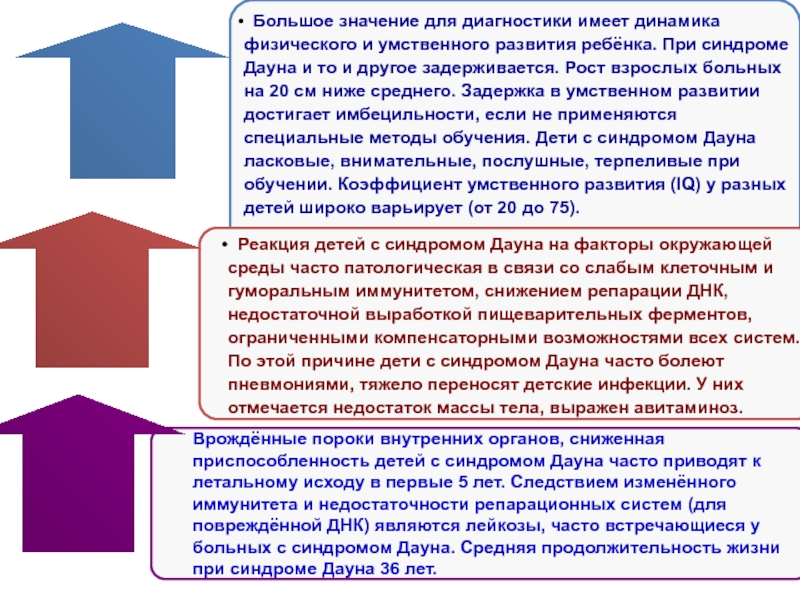
изменённого иммунитета и недостаточности репарационных систем (для повреждённой ДНК) являются лейкозы, часто встречающиеся у больных с синдромом Дауна. Средняя продолжительность жизни при синдроме Дауна 36 лет. Большое значение для диагностики имеет динамика физического и умственного развития ребёнка. При синдроме Дауна и то и другое задерживается. Рост взрослых больных на 20 см ниже среднего. Задержка в умственном развитии достигает имбецильности, если не применяются специальные методы обучения. Дети с синдромом Дауна ласковые, внимательные, послушные, терпеливые при обучении. Коэффициент умственного развития (IQ) у разных детей широко варьирует (от 20 до 75).
Реакция детей с синдромом Дауна на факторы окружающей среды часто патологическая в связи со слабым клеточным и гуморальным иммунитетом, снижением репарации ДНК, недостаточной выработкой пищеварительных ферментов, ограниченными компенсаторными возможностями всех систем. По этой причине дети с синдромом Дауна часто болеют пневмониями, тяжело переносят детские инфекции. У них отмечается недостаток массы тела, выражен авитаминоз.
Слайд 39Диагностика:
В периоде внутриутробного развития синдрома Дауна может быть выявлен при
проведении биохимического скрининга беременных во II-м триместре по резкому снижению
в сыворотке крови уровня хорионического гонадотропина, что является косвенным признаком наличия синдрома Дауна у плода.В этом случае беременная женщина должна быть направлена на ультразвуковое сканирование 2-го уровня, так как при данной патологии почти в 100% наблюдений выявляются УЗИ-маркеры хромосомных синдромов. Для подтверждения диагноза синдрома Дауна и дальнейшего медико-генетического прогнозирования состояния здоровья будущего потомства родителей показано пренатальное кариотипирование плода.
Дифференциальная диагностика проводится с врождённым гипотиреозом, другими формами хромосомных аномалий. Цитогенетическое исследование у детей показано и при подозрении на синдром Дауна, и при клинически установленном диагнозе, поскольку цитогенетическая характеристика пациента необходима для прогноза здоровья будущих детей у родителей и их родственников.
Лечение. Предпринимались попытки лечить детей с синдромом Дауна гормонами щитовидной железы и гипофиза, однако эти методы находятся пока на стадии разработки.
Как и другие умственно отсталые дети их уровня, больные с синдромом Дауна поддаются обучению бытовым навыкам, координации движений, речи и другим простым функциям, необходимым в повседневной жизни.
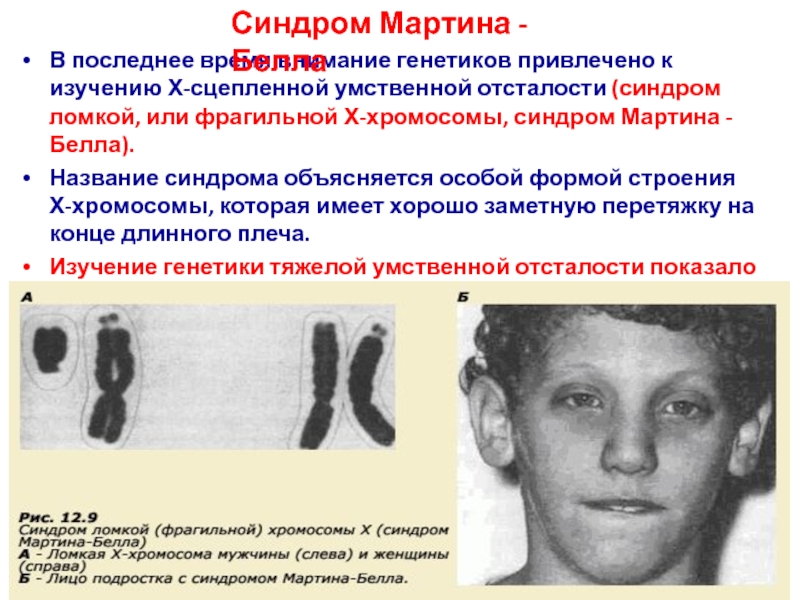
Слайд 40В последнее время внимание генетиков привлечено к изучению Х-сцепленной умственной
отсталости (синдром ломкой, или фрагильной Х-хромосомы, синдром Мартина - Белла).
Название синдрома объясняется особой формой строения Х-хромосомы, которая имеет хорошо заметную перетяжку на конце длинного плеча.
Изучение генетики тяжелой умственной отсталости показало значительную гетерогенность этой группы заболеваний.
Синдром Мартина - Белла
Слайд 41После выявления этой наследственной формы умственной отсталости стала понятной большая
частота встречаемости интеллектуального недоразвития у мальчиков.
Это рецессивное заболевание передается
с Х-хромосомой через мать, поскольку мальчики получают свою единственную Х-хромосому от матери. У мальчиков, в отличие от девочек, только одна Х-хромосома, поэтому рецессивные Х-сцепленные заболевания у них наблюдаются гораздо чаще.Синдром ломкой Х-хромосомы является одним из наиболее распространенных наследственных заболеваний, сопоставимым по частоте с болезнью Дауна (примерно 1 на 2000 мужчин).
Кроме ломкой Х-хромосомы для больных характерны некоторые морфологические признаки, которые не всегда отчетливо проявляются (высокий выпуклый лоб, крупные уши и челюсти, крупные кисти рук, увеличенные яички).
Умственное развитие колеблется между значениями IQ от 30 до 65 (иногда в границах нормы).
Слайд 42Речь изобилует повторами, часто встречается своеобразное заикание (логоневроз).
Для детей
характерна двигательная расторможенность и некоторые симптомы аутизма (ребенок избегает глазного
контакта, производит стереотипные движения руками, испытывает страхи).Даже при легкой степени интеллектуальной недостаточности дети с трудом овладевают навыками счета и письма. Дети с ломкой Х-хромосомой имеют своеобразную электроэнцефалограмму.
В связи с тем, что симптомы заболевания разнообразны, часто ставится ошибочный диагноз (шизофрения, ранний детский аутизм, эпилепсия, синдром дефицита внимания и гиперактивности).
В результате дети не получают соответствующего лечения, а семья остается в неведении относительно истинных причин нарушения развития.
Слайд 43Аномалии соматических хромосом
Трисомия по 18-й паре
— синдром Эдвардса (частота 1:7000). Дети рождаются слабыми, имеют скошенный
подбородок, очень маленький рот, низко посаженные уши. Имеются диспропорции в строении скелета — длинные пальцы, указательный палец прикрывает 3-й и 4-й. Дети рано погибают, так как имеют различные пороки внутренних органов (2/3 детей с синдромом Эдвардса умирают в первые 6 месяцев жизни).Слайд 44Синдром Э́двардса (синдром трисомии 18)
характеризуется комплексом множественных пороков развития и
трисомией 18 хромосомы. (трисомия 18; 47, XX(XY)+18 )
МКБ-10:
Q91.0 Трисомия
18, мейотическое нерасхождение Q91.1 Трисомия 18, мозаицизм (митотическое нерасхождение)
Q91.2 Трисомия 18, транслокация
Q91.3 Синдром Эдвардса неуточненный
Вариации
Кроме трисомии 18, присутствующей во всех клетках организма, а также мозаичной трисомии 18, возможна и частичная трисомия. При этом часть хромосомы 18 присоединяется к другой хромосоме. Такой эффект называется транслокация, и он может произойти как при созревании гамет, так и после оплодотворения в клетках зародыша. В клетках организма при этом оказываются две гомологичные хромосомы 18 и, дополнительно, часть хромосомы 18, прикрепленная к другой хромосоме. У людей, страдающих частичной трисомией 18, аномалии проявляются слабее, нежели при типичном синдроме Эдвардса.
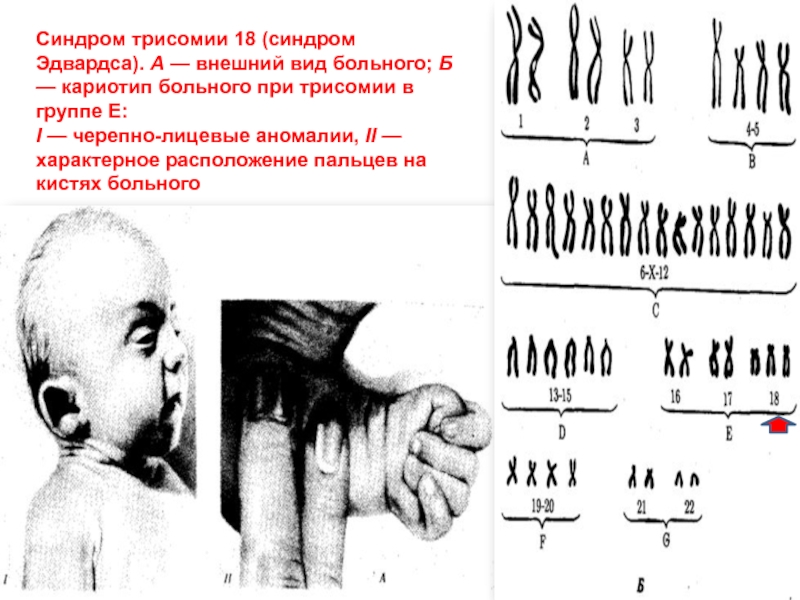
Слайд 45Синдром трисомии 18 (синдром Эдвардса). А — внешний вид больного;
Б — кариотип больного при трисомии в группе Е:
I —
черепно-лицевые аномалии, II — характерное расположение пальцев на кистях больногоСлайд 46Прогноз: Продолжительность жизни детей с синдромом Эдвардса невелика: 60 % детей
умирают в возрасте до 3 мес, до года доживает лишь
5-10 %. Основной причиной смерти служат остановка дыхания и нарушения работы сердца. Оставшиеся в живых — глубокие олигофрены.Диагностика: В периоде внутриутробного развития синдрома Эдвардса может быть выявлен при проведении биохимического скрининга беременных во II-м триместре по резкому снижению в сыворотке крови уровня хорионического гонадотропина, что является косвенным признаком наличия синдрома Эдвардса у плода. В этом случае беременная женщина должна быть направлена на ультразвуковое сканирование 2-го уровня, так как при данной патологии почти в 100% наблюдений выявляются УЗИ-маркеры хромосомных синдромов.
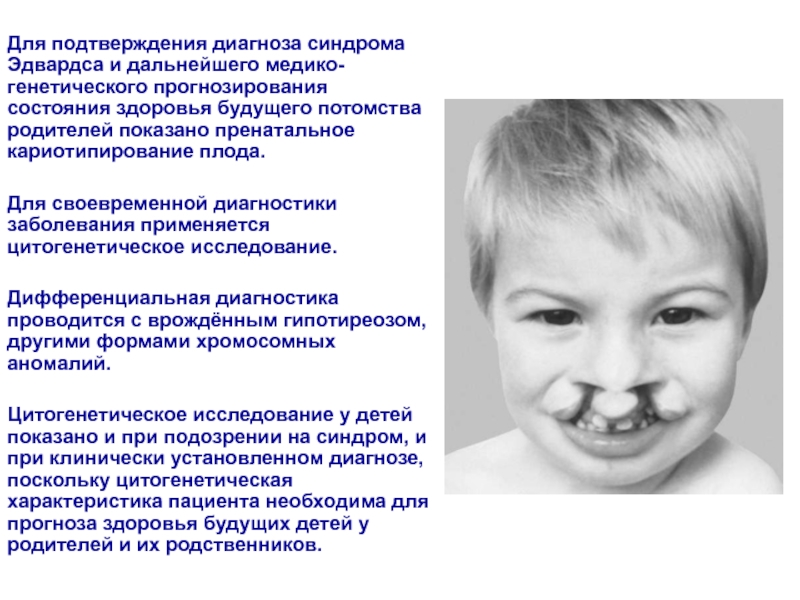
Слайд 47Для подтверждения диагноза синдрома Эдвардса и дальнейшего медико-генетического прогнозирования состояния
здоровья будущего потомства родителей показано пренатальное кариотипирование плода.
Для своевременной
диагностики заболевания применяется цитогенетическое исследование.Дифференциальная диагностика проводится с врождённым гипотиреозом, другими формами хромосомных аномалий.
Цитогенетическое исследование у детей показано и при подозрении на синдром, и при клинически установленном диагнозе, поскольку цитогенетическая характеристика пациента необходима для прогноза здоровья будущих детей у родителей и их родственников.
Слайд 48Аномалии соматических хромосом
Трисомии по 8,9,13-й паре
синдром Патау (1:6000). Дети очень рано гибнут (96 % больных
погибают до 1,5 лет). Характерна микроцефалия, дефекты мягкого и твердого неба, низкие уши, тяжелые изменения со стороны внутренних органов, увеличение количества пальцев. Со стороны нервной системы — атрофия зрительных нервов и обонятельных долей.Слайд 49Синдром Патау
Частота синдрома Патау среди новорождённых равна 1:5000-1:7000.
Цитогенетические варианты
этого синдрома следующие.
Простая полная трисомия 13 как следствие нерасхождения
хромосом в мейозе у одного из родителей (главным образом у матери) встречается у 80-85% больных. Остальные случаи обусловлены в основном передачей дополнительной хромосомы (точнее, её длинного плеча) в робертсоновских транслокациях типа D/13 и G/13.
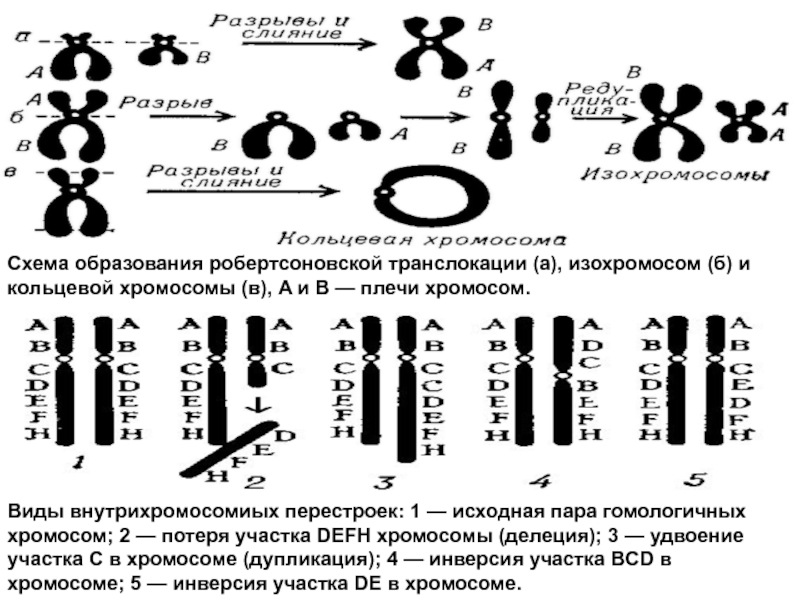
Слайд 50Виды внутрихромосомиых перестроек: 1 — исходная пара гомологичных хромосом; 2
— потеря участка DEFH хромосомы (делеция); 3 — удвоение участка
С в хромосоме (дупликация); 4 — инверсия участка BCD в хромосоме; 5 — инверсия участка DE в хромосоме.Схема образования робертсоновской транслокации (а), изохромосом (б) и кольцевой хромосомы (в), A и В — плечи хромосом.
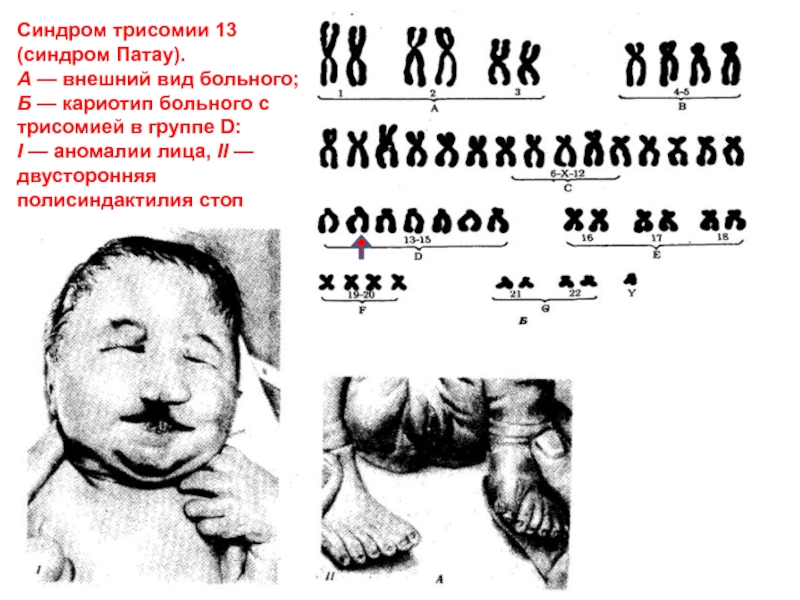
Слайд 51Синдром трисомии 13 (синдром Патау).
А — внешний вид больного; Б
— кариотип больного с трисомией в группе D:
I — аномалии
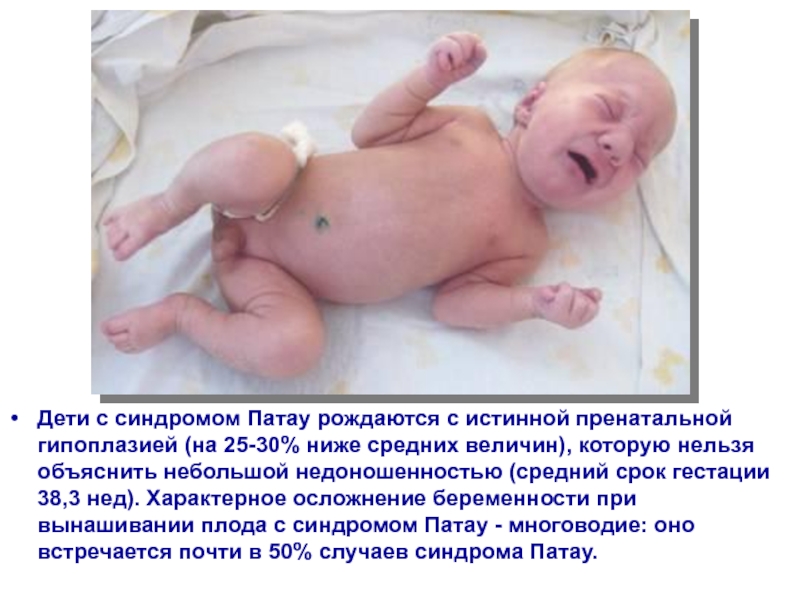
лица, II — двусторонняя полисиндактилия стопСлайд 52Дети с синдромом Патау рождаются с истинной пренатальной гипоплазией (на
25-30% ниже средних величин), которую нельзя объяснить небольшой недоношенностью (средний
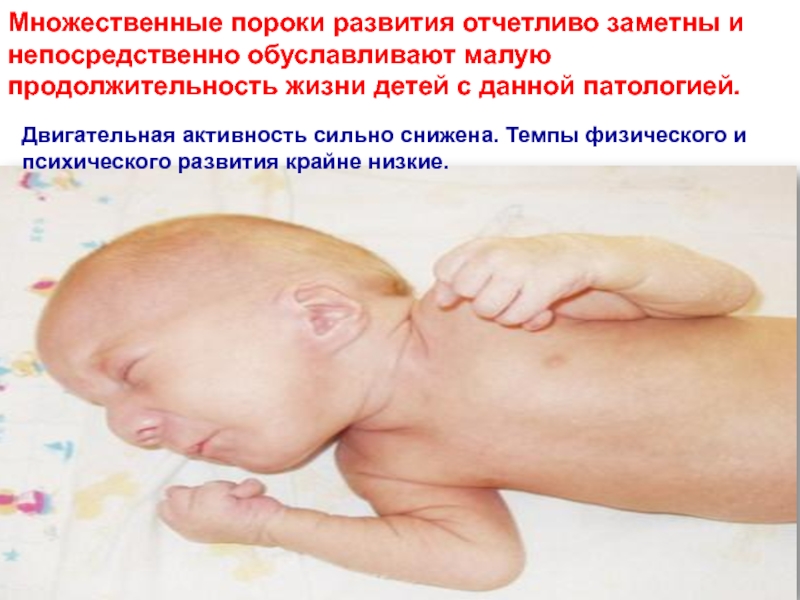
срок гестации 38,3 нед). Характерное осложнение беременности при вынашивании плода с синдромом Патау - многоводие: оно встречается почти в 50% случаев синдрома Патау.Слайд 53Множественные пороки развития отчетливо заметны и непосредственно обуславливают малую продолжительность
жизни детей с данной патологией.
Двигательная активность сильно снижена. Темпы
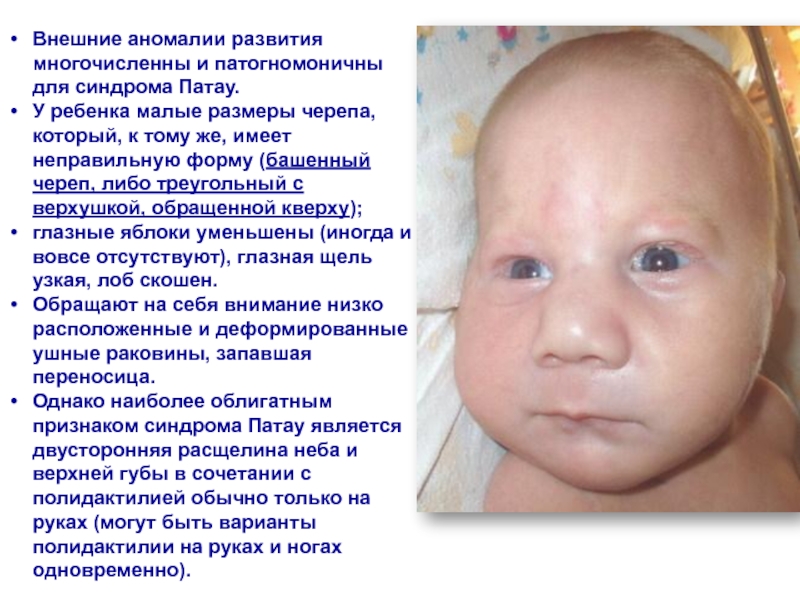
физического и психического развития крайне низкие.Слайд 54Внешние аномалии развития многочисленны и патогномоничны для синдрома Патау.
У
ребенка малые размеры черепа, который, к тому же, имеет неправильную
форму (башенный череп, либо треугольный с верхушкой, обращенной кверху);глазные яблоки уменьшены (иногда и вовсе отсутствуют), глазная щель узкая, лоб скошен.
Обращают на себя внимание низко расположенные и деформированные ушные раковины, запавшая переносица.
Однако наиболее облигатным признаком синдрома Патау является двусторонняя расщелина неба и верхней губы в сочетании с полидактилией обычно только на руках (могут быть варианты полидактилии на руках и ногах одновременно).
Слайд 55В связи с тяжёлыми врождёнными пороками развития большинство детей с
синдромом Патау умирают в первые недели или месяцы (95% -
до 1 года).Однако некоторые больные живут несколько лет. Более того, в развитых странах отмечается тенденция увеличения продолжительности жизни больных с синдромом Патау до 5 лет (около 15% детей) и даже до 10 лет (2-3% детей).
Диагностика и своевременное обнаружение синдрома Патау во время беременности во многом облегчилась благодаря скрининговому ультразвуковому исследованию беременных.
Наиболее важный признак, позволяющий заподозрить данную патологию, - многоводие.
Почти у половины женщин с многоводием во время беременности рождаются дети с различными аномалиями развития, в том числе с синдромом Патау.
Клиническая диагностика основывается на данных осмотра новорожденного. Обычно правильный диагноз в этом случае поставить несложно.
Слайд 56Другие синдромы врождённых пороков развития (синдромы Меккеля и Мора, тригоноцефалия
Опитца) по отдельным признакам совпадают с синдромом Патау.
Решающий фактор
в диагностике - исследование хромосом. Цитогенетическое исследование показано во всех случаях, в том числе у умерших детей.
Точный цитогенетический диагноз необходим для прогноза здоровья будущих детей в семье.
Лечебная помощь детям с синдромом Патау неспецифическая: операции по поводу врождённых пороков развития (по жизненным показаниям), общеукрепляющее лечение, тщательный уход, профилактика простудных и инфекционных болезней.
Дети с синдромом Патау практически всегда имеют глубокую идиотию.
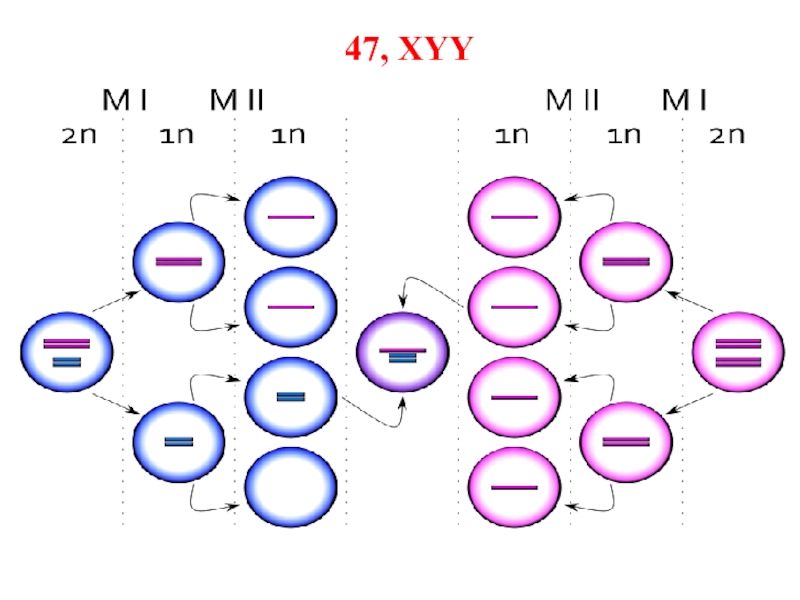
Слайд 58Синдром дубль-Y
Синдром XYY характеризуется кариотипом 47, XYY. Он впервые описан
в 1960 г. Частота синдрома по среднестатистическим данным составляет среди новорожденных
около 1:1000. Иногда приводятся значительно более высокие данные— 1:250.Наиболее частым признаком является высокий рост, который у взрослых больных составляет в среднем 186 см. Однако этот признак не является абсолютным, так как в литературе имеются описания мужчин с кариотипом 47, XYY среднего роста.
Симптоматика: мужчины с нормальным или несколько сниженным интеллектом отличаются высокорослостью, акромегалоидными чертами лица, повышенной агрессивностью, импульсивностью, немотивированными поступками, что часто приводит к социальным конфликтам. Либидо повышено, потенция нормальная, но часто отмечается бесплодие.
Среди лиц с этой патологией частые случаи агрессивных психопатов и сексопатов.
Проводят дифференциальный диагноз с синдромом Клайнфельтера, конституциональной высокорослостью.
Лечение: направлено на уменьшение агрессивности (психотерапия, седативные препараты, транквилизаторы).
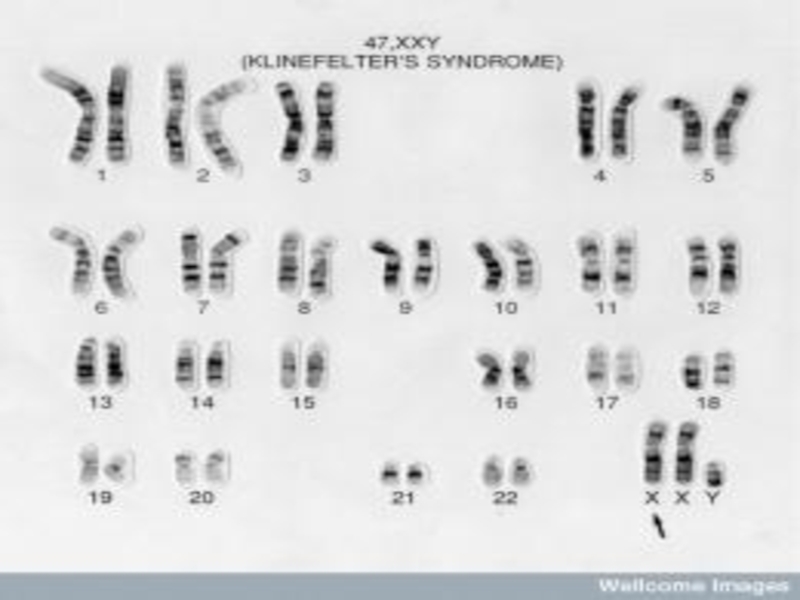
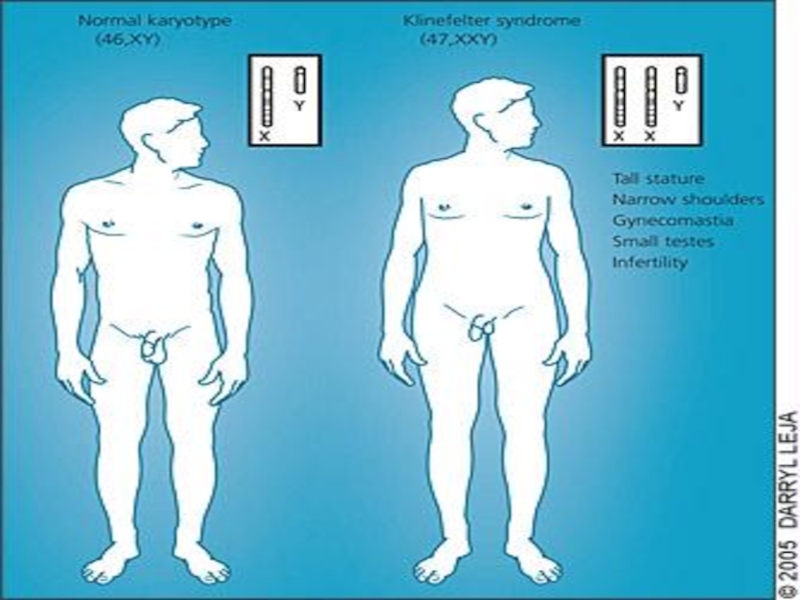
Слайд 61Синдром Кляйнфельтера
Встречается у мужчин. Частота 2 на 1000 новорожденных мальчиков.
Кариотип чаще: XXY, общее количество хромосом — 47.
У больных
мужчин содержится тельце Бара (половой хроматин). Аутосомы с 1-й по 22-ю пару без отклонений от нормы. До полового созревания развитие мальчиков мало чем отличается. Описаны и другие цитогенетические варианты: 48 ХХYY (клинически: глубокая дебильность и страшный садизм) и др.
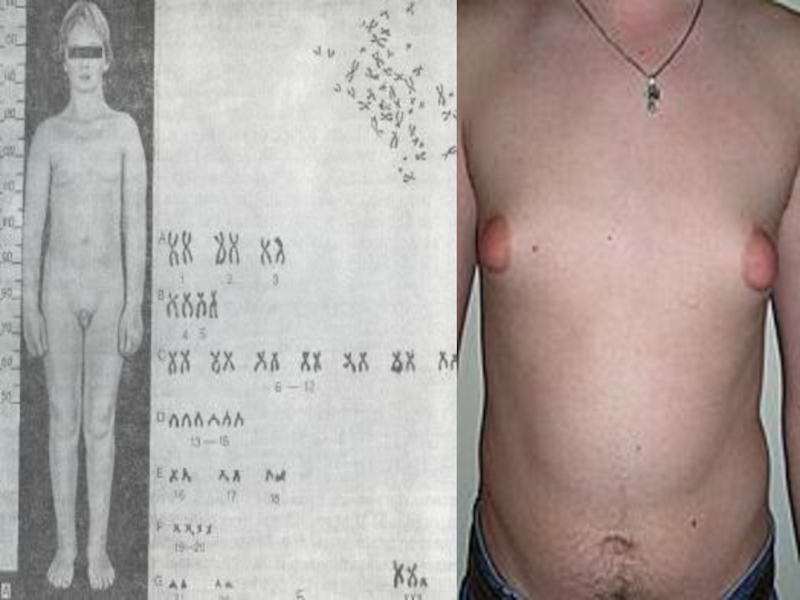
Слайд 62Для мужчин с синдромом Клайнфельтера характерны высокий рост, длинные конечности
и относительно короткое туловище, евнухоидизм, бесплодие, гинекомастия, повышенное выделение женских
половых гормонов, склонность к ожирению.Лишняя Х хромосома обусловливает различные нарушения психики. Больные очень внушаемы, вялы, апатичны, безынициативны, у них часто отмечается умственная отсталость (обычно дебильность).
Нередко возникают параноидные, галлюцинаторно-параноидные, депрессивные психозы и навязчивые состояния, иногда наблюдаются антисоциальное поведение и алкоголизм.
Клиническая картина начинает проявляться у мальчиков в период полового созревания.
Диагностировать синдром Клайнфельтера, особенно у взрослых лиц, нетрудно, особенно при кариотипировании лишней Х хромосомы. Лечение проводится мужскими половыми гормонами для коррекции вторичных половых признаков.
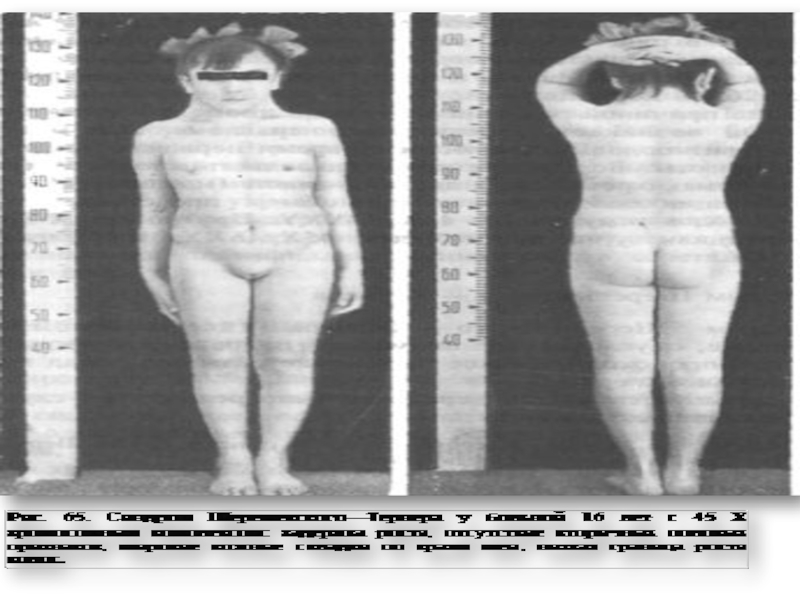
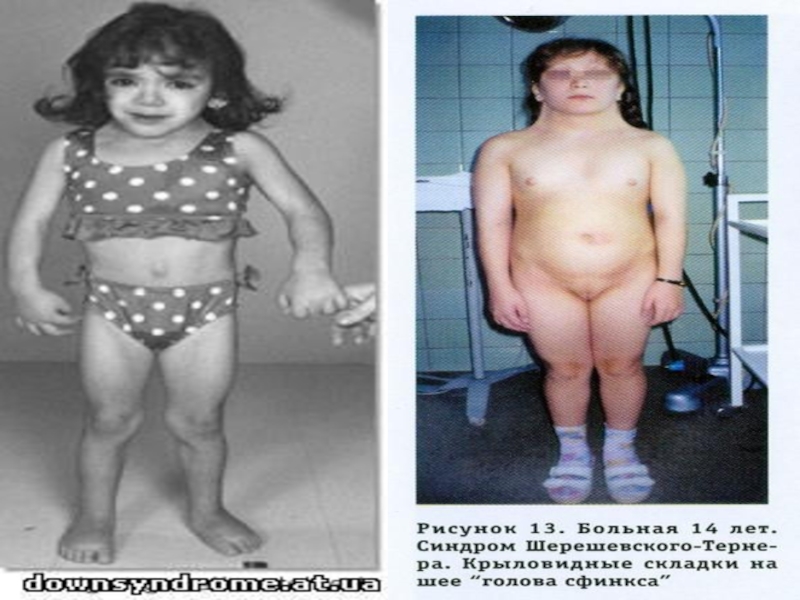
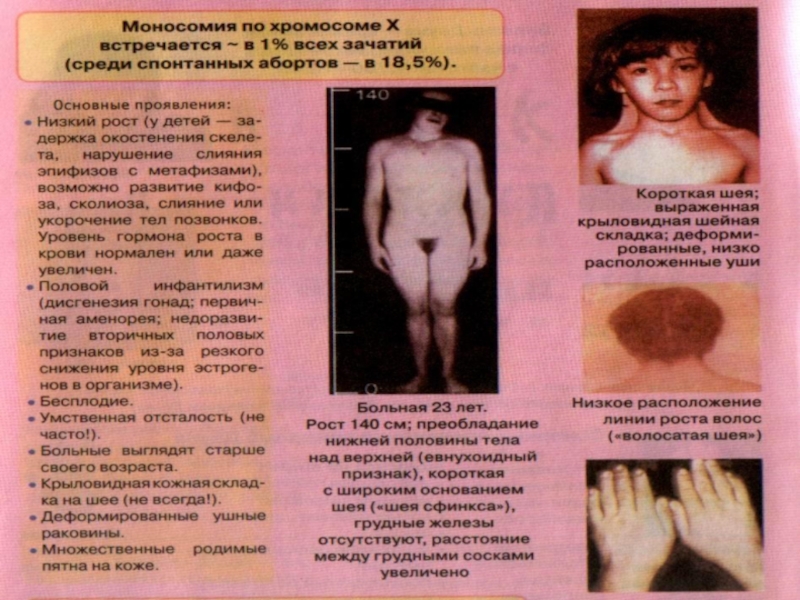
Слайд 67Синдром Шерешевского Тернера - возникает при слиянии патологической женской гаметы,
лишенной Х-хромосомы, с нормальной мужской гаметой, имеющей Х-хромосому, или при
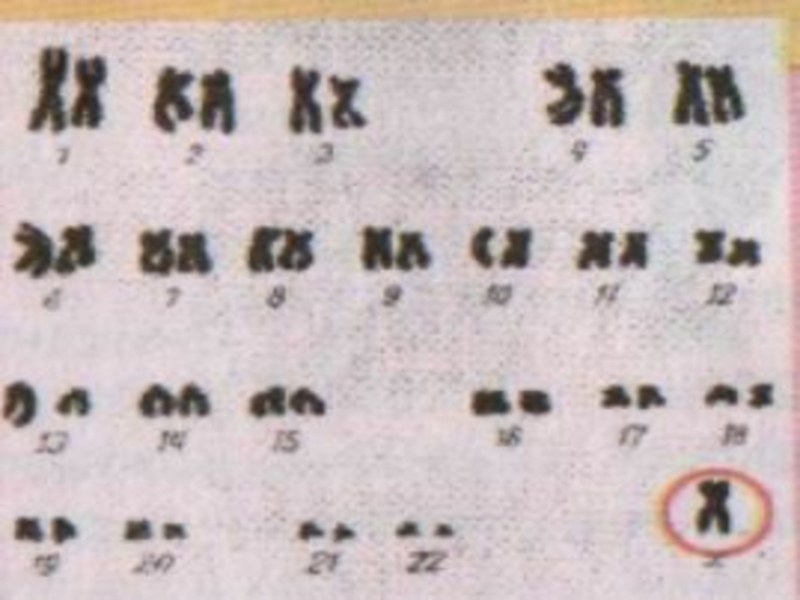
слиянии нормальной женской гаметы, содержащей одну Х-хромосому, с патологической мужской, лишенной половых хромосом.Кариотип характеризуется наличием одной Х-хромосомы вместо двух - 45 ХО.
Но могут быть и другие варианты (делеция короткого или длинного плеча Хp-,Xq-).
Слайд 68Впервые эта болезнь как наследственная была описана в 1925 г.
Н.А. Шерешевским, который считал, что она обусловлена недоразвитием половых желез
и передней доли гипофиза и сочетается с врожденными пороками внутреннего развития.В 1938 г. Тернер выделил характерную для этого симптомокомплекса триаду симптомов:
половой инфантилизм;
кожные крыловидные складки на боковых поверхностях шеи (Pterigium coli);
деформацию локтевых суставов.
Слайд 69При синдроме Тернера половые железы обычно представляют собой недифференцированные соединительнотканные
тяжи, не содержащие элементов гонад.
Реже встречаются рудименты яичников и
элементы яичек, а также рудименты семявыносящего протока.Наиболее важны изменения костно-суставной системы — укорочение пястных и плюсневых костей, аплазия (отсутствие) фаланг пальцев, деформация лучезапястного сустава, остеопороз позвонков.
Рентгенологически при синдроме Тернера турецкое седло и кости свода черепа обычно не изменены.
Отмечаются пороки сердца и крупных сосудов (коарктация аорты, незаращение боталлова протока, незаращение межжелудочковой перегородки, сужение устья аорты), пороки развития почек.
Проявляются рецессивные гены дальтонизма и других заболеваний.
Слайд 70Для течения постнатального периода характерно общее беспокойство новорожденных, нарушение сосательного
рефлекса, срыгивания фонтаном, рвота.
В раннем возрасте у части больных
отмечают задержку психического развития и речи, что свидетельствует о патологии эмбриогенеза нервной системы.Примерно у 15—20% больных задержка развития наблюдается в пубертатном периоде.
Слайд 75Прогноз для жизни при с. Ш.-Т. благоприятный, исключение составляют больные
с тяжелыми врожденными пороками сердца и крупных сосудов, с ренальной
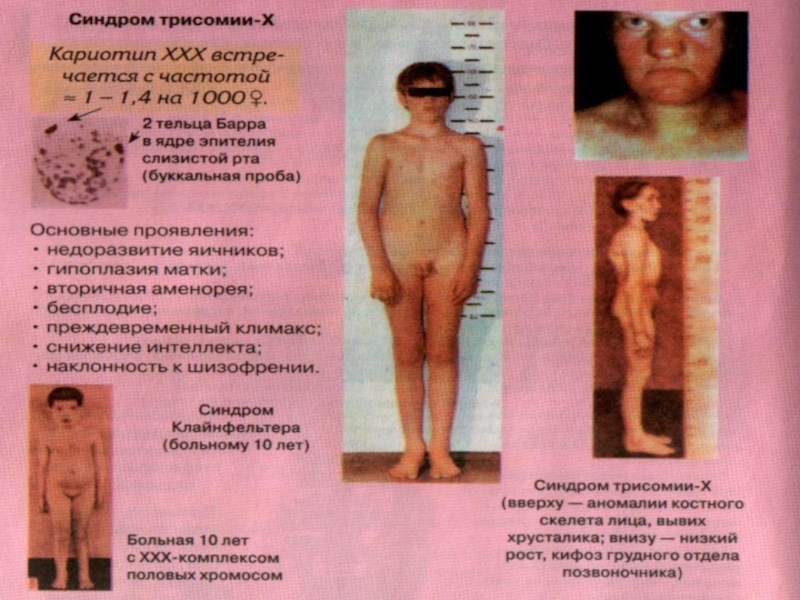
гипертензией. Лечение эстрогенами делает больных с Ш.-Т. способными к семейной жизни, однако абсолютное большинство из них остаются бесплодными.Слайд 76Синдром трисомии X.
Встречается у женщин (1:1000), кариотип — 47
(XXX).
В неделящихся клетках видны два тельца Бара.
У больных
отмечается гипоплазия яичников, бесплодие и умственная отсталость. У 60–70 % больных может быть слабоумие легкой степени.
Нередко у женщин с трисомией X перечисленные проявления вообще отсутствуют.
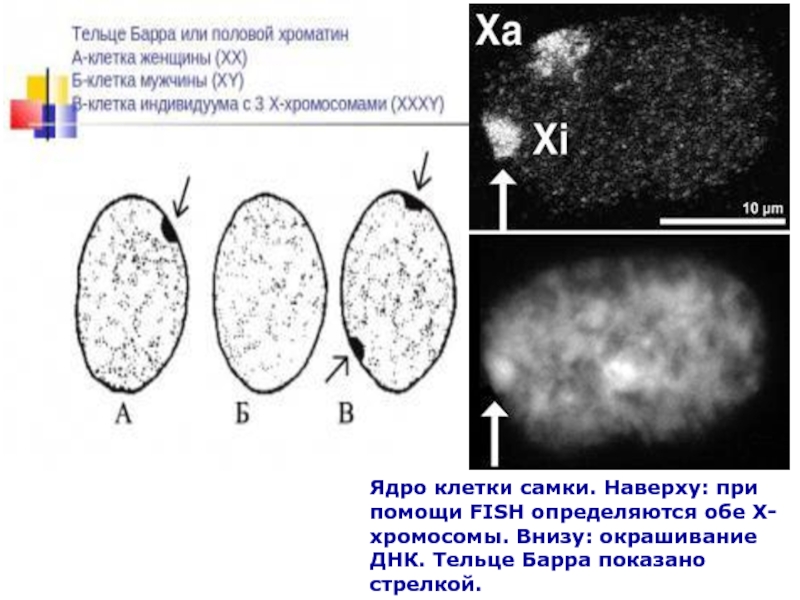
Слайд 80Ядро клетки самки. Наверху: при помощи FISH определяются обе Х-хромосомы.
Внизу: окрашивание ДНК. Тельце Барра показано стрелкой.
Слайд 82Синдром Кошачьего крика - объясняется частичной моносомией.
Развивается при делеции (с
утратой от трети до половины, реже полная утрата) короткого плеча
пятой хромосомы (5р).При этом синдроме наблюдается:
общее отставание в развитии;
низкая масса при рождении и мышечная гипотония;
лунообразное лицо с широко расставленными глазами;
характерный плач ребёнка, напоминающий кошачье мяуканье, причиной которого является изменение гортани (сужение, мягкость хрящей, уменьшение надгортанника, необычная складчатость слизистой оболочки) или недоразвитие гортани, признак исчезает к концу первого года жизни.
Слайд 85Подходы в борьбе с наследственными болезнями
1.
Массовое «просеивание» новорожденных на наследственные дефекты обмена веществ (выявление фенилкетонурии,
гипотиреоза, муковисцидоза, галактоземии и др.).2. Пренатальная диагностика (с использованием разных методов: УЗИ, фетоскопия, амниоцентез и др.) в 1- и 2-м триместрах беременности.
3. Медико-генетическое консультирование.
4. Контроль за мутагенной опасностью факторов окружающей среды.