Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Неорганическая химия Курс лекций для студентов медико-биологического
Содержание
- 1. Неорганическая химия Курс лекций для студентов медико-биологического
- 2. Лекция № 2 Протолитические буферные системы. Буферные системы организма, их взаимоднйствие
- 3. Содержание лекцииБуферные растворы. Определение, составТипы буферных систем3.
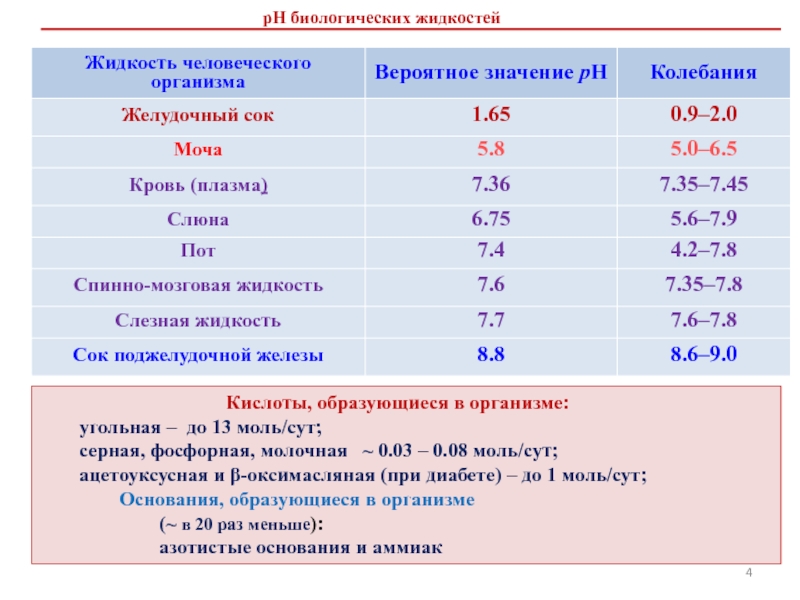
- 4. рН биологических жидкостейКислоты, образующиеся в организме: угольная
- 5. Кислотно-основные (протолитические) буферные системыБуферный раствор – раствор,
- 6. Типы буферных систем Примеры Интервал Значение буферных систем буферного
- 7. Ионы и молекулы амфолитов
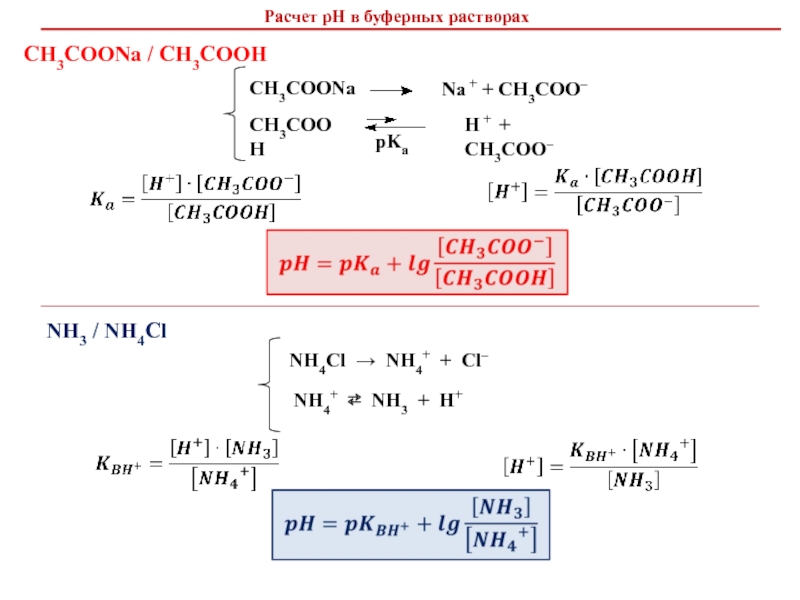
- 8. CH3COOHCH3COONaH + + CH3COO– Na + +
- 9. Уравнение Гендерсона-Хассельбаха
- 10. 4. Используя уравнение Гендерсона–Хассельбаха, можно вычислить, в
- 11. Схема (механизм) буферного действия системы СН3СОО– /
- 12. Буферная емкость Вa(b) — количество кислоты или
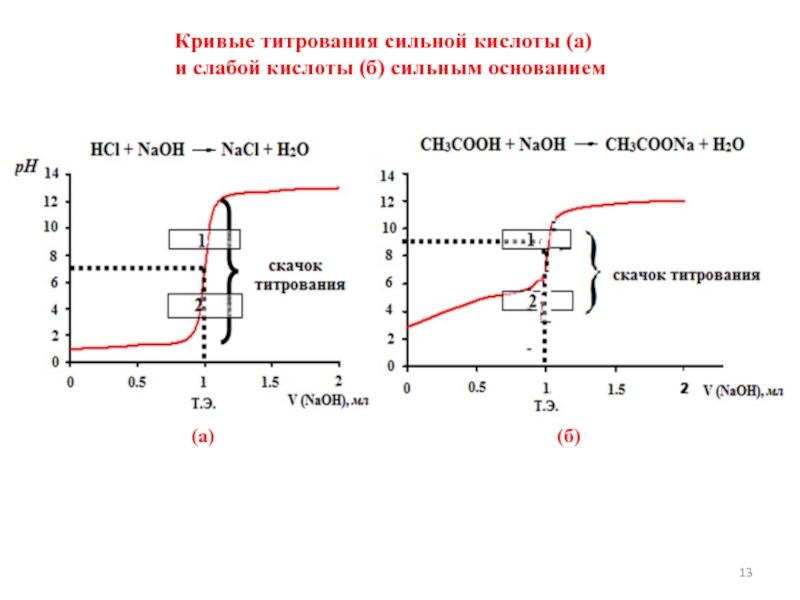
- 13. Кривые титрования сильной кислоты (а) и слабой кислоты (б) сильным основанием(а)(б)
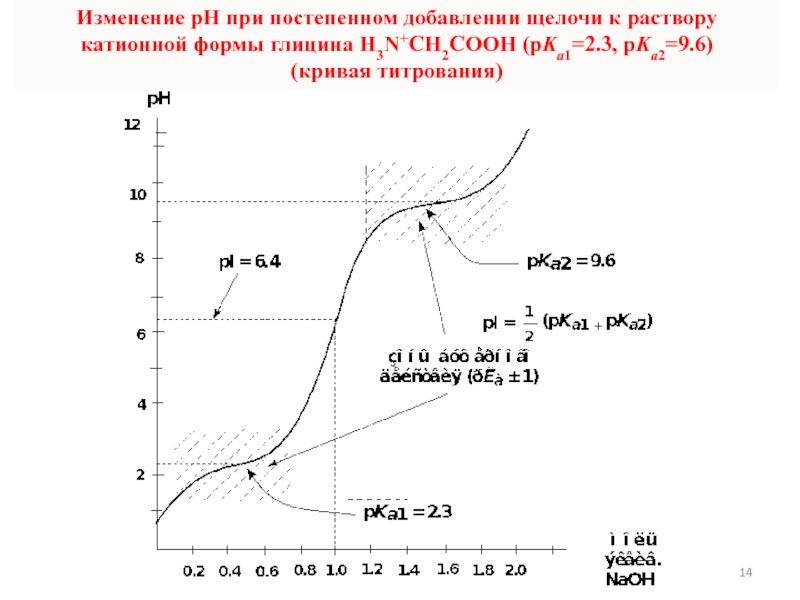
- 14. Изменение рН при постепенном добавлении щелочи к раствору катионной формы глицина H3N+CH2COOH (pKa1=2.3, pKa2=9.6) (кривая титрования)
- 15. Кислотно-основное состояние (КОС) организма человекаПлазма крови:
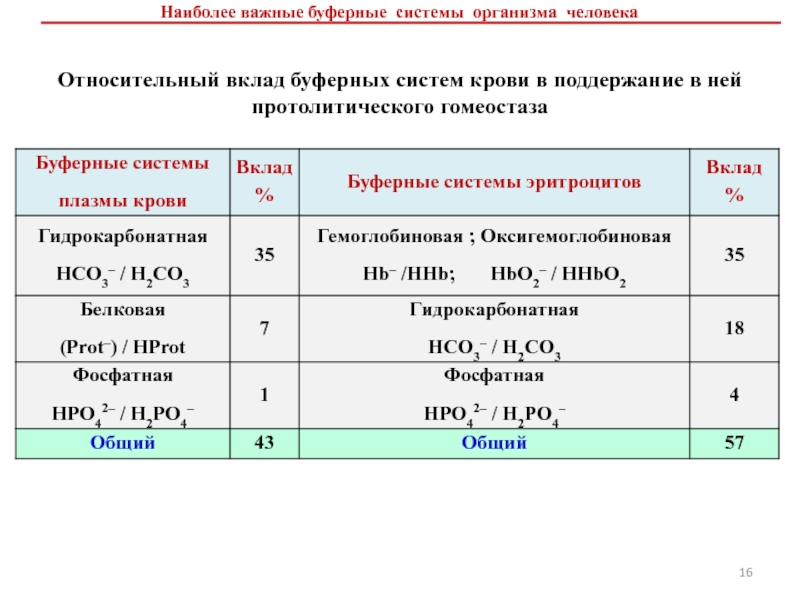
- 16. Наиболее важные буферные системы организма человекаОтносительный вклад буферных систем крови в поддержание в ней протолитического гомеостаза
- 17. В плазме: [HCO3–]/[CO2 + H2CO3] 20
- 18. Гидрофосфатная буферная система (в плазме крови –
- 19. Белковые буферные системы крови
- 20. В эритроцитах: при pH = 7.25Система гемоглобин
- 21. Взаимодействие буферных систем в организмеpKa(HHbO2)= 6.95pKa(HHb)= 8.20рKa(H2CO3)
- 22. В итоге, в плазму крови
- 23. Показатели кислотно-основного состояния (КОС) крови (кислотно-щелочного равновесия
- 24. Показатели кислотно-основного состояния (КОС) крови(продолжение)МЕТАБОЛИЧЕСКИЕ КОМПОНЕНТЫ КОСПоказатель
- 25. Коррекция кислотно-основного состояния организма (кислотно-щелочного равновесия)
- 26. Примеры расчетов для буферных растворов
- 27. Примеры расчетов для буферных растворов
- 28. Примеры расчетов для буферных растворов
- 29. Примеры расчетов для буферных растворов
- 30. КОНЕЦ ЛЕКЦИИВСЕМ СПАСИБО!!!
- 31. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Неорганическая химия
Курс лекций
для студентов медико-биологического факультета, специальность 30.05.01
«Медицинская
биохимия»
МЕДИЦИНСКИЙ УНИВЕРСИТЕТ им. Н.И.ПИРОГОВАСлайд 3Содержание лекции
Буферные растворы. Определение, состав
Типы буферных систем
3. Механизм буферного действия
4. Расчет рН буферных растворов. Уравнение Гендерсона-Хассельбаха. Анализ уравнения
5.
Буферная емкость. Интервал буферного действия6. Буферные системы плазмы крови, их функционирование и взаимодействие
7. Основные параметры КОС организма
Слайд 4рН биологических жидкостей
Кислоты, образующиеся в организме:
угольная – до 13
моль/сут;
серная, фосфорная, молочная ~ 0.03 – 0.08 моль/сут;
ацетоуксусная и
β-оксимасляная (при диабете) – до 1 моль/сут;Основания, образующиеся в организме
(~ в 20 раз меньше):
азотистые основания и аммиак
Слайд 5Кислотно-основные (протолитические) буферные системы
Буферный раствор – раствор, содержащий протолитическую равновесную
систему, способную поддерживать практически постоянное значение рН при добавлении небольших
количеств кислоты или щелочи или при разбавленииA– / HA
В / ВН+
H+ + B
ВН+
кислота
сопряженное
основание
сопряженная
кислота
основание
Все буферные системы помимо воды содержат как минимум два компонента: донора протона и акцептора протона, которые образуют сопряженную кислотно-основную пару
Кислотные буферные системы (ацетатная, гидрокарбонатная и др.)
Основные буферные системы (аммиачная)
Слайд 6Типы буферных систем
Примеры Интервал Значение
буферных систем буферного действия
рKа
Слабая кислота и ее анион А– / НА
Ацетатная
СН3СОО– /СН3СОО 3.8–5.8 4.8
Гидрокарбонатная
НСО3– /H2CO3 5.4–7.4 6.4 (pKa1)
Анионы кислой и средней соли или двух кислых солей
Гидросфатная
HPO42– /H2PO4– 6.2–8.2 7.2 (pKa2)
Карбонатная
CO32– /НCO3– 9.4–11.4 10.4 (pKa2)
Слабое основание и его катион B / BН+
Аммиачная
NН3 / NН4+ 8.2–10.2 9.2
Слайд 7 Ионы и молекулы амфолитов (аминокислот и белков)
Изоэлектрическая точка pI (ИЭТ) – значение рН, при котором
амфолит находится в изоэлектрическом (электронейтральном) состоянии Примеры Интервал Значение
буферных систем буферного действия рКа
Типы буферных систем
Слайд 8CH3COOH
CH3COONa
H + + CH3COO–
Na + + CH3COO–
Расчет рН
в буферных растворах
СН3СООNa / СН3СООН
pKa
NH3 / NH4Cl
NH4Cl → NH4+ +
Cl– NH4+ ⇄ NH3 + H+
Слайд 104. Используя уравнение Гендерсона–Хассельбаха, можно вычислить, в каком соотношении нужно
взять компоненты буферного раствора, чтобы приготовить раствор с заданным значением
рН.Анализ уравнения Гендерсона-Хассельбаха
1. рН буферных растворов зависит от силовых показателей слабой кислоты или основания, образующих конкретную буферную систему.
2. рН буферных растворов зависит от отношения концентраций компонентов сопряженной кислотно-основной пары, но практически не зависит от разбавления раствора.
3. Силовые показатели кислоты рKа или основания рKb, образующих конкретную буферную систему, можно вычислить по измерению рН раствора, если известны молярные концентрации компонентов.
Слайд 11Схема (механизм) буферного действия системы СН3СОО– / СН3СООН
1. Добавление сильной
кислоты:
CH3COO – + H +
(основание)
pH
≈ const2. Добавление сильного основания: NaOH
CH3COO –
Механизм буферного действия
pH ≈ const
CH3COOH
Слайд 12Буферная емкость Вa(b) — количество кислоты или щелочи, которые нужно
добавить к 1 л буферного раствора, чтобы изменить его рН
на единицуЗависит:
1) от концентрации компонентов буфера;
2) от соотношения компонентов (т.е. от рН)
Буферная емкость не постоянна в интервале буферного действия
Интервал буферного действия ВЕ – область значений рН, в пределах которого данная система проявляет буферные свойства:
При рН = pKa; Вк = Вщ
При рН < pKa; Вк < Вщ
При рН > pKa; Вк > Вщ
Буферная емкость
Вa(b) – величина, характеризующая способность буферного раствора противодействовать изменению рН среды при добавлении кислот или щелочей
т.е. ВЕ = pKa 1
Слайд 14Изменение рН при постепенном добавлении щелочи к раствору катионной формы
глицина H3N+CH2COOH (pKa1=2.3, pKa2=9.6)
(кривая титрования)
Слайд 15Кислотно-основное состояние (КОС) организма человека
Плазма крови: рН = 7.40 0.05;
a(H+) = 3.7·10–8 – 4.0·10–8 моль/л
Артериальная
кровь: рН = 7.38 – 7.42Венозная кровь: рН = 7.36 – 7.40
Внутриклеточные жидкости: рН = 6.8 – 7.8
Ацидоз – нарушения КОС организма, вызванные увеличением кислотности (снижением рН) сред организма. Может быть компенсированный (рН ≈ норма) и некомпенсированный (рН ˂ норма)
Алкалоз – нарушение КОС организма, обусловленное повышением рН биологических жидкостей. Может быть компенсированный (рН ≈ норма) и некомпенсированный (рН ˃ норма)
Слайд 16Наиболее важные буферные системы организма человека
Относительный вклад буферных систем крови
в поддержание в ней протолитического гомеостаза
Слайд 17В плазме: [HCO3–]/[CO2 + H2CO3] 20 : 1
Bк = 40 ммоль/л
Bщ = 1–2 ммоль/л
pH↓
pH↑
Гидрокарбонатная буферная система крови
При
появлении кислых метаболитов:При появлении щелочных веществ:
В эритроцитах: [НСО3– ] / [Н2СО3] = 7:1
Вк(эритр) < Вк(пл.кр.)
Физиологические условия:
Слайд 18Гидрофосфатная буферная система
(в плазме крови – Na2НРО4/NaН2РО4; в клетке
– K2НРО4/KН2РО4)
В плазме крови:
Вк = 1–2 ммоль/л Вщ = 0.5
ммоль/лНейтрализует кислые метаболиты, избыточный Н2РО4– выводится почками – рН мочи снижается
При увеличении c(оснований) избыточный НРО42– выводится почками – рН мочи повышается
В эритроцитах:
[НРО42– ] : [Н2РО4– ] = (1.5-4) : 1
По сравнению с гидрокарбонатной гидрофосфатная система более «консервативна» – избыточные продукты нейтрализации выводятся через почки (2–3 суток).
рН мочи 4.8 – 7.5
Слайд 20В эритроцитах: при pH = 7.25
Система гемоглобин (Hb– /ННb) –
оксигемоглобин (HbO2– /ННbО2)
O2
O2
H+ + HbO2–
(pKa= 6.95)Гемоглобиновая / оксигемоглобиновая буферная система
При добавлении кислот поглощать Н+ будет в первую очередь Hb–
Нейтрализовать ОН – активнее будет HHbO2
Гемоглобиновая буферная система играет значительную роль в процессах дыхания, транспорта кислорода, поддержании постоянства рН в эритроцитах. Она эффективно функционирует только в сочетании с другими буферными системами крови
90%
HHbO2
65%
Слайд 21Взаимодействие буферных систем в организме
pKa(HHbO2)= 6.95
pKa(HHb)= 8.20
рKa(H2CO3) = 6.1
HHbO2 +
(Hb·CO2)– ⇄ HbO2– + HHb + CO2
Слайд 22 В итоге, в плазму крови из тканей поступают
продукты метаболизма –
Н+ и СО2, а из эритроцитов –
НСО3– Взаимодействие буферных систем в организме
H2CO3 + Hb– → (Hb– ·CO2) + H2O
HCO3– – 80%
(Hb·CO2)– – 15%
CO2 – 5%
Слайд 23Показатели кислотно-основного состояния (КОС) крови (кислотно-щелочного равновесия (КЩР) крови)
Показатель
КОС
Название
Значение
в норме
Изменения
при патологии
рН
Водородный показатель
7.40.5
6.87.8
7.357.20 ацидоз
7.457.50 алкалоз
рСО2
Показатель СО2, или
парциальное
давление
СО2 над кровью
респираторный (дыха-
тельный) компонент КОС405
мм рт. ст.
(5.30.7
кПа)
10130 5 мм рт. ст.
> 40 мм рт. ст. (рН < 7.4)
дыхательный ацидоз; < 40 мм рт. ст. (рН > 7.4)
дыхательный ацидоз
[HCO3]
Показатель концентрации
гидрокарбонат-ионов HCO3
(щелочной резерв крови)
2425
ммоль/л
Значение [HCO3]
указывает на характер
нарушения КОС *.
* Дыхательный незначительные изменения; метаболический большие изменения
Слайд 24Показатели кислотно-основного состояния (КОС) крови
(продолжение)
МЕТАБОЛИЧЕСКИЕ КОМПОНЕНТЫ КОС
Показатель
КОС
Расшифровка параметра
Значение
в
норме
Изменения
при патологии
BB
(Buffer
Base)
Сумма буферных оснований:
ионы HCO3 (25 ммоль) и анионы
белка (Pt) (17 ммоль);
BB = [HCO3] + [Pt] = 42 ммоль/л 42
ммоль/л
BB > 42 при метаболи-ческом алкалозе;
BB < 42 при метаболи-ческом ацидозе
BE
(Base
Excess)
Избыток оснований или свобо-
дные буферные основания:
количество кислоты или осно-
вания, нужного для доведения
рН крови до нормы при рCO2
= 40 мм рт. ст.;
BB = 42 + BE
03
ммоль/л
+30 30 > ммоль/л;
BE > 0 (рН > 7.4) ─ метаболический алкалоз;
BE < 0 (рН < 7.4) ─ метаболический ацидоз











![Неорганическая химия
Курс лекций для студентов медико-биологического В плазме: [HCO3–]/[CO2 + H2CO3] 20 : 1 Bк = В плазме: [HCO3–]/[CO2 + H2CO3] 20 : 1 Bк = 40 ммоль/лBщ = 1–2 ммоль/лpH↓pH↑Гидрокарбонатная буферная](/img/thumbs/d93c261f0108ce561726cc65254fd449-800x.jpg)