Слайд 1Обмен гемоглобина
В норме обмен Hb связан с
порфиринами, железом, белком и занимает промежуточное положение между обменом порфиринов
и желчными пигментами.
Hb это сложный белок-хромопротеид, но в это семейство включены также миоглобин и цитохромоксидазы, которые относят к классу дыхательных белков.
Гем является древней молекулой, существующей более 500 млн. лет
Эритроциты у взрослых
образуются (эритропоэз)
преимущественно в
костном мозге при активном участии специфического регулятора - эритропоэтина. Эритропоэтин (Эпо) человека – гликопротеин, состоящий из 166 аминокислот (ММ 34.000). Его количество в плазме определяется с использованием радиоиммунолических методов (РИА).
Слайд 3 Эпо синтезируется главным образом почками и скорость
его секреции в кровоток увеличивается при гипоксических состояниях. В костном
мозге он взаимодействует с клетками предшественниками при участии специфического рецептора со свойствами тирозинкиназы. Действие Эпо усиливается другими факторами ( интерлейкином-3 и инсулиноподобным фактором роста). Получение рекомбинантного Эпо позволило использовать его в лечении анемий.
Слайд 4 В процессе дифференцировки клетка приобретает способность синтезировать
свой главный белок – гемоглобин, постепенно теряет ядро и другие
органоиды и превращается в эритроцит, который чаще называют форменным элементом крови, чем клеткой. От более старых эритроцитов, которые уже находились в циркулирующей крови, молодые эритроциты можно отличить по выявляемой при помощи некоторых красителей сеточки, которая состоит из рибосомальной РНК( используемой для синтеза гемоглобина) и других органелл, которые могут функционировать некоторое время (48 часов) после поступления эритроцитов в сосудистую сеть. Такие эритроциты называют ретикулоцитами и их количество в крови составляющее в норме около 1% эритроцитов служит индикатором эритропоэза.
Слайд 5 В норме у взрослых мужчина
- 4.6-6.2 миллионов эритроцитов /мкл крови, а у женщин -
4.2-5.4 миллионов /мкл. Общее количество эритроцитов в кровотоке около 2.5 x 1013. Нормальный уровень Hb для мужчин - 140-180 г/л ( 14 –18 г на 100мл, 8,7-11.2 ммоль/л в пересчете на ММ мономера), и для женщин - 12-16 г/л. Значение гематокрита (объем упакованных эритроцитов) для мужчин и женщин - 42-52 % и .37-47% соответственно. Продолжительность жизни нормального эритроцита - 120 суток. Около 1 % популяции эритроцитов кровеносного русла (200 миллиардов клеток или 2 миллиона в секунду) заменяются ежедневно. Продолжительность жизни красной клетки крови резко сокращается при гемолитических анемиях. В этих состояниях число ретикулоцитов заметно увеличивается, поскольку костный мозг пытается компенсировать потери, увеличивая количество новых, молодых эритроцитов кровотоке.
Слайд 6 «Стареющие» эритроциты захватываются клетками РЭС( селезенка,
костный мозг и печень), где разрушаются. Образующиеся при распаде порфириновых
колец желчные пигменты выделяются, а железо и аминокислоты глобина используются повторно. Повышение эритроцитов в крови называют полицетемией, снижение – анемией. В основе снижения может лежать гемолиз - повышенный распад эритроцитов, достигших нормального возраста ( гемолитическая анемия) или снижение биосинтеза из-за недостаточности железа (железодефицитные анемии) или витамина В12- (мегалобластическая анемия) При повреждение стволовых клеток костного мозга говорят об апластической анемии
Слайд 7
Время жизни 120 дней (110-130).
Поверхность всех эритроцитов 3800 м2.
Общее количество
25XI012.
Ежедневная потребность 208XI09.
Продукция эритроцитов в сек2,4XI06.
Путь, пробегаемый эритроцитами за 120 дней-400 км.
Вес эритроцита 3XI0-11 г(=30пг)
Слайд 8Эритроцит
По структуре эритроцит представляет собой безъядерный, двояковогнутый диск с диаметром
69 мкм, толщиной-1мкм по центру, и по краям 2-2.5
мкм.
Мембрана Э толщиной 6 нм содержит:
49% белка, 44% липидов, 7% углеводов.
Главным катионом эритроцита является К+, затем Na+, Са++, Мg++. Анионы представлены Сl- и
НСО3-.Эритроцит содержит Нb. Рн. и
2,3 ДФГ.
Слайд 9 Эритроцит является осмометром, ,который набухает и
сжимается при увеличении и снижении осмотического давления.
В гипотоническом растворе Эритроциты
набухают и происходит их гемолиз.
В изотонической среде гемолиз Э вызывают детергенты, мыла, хлороформ.
Мембрана Э содержит Na-К –АТФ-азу, которая ингибируется сердечными гликозидами и влияет на проницаемость мембраны для ионов натрия и калия через мембрану Э и др. клеток. Концентрация глюкозы в составе Э равна ее концентрации в плазме, куда она поступает путем облегченной диффузии
Слайд 10 Эритроциты легко меняют свою форму. Архитектура
мембраны эритроцитов определяет ее механические свойства. Благодаря высокой способности изменять
свою форму - поверхность уплощенного двояковогнутого эритроцита повышается до 140 мкм2. Это связано с особенностями структуры мембран эритроцита.
Слайд 11Состав мембраны эритроцитов
Мембрана содержит 25% ХС, 60%
фосфоглицеридов, и 5-10% гликолипидов.
Из 60% ФГ- 15-16% это
сфингомиелин, причем ( 80-86%) его содержания находится на внешней стороне мембраны Э; 15-16% -фосфатидилхолин( находится снаружи), и 15-16 % представлен
-этаноламин.
Слайд 12Белки эритроцита
Эритроцит имеет как поверхностные так
и интегральные белки.
У человека в Э
более обнаружено, более 100 различных ферментативных активностей.Натрий-калий-АТФ-аза и Холинэстераза это ферменты, связанные с мембраной. Спектрин является белком, определяющим каркас Э и связан с актомиозином.
Интегральный белок мембраны-гликофорин является гликопротеидом, весьма чувствительным к токсинам, он выполняет функции антигена, конечный фрагмент молекулы гликофорина имеет структуру Fuc –Gal -N- acetyl, которая определяет группу крови у людей.
Слайд 13Метаболизм эритроцита
В Э нет ЭПР, нет ядра
и митохондрий. Основными метаболическими путями являются анаэробный гликолиз и ПФП.
При низкой ферментативной активности ферментов этих метаболических путей возникают гемолитические анемии, а также происходит нарушение структуры и функции Э. Анаэробный гликолиз является единственным способом извлечения энергии для Э.
Слайд 14
Метаболические процессы в эритроцитах отличаются рядом особенностей
Около 2% белка мембран эритроцитов составляет переносчик глюкозы. Он
состоит из 492 аминокислот, уложенных в 12 трансмебранных сегментов, формирующих пору. Это один из 5 известных переносчиков глюкозы, обнаруженных в разных тканях. Поступление глюкозы в эритроцит не зависит от инсулина.
Слайд 15 Глюкоза в эритроцитах используется в
основном в гликолизе и ПФП.
Глюкоза основной
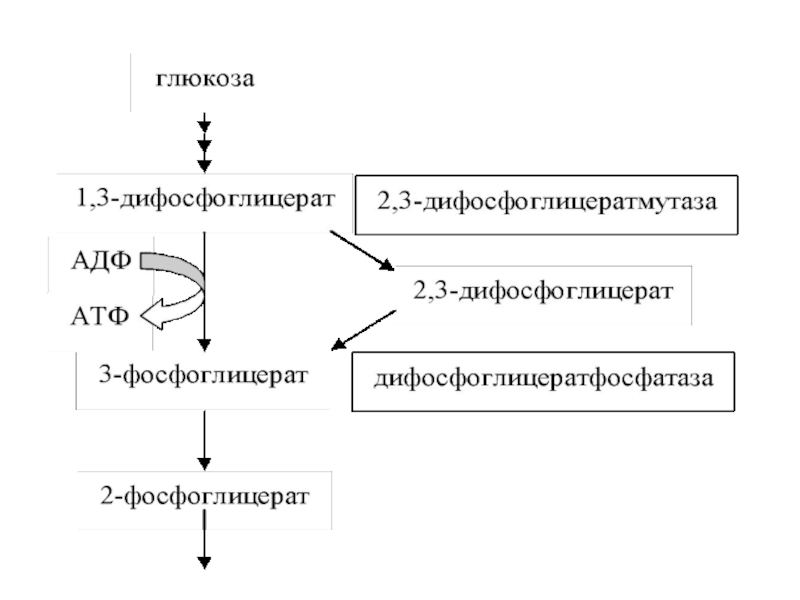
источник энергии в эритроцитах. После поступления в клетку и фосфорилирования в глюкозу –6-фосфат при помощи гексокиназы около 5-10% глюкозы идет на образование НАДФН* Н+ в ПФП и 90-95% окисляется по гликолитическому пути с образованием АТФ. Особенностью обмена в эритроцитах является боковой путь, ответвляющийся на уровне 1.3-дифосфоглицерата.
Слайд 18 Большинство белков мембраны являются
гликопротеинами и являются интегральными белками мембраны.Что касается белков без углеводной
части, то они находятся на внутренней поверхности: к ним относятся ферменты, дегидрогеназа 3 ФГА, структурные белки (спектрин или актин) и гемоглобин. Так как актиновые филаменты взаимодействуют с несколькими молекулами спектрина , образуются разветвления спектрина и формируется единая молекулярная сеть в мембране эритроцита .
Соединение мембранного скелета с бислоем липидов обеспечивает анкирин, который в районе головки спектрина связывается с цитозольном концом белка полосы 3. Анкирин чувствителен к протеолизу.
Слайд 19 Гемоглобин –главный белок цитозоля эритроцитов
Одну треть клеточной массы эритроцитов составляет гемоглобин. Он
же придает и красный цвет эритроциту и крови и выполняет следующие функции:
-Транспорт кислорода по крови
-Участие в транспорте диоксида углерода
-Участие в создании буферной системы, поддерживающей концентрацию ионов водорода во внеклеточном пространстве.
Содержание гемоглобина в одном эритроците можно рассчитать, зная общее содержание гемоглобина и количество эритроцитов При концентрации гемоглобина в 160 г/л крови, которая содержит 5000 млрд эритроцитов содержание Hb в одном эритроците 32 пиког ( в норме 27-54).
Слайд 20 Спектрин главный белок цитоскелета
является димером из двух длинных (100 нм в длину) полипептидных
цепей (спектрин 1 и спектрин 2), которые уложены антипараллельно и формируют суперспираль. Своими головными концами спектриновые димеры путем самоассоциации образуют тетра- и олигомеры. Помимо домена используемого в образовании тетрамеров у спектрина есть участки связывания с анкирином, актином, и белком 4.1.
Слайд 22 При переносе кислорода возможно образование
метгемоглобина -гемоглобина с окисленным Fe3+. За сутки в метгемоглобин окисляется
около 3% всего гемоглобина. Восстановление железа метгемоглобина обеспечивается НАДН-цитохром b5 метгемоглобин редуктазой. НАДН для этой реакции поставляется гликолизом., но образование метгемоглобина сопровождается образованием супероксидного аниона О2- , являющегося представителем активных форм кислорода, к которым относятся перекись водорода (H2O2), пероксильные радикалы (ROO-), и гидроксильные радикалы (ОН').
Слайд 23 Последние - особенно активны
и могут вступать в реакции с белками, нуклеиновыми кислотами, липидами,
и другими молекулами, изменяя их структуру, что в конечном итоге приводит к нарушению функции клетки. Супероксидный анионный радикал может спонтанно дисмутировать с образованием H2O2 и O2; однако, скорость этой реакции значительно увеличивается под влиянием супероксид дисмутазы (СОД).
Слайд 24Ферменты АОЗ в Эритроцитах
- Это глютатионредуктаза,
- метгемоглобин редуктаза
- глутатионпероксидаза.
GluSH защищает ферменты Э от окисления по цистеиновым группам:
Glus-sulG-----?2GluSH ( Se- зависимая)
Hb(Fe++) + O2-----? MetHb(Fe+++) + O2-
O2- + 2H+ ----------?H2O2
Аналогично работают каталаза и СОД
Слайд 25 Перекись водорода, образующаяся в
этих реакциях, может разрушаться разными путями. В эритроцитах эту функцию
выполняют фермент каталаза, превращая перекись в H2O и O2, и, содержащий селен фермент глютатионпероксидаза, который катализирует распад пероксида водорода, с образованием воды, окисляя глутатион. В присутствии Fe2+, пероксид водорода без участия ферментов распадается с образованием гидроксильных радикалов. Эти процессы могут значительно усиливаться при поступлении больших количеств железа.
Слайд 26 ПФП окисления глюкозы в
эритроцитах выполняет важную роль в поставке восстановительных эквивалентов системам, разрушающим
активные формы кислорода. Врожденная недостаточность дегидрогеназы глюкозо-6-фосфата одно из наиболее распространенных и известных причин гемолитической анемии.
Описано свыше 300 генетических вариантов этого фермента и свыше 100 млн людей страдают от этого заболевания. Поступление в организм таких людей веществ, способствующих образованию пероксида водорода или супероксидного аниона кислорода вызывает активное потребление восстановленного глутатиона в глутатионпероксидазной реакции, а недостаточность дегидрогеназы глюкозо-6-фосфата не позволяет регенерировать глутатион и клетка подвергается окислительному стрессу, который завершается нарушением структуры липидов мембран и гемолизом.
Слайд 27 В Э есть рудименты ЦТК- ферменты-
изоцитрат ДГ, малат ДГ, а также АсАТ, АлАТ, Mg++ и
Na-K-АТФ-азы. В Э есть восстановленный GluSH, необходимый для АОЗ.
В Э наблюдается биосинтез ЖК.
ХС в Э не синтезируется, но происходит быстрый обмен с ХС-содержащими фракциями ЛП крови.
Э может использовать уже готовые пурины.
Только в Э работает шунт Раппопорта,
образование 2,3 ДФГК- является своеобразным депо
Слайд 28Шунт Раппопорта конкурентно вытесняет О2 из HbO2 при состоянии гипоксии
в ткани, а 2,3 ДФГ сдвигает кривую насыщения Hb кислородом
вправо.
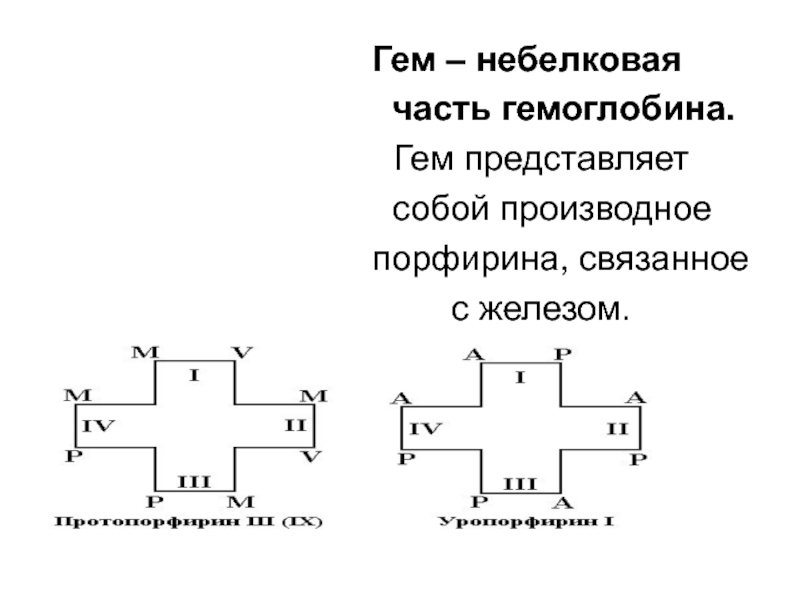
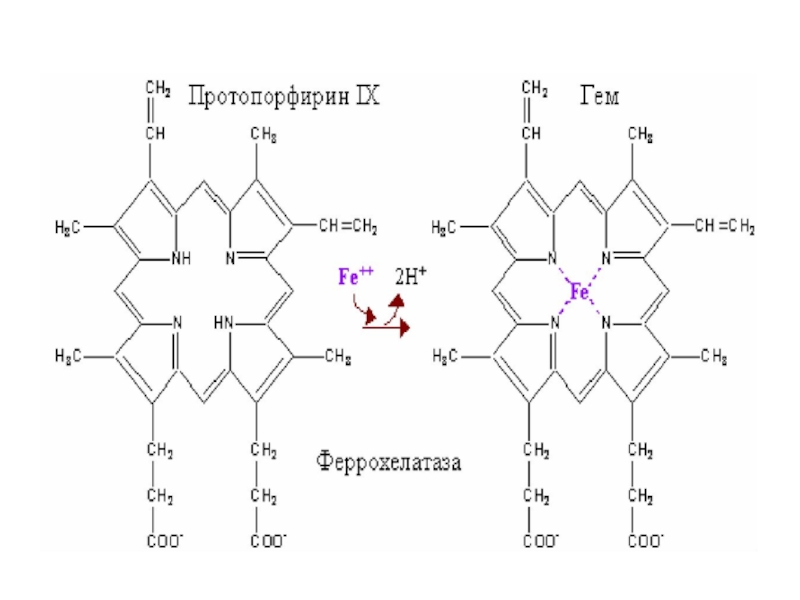
Гем – небелковая
часть гемоглобина.
Гем представляет
собой производное
порфирина, связанное
с железом.
Слайд 33
АЛК-дегидратазу называют также синтазой ПБГ. Этот фермент
связывает восемь атомов Zn 2+, четыре из которых участвуют в
механизме катализа. Zn2+-связывающие домены содержат цистеин и могут также связывать Pb2+, что вызывает торможение активности фермента. Повышенный уровень AЛК в крови является причиной некоторых неврологических проявлений отравления свинцом. Высокие уровни AЛК являются результатом наследственного дефицита некоторых ферментов пути синтеза гема. AЛК оказывает токсический эффект прежде всего на мозг, что по-видимому связано со структурным подобием AЛК с нейромедиатором g-аминомасляной кислотой. При аутоокислении AЛК образуются активные формы кислорода.
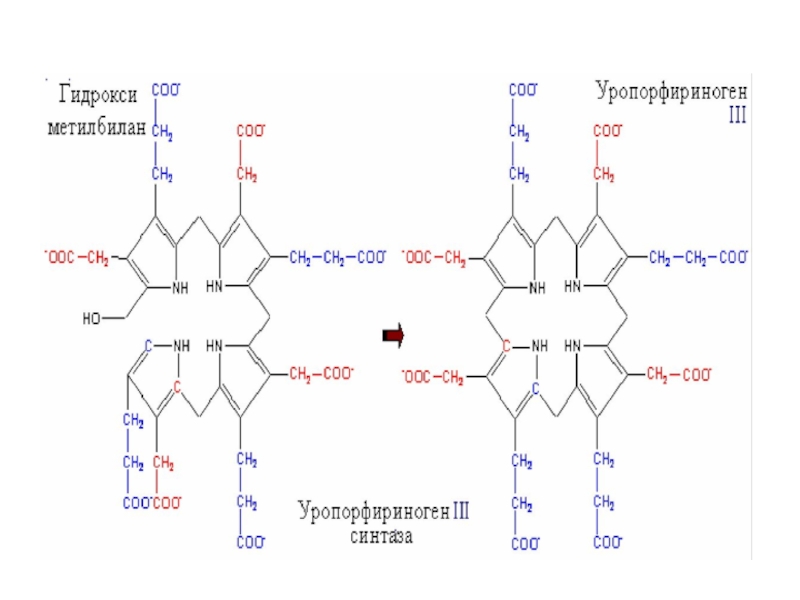
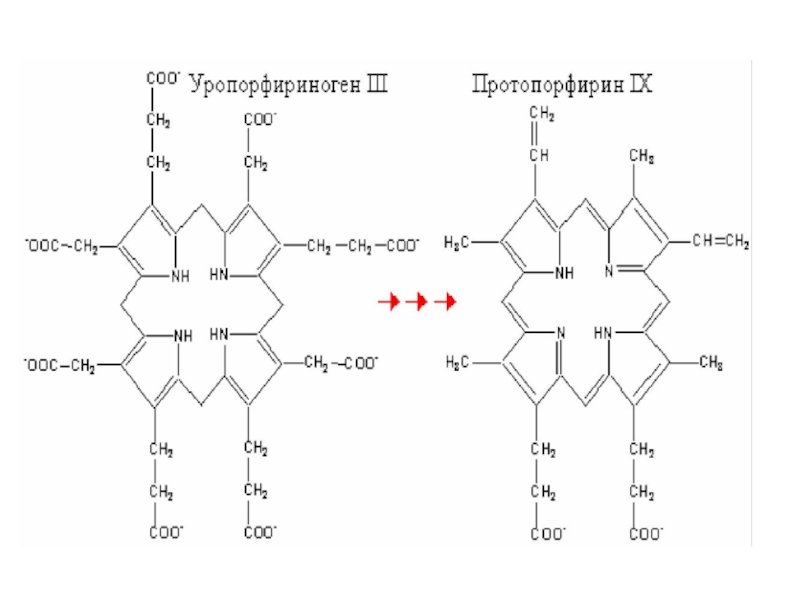
Слайд 35 Следующий этап катализируется уропорфилиноген –I-синтазой или
дезаминазой ПБГ. Дезаминаза ПБГ вначале из двух молекул ПБГ синтезирует
свою простетическую группу (дипиррометан), а затем присоединяет еще 4 молекулы ПБГ. Такая гексапиррольная структура удерживается на ферменте благодаря большой конформационной гибкости фермента, который состоит из 3-х подвижных доменов. Гидролиз связи к дипиррометану высвобождает гидроксиметилбилан, который представляет линейную тетрапиррольную структуру. Под влиянием уропорфириноген III синтазы линейный тетрапиррол превращается в макроциклический уропорфириноген III.
Слайд 39 Причинами гемолитической анемии могут
быть нарушения структурных белков мембран.
Врожденный
элиптоцитоз- гетерогенная группа заболеваний проявляющаяся морфологически овальной формой эритроцитов. Причина- отсутствие белка 4.1, которое ведет к нарушению интеграции мембранных белков эритроцитов тем самым к гемолитической анемии.
Нарушения в структуре спектрина вызывает значительные изменения архитектуры цитоскелета эритроцита и приводит к другому врожденному заболеванию - сфероцитозу. Из-за нарушения ассоциации с другими белками скелета мембран эритроцит приобретает шарообразную сферическую форму и поэтому называется сфероцитом. Эритроциты с измененной формой уже на 10 день жизни удаляются фагоцитами селезенки из крови. Хирургическое удалении селезенки при этом заболевании увеличивает продолжительность жизни сфероцитов до 80 дней.
Слайд 40 При отклонении значений ниже указанных говорят
о гипохромной анемии ( недостаток железа)
При
отклонении значений выше указанных говорят о гиперхромной анемии (недостаток В12)
При уменьшении концентрации Hb и числа эритроцитов говорят о нормохромной анемии.
У нормального взрослого массой 70 кг и объемом крови в 5 л при условии среднего содержания Hb 160 г/л (16 г% или 9.9.ммоль/л ) общее количество Hb составит 800 г. Ежедневно при этом 6.25 г или около 1% распадается и синтезируется вновь.
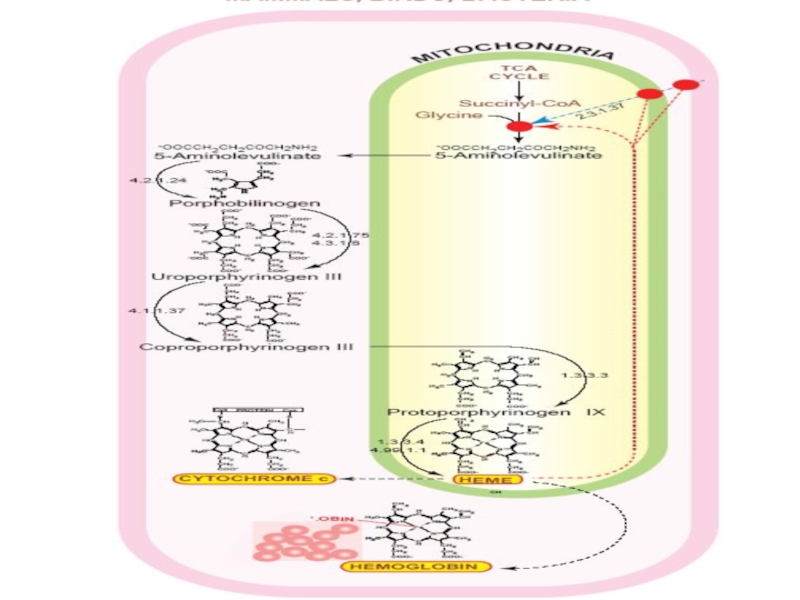
Слайд 42 Гем – главный регулятор
количества АЛК синтазы в клетке.
АЛК-синтаза
катализирует первую реакцию на пути образования гема и ее активность обычно самая низкая по сравнению с другими ферментами, участвующими в синтезе гема. Гем - основной регулятор синтеза этого фермента играет роль корепрессора в механизмах регуляции транскрипции гена, кодирующего АЛК –синтазу. Время полураспада этого фермента составляет только1 час. Всякие процессы, которые ведут к усиленному расходованию гема сопровождаются значительным усилением синтеза АЛК синтазы. Это относится в первую очередь к механизмам обезвреживания ксенобиотиков, в которых принимает активное участие цитохром Р450 и повышенное расходование гема в этих процессах вызывает дерепрессию синтеза АЛК-синтазы и усиление образования гема.
Слайд 43 Температура, значение pН и парциальное
давление CO2 влияют на кривые поглощения кислорода
На
кривую поглощения кислорода оказывают влияние температура, значение рН, парциальное давление СО2 и другие факторы. Под стандартной кривой понимают кривую, полученную при 37 или соответственно 38 C (в зависимости от соглашения) и PH 7,4:
Сдвиг влево этой кривой означает увеличение сродства к кислороду, т.е. связывание О2 в легких облегчается, отдача O2.- в тканях затрудняется.
Сдвиг вправо означает падение сродства к кислороду, т.е. кислород поглощается в легких с трудом, но хорошо передается тканям.
Среди физиологических условий, непосредственно влияющих на сродство гемоглобина к кислороду, стоят изменения значения pН или же парциального давления СО2 в крови.
Слайд 44 Повышение отдачи 02 в кислой
и богатой C02 областях ткани, биологически так же рационально как
улучшение отдачи 02 при повышенной температуре (например. при работающей мышце). Типичные сдвиги кривых насыщения кислородом человеческой крови могут вызываться также
- вызванными мутациями гена изменениями структуры гемоглобина,
- физиологическими разновидностями гемоглобина (HbF или HbA),
- содержанием гемоглобина и концентрацией катионов в отдельном эритроците,
- нарушением активности ферментов в цитозоле эритроцитов,
- cодержанием в эритроцитах органических фосфорсодержащих соединений, регулирующих сродство гемоглобина к кислороду.
Слайд 452.3-дифосфоглицерат сдвигает кривую насыщения гемоглобина кислородом вправо
Эритроцит обладает системой механизмов направленных на поддержание обеспечения кислородом
тканей при различных неблагоприятных внешних условиях. Так при пребывании на высоте в 4500 м наблюдается выраженное повышение концентрации 2,3- дифосфоглицерата, которое нормализуется через 52 часа после возвращения человека к обычным условиям. Одновременно с повышением 2,3 дифосфоглицерата повышается Р50, что соответствует сдвигу кривой насыщения вправо. Организм реагирует таким же компенсаторным механизмом на изменения количества эритроцитов в циркуляции.
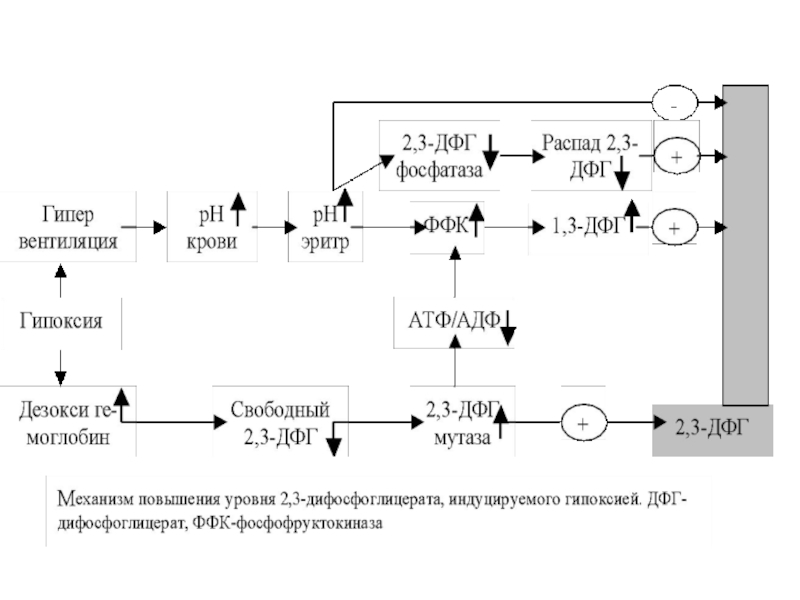
Слайд 46 Гипоксия ведет к повышению уровня 2,3 дифосфоглицерата
в эритроцитах. Изменение рН в эритроцитах играет ключевую роль в
регуляции уровня 2,3-дифосфоглицерата при гипоксии(недостатке кислорода в тканях), алкалозе (повышение рН во внеклеточном пространстве) или ацидозе (падение рН во внеклеточном пространстве).
При гипоксии недостаток кислорода ведет к гипервентиляции с повышенным выделением СО2, что сопровождается повышением значения рН крови и эритроцитов (алкалоз). В эритроцитах алкалоз поддерживается также повышенным связыванием протонов дезоксигемоглобином, количество которого увеличивается при гипоксии
Слайд 48 Защелачивание внутри эритроцитов ведет к
повышению активности ФФК и усилению образования 1,3-ДФГ, а следовательно, и
2,3-ДФГ .Одновременно, тормозится активность фосфатазы 2,3-ДФГ, что является дополнительным источником повышения его концентрации в эритроцитах. Однако, повышение уровня 2,3-ДФГК ведет к увеличению уровня протонов в эритроцитах и противодействует вызванному гипоксией повышению рН внутри эритроцитов и изменениям, связанным с повышением рН, что составляет основу принципа обратной связи, согласно которому 2,3-ДФГ регулирует свой уровень в эритроцитах
Слайд 49 Эритроциты постоянно разрушаются, заменяясь новыми. Суточный распад-
20 мл Э, т.е. 0.85% всей массы Э. Каждый час
у взрослого образуется 6×109 степени кр .кр клеток. Период жизни Э 110-120 дней. У 80 дневного Э концентрация МетHb в 4-5 раз больше, чем у зрелого. Изменение структуры мембраны меняет форму и приводит к гемолизу.
Слайд 50 Распад Э начинается в периферической крови и
заканчивается в клетках РЭС, где образуется непрямой Билирубин. Клетками РЭС
и кровью билирубин переносится к печени. Билирубин представляет собой неполярное, нерастворимое в воде соединение. Оно связывается с альбумином и не проходит через почечный барьер. Под действием микросомальной гем-оксигеназы происходит окисление гема.
Слайд 51 Гем +О2 ---?биливердин + СО2 + Fe
++
Коферментом микросомальной гем- оксигеназы является NADF*H. Микросомальная гем-
оксигеназа имеет смешанную функцию. Для нее необходимы- О2, NADF*H и цитохром С-редуктаза.
Гем +О2 ---?биливердин + СО2 + Fe ++
Гем переходит в вердоглобин далее в биливердин и билирубин.
Образующиеся катионы Fe ++ захватывается трансферрином и направляется в депо, или в костный мозг, на биосинтез Hb или других гем содержащих протеидов.
Глобин подвергается гидролизу на аминокислоты и также используется при других биосинтезах.
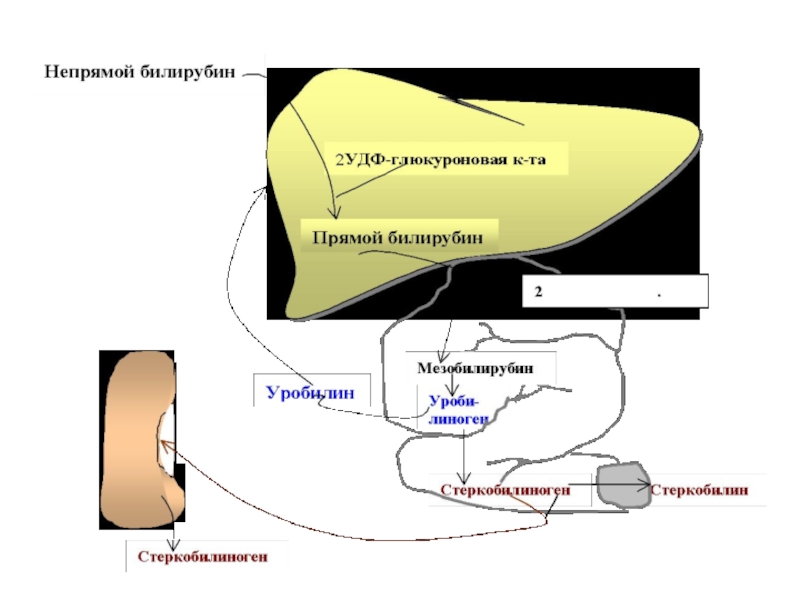
Слайд 52 Образующийся при распаде гемоглобина билирубин
поступает в кровь и связывается альбуминами плазмы - это непрямой
билирубином. В отличие от прямого билирубина, непрямой не даёт цветную реакцию с диазореактивом Эрлиха пока белки плазмы крови не осаждены спиртом. Непрямой билирубин называется также свободным, поскольку его связь с альбуминами плазмы не химическая (не ковалентная), а абсорбционная.
Слайд 53 Клетками РЭС и кровью билирубин
переносится к печени. Билирубин переносится в соотношении --1моль А на
2 моля Б.На клеточных мембранах печени, Билирубин частично освобождается от Альбумина и переносится в гепатоциты. Билирубин это неполярное, нерастворимое в воде соединение. Связанное с А , оно не проходит через почечный барьер. Под действием микросомальной гем-оксигеназы происходит окисление гема.
Б поступает в кишечник через желчные протоки и под действием кишечных бактерий и анаэробных дегидрогеназ- восстанавливается в уробилиноген и стеркобилиноген -основные пигменты мочи и кала.
Слайд 55Попадая в печень, билирубин ковалентно связывается с 2 молекулами УДФ
-глюкуроновой кислоты, образуя диглюкуронид билирубина, который называется связанным билирубином. Связанный
билирубин называется также прямым, поскольку он легко даёт цветную реакцию с диазореактивом Эрлиха.
Прямой и небольшая часть непрямого билирубина вместе с желчью поступают в тонкий кишечник, где от прямого билирубина отщепляется УДФ-глюкуроновая кислота – при этом образуется мезобилирубин. Последний в конечных отделах тонкого кишечника под воздействием микроорганизмов восстанавливается в уробилиноген, часть которого всасывается по мезонтериальным сосудам и поступает в печень (истинный уробилин), где разрушается до пиррольных соединений.
Слайд 56 Т.о. в клетках РЭС
в частности в печени происходит распад :
Эритроцит-Hb--> МетHb?
биливердин+ 2Н+--> билирубин+6Н+—> уробилиноГЕН-- 2Н+--? уробилин, и появляется в моче, даже при незначительном содержании в плазме. Непрямой Б - неконъюгированный в воде нерастворим.
С желчью в кишечник попадает часть непрямого и прямой Б, где от прямого отщепляется глюкуроновая кислота и он восстанавливается в уробилиноген:–билирубин+ 6Н+---?уробилиноГЕН
Слайд 57 Часть уробилиногена 75-80% переходит в стеркобилиногенен--- ?стеркобилин.
20-25% уробилиногена всасывается в обл. тонкой кишки и через
vena porta в печени окисляются до ди и три пирролов, которые опять направляются на биосинтез Hb. Другая часть всасывается в нижних отделах тонкого кишечника в систему нижней полой вены, через геммороидальные вены в большой круг кровобращения - выводится с мочой . В моче обнаруживаются следы стеркобилиногена.
Слайд 58 Экспериментально доказано, что организм образует на 10-15% больше
Б и соответственно Уробилина, чем ожидается при расщеплении Hb. Это
связано с окислением гем- оксигеназой - каталазы, цитохромов, и Миоглобина мышц. Клиренс Hb меньше почечного порога, поэтому в процессе эволюции выработался механизм, сберегающий Fe++ и белок в организме. В плазме крови во фракции альфа 2- глобинов, есть гаптоглобины. Они образуют комплексы -МетHb- гаптоглобин. Поэтому легкие молекулы Hb утяжеляются , и не проходят почечный порог.
Слайд 59
Определение содержания желчных пигментов в крови
и моче играет решающую роль в дифференциальной диагностике различного вида
желтух.
Слайд 60 Неконьюгированный, непрямой Б –липофилен. Он имеет сродство к
мембранам, легко растворяется в подкожной клетчатке, нервной ткани. При увеличении
концентрации выше 25 мкмоль( норма 4-21мкмоль/л) оказывает токсическое действие. Блокирует О/Ф.При гепатитах способность гепатоцитов разрушать уробилин до ди и три пирроллов- снижается.
Слайд 61 Т.о. в клетках РЭС в частности в печени
происходит распад :
Эритроцит- Hb->
МетHb-биливердин+ 2Н++-? билирубин+6Н—>уробилиноГЕН--+2Н+-----? уробилин.
В печени Б конъюгируется с сахарами с помощью фермента UDF-глюкуронилтрансферазы, образуя связанный билирубин. Последний является нетоксичным и определяется в крови как прямой билирубин-глюкуронид. Его молекула очень объемна и не может проходить через мембраны клеток печени. Часть Б соединяется с ФАФС:
Б+ ФАФС + Н2SO4 + глюкоза--?-коньюгат. Это водорастворимый коньюгат он направляется в желчные протоки- печень-с желчью в кишечник, где происходит его распад.
Слайд 62 Этот конъюгат легко диссоциирует, он быстро
фильтруются в почках, и появляется в моче, даже при незначительном
содержании в плазме. Непрямой Б – неконъюгирован, и в воде нерастворим.
С желчью в кишечник попадает часть непрямого и прямой Б, где от прямого отщепляется глюкуроновая кислота и он восстанавливается в уробилиноген:–билирубин+ 6Н---?уробилиноГЕН
кровь
моча кал
желтух _______________________________________________________________________________
желчные прямой непрямой прямой непрямой стерко- уроби- стерко-
пигменты билир. билирубин билир. билирубин билин лин билин
Норма ± + - - + - +
Паренхиматозная ↑↑↑ ↑ + – + ↑↑↑ +
Обтурационная ↑↑↑ ↑ + – – – –
Гемолитическая ± ↑↑↑ - - ↑↑ - ↑↑
Изменение содержания желчных пигментов
в дифференциальной диагностике желтух
Слайд 64Печеночная желтуха связана с патологическими состояниями, при которых нарушаются:
1. Все
три стадии обезвреживания св.Б- элиминация из крови, коньюгирование и выведение.
Это характерно для воспалительных процессов в печени, для токсических поражений, циррозов. В крови возрастает уровень св. Б. В повышенном количестве появляется связанный Б.
Слайд 652. Конъюгирование Б в связи с врожденным дефектом УДФ-глюкуронилтрансферазы.
3. Элиминация
и транспорт Б гепатоцитом.
4.Выведение конъюгированного Б гепатоцитом
Слайд 66Надпеченочная желтуха
Связана с ускоренным высвобождением гемоглобина из Э., ведущим к
избыточному образованию св. Б. Количество св.Б превышает функциональные возможности печени,
наблюдается гипербилирубинемия.
При механической желтухе возникает препятствие на пути оттока желчи. При этом св. Б не изменен, а связанный Б резко повышен.