Слайд 1ОБМЕН ЖИРНЫХ КИСЛОТ
И КЕТОНОВЫХ ТЕЛ
Слайд 2Жирные кислоты в организме человека имеют чётное число атомов углерода,
что связано с особенностями их биосинтеза, при котором к углеводородному
радикалу жирной кислоты последовательно добавляются двухуглеродные фрагменты.
Жирные кислоты - структурные компоненты различных липидов, выполняют функцию депонирования энергии, так как их радикалы содержат богатые энергией СН2-группы.
При окислении СН-связей энергии выделяется больше, чем при окислении углеводов, в которых атомы углерода уже частично окислены (-НСОН-).
Слайд 3).
В свободном, неэтерифицированном состоянии жирные кислоты в организме содержатся
в небольшом количестве, например в крови, где они транспортируются в
комплексе с белком альбумином.
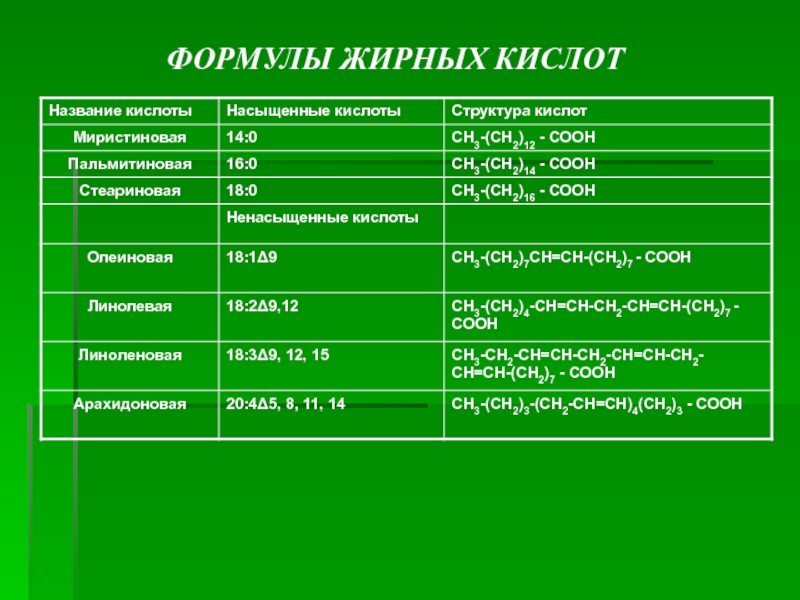
Жирные кислоты липидов человека представляют собой углеводородную неразветвлённую цепь, на одном конце которой находится карбоксильная группа, а на другом - метильная группа (ω-углеродный атом). Большинство жирных кислот в организме содержат чётное число атомов углерода - от 16 до 20.
Слайд 4).
Жирные кислоты, не содержащие двойных связей, называют насыщенными. Основной
насыщенной жирной кислотой в липидах человека является пальмитиновая (до 30-35%).
Жирные кислоты, содержащие двойные связи, называют ненасыщенными. Ненасыщенные жирные кислоты представлены моноеновыми (с одной двойной связью) и полиеновыми (с двумя и большим числом двойных связей).
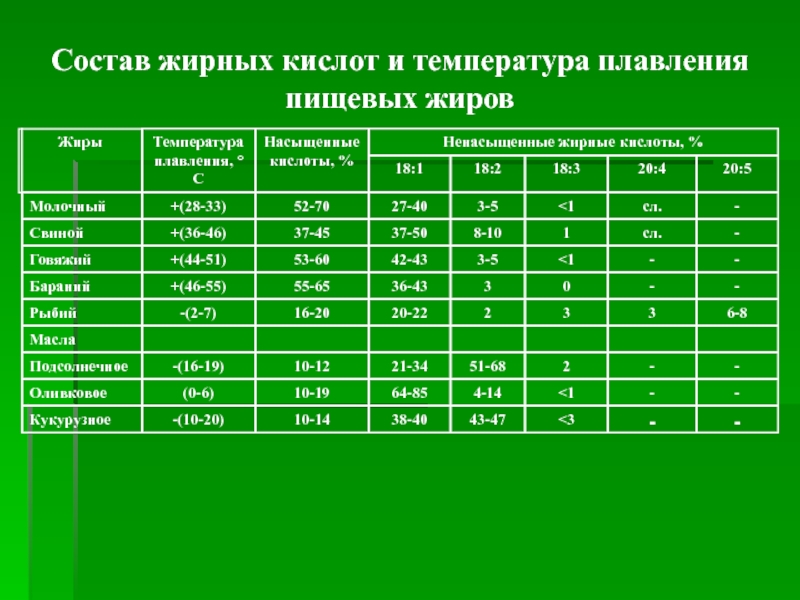
Слайд 6Состав жирных кислот и температура плавления
пищевых жиров
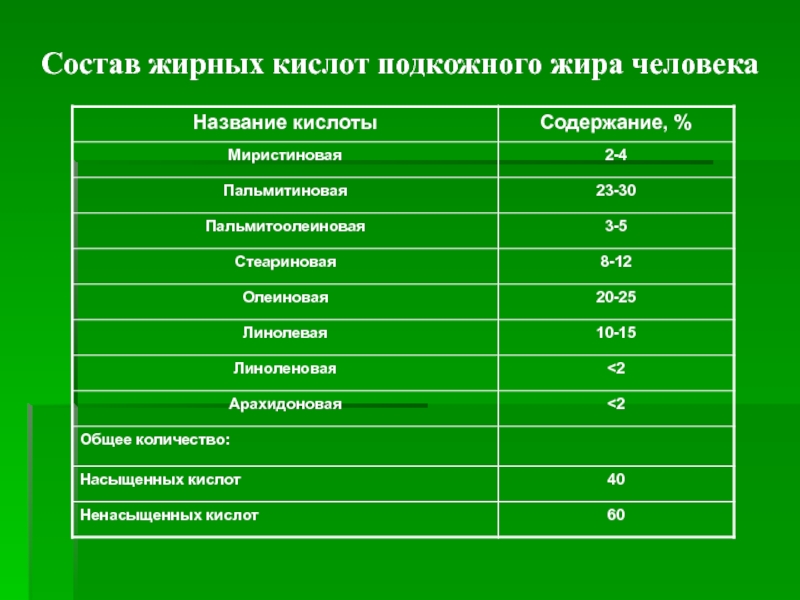
Слайд 7Состав жирных кислот подкожного жира человека
Слайд 8).
Двойные связи в жирных кислотах в организме человека имеют
цис-конфигурацию. Цис-конфигурация двойной связи делает алифатическую цепь жирной кислоты изогнутой,
что нарушает упорядоченное расположение насыщенных радикалов жирных кислот в фосфолипидах мембран и снижает температуру плавления.
Конфигурации радикалов жирных кислот
А - излом радикала жирной кислоты при двойной связи в цис-конфигурации;
Б - нарушение упорядоченного расположения радикалов насыщенных жирных кислот в гидрофобном слое мембран ненасыщенной кислотой с цис-конфигурацией двойной связи.
Слайд 9Жирные кислоты поступают с пищей или синтезируются в организме (кроме
ненасыщенных кислот).
Субстраты, необходимые для синтеза жирных кислот, образуются при
катаболизме глюкозы и таким образом,
часть глюкозы превращается сначала в жирные кислоты, а затем в жиры.
Слайд 10Хотя путь катаболизма жирных кислот заканчивается образованием ацетил-КоА, служащим исходным
субстратом для синтеза жирных кислот, процессы синтеза и окисления жирных
кислот необратимы.
Они происходят в разных компартментах клеток (биосинтез протекает в цитозоле, а окисление - в митохондриях) и катализируются разными ферментами.
Слайд 11Окисление жирных кислот увеличивается в постабсорбтивный период, при голодании и
физической работе в печени и мышцах.
При голодании часть жирных
кислот в печени превращается в другие "топливные" молекулы - кетоновые тела. Они, в отличие от жирных кислот, могут использоваться нервной тканью как источник энергии.
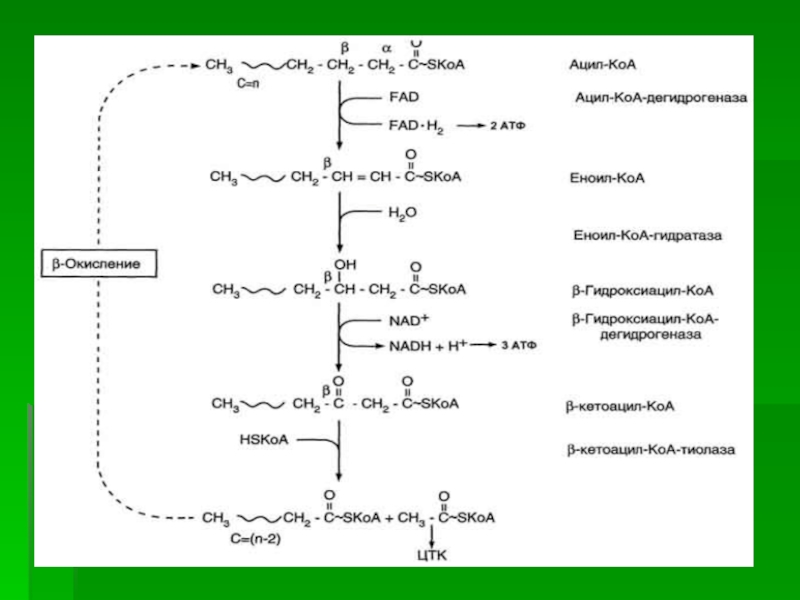
Слайд 12β-Окисление - специфический путь катаболизма жирных кислот, при котором от
карбоксильного конца жирной кислоты последовательно отделяется по 2 атома углерода
в виде ацетил-КоА.
Реакции β-окисления и последующего окисления ацетил-КоА в ЦТК служат одним из основных источников энергии для синтеза АТФ по механизму окислительного фосфорилирования.
β-Окисление жирных кислот происходит только в аэробных условиях.
Слайд 13Активация жирных кислот
Перед тем, как вступить в различные реакции,
жирные кислоты должны быть активированы, т.е. связаны макроэргической связью с
коферментом А:
RCOOH + HSKoA + АТФ → RCO ~ КоА + АМФ + Н4Р2О7
Реакцию катализирует фермент ацил-КоА синтетаза. Выделившийся в ходе реакции пирофосфат гидролизуется ферментом пирофосфатазой: Н4Р2О7 + Н2О → 2 Н3РО4.
Слайд 14Ацил-КоА синтетаза находится как в цитозоле, так и в матриксе
митохондрий. Этот фермент отличается по специфичности к жирным кислотам с
различной длиной углеводородной цепи.
Жирные кислоты (от 4 до 12 атомов углерода) могут проникать в матрикс митохондрий путём диффузии и там происходит их активация.
Жирные кислоты (от 12 до 20 атомов углерода), активируются ацил-КоА синтетазами, расположенными на внешней мембране митохондрий.
Слайд 15Транспорт жирных
кислот с длинной
углеводородной цепью
в митохондриях
Слайд 16β-Окисление жирных кислот, происходит в матриксе митохондрий, поэтому после активации
жирные кислоты должны транспортироваться внутрь митохондрий.
Жирные кислоты с длинной
углеводородной цепью переносятся через плотную внутреннюю мембрану митохондрий с помощью карнитина.
Слайд 17Карнитин поступает с пищей или синтезируется из аминокислот лизина и
метионина.
В реакциях синтеза карнитина участвует витамин С.
В наружной
мембране митохондрий находится фермент карнитинацилтрансфераза I, катализирующий реакцию с образованием ацилкарнитина.
Слайд 18Ацилкарнитин проходит через межмембранное пространство к наружной стороне внутренней мембраны
и транспортируется с помощью карнитинацилкарнитинтранслоказы на внутреннюю поверхность внутренней мембраны
митохондрий.
Карнитинацилтрансфераза II катализирует перенос ацила на внутримитохондриальный КоА.
Таким образом, ацил-КоА становится доступным для ферментов β-окисления.
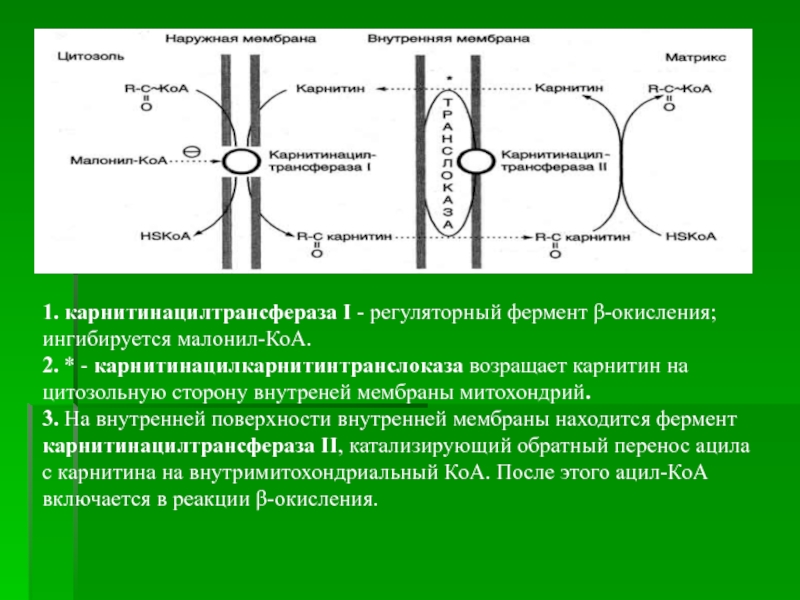
Слайд 191. карнитинацилтрансфераза I - регуляторный фермент β-окисления; ингибируется малонил-КоА.
2. *
- карнитинацилкарнитинтранслоказа возращает карнитин на цитозольную сторону внутреней мембраны митохондрий.
3.
На внутренней поверхности внутренней мембраны находится фермент карнитинацилтрансфераза II, катализирующий обратный перенос ацила с карнитина на внутримитохондриальный КоА. После этого ацил-КоА включается в реакции β-окисления.
Слайд 20β-Окисление жирных кислот - специфический путь катаболизма жирных кислот, протекающий
в матриксе митохондрий только в аэробных условиях и заканчивающийся образованием
ацетил-КоА.
ацил-КоА синтетазами
Водород из реакций β-окисления поступает в ЦПЭ, а ацетил-КоА окисляется в цитратном цикле, также поставляющем водород для ЦПЭ.
Поэтому β-окисление жирных кислот - важнейший метаболический путь, обеспечивающий синтез АТФ в дыхательной цепи.
Слайд 21β-Окисление начинается с дегидрирования ацил-КоА FAD-зависимой ацил-КоА дегидрогеназой с образованием
двойной связи между α- и β-атомами углерода в продукте реакции
- еноил-КоА.
Восстановленный в этой реакции кофермент FADH2 передаёт атомы водорода в ЦПЭ на кофермент Q.
В результате синтезируются 2 молекулы АТФ.
Слайд 22В следующей реакции β-окисления по месту двойной связи присоединяется молекула
воды таким образом,
что ОН-группа находится у β-углеродного атома ацила,
образуя β-гидроксиацил-КоА.
Слайд 23Затем β-гидроксиацил-КоА окисляется NАD+-зависимой дегидрогеназой.
Восстановленный NADH, окисляясь в ЦПЭ,
обеспечивает энергией синтез 3 молекул АТФ.
Образовавшийся β-кетоацил-КоА подвергается действию
фермента тиолазой, так как по месту разрыва связи С-С через атом серы присоединяется молекула кофермента А.
Слайд 24В результате этой последовательности из 4 реакций от ацил-КоА отделяется
двухуглеродный остаток - ацетил-КоА. Жирная кислота, укороченная на 2 атома
углерода, опять проходит реакции дегидрирования, гидратации, дегидрирования, отщепления ацетил-КоА.
Эта последовательность реакций ("цикл β-окисления«), повторяется с радикалом жирной кислоты до тех пор, пока вся кислота не превратится в ацетильные остатки.
Слайд 26Продуктами каждого цикла β-окисления являются FADH2, NADH и ацетил-КоА.
Хотя
реакции в каждом "цикле" одни и те же, остаток кислоты,
который входит в каждый последующий цикл, короче на 2 углеродных атома.
В последнем цикле окисляется жирная кислота из 4 атомов углерода, поэтому образуются 2 молекулы ацетил-КоА, а не 1, как в предыдущих. Суммарное уравнение β-окисления, например пальмитоил-КоА может быть представлено таким образом:
С15Н31СО-КоА + 7 FAD + 7 NAD+ + 7 HSKoA → 8 СН3-СО-КоА + 7 FADH2 + 7 (NADH + H+)
Слайд 27Если рассчитывать выход АТФ при окислении пальмитиновой кислоты,
то из
общей суммы молекул АТФ необходимо вычесть 2 молекулы, так как
на активацию жирной кислоты тратится энергия 2 макроэргических связей.
Слайд 28Во многих тканях окисление жирных кислот - важный источник энергии.
Это ткани с высокой активностью ферментов ЦТК и дыхательной цепи
- клетки красных скелетных мышц, сердечная мышца, почки.
Эритроциты, в которых отсутствуют митохондрии, не могут окислять жирные кислоты.
Слайд 29Синтез АТФ при полном окислении
пальмитиновой кислоты
Слайд 30Регуляция скорости β-окисления
β-Окисление - метаболический путь, прочно связанный с
работой ЦПЭ и общего пути катаболизма.
Поэтому его скорость регулируется
потребностью клетки в энергии, т.е. соотношениями АТФ/АДФ и NADH/NAD+, так же, как и скорость реакций ЦПЭ и общего пути катаболизма.
Слайд 31Скорость β-окисления в тканях зависит от доступности субстрата, т.е. от
количества жирных кислот, поступающих в митохондрии.
Концентрация свободных жирных кислот в
крови повышается при активации липолиза в жировой ткани при голодании под действием глюкагона и при физической работе под действием адреналина.
Слайд 32В этих условиях жирные кислоты становятся преимущественным источником энергии для
мышц и печени, так как в результате β-окисления образуются NADH
и ацетил-КоА, ингибирующие пируватдегидрогеназный комплекс.
Превращение пирувата, образующегося из глюкозы, в ацетил-КоА замедляется.
Слайд 33Также накапливаются промежуточный метаболит гликолиза, глюкозо-6-фосфат.
Глюкозо-6-фосфат ингибирует гексокиназу и
препятствует использованию глюкозы в процессе гликолиза.
!!! Таким образом, преимущественное
использование жирных кислот как основного источника энергии в мышечной ткани и печени сберегает глюкозу для нервной ткани и эритроцитов.
Слайд 34Скорость β-окисления зависит также от активности фермента карнитинацилтрансферазы I. В
печени этот фермент ингибируется малонил-КоА.
В абсорбтивный период в печени
активируется гликолиз и увеличивается образование ацетил-КоА из пирувата.
Ацетил-КоА превращается в малонил-КоА. Малонил-КоА ингибирует β-окисление жирных кислот, которые могут использоваться для синтеза жира.
Слайд 36В липидах мозга и нервной ткани преобладают жирные кислоты с
очень длинной цепью - более 20 углеродных атомов.
Они окисляются
по типу α-окисления, при котором от жирной кислоты отщепляется по одному атому углерода, в виде СО2.
Этот путь катаболизма жирных кислот не связан с синтезом АТФ.
Слайд 38В отличие от других тканей мозг и нервная ткань практически
не используют жирные кислоты в качестве источника энергии.
В печени
часть жирных кислот превращается в кетоновые тела, которые окисляются мозгом, нервной тканью, мышцами, обеспечивая достаточное количество энергии для синтеза АТФ и уменьшая потребление глюкозы.
Слайд 39К кетоновым телам относят
β-гидроксибутират, ацетоацетат и ацетон.
Первые две
молекулы могут окисляться в тканях, обеспечивая синтез АТФ.
Ацетон образуется
только при высоких концентрациях кетоновых тел в крови и, выделяясь с мочой, выдыхаемым воздухом и потом, позволяет организму избавляться от избытка кетоновых тел.
Слайд 40При низком соотношении инсулин/глюкагон в крови в жировой ткани активируется
распад жиров.
Жирные кислоты поступают в печень в большем количестве,
чем в норме, поэтому увеличивается скорость β-окисления.
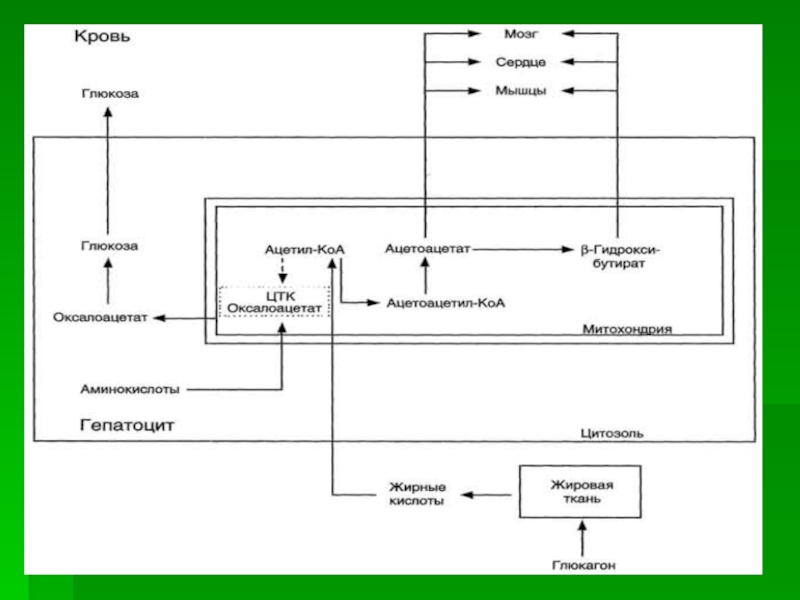
Слайд 41Синтез кетоновых тел начинается с взаимодействия двух молекул ацетил-КоА, которые
под действием фермента тиолазы образуют ацетоацетил-КоА.
С ацетоацетил-КоА взаимодействует третья
молекула ацетил-КоА, образуя 3-гидрокси-3-метилглутарил-КоА (ГМГ-КоА). Эту реакцию катализирует фермент ГМГ-КоА-синтаза. Далее ГМГ-КоА-лиаза катализирует расщепление ГМГ-КоА на свободный ацетоацетат и ацетил-КоА.
Слайд 42В клетках печени при активном β-окислении создаётся высокая концентрация NADH.
Это способствует превращению большей части ацетоацетата в β-гидроксибутират, поэтому основное
кетоновое тело в крови - именно β-гидроксибутират.
При голодании для многих тканей жирные кислоты и кетоновые тела становятся основными топливными молекулами. Глюкоза используется в первую очередь нервной тканью и эритроцитами.
Слайд 43При высокой концентрации ацетоацетата часть его декарбоксилируется, превращаясь в ацетон.
Ацетон не утилизируется тканями, но выделяется с выдыхаемым воздухом и
мочой.
Таким путём организм удаляет избыточное количество кетоновых тел, которые не успевают окисляться, но, являясь водорастворимыми кислотами, вызывают ацидоз.
Слайд 44При голодании в результате действия глюкагона активируется липолиз в жировой
ткани и в печени. Количество оксалоацетата в митохондриях уменьшается, так
как он в виде малата, выходит в цитозоль, где опять превращается в оксалоацетат и используется в глюконеогенезе.
В результате скорость реакций ЦТК и окисление ацетил-КоА замедляются. Концентрация ацетил-КоА в митохондриях увеличивается, и активируется синтез кетоновых тел.
Синтез кетоновых тел увеличивается также при сахарном диабете.
Слайд 47Регуляторный фермент синтеза кетоновых тел - ГМГ-КоА синтаза (3-гидрокси-3-метилглутарил-КоА)
Синтез ГМГ-КоА-синтазы
увеличивается при повышении концентрации жирных кислот в крови. Концентрация жирных
кислот в крови увеличивается при мобилизации жиров из жировой ткани под действием глюкагона, адреналина, т.е. при голодании или физической работе.
ГМГ-КоА-синтаза ингибируется высокими концентрациями кофермента А.
Слайд 48 Когда поступление жирных кислот в клетки печени увеличивается, КоА
связывается с ними, концентрация свободного КоА снижается, и фермент становится
активным.
Если поступление жирных кислот в клетки печени уменьшается, увеличивается концентрация свободного КоА, ингибирующего фермент.
!!! Следовательно, скорость синтеза кетоновых тел в печени зависит от поступления жирных кислот.
Слайд 49При длительном голодании кетоновые тела становятся основным источником энергии для
скелетных мышц, сердца и почек.
!!! Таким образом, глюкоза сохраняется
для окисления в мозге и эритроцитах.
Уже через 2-3 дня после начала голодания концентрация кетоновых тел в крови достаточна для того, чтобы они проходили в клетки мозга и окислялись, снижая его потребности в глюкозе.
Слайд 50Кетоацидоз
В норме концентрация кетоновых тел в крови составляет 1-3
мг/дл (до 0,2 мМ/л), но при голодании значительно увеличивается. Увеличение
концентрации кетоновых тел в крови называют кетонемией, выделение кетоновых тел с мочой - кетонурией.
Кетоацидоз достигает опасных величин при сахарном диабете, концентрация кетоновых тел может доходить до 400-500 мг/дл.
Тяжёлая форма ацидоза - одна из основных причин смерти при сахарном диабете.