Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общая геохимия
Содержание
- 1. Общая геохимия
- 2. Слайд 2
- 3. Классификация по распространенности: главные (петрогенные) и редкие элементы
- 4. Половина земной коры состоит из O. Таким
- 5. O, Si, Al, Fe, Ca, K, Na,
- 6. Принципиальная разница между петрогенными и редкими элементами
- 7. В геохимии есть еще понятие микроэлементы, которое означает элементы, содержащиеся в малых количествах (
- 8. Геохимические классификации элементовГеохимическая классификация элементов –
- 9. Д.И. Менделеев (1869 г.) так cформулировал периодический
- 10. Согласно периодическому закону, свойства химических элементов изменяются
- 11. Слайд 11
- 12. Атом (от греч. atomos — неделимый), частица
- 13. Между величинами атомных весов и атомным номером
- 14. Агрегатное состояние элементов в обычн. условиях
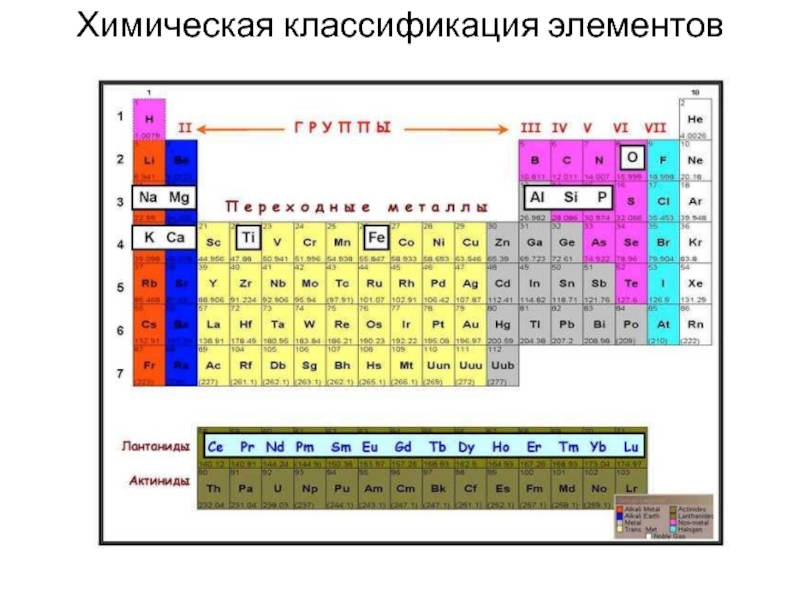
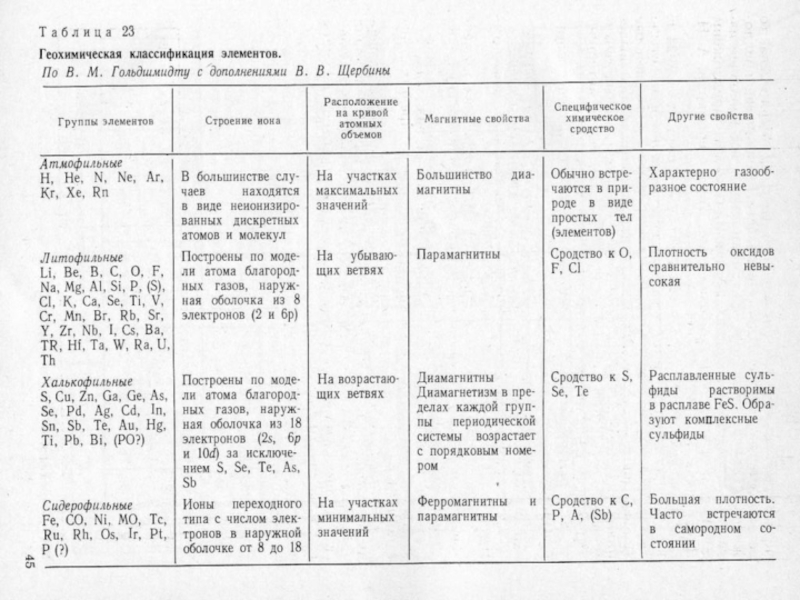
- 15. Химическая классификация элементов
- 16. Как писал В.И. Вернадский, “геохимические факты не
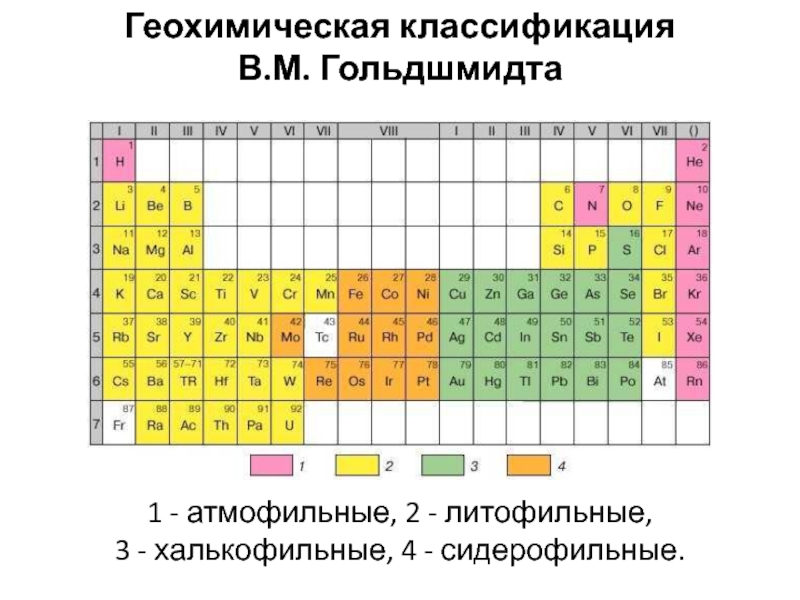
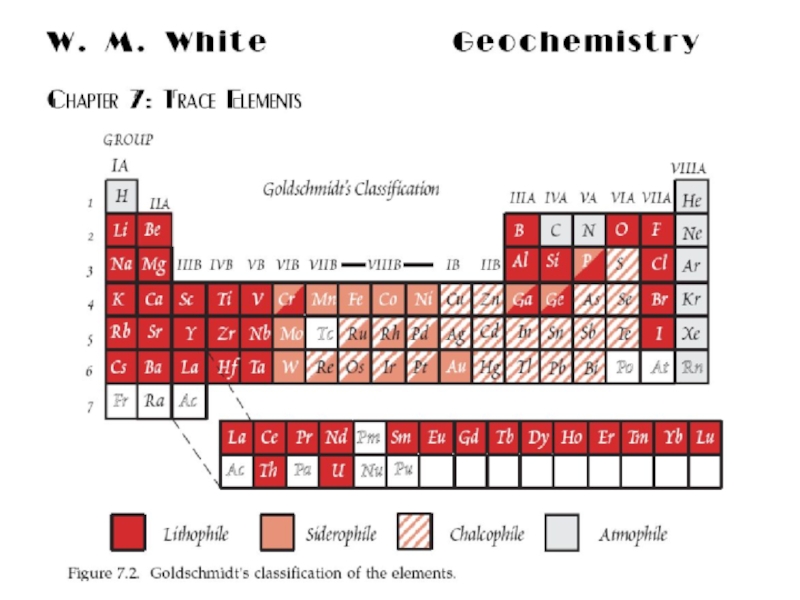
- 17. В 1923 г. В.М. Гольдшмидт сформулировал
- 18. В.М. Гольдшмидт сравнил дифференциацию элементов в расплавленной
- 19. 1 - атмофильные, 2 - литофильные, 3 - халькофильные, 4 - сидерофильные. Геохимическая классификация В.М. Гольдшмидта
- 20. Слайд 20
- 21. Это классификация по наибольшему коэффициенту распределения элемента между четырьмя фазами.
- 22. Слайд 22
- 23. Слайд 23
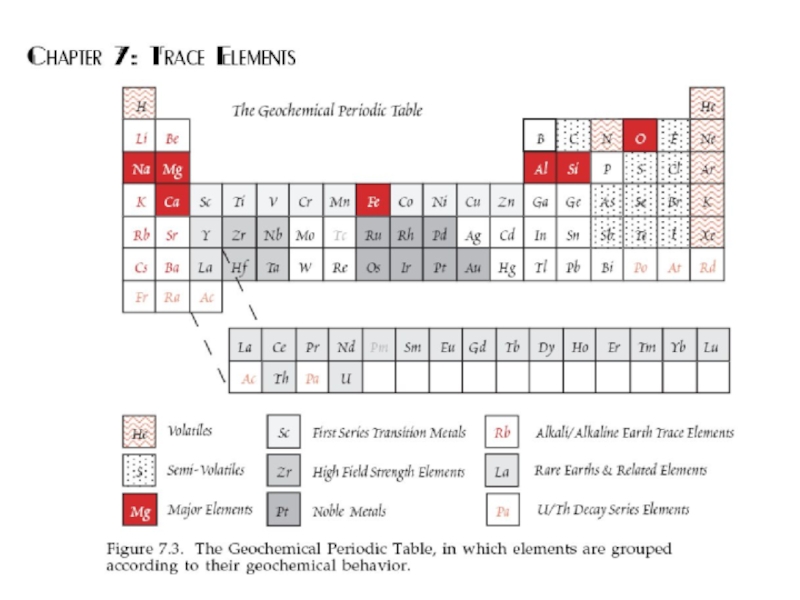
- 24. Современная геохимическая классификация элементов Группы элементов, объединенные по сходным свойствам или поведению в геологических процессах.
- 25. Слайд 25
- 26. Слайд 26
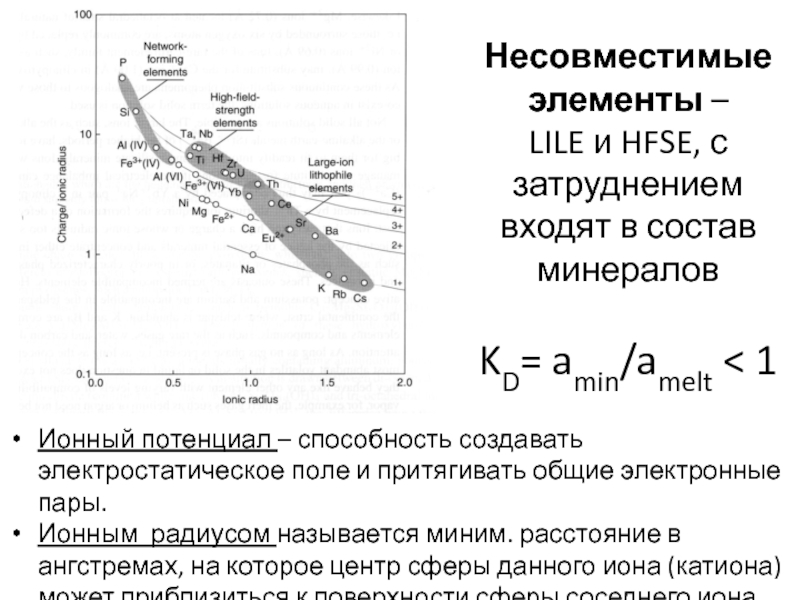
- 27. Несовместимые элементы – LILE и HFSE,
- 28. LILE – крупноионные литофилыCs, Rb, K, Ba. Также Sr, Eu2+ ,(Pb2+)???Ионный потенциал
- 29. Щелочные и щелочноземельные элементыLi, Be, K, Rb,
- 30. HFSE – высокозарядные элементыSc, Y, Th, U,
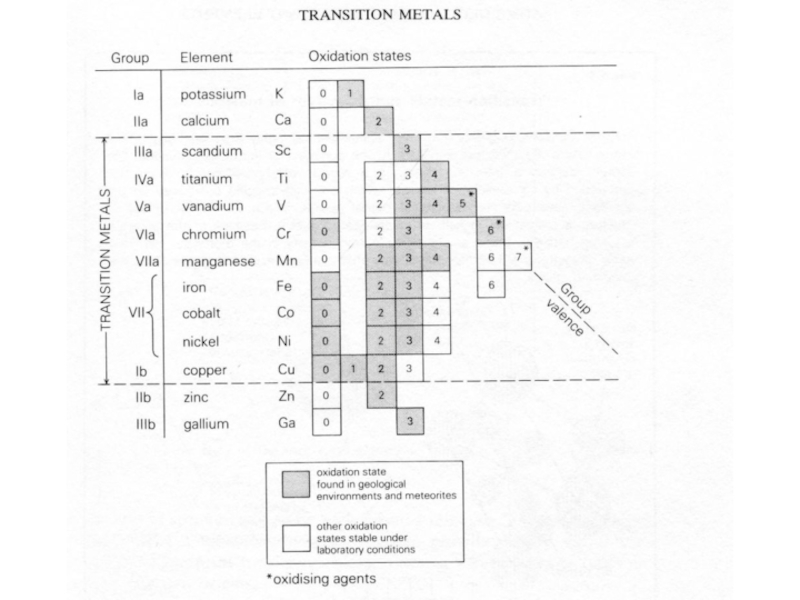
- 31. Переходные металлы (транзитные элементы)Sc, Ti, V, Cr,
- 32. Слайд 32
- 33. Платиноиды (PGE, ЭПГ)Ru, Rh, Pd, Os, Ir,
- 34. Летучие элементы (volatile)H, N, инертные газы. Химически
- 35. «Другие» элементыВ – главный элемент морской воды.
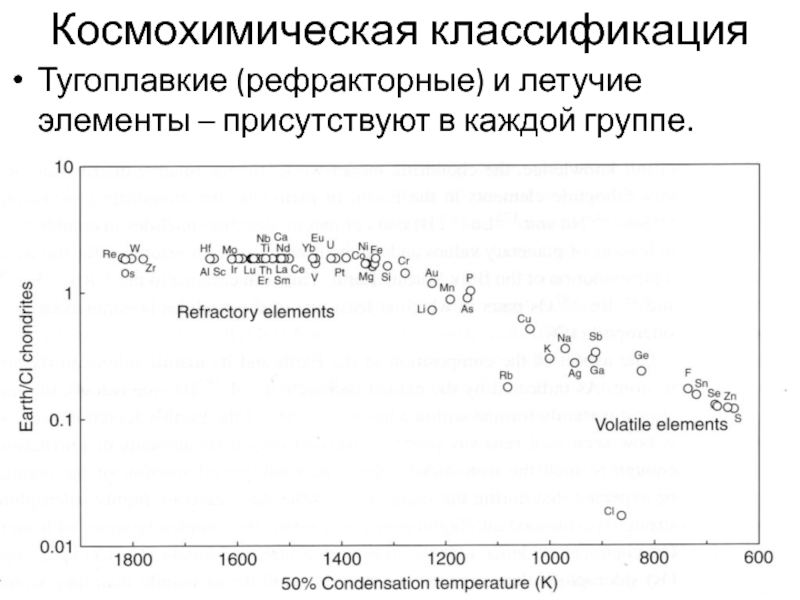
- 36. Космохимическая классификацияТугоплавкие (рефракторные) и летучие элементы – присутствуют в каждой группе.
- 37. Рефракторные элементы – Re, W, Os, ZrЛетучие
- 38. Земля обеднена летучими, по сравнению с Солнечной системой.
- 39. Классификация В.И. ВернадскогоПрисутствие или отсутствие в истории
- 40. Слайд 40
- 41. Из анализа групп, в которых каждый элемент
- 42. А.Е. Ферсман (1932 г.), используя развернутую форму
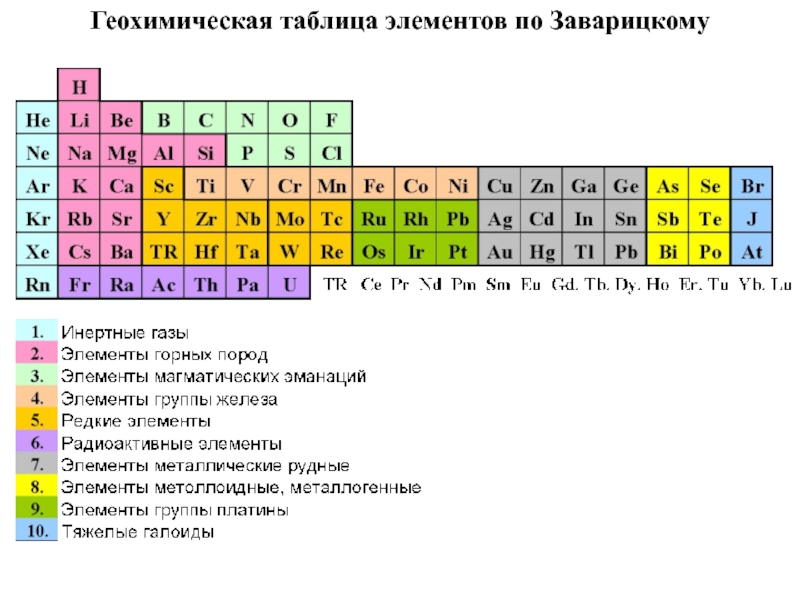
- 43. А.Н. Заварицкий (1950 г.) выделяет 10 гр.:
- 44. Геохимическая таблица элементов по Заварицкому
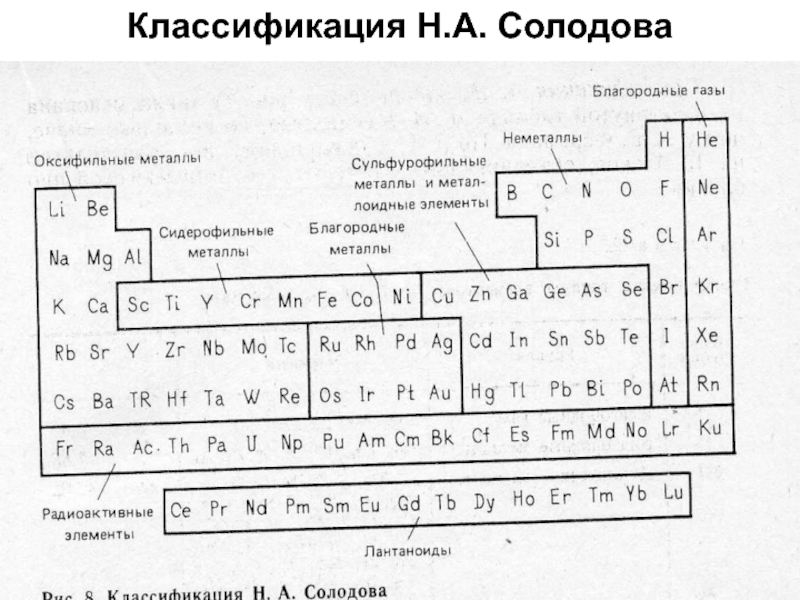
- 45. Классификация Н.А. Солодова
- 46. Скачать презентанцию
Классификация по распространенности: главные (петрогенные) и редкие элементы
Слайды и текст этой презентации
Слайд 5O, Si, Al, Fe, Ca, K, Na, Mg (Ti, P,
Mn)
Главные, петрогенные элементы (>1 - 0.1%).
Элементы, содержание которых не
превышает 0.1-0.0001%, называют редкими (уст. – малые). Если редкие элементы не образуют собственных минералов, то их называют "редкими рассеянными" (Br, In, Ra, Re, Hf, Se и др.). Содержание в ppm, г/т.Так, у U и Br кларки почти одинаковы (2.5*10-4 и 2.1*10-4), но U – редкий элемент, т. к. известно 104 урановых минерала и урановые месторождения,
Br – рассеянный (имеет лишь один минерал).
Слайд 6Принципиальная разница между петрогенными и редкими элементами заключается в том,
что петрогенные элементы определяют фазовый (минеральный) состав системы, в то
время как редкие элементы входят в эти фазы в виде примесей и пассивно распределяются между существующими фазами, но не влияют на их содержание и устойчивость. У этого правила есть исключения. Так, Sr даже в небольших количествах сильно влияет на устойчивость кальцита.Слайд 7В геохимии есть еще понятие микроэлементы, которое означает элементы, содержащиеся
в малых количествах (
микроэлемент в живом организме и макроэлемент в силикатных породах.Слайд 8Геохимические классификации элементов
Геохимическая классификация элементов –
ряд принципов группировки химических
элементов в зависимости от подходов и цели исследователя. Геохимические классификации элементов
– способы систематизации химических элементов в зависимости от их встречаемости в природе.Слайд 9Д.И. Менделеев (1869 г.) так cформулировал периодический закон:
"Свойства простых тел,
а также формы и свойства (сложных) соединений находятся в периодической
зависимости от величиныатомных весов элементов".
Слайд 10Согласно периодическому закону, свойства химических элементов изменяются периодически, в зависимости
от атомного порядкового номера элемента.
В первую очередь, это касается
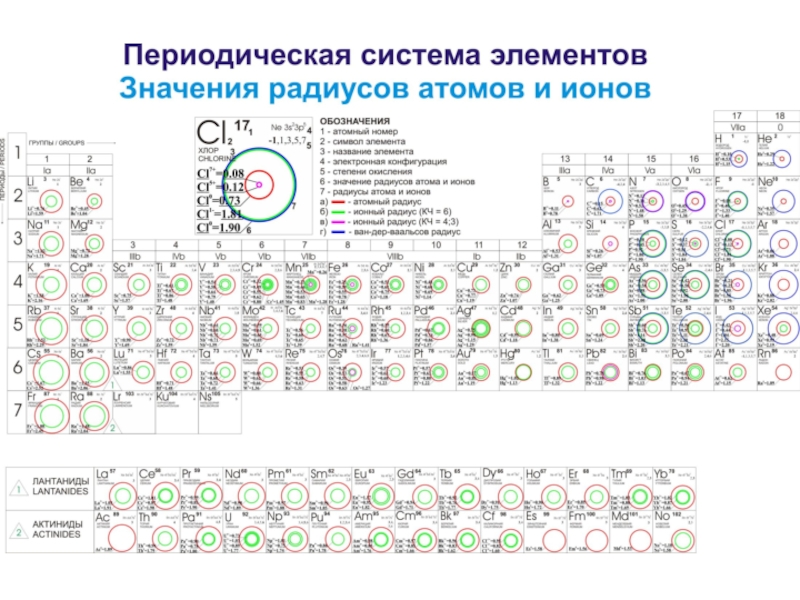
химических свойств элементов, их валентности, способности вступать в химические соединения с другими элементами, состава и свойств этих соединений. Периодичность обнаруживают многие физические свойства (оптические спектры, потенциалы ионизации, радиусы атомов и ионов, атомные объемы и др). Они связаны со строением электронных оболочек атомов.
Слайд 12Атом (от греч. atomos — неделимый), частица вещества микроскопических размеров
и очень малой массы (микрочастица), наименьшая часть химического элемента, являющаяся
носителем его свойств. Каждому элементу соответствует определённый род атома, обозначаемых символом элемента: Н, Fe, Hg, U.Атом: а - электрон, б - протон, в – нейтрон.
Масса ядра атома приближённо равна массовому числу А - общему числу протонов и нейтронов в ядре.
Слайд 13Между величинами атомных весов и атомным номером (или зарядом ядра
атома) имеется определенная связь: Атомный вес (А) примерно в 2–2.5
раза больше величины атомного номера Z. Число нуклонов A = Z+N, где N – число нейтронов, относится к числу протонов Z как А/Z ≈ 2. Разность N-Z - избыток нейтронов. Для многих элементов начала периодической системы (от He до O) это отношение довольно точно равно 2, начиная с железа оно увеличивается от 2.1 у Fe до 2.5 у Hg и 2.6 у U.Слайд 16Как писал В.И. Вернадский, “геохимические факты не были приняты во
внимание при построении периодической системы химических элементов. Поэтому геохимическая классификация
элементов не может быть заменена их химической классификацией”.Это, вероятно, связано с тем, что общие химические свойства элементов в значительной степени отличаются от их особенностей в природных физико-химических и, в частности рудообразующих системах.
Близкие по химическим свойствам элементы нередко образуют обособленные концентрации (Na и K, I и Cl) и, наоборот, элементы, не имеющие черт сходства, в природных условиях, образуют совместные концентрации (Cu и Mo, Au и W).
Слайд 17В 1923 г. В.М. Гольдшмидт сформулировал основной закон геохимии: Общая
распространенность элемента зависит от свойств его атомного ядра, а характер
распространения – от свойств наружной электронной оболочки его атома. Классификация элементов была предложена В. Гольдшмидтом исходя из предположения, что Земля образовалась в результате разделения первично однородного вещества, аналогичного метеоритам, на четыре части: металл, серный расплав, силикатная часть и атмосфера с океаном.Слайд 18В.М. Гольдшмидт сравнил дифференциацию элементов в расплавленной планете с выплавкой
металла из руд, когда на дно металлургической печи опускается тяжелый
металл с плотностью около 7 (аналог ядра), а на поверхность всплывает легкий силикатный шлак (аналог земной коры). Между ними располагается слой «штейна» - сульфида Fe с примесью сульфидов других металлов (аналог мантии).Слайд 191 - атмофильные, 2 - литофильные,
3 - халькофильные, 4
- сидерофильные.
Геохимическая классификация
В.М. Гольдшмидта
Слайд 24Современная геохимическая классификация элементов Группы элементов, объединенные по сходным свойствам или
поведению в геологических процессах.
Слайд 27Несовместимые элементы – LILE и HFSE, с затруднением входят в
состав минералов
KD= amin/amelt < 1
Ионный потенциал – способность создавать
электростатическое поле и притягивать общие электронные пары.Ионным радиусом называется миним. расстояние в ангстремах, на которое центр сферы данного иона (катиона) может приблизиться к поверхности сферы соседнего иона (аниона).
Слайд 28LILE – крупноионные литофилы
Cs, Rb, K, Ba. Также Sr, Eu2+
,(Pb2+)???
Ионный потенциал
1, реже 2).Наибольшая подвижность в геологических процессах.
Слайд 29Щелочные и щелочноземельные элементы
Li, Be, K, Rb, Sr, Cs, Ba.
Низкая электроотрицательность (способность атома в молекуле притягивать к себе общие
электронные пары) и валентность 1 или 2. Образуют ионные связи (кроме Be – ковалентные).
Растворимы в водных растворах и подвижны в различных процессах.
Несовместимые элементы.
Слайд 30HFSE – высокозарядные элементы
Sc, Y, Th, U, Pb, Zr, Hf,
Ti, Nb, Ta, REE.
Ионный потенциал >2.0.
Ионный радиус не превышает ионный
радиус Ca2+ .Наименее подвижные при наложенных геологических процесссах.
Распределение HFSE позволяет судить о природе различных магматических пород.
Слайд 31Переходные металлы (транзитные элементы)
Sc, Ti, V, Cr, Mn, Fe, Co,
Ni, Cu, Zn.
Формируют d-блок Периодической системы.
Химически стабильны, характерна различная валентность.
Более
подвижны при различных процессах по сравнению с HFSE, т.к. образуют широкий спектр соединений.Ответственны за окраску и магнитные свойства минералов.
Слайд 33Платиноиды (PGE, ЭПГ)
Ru, Rh, Pd, Os, Ir, Pt. Вместе с
Au – группа благородных металлов.
Халькофилы, стабильны в металлической форме.
Слайд 34Летучие элементы (volatile)
H, N, инертные газы.
Химически инертны, не входят
в состав горных пород и минералов.
Большой ионный радиус (кроме
He). N в виде аммония NH4+ входит в минералы, замещая К.Полулетучие элементы (semi-volatile)
Cl, Br, S, C и др. Сильно зависят от давления и фугитивности кислорода.
Слайд 35«Другие» элементы
В – главный элемент морской воды. Маркер зон субдукции.
Re,
Os. Близки по свойствам к платиноидам.
Р часто выступает как главный
элемент.Ga и Ge «подражают» Al и Si.
Слайд 36Космохимическая классификация
Тугоплавкие (рефракторные) и летучие элементы – присутствуют в каждой
группе.
Слайд 37Рефракторные элементы – Re, W, Os, Zr
Летучие – Sn, Zn,
S, Se.
Геохимически близкие элементы могут отличаться по степени летучести:
Sb –
As; Zr – Hf; Al – Ge. Слайд 39Классификация В.И. Вернадского
Присутствие или отсутствие в истории элемента химических и
радиохимических процессов
Характер этих процессов – обратимость или необратимость
Присутствие или отсутствие
в истории элементов в земной коре их химических соединений или молекул, состоящих из нескольких атомов.Слайд 41Из анализа групп, в которых каждый элемент встречается всего один
раз, видно, что они нередко выделены только по одному из
признаков.В этой классификации особый интерес представляет группа циклических или органогенных элементов - наиболее распространенная как по количеству, так и по геохимической значимости.
В понятие “циклические элементы” входило их активное участие в круговороте в связи с состоянием динамического равновесия элементов в биосфере.