Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общие способы получения металлов. Коррозия
Содержание
- 1. Общие способы получения металлов. Коррозия
- 2. Общие способы получения металлов Гидрометаллургия – получение
- 3. Общие способы получения металловГидрометаллургия1 стадия: растворение в
- 4. Электролиз расплавов:NaCl → Na+ + Cl─катод (─)
- 5. Общие способы получения металловПирометаллургия Восстановление углем (угарным
- 6. Химическая Электрохимическая Коррозия железа в контакте с
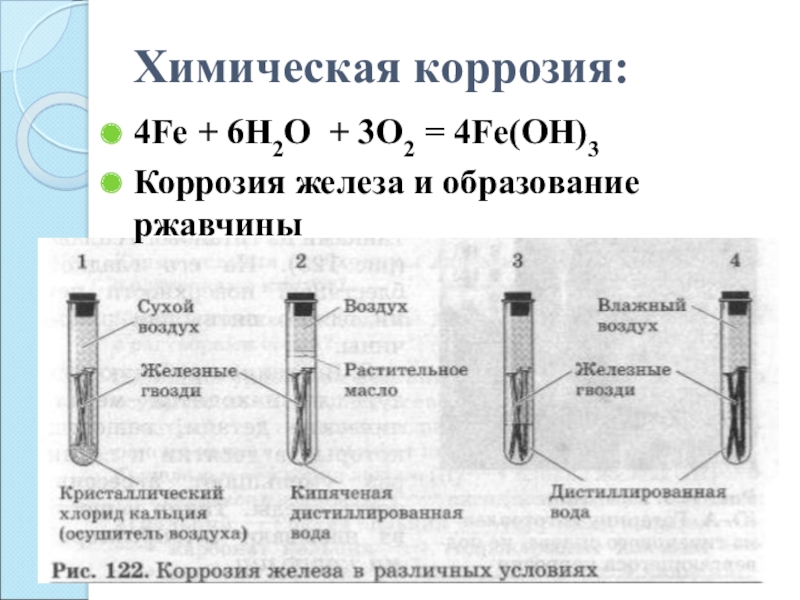
- 7. Химическая коррозия:4Fe + 6H2O + 3O2 = 4Fe(OH)3Коррозия железа и образование ржавчины
- 8. Коррозия железа в контакте с оловом под
- 9. Защита от коррозии:1) Нанесение защитных покрытий (лаки,
- 10. Протекторная защита по механизму схожа с покрытием
- 11. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Общие способы получения металлов
Гидрометаллургия – получение металлов из водных
растворов.
Пирометаллургия – получение металлов и сплавов под действием высоких температур.Слайд 3Общие способы получения металлов
Гидрометаллургия
1 стадия: растворение в кислоте нерастворимых минералов,
содержащих металлы:
CuS + 2HCl = CuCl2 + H2S
2 стадия:
вытеснение металлов из растворов их солей более активными металлами:CuCl2 + Fe = FeCl2 + Cu
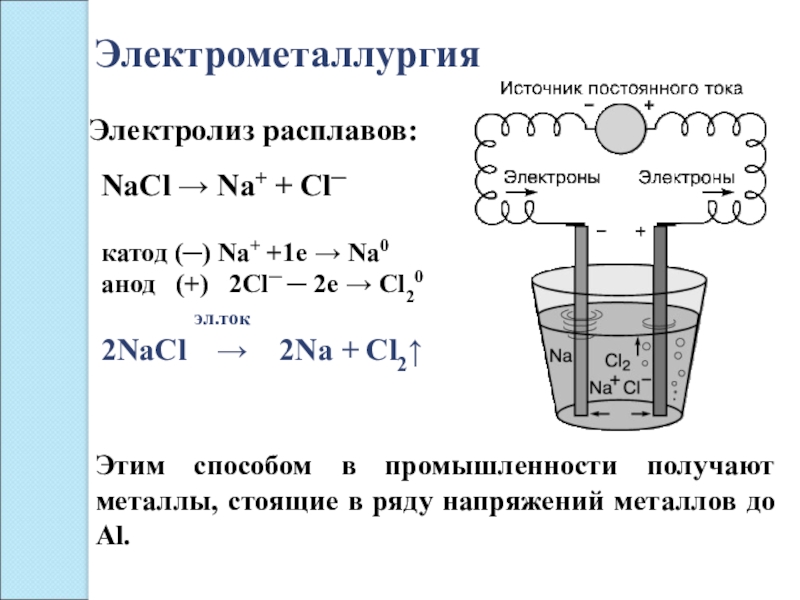
Слайд 4Электролиз расплавов:
NaCl → Na+ + Cl─
катод (─) Na+ +1e →
Na0
анод (+) 2Cl─ ─ 2e → Cl20
эл.ток2NaCl → 2Na + Cl2↑
Этим способом в промышленности получают металлы, стоящие в ряду напряжений металлов до Al.
Электрометаллургия
Слайд 5Общие способы получения металлов
Пирометаллургия
Восстановление углем (угарным газом):
2PbO +
C = CO2 + 2Pb
Восстановление алюминием (кальцием):
2Al +
Fe2O3 = Al2O3 + 2FeВосстановление водородом:
СuO + H2 = Cu + H2O
Слайд 6Химическая
Электрохимическая
Коррозия железа в контакте с медью и в
растворе соляной кислоты:
Катод 2Н+ + 2е = Н2
Анод Fe2+ -
2e = Fe0 Коррозия металлов
Самопроизвольное разрушение металлических материалов, происходящее под воздействием окружающей среды, называется коррозией.
Слайд 8Коррозия железа в контакте с оловом под воздействием воды:
Катод О2
+ 2 Н2О + 4е → ОН–
Анод Fe0 →
Fe2+ + 2е Электрохимическая коррозия:
Слайд 9Защита от коррозии:
1) Нанесение защитных покрытий (лаки, краски, другой металл
(лужение – покрытие оловом));
2) Изготовление сплавов, стойких к коррозии;
3)Использование замедлителей
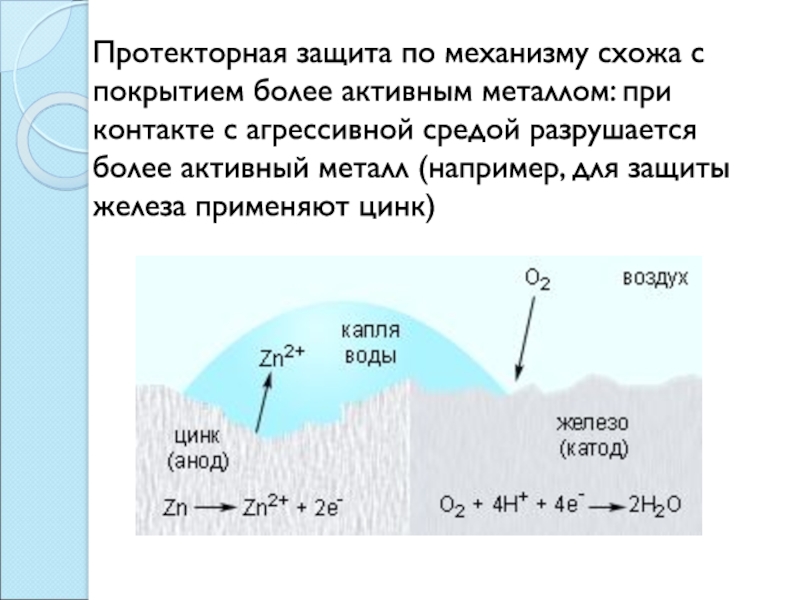
коррозии;4) Защита более активным металлом (протекторная защита);
5) Пассивация металлов.