Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Общая химия
Содержание
- 1. Общая химия
- 2. ПреподавательБедило Александр Федорович, к.х.н.Основное место работы: Институт
- 3. Учебные пособияКурс лекций, методички кафедры с контрольными
- 4. Определение химииХимия – это наука о природе
- 5. ВеществоВещество – это отдельный вид материи, обладающий
- 6. Физические свойстваСвойства, которые не включают в себя превращения одного вещества в другое, называют физическими.Например: запах плотность цвет температура плавления вкус сжимаемость
- 7. Химические свойстваВ отличие от физических, химические свойства
- 8. Физические превращенияПри физических превращениях изменяются свойства, но не природа веществ.Например: плавление кипение измельчение
- 9. Химическая реакцияХимическая реакция – процесс, в котором
- 10. Химическое уравнениеХимическое уравнение – это краткая запись
- 11. Слайд 11
- 12. Молекулы и атомыМолекула – это мельчайшая электронейтральная
- 13. Закон сохранения массыВ ходе химической реакции как
- 14. Атомная теория ДальтонаВся материя состоит из мельчайших
- 15. Атомные единицы массыНа основании закона кратных соотношений
- 16. Молекулярная массаМолекулярной массой вещества называют отношение его
- 17. МольМоль – количество вещества, которое содержит такое
- 18. Этапы стехиометрических расчетовУравняйте химическое уравнение.Рассчитайте молярные массы.Переведите
- 19. Стехиометрические расчетыЗадача: Сколько кислорода необходимо для окисления
- 20. Стехиометрические расчетыОпределяем количество молей CO: n (CO)
- 21. Химическая кинетикаХимической кинетикой называется раздел химии, изучающий
- 22. Закон действия массВ 1867 г. Гульберг и
- 23. Зависимость скорости реакции от температурыСкорость большинства химических
- 24. Химическое равновесиеМногие химические реакции протекают не до
- 25. Константа равновесияaA + bB ↔ cС +
- 26. Равновесие в гетерогенных реакцияхДля гетерогенных реакций, где
- 27. Равновесие в газовых смесяхЕсли все вещества, участвующие
- 28. Факторы, влияющие на равновесиеДобавление реагента или продукта
- 29. Принцип Ле ШательеПринцип Ле Шателье (1884 г.)При
- 30. Проявления принципа Ле ШательеПри увеличении концентрации какого-либо
- 31. Проявления принципа Ле ШательеПри понижении температуры равновесие
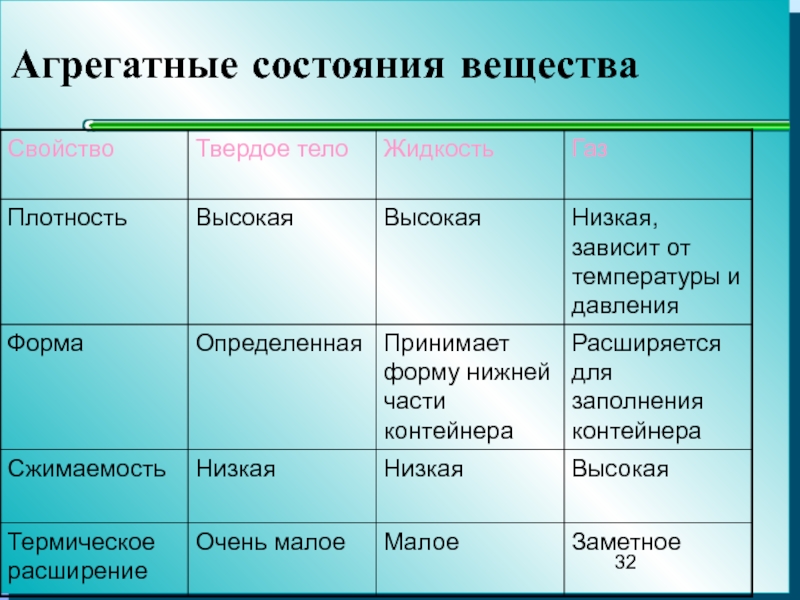
- 32. Агрегатные состояния вещества
- 33. Давление газаВсе газы оказывают давление на стенки
- 34. Закон Бойля-МариоттаПри постоянной температуре и количестве вещества
- 35. Закон Гей-ЛюссакаПри постоянном давлении и количестве вещества
- 36. Закон ШарляПри постоянном объеме и количестве вещества
- 37. Закон АвогадроОдинаковые объемы газа при одинаковых температуре
- 38. Объем газа при стандартных условияхСтандартные условия: Температура:
- 39. Уравнение состояния идеального газа (Менделеева-Клапейрона)Закон Бойля-Мариотта: V
- 40. Закон парциальных давлений газов (Дальтона)Общее давление смеси
- 41. Концентрация растворовРаствор – это однородная смесь двух
- 42. Объемные доли и процентыОбъемная доля равна отношению
- 43. Массовые доли и процентыМассовая доля равна отношению
- 44. Мольные доли и процентыМольная доля равна отношению
- 45. Молярная концентрацияМолярная концентрация равна количеству молей растворенного
- 46. МоляльностьМоляльность – это количество молей вещества, растворенное
- 47. Закон ГенриПри постоянной температуре растворимость газа в
- 48. Закон РауляПарциальное давление пара компонента раствора равно
- 49. Коллигативные свойстваКоллигативными называются физические свойства растворов, которые
- 50. Снижение давление пара растворителяПри введении в раствор
- 51. Повышение температуры кипенияПри введении в раствор нелетучего
- 52. Снижение температуры плавленияПри введении в раствор нелетучего
- 53. ОсмосОсмос – это явление, состоящее в перемещении
- 54. Осмотическое давлениеОсмотическое давление – количественная характеристика осмоса.
- 55. Сравнение эффекта ионных и ковалентных веществЭксперимент показывает,
- 56. Особенности свойств растворов кислот, солей и основанийБыло
- 57. Теория электролитической диссоциации (1887 г)Аррениус обнаружил тесную
- 58. Растворы электролитовВещества, проводящие электрический ток своими ионами
- 59. Сила электролитовСильный электролит – это соединение, которое
- 60. Закон разбавления ОствальдаРассмотрим раствор электролита BA с
- 61. Кислоты и основания по теории электролитической диссоциации
- 62. Сильные и слабые кислоты и основанияСильные кислоты
- 63. Автоионизация водыАвтоионизация воды – это процесс, в
- 64. pH и pOHВ водных растворах необходимо измерять
- 65. Сильные кислоты и основанияДля сильных кислот и
- 66. Константа диссоциации кислоты KaДля расчета кислотности слабых
- 67. Ионно-молекулярные уравнения реакций в растворахВ растворах сильные
- 68. Реакции ионного обменаРеакции, в которых электролиты обмениваются
- 69. ГидролизГидролизом называется взаимодействие вещества с водой, в
- 70. ГидролизСоли, образованные сильным основанием и слабой кислотой,
- 71. ГидролизСоли, образованные слабым основанием и сильной кислотой,
- 72. ГидролизСоли, образованные слабым основанием и слабой кислотой,
- 73. ЭнергияЭнергия – это способность производить работу или
- 74. Внутренняя энергия, термохимияХимические реакции протекают с выделением
- 75. Экзотермические и эндотермические реакцииРеакции, протекающие с выделением
- 76. Внутренняя энергияВнутренняя энергия (U) – функция состояния
- 77. Первый закон термодинамикиПервый закон термодинамики - является
- 78. Реакции при постоянном объеме и при постоянном
- 79. Термохимические уравненияТепловые эффекты можно включать в уравнения
- 80. Стандартная мольная энтальпияСтандартная мольная энтальпия реакции (ΔH°298)–
- 81. Стандартная мольная энтальпия образованияВ термохимических уравнениях, если
- 82. Закон ГессаВнутренняя энергия и энтальпия являются функциями
- 83. Закон ГессаЗакон Гесса можно использовать для определения
- 84. ЭнтропияЭнтропия (S) – это мера неупорядоченности системы.
- 85. Второй закон термодинамики Второй закон термодинамики утверждает,
- 86. Энергия ГиббсаЧтобы судить о возможности самопроизвольного протекания
- 87. Критерий самопроизвольного протекания процесса в неизолированной системе
- 88. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Преподаватель
Бедило Александр Федорович, к.х.н.
Основное место работы: Институт Катализа им. Г.К.
Борескова СО РАН
Слайд 3Учебные пособия
Курс лекций, методички кафедры с контрольными работами.
Учебник «Общая химия»
Глинки или любой другой учебник общей химии для вузов.
Можно
использовать книги для подготовки к ЕГЭСлайд 4Определение химии
Химия – это наука о природе материи и ее
превращениях.
Wikipedia, классическое определение
Химия – это наука о материи, которая
исследует состав, строение и свойства веществ и их превращения. Wikipedia, современное определение
Слайд 5Вещество
Вещество – это отдельный вид материи, обладающий при данных условиях
определенными физическими свойствами, не меняющимися от образца к образцу.
Например:
вода кислород
Шоколад не
является индивидуальным веществом, а смесью, т.к. его свойства меняются от одной шоколадки к другойСлайд 6Физические свойства
Свойства, которые не включают в себя превращения одного вещества
в другое, называют физическими.
Например:
запах плотность
цвет температура плавления
вкус сжимаемость
Слайд 7Химические свойства
В отличие от физических, химические свойства подразумевают возможность превращения
одних веществ в другие.
Например:
Химическим свойством дров является их способность к
сгоранию (горючесть)Слайд 8Физические превращения
При физических превращениях изменяются свойства, но не природа веществ.
Например:
плавление
кипение
измельчение
Слайд 9Химическая реакция
Химическая реакция – процесс, в котором одни вещества превращаются
в другие.
Дрова + кислород Углекислый газ + вода
+ золаРеагенты
Продукты
При химических превращениях изменяются как свойства, так и природа веществ.
Слайд 10Химическое уравнение
Химическое уравнение – это краткая запись химической реакции с
использованием химических символов.
В уравнениях должны быть показаны:
все реагенты и
продукты;физические состояния всех веществ;
любые дополнительные условия реакции;
Количество атомов каждого элемента в реагентах и продуктах должны быть равны.
t
CaCO3 (тв) = CaO (тв) + CO2 (газ) ↑
Слайд 12Молекулы и атомы
Молекула – это мельчайшая электронейтральная частица вещества, сохраняющая
его химические свойства.
Атом – это мельчайшая частица простого вещества,
сохраняющая его химические свойства. Молекула может состоять из одного, двух, трех или более атомов.
Гомоатомные молекулы состоят из атомов только одного элемента.
Например: Ar, O2
Гетероатомные молекулы состоят из разных атомов.
Например: H2O, CO2
Слайд 13Закон сохранения массы
В ходе химической реакции как общая масса веществ,
так и масса отдельных элементов остается постоянной.
Ломоносов, 1748
Лавуазье, 1774
Антуан
Лоран Лавуазье
(1743-1794)Михаил Васильевич
Ломоносов
(1711-1765)
Слайд 14Атомная теория Дальтона
Вся материя состоит из мельчайших частиц, называемых атомами,
которые являются наименьшими частицами элементов, участвующих в химических реакциях.
Все атомы
каждого элемента одинаковы.Атомы различных элементов различны
Соединения образуются из атомов различных элементов в строго определенных пропорциях.
В ходе химических реакций атомы не разрушаются и не создаются, а только изменяется характер их взаимодействия друг с другом.
Дальтон, 1803
Слайд 15Атомные единицы массы
На основании закона кратных соотношений Дальтон определил атомные
массы известных к тому времени элементов, взяв за единицу массу
наиболее легкого атома водорода.Абсолютные массы атомов, точно определенные позже, весьма невелики (~ 10-27 – 10-25 кг). Поэтому химики обычно пользуются относительными атомными единицами массы (а.е.м.). С 1961 года в качестве единой а.е.м. используются углеродные единицы – 1/12 массы изотопа 12С.
1 а.е.м. = 1,661 * 10-27 кг
Слайд 16Молекулярная масса
Молекулярной массой вещества называют отношение его массы к 1/12
массы атома углерода.
Поскольку масса молекулы равна сумме масс составляющих
ее атомов, то молекулярная масса равна сумме соответствующих атомных масс.Слайд 17Моль
Моль – количество вещества, которое содержит такое же число структурных
единиц (молекул, атомов, ионов, электронов и т.д.), как и в
12,000 г изотопа углерода 12С.Молярная масса (масса одного моля) вещества в г/моль численно равна его молекулярной массе в а.е.м.
1 моль любого вещества содержит 6,022 * 1023 молекул (атомов и т.п.).
Число Авогадро
Слайд 18Этапы стехиометрических расчетов
Уравняйте химическое уравнение.
Рассчитайте молярные массы.
Переведите все данные массы
(объемы) в моли.
Используйте химическое уравнение для получения нужного результата.
Переведите моли
назад в массы, если нужно.Слайд 19Стехиометрические расчеты
Задача: Сколько кислорода необходимо для окисления 2,57 г CO
в CO2.
Решение:
Записываем уравнение реакции: CO + O2 = CO2
Уравниваем
его: 2 CO + O2 = 2 CO2 Рассчитываем молярные массы всех реагентов: M (CO) = 28,01 г/моль; M (CO2) = 44,01 г/моль; M (O2) = 32,00 г/моль.
Слайд 20Стехиометрические расчеты
Определяем количество молей CO:
n (CO) = 2,57 г /
28,01 г/моль = 0,09175 моль.
Из уравнения реакции определяем, что 2
моля CO реагирует с 1 молем O2.
n (O2) = n (CO) / 2 = 0,09175 / 2 = 0,04588 мольРассчитываем массу прореагировавшего O2: m (O2) = n (O2) * M (O2) = 0,04588 * 32,00 = 1,47 г.
Слайд 21Химическая кинетика
Химической кинетикой называется раздел химии, изучающий скорости протекания химических
реакций.
A + 2B → С + D
Из химического уравнения
не следует как быстро протекает та или иная реакция! Химические превращения протекают в соотношениях пропорциональных количеству молекул или молей реагирующих веществ. Поэтому за скорость химической реакции можно взять изменение количества вещества за единицу времени. Поскольку изменения количества вещества реагентов и продуктов в ходе реакции связано между собой, можно брать для любого вещества, разделив на его стехиометрический коэффициент. Скорость реакции – величина положительная. Поэтому для реагентов изменение количества вещества (отрицательное) берется со знаком “минус”.Скорость = - (ΔnA/Δt) = -1/2 (ΔnB/Δt) = (ΔnC/Δt) = (ΔnD/Δt)
Слайд 22
Закон действия масс
В 1867 г. Гульберг и Вааге предположили, что
скорость реакции пропорциональна концентрациям реагентов в степенях, равных коэффициентам, стоящим
перед формулой этого вещества в уравнении реакции.A + 2B → C + D
v = k [A] [B]2
Это гипотеза называется законом действия масс (закон действующих масс).
Такая зависимость справедлива для многих (не для всех!) гомогенных реакций. Для гетерогенных реакций учитываются только концентрации веществ в газовой фазе или растворе. Концентрация веществ в твердой фазе постоянна и входит в константу скорости.
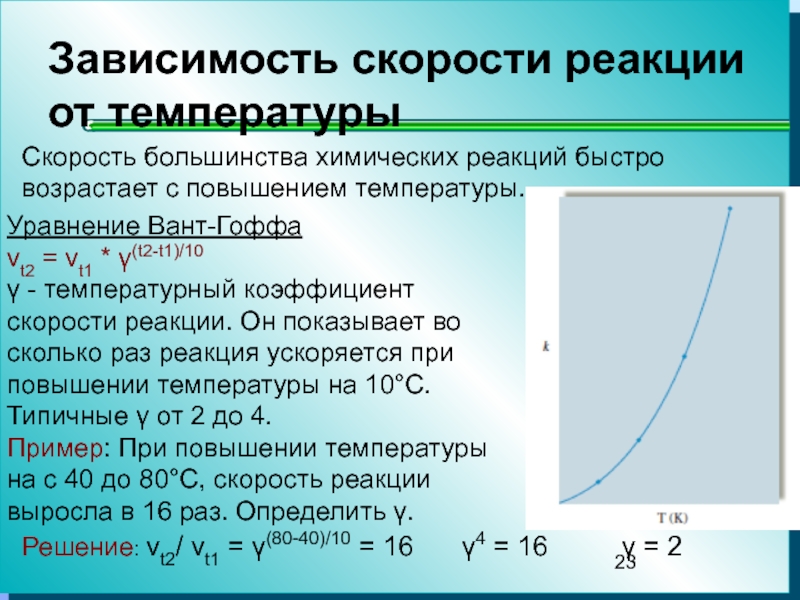
Слайд 23Зависимость скорости реакции от температуры
Скорость большинства химических реакций быстро возрастает
с повышением температуры.
Уравнение Вант-Гоффа
vt2 = vt1 * γ(t2-t1)/10
γ -
температурный коэффициент скорости реакции. Он показывает во сколько раз реакция ускоряется при повышении температуры на 10°С. Типичные γ от 2 до 4.Пример: При повышении температуры на с 40 до 80°С, скорость реакции выросла в 16 раз. Определить γ.
Решение: vt2/ vt1 = γ(80-40)/10 = 16 γ4 = 16 γ = 2
Слайд 24Химическое равновесие
Многие химические реакции протекают не до конца, а до
некого состояния, при котором в реакционной смеси наряду с продуктами
остаются и исходные реагенты. Это происходит из-за того, что сравниваются скорости прямой реакции образования продуктов из исходных реагентов и обратной реакции образования исходных реагентов из продуктов. Такое состояние, когда скорости прямой и обратной реакций равны, называется состоянием равновесия.Слайд 25Константа равновесия
aA + bB ↔ cС + dD
В состоянии равновесия
скорости прямой и обратной реакций равны. По закону действующих масс:
Vпр
= kпр [A]a [B]b = Vобр = kобр [C]c [D]d Приравняем эти выражения и поделим одно на другое.
kпр/ kобр = [C]c [D]d /([A]a [B]b)
Слева в выражении отношение констант, т.е. константа. Она называет константой равновесия.
Kc = [C]c [D]d /([A]a [B]b)
Это выражение справедливо для всех реакций, но только в состоянии равновесия!
Обозначение Kc означает, что она выражена для концентраций (c).
Слайд 26Равновесие в гетерогенных реакциях
Для гетерогенных реакций, где наряду с газами
или растворенными веществами присутствуют твердые вещества или жидкости, концентрации последних
не входят в выражение константы равновесия, т.к. они постоянны.O2(газ) + С(тв) = CO2 (газ)
Kc = [CO2]/[O2]
Слайд 27Равновесие в газовых смесях
Если все вещества, участвующие в химической реакции,
находятся в газовой фазе, то константу равновесия можно выразить не
только, через концентрации, но и через парциальные давления.aA + bB ↔ cС + dD
Kp = (pC)c (pD)d / (pA)a (pB)b
Константа равновесия, выраженная в парциальных давлениях обозначается Kp.
Слайд 28Факторы, влияющие на равновесие
Добавление реагента или продукта
Удаление реагента или
продукта
Изменение объема, приводящее к изменению концентраций реагента и/или продукта
Изменение температурыСлайд 29Принцип Ле Шателье
Принцип Ле Шателье (1884 г.)
При приложении любого воздействия
на систему, находящуюся в состоянии равновесия, в результате протекающих в
ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.Анри Луи
Ле Шателье
(1850-1936)
Слайд 30Проявления принципа Ле Шателье
При увеличении концентрации какого-либо вещества равновесие смещается
в сторону расходования этого вещества.
При уменьшении концентрации какого-либо вещества равновесие
смещается в сторону образования этого вещества.При повышении температуры равновесие смещается в сторону эндотермической (идущей с поглощением тепла) реакции. Т.е. равновесие эндотермической реакции смещается в сторону продуктов, а равновесие экзотермической (идущей с выделением тепла) реакции – в сторону реагентов.
Слайд 31Проявления принципа Ле Шателье
При понижении температуры равновесие смещается в сторону
экзотермической реакции.
При повышении давления путем сжатия системы равновесие смещается в
сторону уменьшения числа молекул газов.При повышении давления путем сжатия системы равновесие смещается в сторону увеличения числа молекул газов
Слайд 33Давление газа
Все газы оказывают давление на стенки сосуда, куда они
помещены. Его можно измерить барометром. Давление 1 атмосферы газа на
уровне моря при нормальном давлении равно 760 мм ртутного столба.Слайд 34Закон Бойля-Мариотта
При постоянной температуре и количестве вещества объем газа обратно
пропорционален его давлению.
P*V = const или P1V1 = P2V2
Роберт
Бойль
(1627-1691)
Эдм Мариотт
(1620-1684)На рисунке членов Французской
Академии наук 6-ой справа
Слайд 35Закон Гей-Люссака
При постоянном давлении и количестве вещества объем газа прямо
пропорционален абсолютной температуре.
V/T = const или V1/T1 = V2/T2
Абсолютная температура
измеряется в Кельвинах. Она равна температуре в °С плюс 273,15.0°С = 273,15 K
Жозеф Луи
Гей-Люссак
(1778-1850)
Слайд 36Закон Шарля
При постоянном объеме и количестве вещества давление газа прямо
пропорционально абсолютной температуре.
P/T = const или P1/T1 = P2/T2
Жак Александр
СезарШарль
(1746-1823)
Слайд 37Закон Авогадро
Одинаковые объемы газа при одинаковых температуре и давлении содержат
одинаковое количество молекул.
V = const * n или V1/n1
= V2/n2Амедео
Авогадро
(1776-1856)
Слайд 38Объем газа при стандартных условиях
Стандартные условия:
Температура: 0°С = 273,15
K
Давление: 1 атм = 1,013 * 105 Па
В этих условиях
объем одного моля любого идеального газа равен 22,4 л. Слайд 39Уравнение состояния идеального газа (Менделеева-Клапейрона)
Закон Бойля-Мариотта: V ~ 1/P
Закон Гей-Люссака: V
~ T
Закон Авогадро: V ~ n
Объединяем эти законы: V ~
n * T / PУравнение состояния идеального газа (Менделеева-Клапейрона): P * V = R * n * T
R – газовая постоянная
R = 8,314 Дж/(моль * K) = 0,08206 л * атм/(моль*K) = 62,36 л * мм.рт.ст /(моль*K)
Слайд 40Закон парциальных давлений газов (Дальтона)
Общее давление смеси газов равно сумме
парциальных давлений всех газов:
Pобщ = P1 + P2 + P3
+ ….Парциальное давление газа – это давление, которое создавал бы этот газ, если бы он один занимал весь объем при данной температуре.
Воздух представляет собой смесь газов и его общее давление равно сумме давлений всех газов, из которых он состоит.
Pвозд = PN2 + PO2 + PAr + PCO2 + PH2O + ….
Слайд 41Концентрация растворов
Раствор – это однородная смесь двух или более веществ.
Концентрация раствора – это количественная мера того, сколько вещества растворено
в растворителе (преобладающем компоненте раствора).Существуют много способов выражения концентрации:
Объемные доли (проценты)
Массовые доли (проценты)
Мольные доли (проценты)
Молярная концентрация
Моляльность
Слайд 42Объемные доли и проценты
Объемная доля равна отношению объема растворенного вещества
к общему объему раствора.
Объемный процент растворенного вещества равен его
объемной доле, помноженной на 100%c (об.%) = Vрастворенного в-ва / Vраствора * 100%
Слайд 43Массовые доли и проценты
Массовая доля равна отношению массы растворенного вещества
к общей массе раствора.
Массовый процент растворенного вещества равен его
массовой доле, помноженной на 100%c (масс.%) = mрастворенного в-ва / mраствора * 100%
Слайд 44Мольные доли и проценты
Мольная доля равна отношению количества молей того
или иного растворенного вещества к общему количеству молей раствора.
Мольный
процент растворенного вещества равен его мольной доле, помноженной на 100%χA = nA / (nA + nB + nC +…..)
Сумма мольных долей всех компонентов раствора равна единице!
Слайд 45Молярная концентрация
Молярная концентрация равна количеству молей растворенного вещества в 1
литре раствора.
Молярная концентрация измеряется в моль/л (обозначается буквой M)
Растворы
с одинаковой молярной концентрацией содержат одинаковое количество молекул растворенного веществаСлайд 46Моляльность
Моляльность – это количество молей вещества, растворенное в 1 кг
растворителя (обозначается буквой m).
В отличие от молярности, моляльность не зависит
от температуры. Слайд 47Закон Генри
При постоянной температуре растворимость газа в жидкости прямо пропорциональна
давлению газа над жидкостью.
c = k ∙ p
Закон справедлив
с точностью 1-3% для слабо растворимых газов при давлениях не выше 1 атм. Вильям Генри (1775 – 1836)
Слайд 48Закон Рауля
Парциальное давление пара компонента раствора равно произведению давления пара
чистого компонента на его мольную долю.
pA = pA° ∙ χA
Закон
выполняется только для идеальных растворов.Франсуа-Мари Рауль (1830-1901)
Слайд 49Коллигативные свойства
Коллигативными называются физические свойства растворов, которые зависят только от
концентрации частиц растворенного вещества и не зависят от его природы.
Снижение давления параПонижение температуры замерзания
Повышение температуры кипения
Осмотическое давление
Все эти свойства относятся к растворам, содержащим нелетучие растворенные вещества.
Слайд 50Снижение давление пара растворителя
При введении в раствор нелетучего компонента давление
пара растворителя понижается пропорционально мольной доле растворенного вещества.
pA° -
pA = pA° ∙ χBСлайд 51Повышение температуры кипения
При введении в раствор нелетучего компонента температура кипения
раствора возрастает пропорционально его моляльности.
ΔT = KЭб ∙ сm
KЭб
– эбулиоскопическая константа зависит только от свойств растворителя.Температура кипения повышается по мере добавления нелетучего компонента до насыщения
Слайд 52Снижение температуры плавления
При введении в раствор нелетучего компонента температура плавления
раствора снижается пропорционально его моляльности.
ΔT = KКр ∙ сm
KКр
– криоскопическая константа зависит только от свойств растворителя.Температура плавления снижается по мере добавления нелетучего компонента до насыщения.
Пример: добавление соли для таяния льда
Слайд 53Осмос
Осмос – это явление, состоящее в перемещении растворителя через полупроницаемую
мембрану из более разбавленного раствора в более концентрированный.
Полупроницаемые мембраны
пропускают только мелкие молекулы. Самые распространенные полупроницаемые мембраны – стенки клеток живых существ. Слайд 54Осмотическое давление
Осмотическое давление – количественная характеристика осмоса. Оно численно равно
внешнему давлению, которое необходимо приложить, чтобы остановить процесс осмоса.
π
= сM ∙ R ∙ T Нетрудно заметить, что это уравнение формально совпадает с уравнением состояния идеального газа.
π ∙ V = ν ∙ R ∙ T
Если концентрация выражена в моль/л, то π = 1000* сM ∙ R ∙ T
Якоб Хендрик
Вант-Гофф
(1852-1911)
Первый лауреат Нобелевской премии по химии
Слайд 55Сравнение эффекта ионных и ковалентных веществ
Эксперимент показывает, что растворенные ионные
вещества оказывают большее влияние на коллигативные свойства растворов, чем ковалентные.
Глюкоза 1 моль/кг воды ⇒ 1 m частиц
NaCl 1 моль/кг воды ⇒ 2 m частиц
CaCl2 1 моль/кг воды ⇒ 3 m частиц
Эти результаты свидетельствуют о диссоциации (распаде) ионных веществ при растворении в воде.
Слайд 56Особенности свойств растворов кислот, солей и оснований
Было обнаружено, что растворы
многих веществ отклоняются от законов, определенных для коллигативных свойств. Чтобы
распространить их на такие растворы, Вант-Гофф ввел понятие изотонического коэффициента, который показывает, во сколько раз осмотическое давление данного раствора выше нормального.π = i ∙ C ∙ R ∙ T
Слайд 57Теория электролитической диссоциации (1887 г)
Аррениус обнаружил тесную связь между электропроводностью
растворов и отклонениями от законов Рауля и Вант-Гоффа. Он предположил,
что при образовании таких растворов исходные вещества распадаются на ионы, которые проводят ток и увеличивают концентрацию частиц в раствореСванте Аррениус
(1859-1927)
Нобелевская премия по химии 1903 г.
Слайд 58Растворы электролитов
Вещества, проводящие электрический ток своими ионами называют электролитами. В
частности электролитами являются проводящие растворы кислот, солей и оснований. При
растворении они распадаются на положительно заряженные ионы (катионы) и отрицательной заряженные ионы (анионы).Например в разбавленных растворах:
BaCl2 = Ba2+ + 2Cl- (3 частицы, i ≈ 3)
Слайд 59Сила электролитов
Сильный электролит – это соединение, которое полностью ионизовано в
растворе.
Например: соляная кислота, NaOH
Слабый электролит – это вещество, которое лишь
частично диссоциирует в растворе. При этом в растворе устанавливается равновесие между молекулами такого вещества и ионами, образующимися при диссоциации.Например: уксусная кислота, H2S
Слайд 60Закон разбавления Оствальда
Рассмотрим раствор электролита BA с концентрацией с и
мольной долей диссоциированных молекул α. Величину α называют степенью диссоциации.
Константу равновесия процесса растворения называют константой диссоциации.Kc = α2c / (1-α)
При малых α, 1- α ≈ 1. Тогда Kc = α2c
Слайд 61Кислоты и основания по теории электролитической диссоциации
Кислота – электролит,
диссоциирующий в растворах с образованием ионов водорода. HCl = H+ +
Cl-Основание – электролит, диссоциирующий в растворах с образованием гидроксид-ионов NaOH = Na+ + OH-
Эта теория ограничена водными растворами
Слайд 62Сильные и слабые кислоты и основания
Сильные кислоты и основания полностью
ионизуются в растворах
HCl + H2O = H3O+ + Cl-
NaOH =
Na+ + OH- Слабые кислоты и основания не полностью ионизуются в растворах
CH3COOH + H2O = H3O+ + CH3COO-
NH3 + H2O = NH4+ + OH-
Ионы H3O+ называют ионами гидроксония. Точное количество молекул воды в них неизвестно.
Слайд 63Автоионизация воды
Автоионизация воды – это процесс, в котором одна молекула
воды выступает в роли кислоты, а другая в роли основания.
H2O
+ H2O = H3O+ + OH-Константу равновесия этого процесса Kw называют ионным произведением воды.
Kw = [H3O+] [OH-] = 1,0 x 10-14 при 25°С
Тогда в чистой воде концентрации [H3O+] и [OH-] равны 10-7 M.
Слайд 64pH и pOH
В водных растворах необходимо измерять концентрации кислот и
щелочей в широких пределах. Для выражения таких концентраций используют шкалы
pH и pOH.pH = - lg[H3O+]
pOH = - lg[OH-]
pH + pOH = 14 = pKw
pKw = -lg(Kw)
Слайд 65Сильные кислоты и основания
Для сильных кислот и оснований можно прямо
рассчитать pH и pOH из молярной концентрации.
Пример: Рассчитать pH
и pOH 0,15 M HCl.[H3O+ ] = 0.15 M; pH = - lg(0,15) = 0,82;
pOH = 14,00 – pH = 14,00 – 0,82 = 13,18
Рассчитать pH и pOH 0,052 M NaOH
[OH-] = 0,052 M; pOH = -lg(0,052) = 1,28
pH = 14,00 – 1,28 = 12,72
Слайд 66Константа диссоциации кислоты Ka
Для расчета кислотности слабых кислот следует применять
закон разбавления Оствальда.
HA + H2O = H3O+ + A-
Константу
равновесия этого процесса называют константой диссоциации кислоты Ka.Ka = [A-] [H3O+] / [HA]
Аналогично pH, введем pKa = -lg(Ka)
Слайд 67Ионно-молекулярные уравнения реакций в растворах
В растворах сильные электролиты диссоциированы на
ионы. Поэтому реакции с их участием правильнее записывать как реакции
ионов.CuCl2 + 2 NaOH = Cu(OH)2↓ + 2 NaCl (Молекулярное уравнение)
Cu2+ + 2 Cl- + 2 Na+ + 2 OH- = Cu(OH)2↓ + 2 Na+ + 2 Cl-
Ионы Na+ и Cl- присутствуют в левой и правой частях уравнения и не изменяются в ходе реакции. Такие ионы называют ионами-наблюдателями. При записи ион-молекулярных уравнений реакции мы их опускаем. Оставляем только ионы, участвующие в реакции и нерастворимые или недиссоциирующие вещества в молекулярной форме.
Cu2+ + 2 OH- = Cu(OH)2↓ (Ионно-молекулярное уравнение)
Слайд 68Реакции ионного обмена
Реакции, в которых электролиты обмениваются своими ионами, называют
реакциями ионного обмена.
CuCl2 + 2 NaOH = Cu(OH)2↓ + 2
NaClОбязательным условием протекания реакций обмена между электролитами является удаление из раствора тех или иных ионов в виде осадка, газа или слабо диссоциирующих веществ.
Реакцию обмена между кислотами и основаниями называют реакцией нейтрализации. Она протекает из-за образования слабого электролита – воды.
HCl + NaOH = NaCl + H2O (Молекулярное уравнение)
H+ + OH- = H2O (Ионно-молекулярное уравнение)
Слайд 69Гидролиз
Гидролизом называется взаимодействие вещества с водой, в котором составные части
вещества соединяются с составными частями воды.
NaF + H2O ↔
HF + NaOHF- + H2O ↔ HF + OH-
Гидролиз приводит к образованию малорастворимого, слабодиссоциирующего или газообразного вещества и (обычно) изменением pH раствора.
Соли, образованные сильной кислотой и сильным основанием гидролизу не подвергаются! Реакция среды – нейтральная.
NaCl + H2O ≠
Слайд 70Гидролиз
Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по
аниону.
NaCN + H2O ↔ HCN + NaOH
CN- + H2O
↔ HCN + OH-В ходе реакции выделяются гидроксид-ионы.
Среда щелочная, pH > 7.
Если кислота 2-х или более основная, то гидролиз может протекать в несколько ступеней. Гидролиз всегда протекает сильнее по первой ступени.
CO32- + H2O ↔ HCO3- + OH-
HCO3- + H2O ↔ H2CO3 + OH-
Слайд 71Гидролиз
Соли, образованные слабым основанием и сильной кислотой, подвергаются гидролизу по
катиону.
NH4Cl + H2O ↔ NH4OH + HCl
NH4+ + H2O
↔ NH4OH + H+В ходе реакции выделяются протоны.
Среда кислая, pH < 7.
Если основание 2-х или более кислотное, то гидролиз может протекать в несколько ступеней. Гидролиз всегда протекает сильнее по первой ступени.
Zn2+ + H2O ↔ ZnOH+ + H+
ZnOH+ + H2O ↔ Zn(OH)2 + H+
Слайд 72Гидролиз
Соли, образованные слабым основанием и слабой кислотой, подвергаются гидролизу и
по аниону и по катиону.
NH4CN + H2O ↔ HCN
+ NH4OHCN- + H2O ↔ HCN + OH-
NH4+ + H2O ↔ NH4OH + H+
Реакция среды зависит от соотношения констант диссоциации кислоты и основания.
Если Kb > Ka – среда щелочная, pH > 7
Если Ka > Kb – среда кислая, pH < 7
Если Ka ≈ Kb – среда почти нейтральная, pH ≈ 7.
Слайд 73Энергия
Энергия – это способность производить работу или передавать тепло (существуют
и другие определения). В курсе физике изучаются самые распространенные формы
энергии – кинетическая и потенциальная.Закон сохранения энергии гласит, что полная энергия остается постоянной.
Слайд 74Внутренняя энергия, термохимия
Химические реакции протекают с выделением или поглощением тепла.
Значит, химические вещества обладают некой энергией в скрытой форме. Такая
форма энергии, освобождающаяся в ходе химический реакций называется внутренней энергией.Раздел химии, изучающий тепловые эффекты реакций называют термохимией. Термохимия часть является одним из разделов химической термодинамики, которая изучает физико-химические процессы, сопровождающиеся выделением или поглощением тепла.
Слайд 75Экзотермические и эндотермические реакции
Реакции, протекающие с выделением энергии называют экзотермическими.
Реакции, протекающие с поглощением энергии называют эндотермическими.
Единица измерения энергии в
системе СИ – Джоуль (Дж). 1 Дж = 1 кг * м /с2
Еще одна распространенная единица энергия – калория (кал).
1 кал = 4,184 Дж
Слайд 76Внутренняя энергия
Внутренняя энергия (U) – функция состояния системы. Ее абсолютное
значение нельзя измерить. Но на практике можно определить изменение внутренней
энергии к ходе какого-либо процесса:ΔU = Uконечн – Uначальн.
Если ΔU < 0, то Uконечн < Uначальн, т.е. система теряет энергию, отдавая ее окружению.
Если ΔU > 0, то Uконечн > Uначальн, т.е. система увеличивает энергию, получая ее от окружения.
Слайд 77Первый закон термодинамики
Первый закон термодинамики - является другой формой закона
сохранения энергии. Согласно ему, энергия не появляется и не исчезает,
а может только переходить из одной формы в другую.Следовательно, сумма энергии системы и энергии окружения есть величина постоянная, т.е.
ΔUсис + ΔUокруж = 0
Слайд 78Реакции при постоянном объеме и при постоянном давлении
При постоянном объеме
ΔV = 0, т.е. ΔU = qV. Здесь знак V
означает, что реакция идет при постоянном объеме (V)Таким образом, если реакция протекает при постоянном объеме, изменение внутренней энергии системы равно теплоте, поглощаемой системой.
Можно также сконструировать функцию состояния, изменение которой при постоянном давлении равно теплоте, поглощаемой системой. Такая функция состояния называется энтальпией (H). Она равна сумме внутренней энергии и произведения давления на объем системы.
H = U + PV
Действительно:
ΔH = ΔU + PΔV = qp - PΔV + PΔV = qp.
Для реакций, в который участвуют только твердые вещества и жидкости, член PΔV пренебрежимо мал, т.е. ΔH ≈ ΔU
Слайд 79Термохимические уравнения
Тепловые эффекты можно включать в уравнения реакции. Химические уравнения,
в которых указано количество поглощаемой или выделяющейся теплоты, называют термохимическими
уравнениями.Значительная часть химических реакций проходит при постоянном давлении. Поэтому для определения передачи тепла в термодинамике обычно пользуются изменениями энтальпии, а не внутренней энергии.
Слайд 80Стандартная мольная энтальпия
Стандартная мольная энтальпия реакции (ΔH°298)– это изменение энтальпии
при стандартных условиях в расчете на 1 моль реакции, т.е.
в соответствии со стехиометрическим уравнением реакции. Стандартные условия – температура 25°С (298 К), парциальное давление – 1 атм.Предполагается, что в этих условиях каждый из продуктов и реагентов находится в своем нормальном (для стандартных условий) агрегатном состоянии.
2H2(г) + O2(г) → 2H2O(ж)
ΔH°298 = -571,6 кДж/моль
Слайд 81Стандартная мольная энтальпия образования
В термохимических уравнениях, если тепло поглощается системой
(реакция эндотермическая), то ΔH° > 0. Если тепло выделяется системой
(реакция экзотермическая), то ΔH° < 0.Стандартной мольной энтальпией образования (теплотой образования) называется изменение энтальпии при образовании одного моля вещества из входящих в него элементов при стандартных условиях.
H2(г) + ½O2(г) → H2O(ж)
ΔH°обр,298=-285,8 кДж/моль
Слайд 82Закон Гесса
Внутренняя энергия и энтальпия являются функциями состояния. Поэтому их
изменение зависит только от начального и конечного состояний системы, но
не зависит от того, как именно конечное состояние было получено. Этот принцип, именуемый законом Гесса, можно сформулировать так:Тепловой эффект реакции зависит только от начального и конечного состояний вещества, но не зависит от промежуточных стадий процесса.
Слайд 83Закон Гесса
Закон Гесса можно использовать для определения энтальпий реакций, прямое
экспериментальное определение которых невозможно, из стандартных энтальпий образования или сгорания.
ΔH°298 (реакции) = Σ [ΔH°обр,298 (продукты)] –
Σ [ ΔH°обр,298 (реагенты)]
Т.е. стандартная мольная энтальпия любой реакции равна сумме стандартных мольных энтальпий образования продуктов минус сумма стандартных мольных энтальпий образования реагентов. Это очень часто используемая математическая формулировка закона Гесса.
Слайд 84Энтропия
Энтропия (S) – это мера неупорядоченности системы. Энтропия тем больше,
чем менее упорядочена система, т.е. чем большим количеством способов можно
это состояние реализовать. Энтропия связана с количество микросостояний, которым можно реализовать макросостояние системы: S = k ln W. Учет энтропии важен для предсказания, какие процессы (реакции) будут протекать самопроизвольно.Слайд 85Второй закон термодинамики
Второй закон термодинамики утверждает, что все самопроизвольно
протекающие процессы сопровождаются увеличением суммарной энтропии системы и окружения. Это
означает, что в любой изолированной системе происходит постоянное увеличение беспорядка с течением времени.ΔSполн > 0, где ΔSполн = ΔSсист + ΔSокр
Энтропия - это функция состояния. Поэтому можно ввести стандартные мольные энтропии веществ в стандартном состоянии S°298, аналогично стандартным мольным энтальпиям образования.
Слайд 86Энергия Гиббса
Чтобы судить о возможности самопроизвольного протекания процесса надо учитывать
два фактора:
1) все системы стремятся к минимуму энергии;
2) все
системы стремятся к максимуму энтропии. Оказалось, что можно ввести термодинамическую функцию состояния, которая учитывает оба этих фактора. Такой функцией для процессов, протекающих при постоянных давлении и температуре является энергия Гиббса (G).
G = H – TS
Слайд 87Критерий самопроизвольного протекания процесса в неизолированной системе
Изменение энергии Гиббса
в ходе такой реакции будет равно:
ΔG = ΔH – TΔS
По
второму закону термодинамики ΔSполн > 0, где ΔSполн = ΔSсист + ΔSокр = ΔSсист - ΔH/T.
Помножим обе части этого уравнения на T.
T ΔSполн = TΔSсист - ΔH = - ΔG > 0
Таким образом, критерием самопроизвольного протекания процесса в неизолированной системе при постоянных давлении и температуре является
(- ΔG > 0), т.е. ΔG < 0