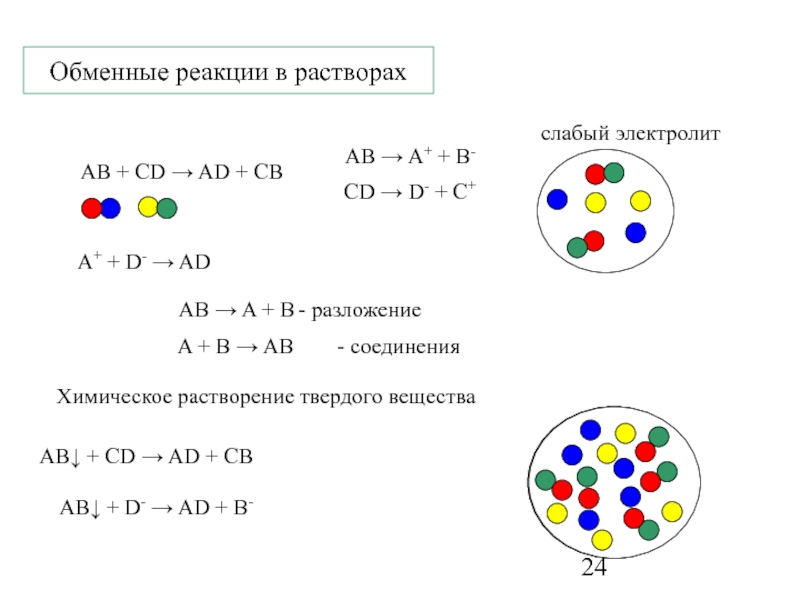
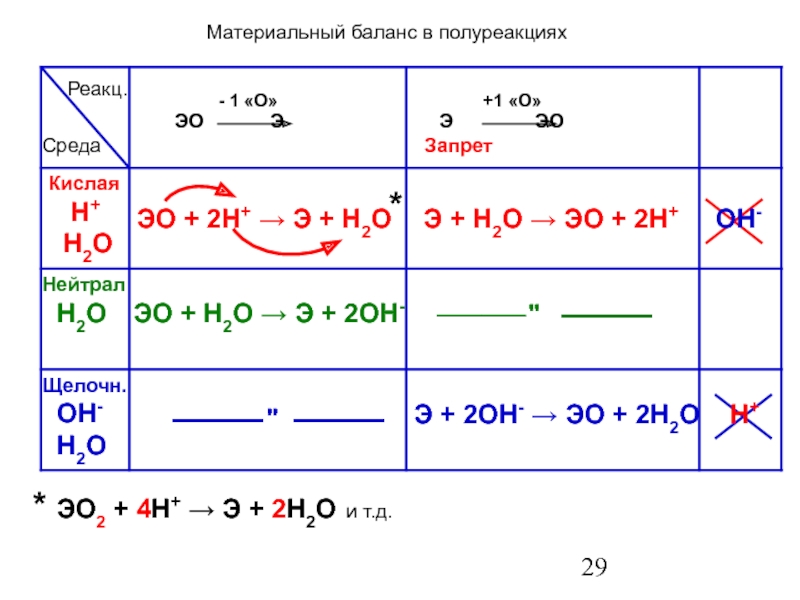
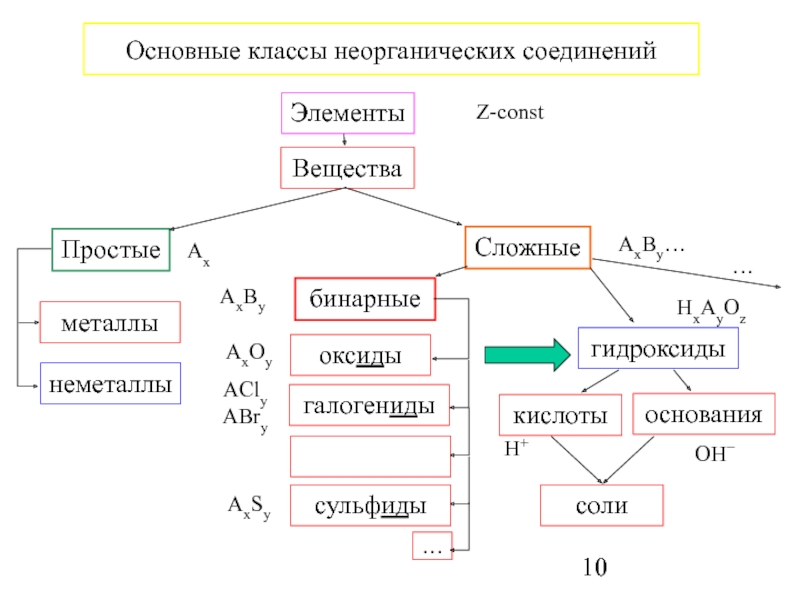
элемент – атомы Z-const
Zē
Молекула – количество атомов n ≥ 2
H,
O, N, S, Na, Cu,…Вещества – состоят из атомов или молекул
Простые вещества - Ax
Сложные вещества - AxBy…
Химическая формула
H2O,


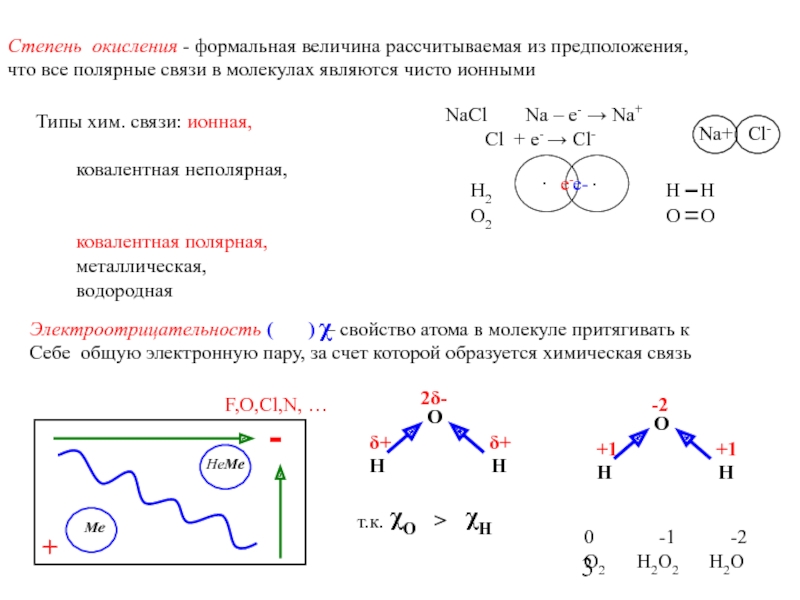








![Общая химия.ppt Основные солиMe(OH)n + m H+ → m H2O + [Me(OH)n-m]m+Al(OH)3 + Основные солиMe(OH)n + m H+ → m H2O + [Me(OH)n-m]m+Al(OH)3 + H+ → H2O + [Al(OH)2]+[Al(OH)2]Clдигидроксохлорид алюминияMen+](/img/thumbs/12e2d27265eeeab4f088fcd012816b1f-800x.jpg)