Слайд 1С.М.Судариков
Гидрогеохимия
Роль океанской воды в формировании
химического состава природных вод
Слайд 2Образование и эволюция химического состава воды Мирового океана
Постепенное изменение океанской
воды под влиянием процессов выветривания первичных изверженных пород. Примеры реакций:
2СaAl2Si2O8
+ 6H2O ––––> Al4Si4O10OH8 + 2Ca2+ + OH-
анортит каолинит или:
2СaAl2Si2O8 + H2O + H+ –––––> Al4Si4 O10OH8 + 2Ca2+
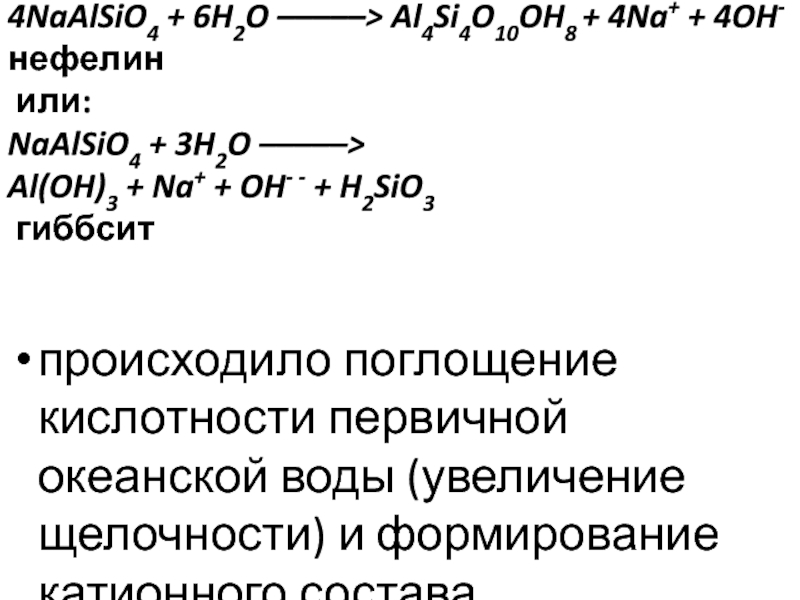
Слайд 34NaAlSiO4 + 6H2O –––––> Al4Si4O10OH8 + 4Na+ + 4OH-
нефелин
или:
NaAlSiO4 + 3H2O –––––>
Al(OH)3 + Na+ + OH- - + H2SiO3
гиббсит
происходило поглощение кислотности первичной океанской воды (увеличение щелочности) и формирование катионного состава.
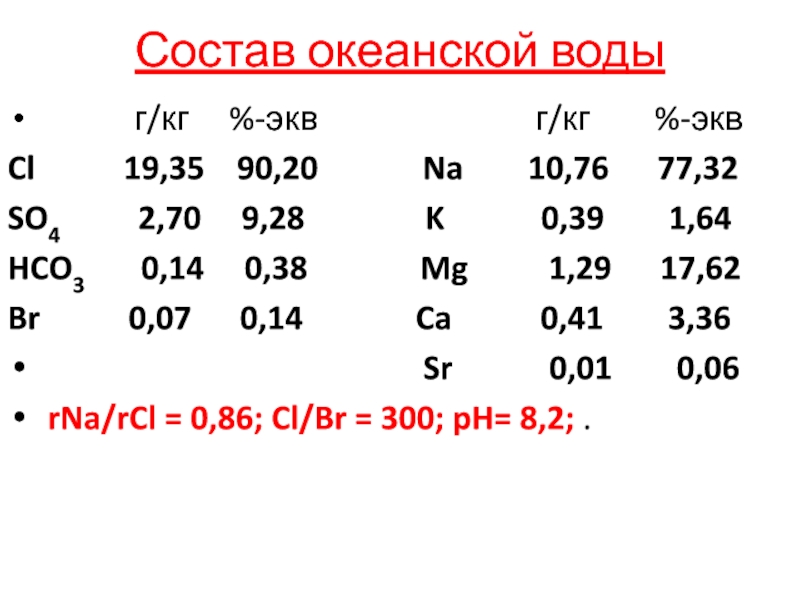
Слайд 4Состав океанской воды
г/кг
%-экв
г/кг %-экв
Cl 19,35 90,20 Na 10,76 77,32
SO4 2,70 9,28 K 0,39 1,64
HCO3 0,14 0,38 Mg 1,29 17,62
Br 0,07 0,14 Ca 0,41 3,36
Sr 0,01 0,06
rNa/rCl = 0,86; Cl/Br = 300; pH= 8,2; .
Слайд 5Изменение состава океанской воды при упаривании
130 г/кг; начало садки гипса,
в результате которой в твердую фазу уходит весь кальций; объем
оставшейся воды 19,6 % от исходной; оставшееся к-во сульфатов 7 %-экв;
280 г/кг; начало садки галита; выпадает с тв. фазой натрий; объем оставшейся воды 9,3 % от исходной; после осаждения галита сульфатов 25%-экв;
Слайд 6325 г/кг; начало садки эпсомита (MgSO4. 7H2O); осталось 6 %
воды; 5 %-экв калия;
350 г/кг; начало садки сильвина и карналлита
(KCl.MgCl2. 6H2O); осталось 3,1 (сильвин) -3,9 (карналлит) % от исходной воды; 6 %-экв. калия;
около 370 г/кг; начало садки бишофита (MgCl2.6H2O); осталось 2,7 % воды;
если исходная вода была обогащена кальцием (седиментогенные рассолы), обособляется стадия садки тахгидрита (2MgCl2.CaCl2.12H2O), 1,9 % от исходного количества воды;
420 г/кг; эвтоника.
Слайд 7Кислород (O2)
Объемная доля кислорода в воздухе составляет 20,9 %. Растворимость кислорода
(при 0 °C и парциальном давлении 0,1 МПа) 49,2 мл/л, или 70,3 мг/л (34
мл/л). В равновесии с воздухом может находиться 70,3 · 0,209=14,7 мг/л кислорода.
Близкие к этому значения содержания кислорода и характерны для поверхностных и грунтовых вод. Главный источник растворенного в воде кислорода – воздух.
Слайд 8В недрах кислород расходуется на окисление органич. веществ, Fe, сульфидов.
Участие
аэробных бактерий приводит к появлению в подземных водах биогенного CO2
Выпадают
в осадок оксиды и гидроксиды Fe, цементирующие горные породы.
Формируются зоны окисления и вторичного обогащения на сульфидных месторождениях.
В результате кислород быстро расходуется и на глубинах первых сотен метров его содержание обычно не превышает нескольких миллиграммов на литр.
Слайд 9Озон (O3) (от др-греч ὄζω — пахну)
Впервые озон обнаружил в
1785 г. голландский физик М. ван Марум по характерному запаху
и окислительным свойствам, которые приобретает воздух после пропускания через него электрических искр. Термин озон предложен немецким химиком X.Ф. Шёнбейном в 1840 г., вошёл в словари в конце XIX века.
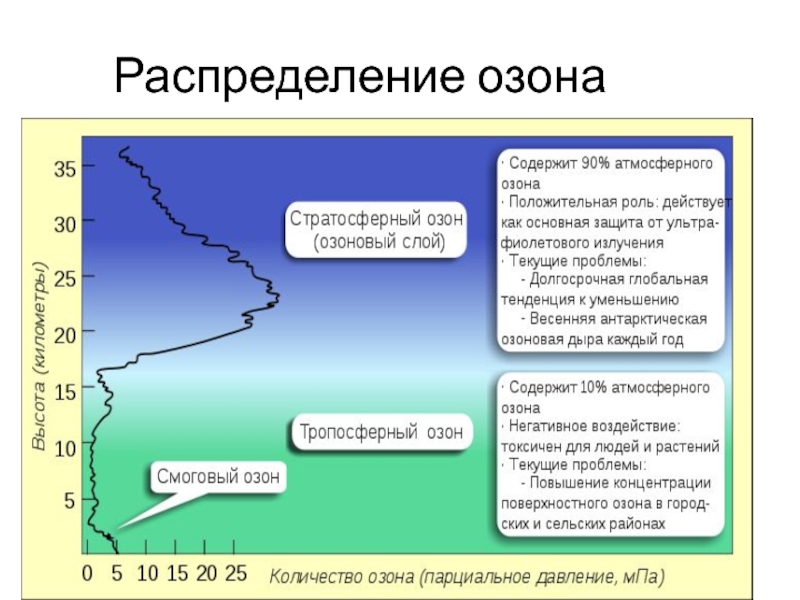
Слайд 10Распределение озона
В воздухе на поверхности Земли 1.1012 см-3 (молекул в
куб.см газа).
На высоте 15-25 км в 3 раза больше.
В полярных широтах до 5.1012 .
Это и есть озоновый слой, сформировавшийся в силуре, когда количество кислорода в атмосфере достигло около 10 % от современного.
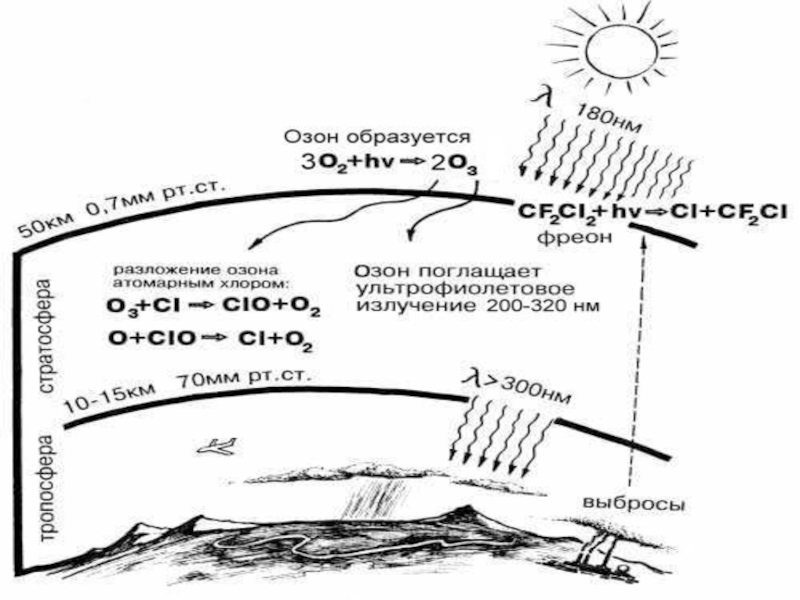
Слайд 12Образование
Озон образуется под действием ультрафиолетовых лучей с длиной волны менее
180 нм. УФ-свет с большей длиной волны (около 320 нм),
наоборот, способствует разложению озона. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов.
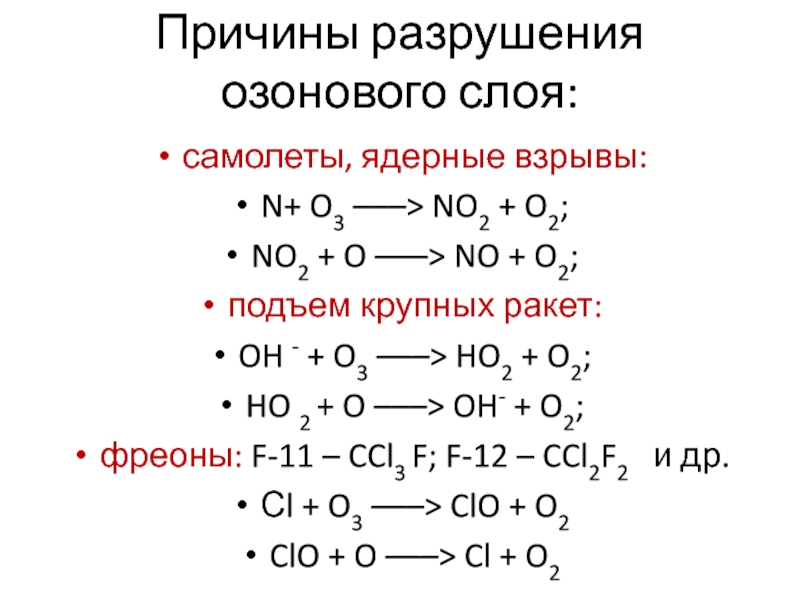
Слайд 14Причины разрушения озонового слоя:
самолеты, ядерные взрывы:
N+ O3 –––> NO2
+ O2;
NO2 + O –––> NO + O2;
подъем крупных ракет:
OH - + O3 –––> HO2 + O2;
HO 2 + O –––> OH- + O2;
фреоны: F-11 – CCl3 F; F-12 – CCl2F2 и др.
Сl + O3 –––> ClO + O2
ClO + O –––> Cl + O2
Слайд 15Углекислый газ (CO2)
В воздухе: начало века – 0,030 %; семидесятые
годы 0,033, теперь около 0,04. То есть, содержание углекислого газа
в воздухе невелико.
Растворимость CO2 довольно высокая. При 0 °C и давлении 0,1 МПа составляет 1713 мл/л, или 3350 мг/л. Однако, количество углекислого газа в воде, находящегося в равновесии с воздухом, составит 3350 · 0,00033 = 1,1 мг/л. Воды, находящиеся в соприкосновении с атмосферой, содержат относительно мало углекислого газа.
Слайд 16Подземные воды содержат значительно большее количество углекислого газа. Является обязательным
компонентом большинства природных вод.
Процессы окисления органического вещества, сульфатредукции, продуцируют углекислый
газ, содержание которого в почвенном воздухе составляет обычно десятые доли процента и даже первые проценты.
Соответственно увеличивается и содержание углекислого газа в грунтовых водах, составляющее обычно от 20–30 до 200–300 мг/л.
Слайд 17Другим мощным источником CO2 в недрах являются процессы термального метаморфизма
горных пород
На всех стадиях термального метаморфизма происходят физико-химические процессы,
продуцирующие CO2 при температурах от 100 до 800–1100 °C и давлениях от 100–200 до 1000–1500 МПа.
Выделяющийся газ поднимается по зонам тектонических нарушений и, смешиваясь с подземными водами различного генезиса, формирует широкую гамму углекислых вод, разного химического состава.
Слайд 18Выделяющийся CO2 вдоль зоны тектонического нарушения создает травертиновый хребет (вблизи
г. Сиена)
Слайд 19Травертин - (синоним — известковый туф) — легкая пористая (ячеистая)
порода, образовавшаяся в результате осаждения карбоната кальция из горячих или
холодных углекислых источников.
Слайд 20Концентрация углекислого газа в таких водах зависит от его парциального
давления и температуры и обычно составляет 1–3 г/л, в редких случаях
достигает 15–20 г/л.
Слайд 21CO2 скапливается в понижениях рельефа
Слайд 22Аргон (Ar)
Является постоянной составляющей газового состава природных вод. Содержание аргона
в воздухе по объему составляет 0,93 %. Растворимость аргона при 0 °С
и давлении 0,1 МПа составляет 57,8 мл/л, или 107,8 мг/л
Вода, находящаяся в равновесии с воздухом, содержит около 0,96 мг/л аргона.
Соотношения, изотопов аргона, в воздухе: 36Ar; 38Аr; 40Ar : 0,337; 0,063; 99,600 %. 40Ar / 36Ar = 295,6.
Слайд 23Поскольку Ar как благородный газ не вступает в реакции с
горными породами, его содержание в воздухе служит показателем доли атмосферного
газа в природных водах
40Ar радиог. = Σ 40Ar - 40Ar возд.
Содержание радиогенного аргона в источниках Камчатки в 1/3 проб 3-10%. Нефтяные газы Ферганы – 100-120 ppm. Источники накопления радиогенного аргона – мантия, радиоактивный распад.
Использование – индикатор воздушной составляющей (Ar/N2; He/Ar) Изменение соотношения изотопов аргона в воде используется при прогнозе землетрясений.
Слайд 24Гелий (He).
Это один из самых распространенных во Вселенной газов,
составляющий 23 % от общей массы звезд, планетарных туманностей и межзвездного
газа. На Земле распространенность гелия ниже на 10 порядков. Содержание гелия в воздухе невелико и объемная доля составляет 5,24 · 10-4 % (~0,0005 %).
Растворимость гелия при 0 °C и давлении 0,1 МПа 9,7 мл/л, или 1,73 мг/л. В нормальных условиях 7 мг/л. Относительно малая распространенность гелия на Земле объясняется его диссипацией, в особенности в начальный период формирования нашей планеты.
Слайд 25Гелий как индикатор возраста и генезиса воды
He/Ar для воздуха
около 0,0005. Накопление – радиоактивный распад калийсодержащих минералов.
Отсюда гелий-аргоновый
метод определения возраста подземных вод. Для "древних" вод содержание гелия может достигать первых процентов.
Много "помех", затрудняющих использование гелий-аргонового метода, связанных с другими источниками поступления гелия. На урановых м-иях содержание гелия может быть очень высоким. Золото-урановое месторождение Витватерсранд (Ю.Африка) – 13,5 %.
Слайд 26Гелий имеет два стабильных изотопа – 3He и 4He, причем
содержание тяжелого изотопа всегда на несколько порядков выше.
Для первичного
(мантийного) гелия отношение 3He/4He составляет примерно 10-4.
Гелий, образующийся в результате радиоактивного распада урана и тория в литосфере (коровый), характеризуется 3He/4He = 10-8.
Отношения 3He/4He для природных вод находятся в промежутке между этими значениями и являются генетическим признаком, помогающим исследовать происхождение тех или иных их разновидностей.
Слайд 27Водород (H2)
Водород – самый распространенный элемент Вселенной. В
земных условиях водород распространен прежде всего в виде соединения с
кислородом – воды, а газ H2 присутствует только на значительных глубинах. В воздухе 10-4 %.
Растворимость водорода близка к растворимости азота и составляет при 0 °C и давлении 0,1 МПа 21,5 мл/л (1,9 мг/л).
Водород может продуцироваться в недрах Земли в восстановительной обстановке. Значительные содержания водорода могут встречаться в водах современных океанических рифтов. Здесь под влиянием мантийных расплавов могут формироваться парогидротермы, в газовом составе которых объемные содержания водорода могут достигать нескольких десятков процентов.
Установлено, что под влиянием процессов серпентинизации ультраосновных (мантийных) пород в гидротермальных системах Срединно-Атлантического хребта продуцируется водород и метан.
Слайд 28Влияние процессов серпентинизации ультрабазитов на формирование состава флюидов прослеживается по
реакции (Сharlou et al., 2002; Леин и др., 2003):
6((Mg1.5Fe0.5)SiO4) +7H2O
=
серпентин
3(Mg3Si2O5(OH)4) +Fe3O4+H2
оливин магнетит
с последующим образованием CH4 при взаимодействии генерируемого водорода и растворенного в морской воде диоксида углерода
CO2+4H2=CH4+2H2O
Слайд 29Наиболее яркие проявления таких вод описаны для современной рифтовой зоны
Исландии ("водородные" термы, до 32 % водорода).
Газовые включения в минералах:
Верхнекамское
калийное месторождение, карналлит: 19 % водорода, 31,6 % метана.
Алмазы Якутии: 22 % водорода, 64,6 % метана.