Слайд 1ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ
Слайд 2В окислительно-восстановительном титровании используют реакции, связанные с изменением степени окисления
реагирующих веществ, т.е. реакции окисления - восстановления.
Все методы в окислительно-восстановительном
титровании основаны на количественном окислении или восстановлении анализируемого вещества.
Другие названия для этих методов — редоксиметрия, оксидиметрия, оксредметрия происходят от соединения начальных слогов слов reductio (восстановление) и oxydatio (окисление).
Слайд 3Методы в окислительно-восстановительном титровании классифицируют в соответствии с применяемым титрованным
раствором. К наиболее распространенным из них относятся следующие:
йодометрия
(I2);
перманганатометрия (KMnO4);
броматометрия (KBrO3);
хроматометрия (K2Cr2O7);
цериметрия (Ce(SO4)2);
ванадометрия (NH4VO3);
титанометрия (TiCl3) и т.д.
Слайд 4В любом процессе титрования изменяется концентрация реагирующих веществ, иначе говоря,
степень оттитрованности f . Если степень оттитрованности взять за независимую
переменную, то зависимой переменной в этом случае будет потенциал окислительно-восстановительной системы, находимый по формуле Нернста:
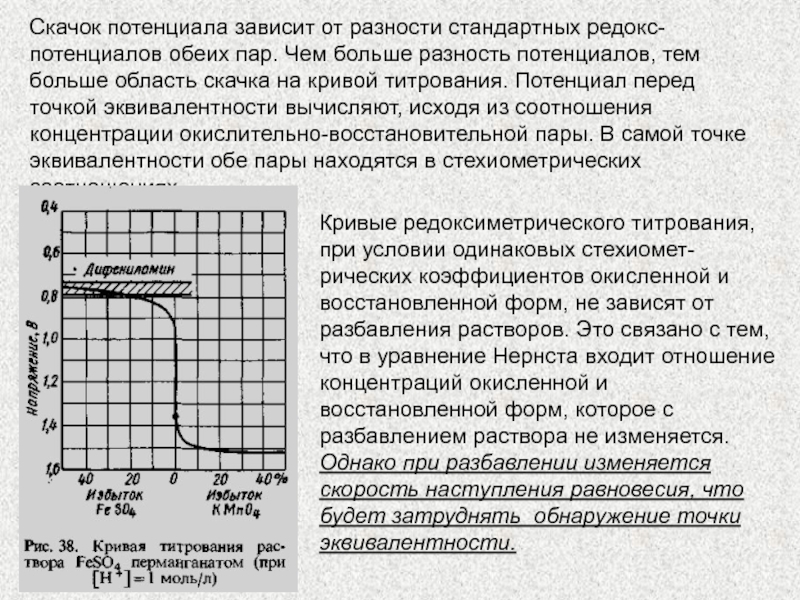
Форма кривой перед точкой эквивалентности определяется в основном свойствами восстановителя, а после точки эквива-лентности — свойствами окислителя. Вблизи точки эквива-лентности происходит резкий скачок редокс-потенциала. Кривая на других участках имеет незначительный уклон, так как потенциал медленно изменяется при титровании. Наличие скачка при титровании в точке эквивалентности, в случае неокрашенных растворов окислителя и восстановителя, наблюдается с помощью индикаторов, например дифениламина.
Слайд 5Скачок потенциала зависит от разности стандартных редокс-потенциалов обеих пар. Чем
больше разность потенциалов, тем больше область скачка на кривой титрования.
Потенциал перед точкой эквивалентности вычисляют, исходя из соотношения концентрации окислительно-восстановительной пары. В самой точке эквивалентности обе пары находятся в стехиометрических соотношениях.
Кривые редоксиметрического титрования, при условии одинаковых стехиомет-рических коэффициентов окисленной и восстановленной форм, не зависят от разбавления растворов. Это связано с тем, что в уравнение Нернста входит отношение концентраций окисленной и восстановленной форм, которое с разбавлением раствора не изменяется. Однако при разбавлении изменяется скорость наступления равновесия, что будет затруднять обнаружение точки эквивалентности.
Слайд 6В оксидиметрии возможно безындикаторное и индикаторное титрование.
Безындикаторное титрование можно проводить
всеми окрашенными окислителями и восстановителями (перманганат, раствор иода и т.д.).
При титровании различных восстановителей перманганатом в кислой среде одна капля его после точки эквивалентности окрашивает раствор в розовый цвет.
Индикаторное титрование проводят с индикаторами, которые вступают в специфическую реакцию с окислителем или восстановителем. Например, тиоцианат-ионы являются индикатором на железо (III), образуя окрашенные в красный цвет комплексные ионы. Раствор крахмала дает с малыми количествами свободного иода сорбционные и комплексные соединения, окрашенные в синий цвет.
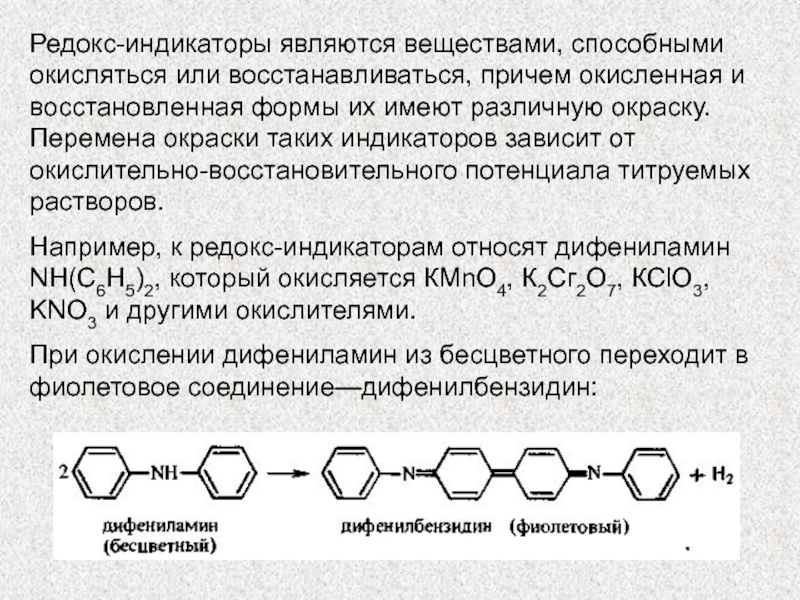
Слайд 7Редокс-индикаторы являются веществами, способными окисляться или восстанавливаться, причем окисленная и
восстановленная формы их имеют различную окраску. Перемена окраски таких индикаторов
зависит от окислительно-восстановительного потенциала титруемых растворов.
Например, к редокс-индикаторам относят дифениламин NH(C6H5)2, который окисляется КМnO4, К2Сг2O7, КСlO3, KNO3 и другими окислителями.
При окислении дифениламин из бесцветного переходит в фиолетовое соединение—дифенилбензидин:
Слайд 8Изменение окраски происходит при определенном окислитель-ном потенциале
. Дифениламин при
бесцветен, при он переходит в дифенилбензидин (фиолетовый).
Превращение окисленной формы индикатора в восстановлен-ную и обратно можно выразить уравнением:
К этой системе можно применить уравнение Нернста:
где - стандартный редокс-потенциал данной пары, т.е. потенциал, соответствующий случаю, когда .
Окраска индикатора при переходе одной формы в другую заметна тогда, когда после прибавления любого окислителя или восстановителя установится соотношение концентраций формы индикатора окисленной и восстановленной в 10 раз больше или меньше.
Слайд 9ПЕРМАНГАНАТОМЕТРИЯ
Перманганатометрия — один из наиболее часто применяемых методов окислительно-восстановительного
титрования. В качестве титранта используют раствор перманганата калия, окислительные свойства
которого можно регулировать в зависимости от кислотности раствора.
В кислых средах восстановление MnO4- до Mn2+ проходит быстро и стехиометрично по уравнению:
MnO4- + 8H+ + 5e = Mn2+ + 4H2O
С учетом уравнения Нернста:
Особенностью метода является сильное влияние [H+] на Eo системы MnO4-+8H+/Mn2+
Слайд 10К достоинствам перманганатометрического метода относят:
1) возможность титрования раствором KMnO4
в любой среде (кислой, нейтральной, щелочной);
2) применимость растворов перманганата
калия в кислой среде для определения многих веществ, которые не взаимодействуют с более слабыми окислителями;
3) стехиометричиость большинства окислительно-восстановительных реакций с участием MnO4- — при оптимально выбранных условиях с достаточной скоростью;
4) возможность титрования без индикатора;
5) доступность перманганата калия.
Наряду с перечисленными достоинствами метод перманганатометрии имеет ряд недостатков:
титрант KMnO4 готовят как вторичный стандарт, поскольку исходный реагент — перманганат калия — трудно получить в химически чистом состоянии, реагент крайне неустойчив;
реакции с участием MnO4- возможны в строго определенных условиях (рН, температура и т.д.);
титрование раствором KMnO4 не рекомендуется проводить в присутствии Cl-
Слайд 11ИОДОМЕТРИЯ
Иодометрия основана на окислительно-восстановительных процессах, связанных с восстановлением J2
до 2J- ионов или окислением их до J2. Свободный йод
является слабым окислителем, а J--ионы - сильным восстановителем.
Основная реакция при иодометрических определениях
J2+2е ⇄ 2J-
Стандартный потенциал пары J2/2J- = +0,54 В.
Кристаллы J2 мало растворимы в воде, поэтому их растворяют в растворе KJ. При этом образуется комплексное соединение К[J3].
Следовательно, основная реакция выражается уравнением
[J3]- + 2e- = 3J-
Слайд 12 Пара J2/2J- расположена примерно в середине таблицы редокс-потенциалов,
поэтому она имеет двойственный характер и применяется в качестве окислителя
и восстановителя.
Метод иодометрии применяют для определения восстановителей путем окисления их раствором иода, окислителей, используя метод замещения, и сильных кислот на основе реакции
JO3- + 5J- + 6Н- = 3J2 + ЗН2O
В йодометрии применяют специфический индикатор -крахмал, весьма чувствительный к йоду, но не к йодид-ионам. Момент окончания титрования определяют благодаря этому очень точно.
В качестве стандартных растворов используют растворы йода и тиосульфата. Первичным стандартом растворов тиосульфата является дихромат калия.
Слайд 13Источники погрешностей в йодометрических методах следующие:
1) потери йода вследствие
летучести;
2) окисление иодид-иона кислородом воздуха;
3) изменение характеристик стандартных
растворов тиосульфата в процессе их хранения и использования;
4) изменение стехиометрии реакции йода с тиосульфатом при титровании щелочных растворов;
5) относительно медленная реакция окисления йодидов окислителями;
6) адсорбция элементного йода поверхностно-активными веществами и некоторыми осадками, получающимися в процессе йодометрического титрования.
Поэтому в конце титрования следует тщательно перемешивать титруемый раствор, содержащий осадок.
Слайд 14ХРОМАТОМЕТРИЯ
В основе метода лежит окисление растворов восстанови-телей дихроматом калия К2Сг2O7:
Сr2O72-
+ 14Н+ -6е- ⇄ 2Сr3+ +7Н2O
При взаимодействии с
восстановителем дихромат-ион Сr2O72- принимает 6 электронов и переходит в Сг3+.
Восстановление Сr2O72--ионов проходит в кислой среде, поэтому хроматометрией можно определять восстанови-тели, определяющиеся в перманганатометрии.
В отличие от перманганатометрии, где титрование перманганатом проводится без индикатора, при титровании исследуемого раствора дихроматом калия необходим индикатор, в качестве которого используют дифениламин, который при незначительном избытке раствора К2Сг2O7 окрашивается в интенсивно синий цвет.
Слайд 15Преимущества хроматометрического метода:
дихромат калия легко получается в химически чистом
виде при перекристаллизации его из водного раствора. Просушивают его в
сушильном шкафу при температуре 150°С. Поэтому стандартный раствор можно приготовить, растворив точную навеску в точном объеме воды, т.е. в мерной колбе;
раствор дихромата калия очень устойчив и не меняет своей концентрации даже при кипячении подкисленного раствора. Раствор дихромата калия может длительно храниться в закрытом сосуде;
дихромат калия не окисляет хлорид-ионы в обычных условиях, что дает возможность вести титрование в присутствии хлороводородной кислоты.
Слайд 16Другие методы, используемые при окислительно-восстановительном титровании, Вами должны быть рассмотрены
самостоятельно.