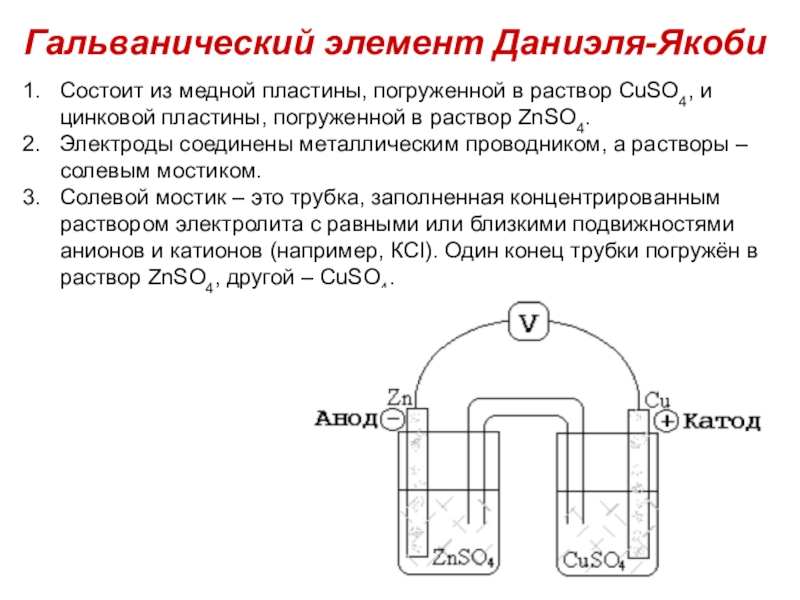
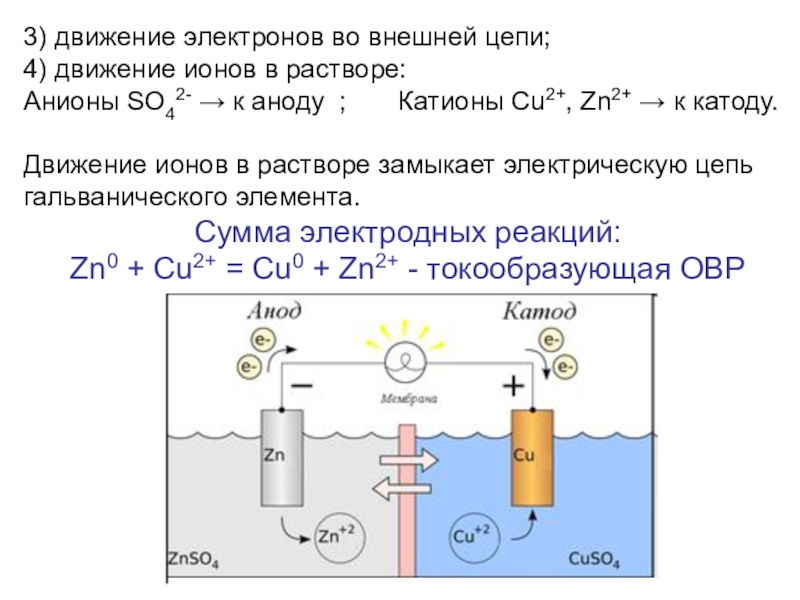
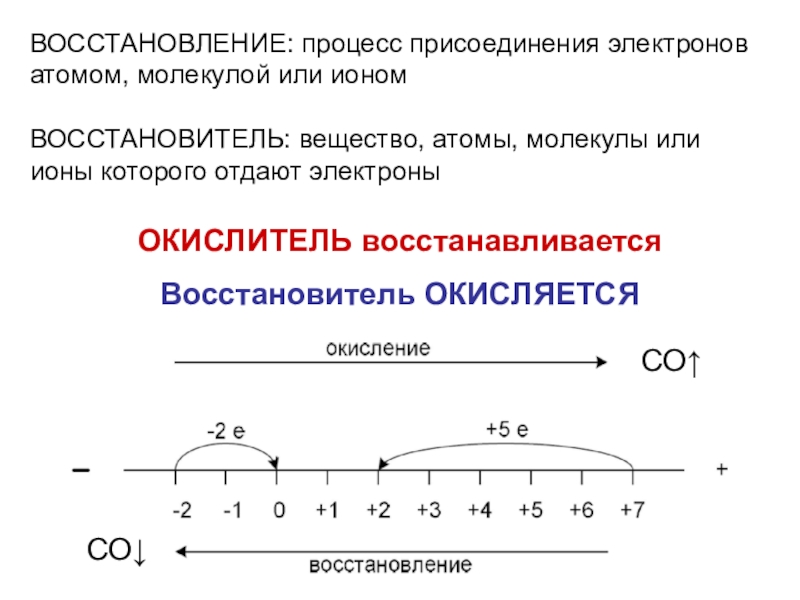
Степень окисления (СО) - определяется как условный заряд атома в
соединении, вычисленный, исходя из предположения, что соединение состоит из ионов.СТЕПЕНЬ ОКИСЛЕНИЯ
1. Степень окисления элемента в простом веществе, например, в
металле или в простой молекуле равна нулю (Н2, N2, O3)
2. Некоторые элементы имеют постоянную степень окисления:
– элементы I, II-ой групп, главных подгрупп периодической системы
Менделеева, соответственно для I: +1, для II: +2,
– фтор F–1,
– алюминий Al+3,
– цинк Zn+2










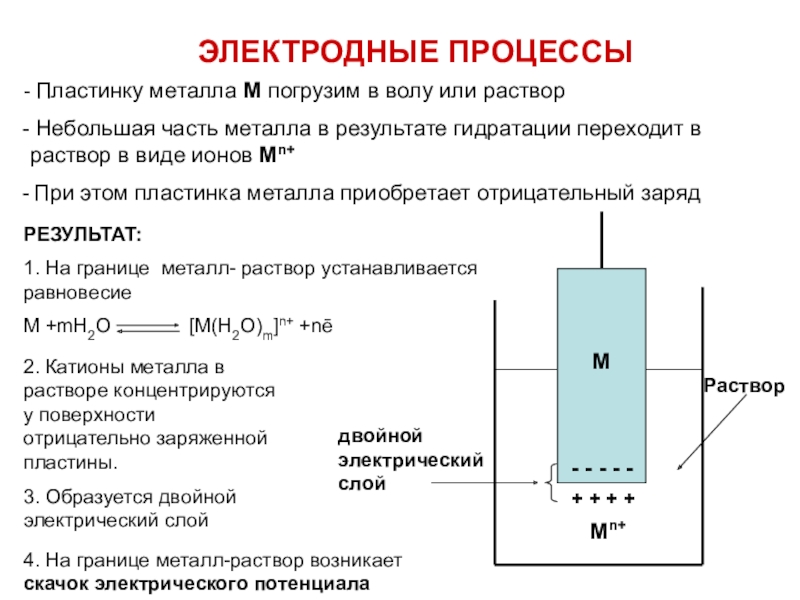
![ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ Скачок потенциала на границе металл-раствор электролита называют ЭЛЕКТРОДНЫМ ПОТЕНЦИАЛОМ - Е Скачок потенциала на границе металл-раствор электролита называют ЭЛЕКТРОДНЫМ ПОТЕНЦИАЛОМ - Е [В]Величина электродного потенциала зависит от :-](/img/tmb/7/607225/663f50bfa70b95493aaa62af07254aac-800x.jpg)