несколько оксидов азота.
+1 +2
+3 +4 +5Солеобразующие: N2O3 NO2 N2O4 N2O5
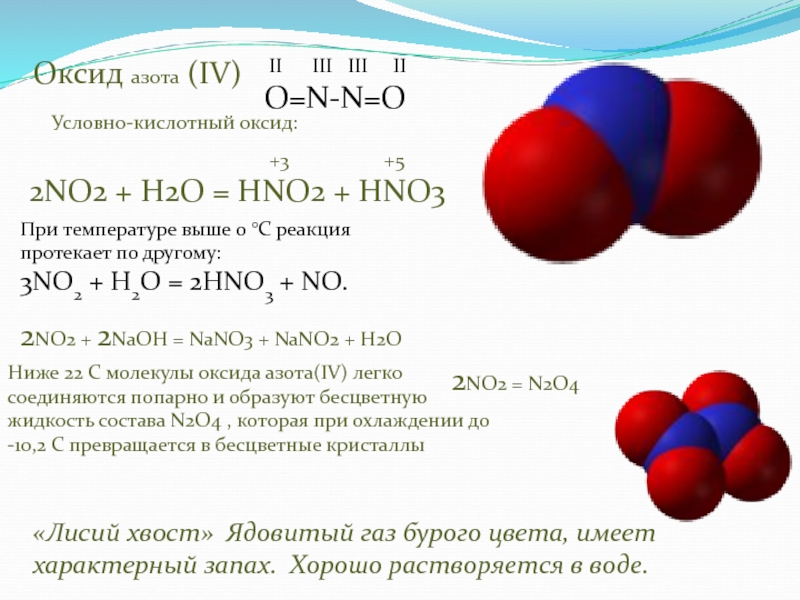
димер
оксида азота(IV)
Несолеобразующие: N2O NO
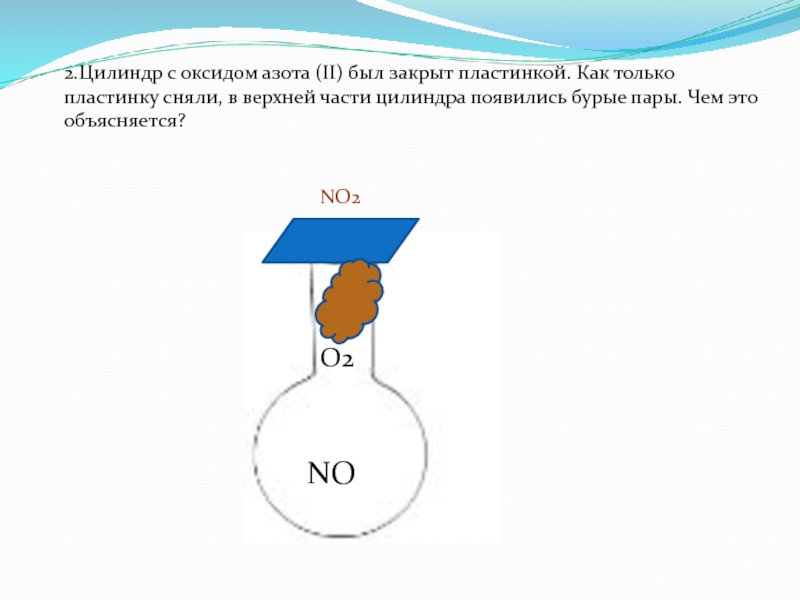
Все оксиды азота, кроме N2O, ядовитые вещества.
N2O5
N2O
NO
N2O3
NO2