Слайд 1Олово и оловоорганические соединения, их свойства и применение
Подготовили студенты группы
ХЕМО-01-18:
Осипова Н.И.
Калиниченко Н.К.
Семяшкина И.А.
Тихонова Д.А.
Кафедра химии и технологии элементоорганических соединений
имени К.А. Андрианова,
МИРЭА - Российский технологический университет,
2019
Слайд 3Sn – олово. Порядковый номер 50, находится в IV группе,
в главной подгруппе, p-элемент. Относительная атомная масса Ar = 119.
Температура плавления 231,91 °C. Олово — пластичный, ковкий и легкоплавкий блестящий металл серебристо-белого цвета.
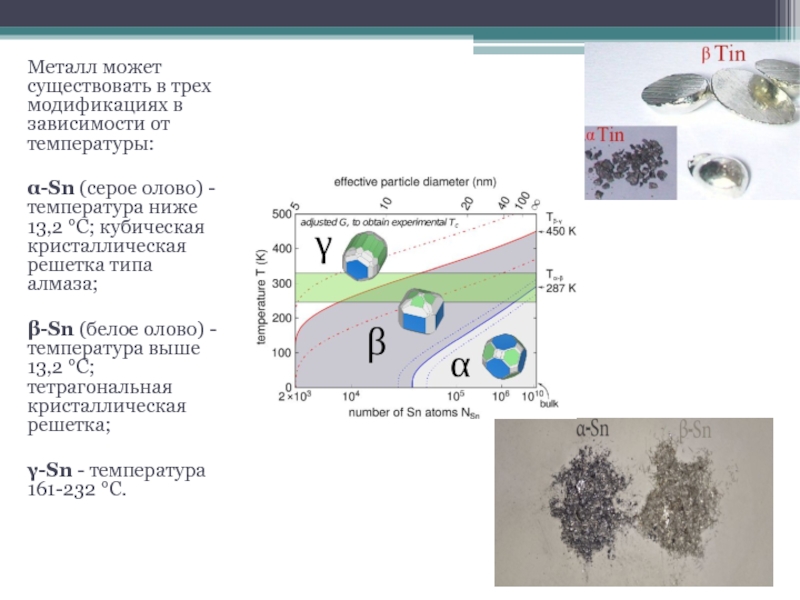
Слайд 4Металл может существовать в трех модификациях в зависимости от температуры:
α-Sn
(серое олово) - температура ниже 13,2 °С; кубическая кристаллическая решетка
типа алмаза;
β-Sn (белое олово) - температура выше 13,2 °С; тетрагональная кристаллическая решетка;
γ-Sn - температура 161-232 °С.
Слайд 5История открытия
Олово было известно человеку уже в IV тысячелетии до
н. э. Этот металл был малодоступен и дорог, поэтому изделия
из него редко встречаются среди римских и греческих древностей. Олово является (наряду с медью) одним из компонентов оловяннистой бронзы, изобретённой в конце или середине III тысячелетия до н. э.
Чистое олово получено не ранее XII в., о нем упоминает в своих трудах Р. Бэкон. До этого олово всегда содержало переменное количество свинца. Хлорид SnCl4 впервые получил А. Либавий в 1597 г. Аллотропию олова и явление «оловянной чумы» объяснил Э. Кохен в 1899 г.
Слайд 7Нахождение в природе
Олово — редкий рассеянный элемент, по распространённости в
земной коре олово занимает 47-е место.
Основной минерал олова —
касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова.
Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn).
Слайд 8Мировые месторождения олова находятся в основном в Китае и Юго-Восточной
Азии — Индонезии, Малайзии и Таиланде. Также есть крупные месторождения
в Южной Америке (Боливии, Перу, Бразилии) и Австралии.
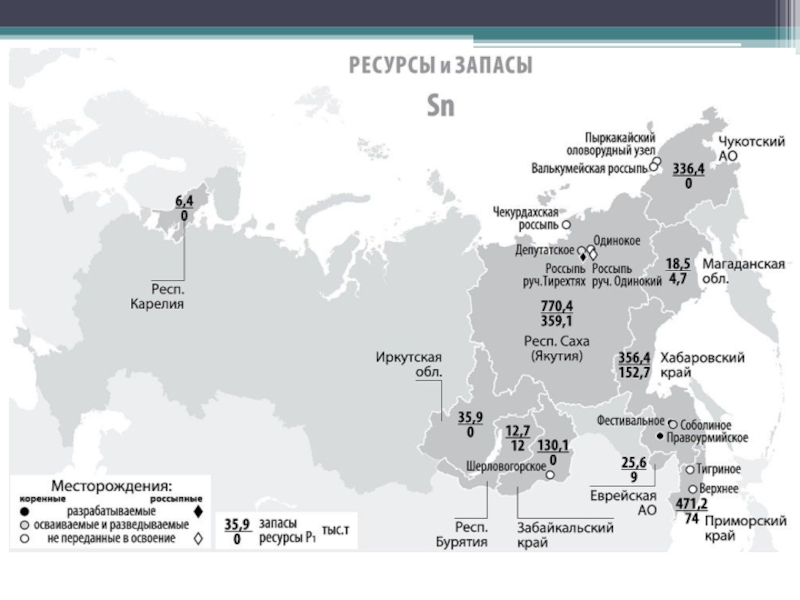
Слайд 9В России запасы оловянных руд расположены в Хабаровском крае в
Чукотском автономном округе (месторождений закрыта в начале 1990-х годов), в
Приморском крае (Кавалеровский район), в Якутии (месторождение Депутатское) и других районах.
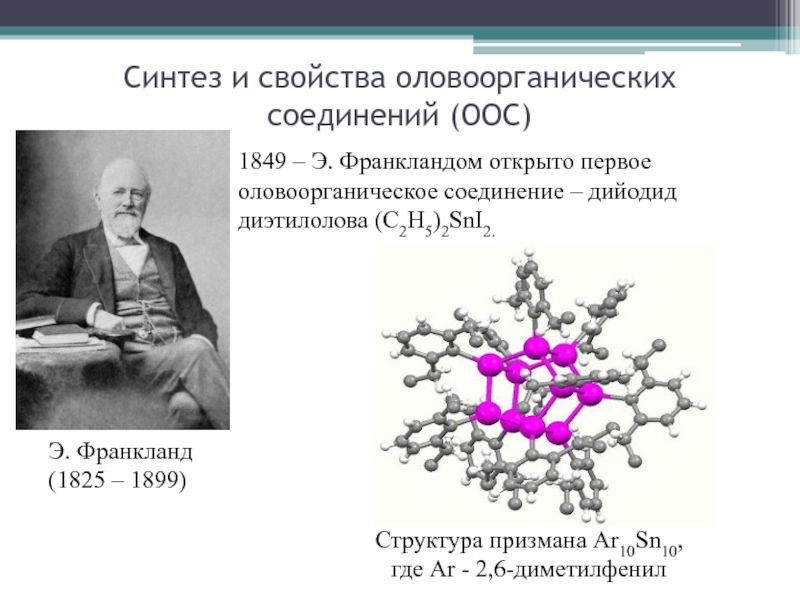
Слайд 17Синтез и свойства оловоорганических соединений (ООС)
Э. Франкланд
(1825 – 1899)
1849 –
Э. Франкландом открыто первое оловоорганическое соединение – дийодид диэтилолова (C2H5)2SnI2.
Структура
призмана Ar10Sn10, где Ar - 2,6-диметилфенил
Слайд 18Синтез и свойства органических соединений
олова (II)
SnCl2 + 2EtLi →
2LiCl + Et2Sn
Ph2SnH2 → Ph2Sn + H2
nSn(CH3)2 → [-Sn(CH3)2-]n
ООС
двухвалентного олова полимеризуются:
Соединения с эмпирической формулой SnR2 несколько нестабильны и существуют в виде колец или полимеров.
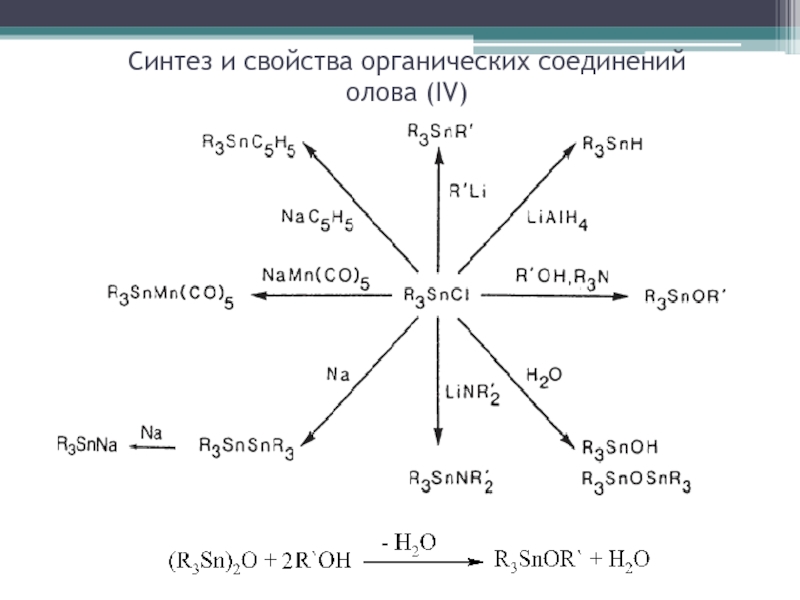
Слайд 19Синтез и свойства органических соединений
олова (IV)
Полнозамещенные соединения R4Sn, а
также соединения типа R3SnX, R2SnX2 и RSnX3, где R -
одинаковые или разные органические радикалы, Х - галоген, водород, кислород или остаток, связанный с атомом олова через гетероатом О, N, S.
Соединения олова типа R4Sn устойчивы по отношению к воздуху, воде и, как правило, термически стабильны. Например, Me4Sn разлагается только выше 400 °C.
Слайд 20Алкилирование тетрахлорида олова реактивом Гриньяра в тетрагидрофуране:
SnCl4 + 4RMgCl →
R4Sn + MgCl2, где R – органический радикал.
4EtMgBr + SnCl4
→ Et4Sn + 4MgClBr
• Основной промышленный метод - через алюминийорганические соединения в присутствии диэтилового эфира:
4R3Al + 3SnCl4 → 3R4Sn + 4AlCl3, где R – органический радикал.
Реакция диспропорционирования соединений олова (реакция Кошечкова):
Синтез и свойства органических соединений
олова (IV)
Слайд 21Синтез и свойства органических соединений
олова (IV)
Прямой синтез алкилгалогенидов олова:
Окислительное
присоединение:
Слайд 22Синтез и свойства органических соединений
олова (IV)
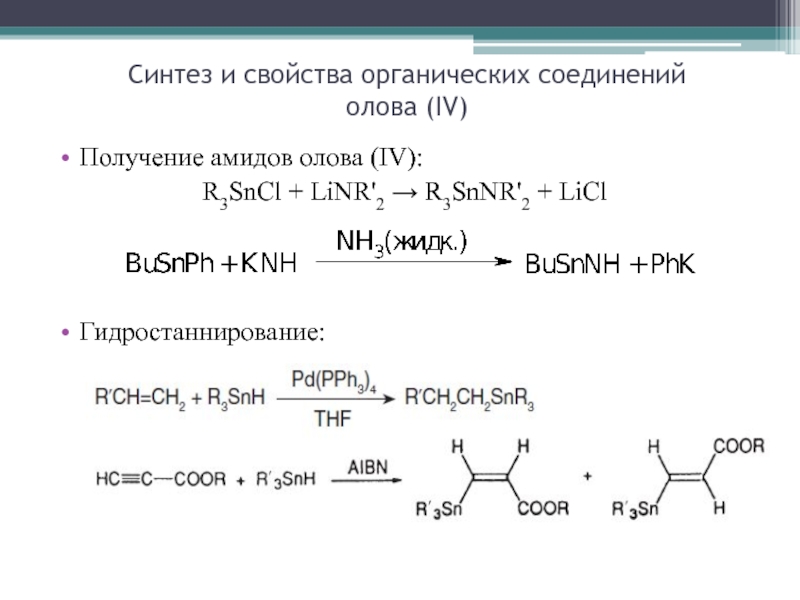
Слайд 23Получение амидов олова (IV):
R3SnCl + LiNR'2 → R3SnNR'2 + LiCl
Гидростаннирование:
Синтез
и свойства органических соединений
олова (IV)
Слайд 24ООС с двумя и тремя -OH группами нестойки:
[R2Sn(OH)2] → [R2SnO]
+ H2O
Связи Sn-R довольно прочные и не расщепляются водой и
кислородом воздуха.
Реакция Стилле (где R – Ar, Alk; Х – галоген):
Синтез и свойства органических соединений
олова (IV)
Слайд 25Применение
Оловоорганические соединения
↗
→
↘
60% - стабилизаторы поливинилхлорида
30% — биоциды
10% - различные специальные области
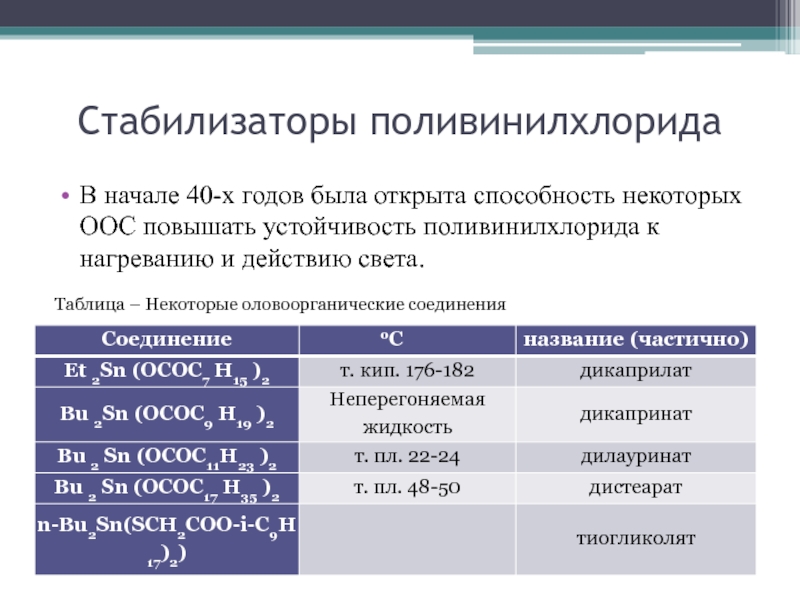
Слайд 27В начале 40-х годов была открыта способность некоторых ООС повышать
устойчивость поливинилхлорида к нагреванию и действию света.
Стабилизаторы поливинилхлорида
Таблица –
Некоторые оловоорганические соединения
Слайд 28n-Bu2Sn(SCH2COO-i-C9H17)2) замедляет отщепление HCl в процессе термической обработки ПВХ при
180–200 °С путем замещения реакционноспособных аллильных атомов хлора на тиогликолевые
группы.
В полученном ПВХ оловоорганические соединения служат УФ-стабилизаторами благодаря своей способности к обрыву цепных радикальных реакций.
Стабилизаторы поливинилхлорида
Слайд 30Применение
Bu3SnOH широко применяется в текстильной и бумажной промышленности как антисептик,
а также для защиты древесины и борьбы с планктоном в
промышленных водоемах.
Соединения типа R3SnX (например, (n-Bu3Sn)2O, Ph3SnOOCCH3, n-Bu3SnOOC(CH2)10CH3) используются в качестве биоцидов для контроля роста бактерий.
(C4H9)3SnOONa - гидрофобизирующий агент для целлюлозы, хлопкового текстиля, бумаги, дерева.


















![Олово и оловоорганические соединения, их свойства и применение ООС с двумя и тремя -OH группами нестойки:[R2Sn(OH)2] → [R2SnO] + ООС с двумя и тремя -OH группами нестойки:[R2Sn(OH)2] → [R2SnO] + H2OСвязи Sn-R довольно прочные и не](/img/thumbs/a0c44709e95182da0d9e5286e5ab466d-800x.jpg)