Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ОБЩЕЙ И БИООРГАНИЧЕСКОЙ
Содержание
- 1. ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ОБЩЕЙ И БИООРГАНИЧЕСКОЙ
- 2. Устойчивость ДС: понятие, виды, факторы Коллоидные
- 3. Устойчивость ДС: понятие, виды, факторы Под
- 4. Устойчивость ДС: понятие, виды, факторы Виды
- 5. Устойчивость ДС: понятие, виды, факторы В
- 6. Устойчивость ДС: понятие, виды, факторы Потеря
- 7. Теории устойчивости ДС ДС, являясь термодинамически
- 8. Теории устойчивости ДСАдсорбционная теория коагуляции Г. Фрейндлиха.
- 9. Теории устойчивости ДС Адсорбционная теория коагуляции
- 10. Теории устойчивости ДС Основные положения современной
- 11. Теории устойчивости ДС
- 12. Теории устойчивости ДС Притяжение частиц обусловлено
- 13. Теории устойчивости ДС Взаимодействие двух частиц
- 14. Теории устойчивости ДС Потенциальные кривые: 1
- 15. Теории устойчивости ДС Анализ результирующей потенциальной
- 16. Теории устойчивости ДСв области средних расстояний на
- 17. Теории устойчивости ДС Частицы ДФ обладают определенной
- 18. Теории устойчивости ДС а - перекрывание диффузных слоев; б - агрегативно устойчивая система; в - коагуляция
- 19. Теории устойчивости ДСВысокий энергетический барьер (ΔUб >>kT)
- 20. Теории устойчивости ДС 3. При
- 21. Теории устойчивости ДССхемы строения пространственной сетки геля:
- 22. Теории устойчивости ДС Таким образом, из
- 23. Теории устойчивости ДСФакторы устойчивости дисперсных систем.
- 24. Теории устойчивости ДСадсорбционно-сольватный - приводит к уменьшению
- 25. Теории устойчивости ДСК кинетическим факторам устойчивости, снижающим
- 26. Теории устойчивости ДС В реальных системах
- 27. Теории устойчивости ДС Рассмотрение действия сразу
- 28. Теории устойчивости ДС
- 29. Теории устойчивости ДС Расклинивающее давление можно
- 30. Теории устойчивости ДСПри рассмотрении действия расклинивающего давления
- 31. Теории устойчивости ДССилы отталкивания определяют положительную составляющую
- 32. Теории устойчивости ДСВывод: устойчивость ДС обеспечивается наличием
- 33. Скачать презентанцию
Устойчивость ДС: понятие, виды, факторы Коллоидные растворы, как и другие виды ДС, - термодинамически неустойчивые системы. Причиной неустойчивости является большая межфазная поверхность. Проблема устойчивости - одна из основных проблем
Слайды и текст этой презентации
Слайд 1ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
КАФЕДРА ОБЩЕЙ И БИООРГАНИЧЕСКОЙ ХИМИИ
Лекция 9. Устойчивость
дисперсных систем
Фрейндлиха. Теория ДЛФО.Слайд 2Устойчивость ДС: понятие, виды, факторы
Коллоидные растворы, как и
другие виды ДС, - термодинамически неустойчивые системы. Причиной неустойчивости является
большая межфазная поверхность.Проблема устойчивости - одна из основных проблем коллоидной химии, так как это проблема «жизни и смерти» ДС.
Практика ставит противоположные задачи: сохранение или разрушение ДС, т.е. сделать систему устойчивой или неустойчивой. Устойчивыми должны быть лекарственные препараты в форме аэрозолей, мазей, паст, суспензий. При очистки воды от взвешенных частиц, наоборот требуется разрушение ДС.
Слайд 3Устойчивость ДС: понятие, виды, факторы
Под устойчивостью ДС понимают
постоянство во времени ее состояния и основных свойств:
дисперсности;
равномерного распределения частиц
ДФ в объеме ДСр;характера взаимодействия между частицами.
Слайд 4Устойчивость ДС: понятие, виды, факторы
Виды устойчивости ДС (М.П.
Песков):
Кинетическая (седиментационная) устойчивость позволяет системе сохранять равномерное распределение частиц в
объеме, т. е. противостоять действию силы тяжести и процессам оседания или всплывания частиц. Основными условиями этой устойчивости являются высокая дисперсность и участие частиц ДФ в броуновском движении.Термодинамическая (агрегативная) устойчивость дисперсных систем -это способность противостоять агрегации частиц.
Слайд 5Устойчивость ДС: понятие, виды, факторы
В этом отношении ДС
делят на два класса:
термодинамически устойчивые, или лиофильные коллоиды, которые самопроизвольно
диспергируются и существуют без дополнительной стабилизации (мицеллярные растворы ПАВ, растворы ВМВ и т. п.). При образовании этих систем свободная энергия Гиббса системы уменьшается (ΔG < 0);термодинамически неустойчивые, или лиофобные, системы (золи, суспензии, эмульсии, пены, аэрозоли). Для них ΔG > 0.
Слайд 6Устойчивость ДС: понятие, виды, факторы
Потеря коллоидными системами агрегативной
устойчивости приводит к коагуляции ДС.
Коагуляция – процесс слипания
частиц, образования более крупных агрегатов, в результате чего система теряет седиментационную устойчивость, происходит разделение фаз и ДС разрушается.В системах с жидкой ДФ процесс слияния частиц называется коалесценцией.
Слайд 7Теории устойчивости ДС
ДС, являясь термодинамически неустойчивыми, вместе с
тем, обладают способностью сохранять в течении определенного времени свое состояние
и свойства неизменными.Этот факт объясняют различные теории устойчивости ДС.
Слайд 8Теории устойчивости ДС
Адсорбционная теория коагуляции
Г. Фрейндлиха.
Эта
теория исходит из положения, что при коагуляции золей ионы-коагуляторы адсорбируются
коллоидными частицами в соответствии с изотермой адсорбции а=КС1/n. При этом Фрейндлих считал, что коагуляция наступает при одинаковом понижении ζ-потенциала, которое достигается при адсорбции эквивалентных количеств различных ионов.Слайд 9Теории устойчивости ДС
Адсорбционная теория коагуляции объясняла снижение ζ
-потенциала до критического значения уменьшением числа зарядов потенциалобразующих ионов вследствие
нейтрализации их адсорбирующимися ионами-коагуляторами.Однако дальнейшие исследования показали, что эта теория имеет ограниченное применение, так как далеко не всегда наблюдались эквивалентность адсорбции разных электролитов и совпадение изотерм адсорбции различных ионов. Кроме того, во многих случаях коагуляция связана с изменениями лишь в диффузном слое, а заряд потенциалобразующих ионов остается постоянным.
Слайд 10Теории устойчивости ДС
Основные положения современной теории устойчивости были
изложены в работах Дерягина и Ландау в 1937-1941 гг. Несколько
позднее и независимо от них к аналогичным выводам пришли голландские физико-химики Фервей и Овербек. В честь этих ученых она названа теорией ДЛФО.Согласно современной теории ДЛФО между частицами ДФ действуют силы молекулярного притяжения и силы отталкивания. Баланс этих сил (энергий) определяет результат встречи двух частиц ДФ.
Слайд 12Теории устойчивости ДС
Притяжение частиц обусловлено силами Ван-дер-Ваальса и
изменяется обратно пропорционально квадрату расстояния между частицами.
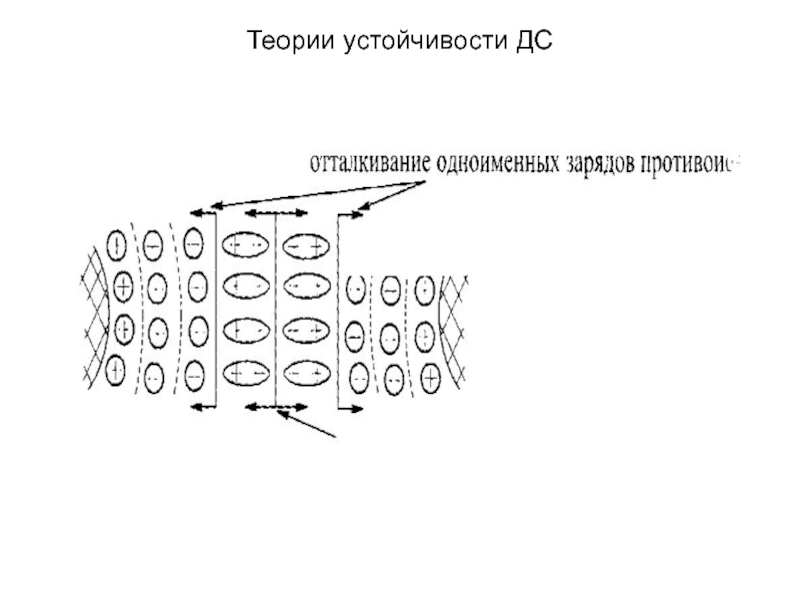
Силы отталкивания,
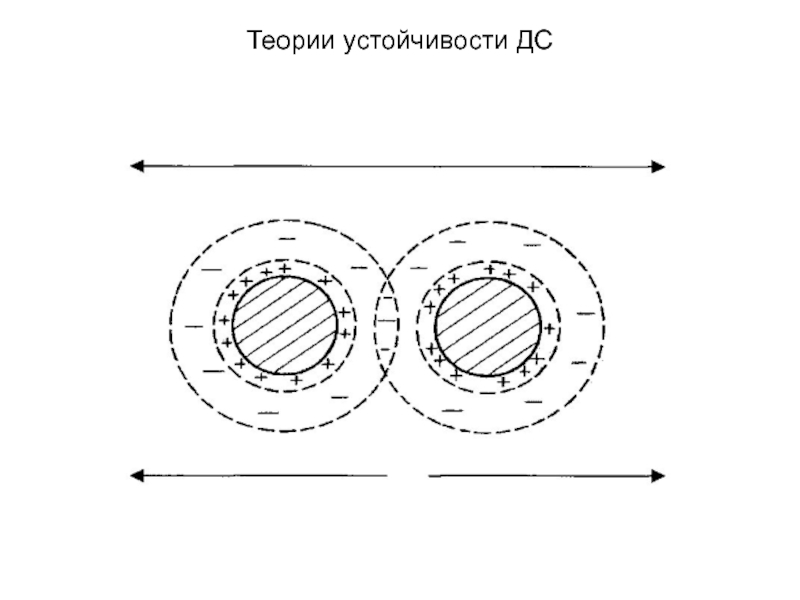
согласно теории ДЛФО, носят электростатический характер. Они проявляются, если две одноименно заряженные частицы сближаются настолько, что их диффузные слои взаимно перекрываются. Энергия отталкивания убывает с расстоянием. Слайд 13Теории устойчивости ДС
Взаимодействие двух частиц дисперсной фазы принято
характеризовать с помощью потенциальных кривых - зависимостей суммарной энергии взаимодействия
частиц от расстояния.Слайд 14Теории устойчивости ДС
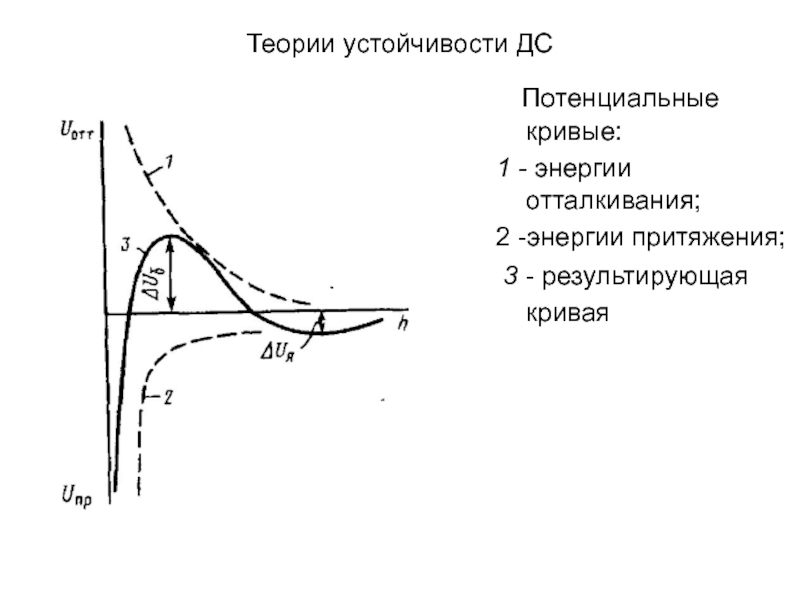
Потенциальные кривые:
1 - энергии отталкивания;
2 -энергии притяжения;
3 - результирующая кривая
Слайд 15Теории устойчивости ДС
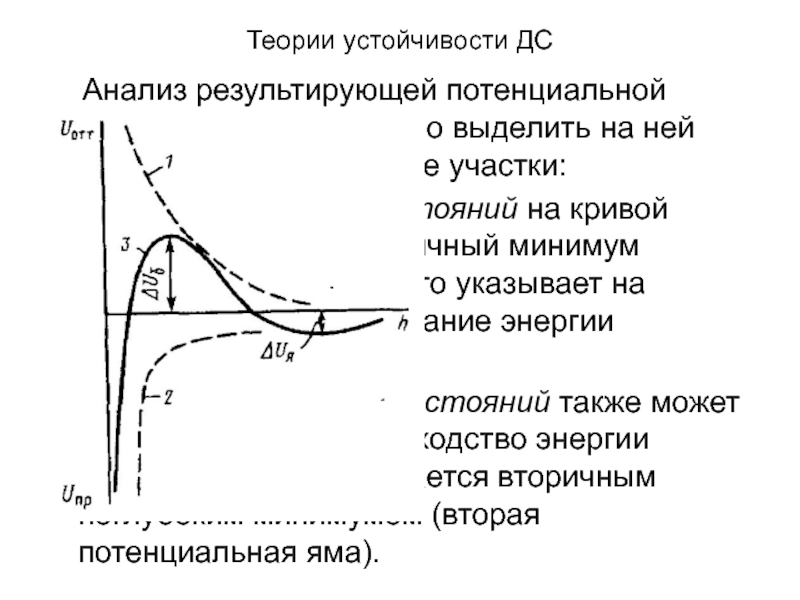
Анализ результирующей потенциальной кривой. На кривой
можно выделить на ней следующие характерные участки:
в области малых расстояний
на кривой имеется глубокий первичный минимум (потенциальная яма), что указывает на значительное преобладание энергии притяжения.в области больших расстояний также может быть некоторое превосходство энергии притяжения, что отражается вторичным неглубоким минимумом (вторая потенциальная яма).
Слайд 16Теории устойчивости ДС
в области средних расстояний на кривой имеется максимум,
и если он расположен над осью абсцисс, то появляется потенциальный
энергетический барьер сил отталкивания ΔUб. Величина ΔUб, тесно связана с агрегативной устойчивостью системы.Слайд 17Теории устойчивости ДС
Частицы ДФ обладают определенной кинетической энергией (кТ), за
счет которой они могут сближаться на то или другое расстояние.
В зависимости от высоты энергетического барьера и глубины потенциальных ям возможны следующие варианты поведения частиц при сближении.Слайд 18Теории устойчивости ДС
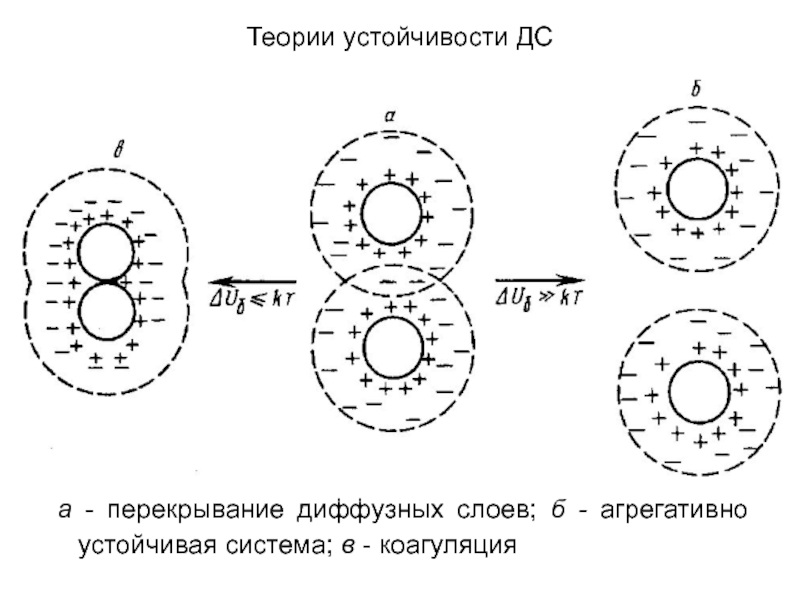
а - перекрывание диффузных слоев; б -
агрегативно устойчивая система; в - коагуляция
Слайд 19Теории устойчивости ДС
Высокий энергетический барьер (ΔUб >>kT) и отсутствие или
неглубокий вторичный минимум (ΔUя≤kT) означают, что частицы не могут преодолеть
барьер и расходятся без взаимодействия. В этом случае система агрегативно устойчива (рис., б).При малой высоте барьера и неглубоком вторичном минимуме, когда броуновское движение может сблизить частицы до таких малых расстояний, что они попадут в первую потенциальную яму, при этом частицы вступают в ближнее взаимодействие, т. е. непосредственно соприкасаются, и происходит элементарный акт коагуляции (рис., в).
Слайд 20Теории устойчивости ДС
3. При умеренно глубоком вторичном
минимуме (ΔUя≤kT) и наличии заметного энергетического барьера (ΔUб >kT) имеет
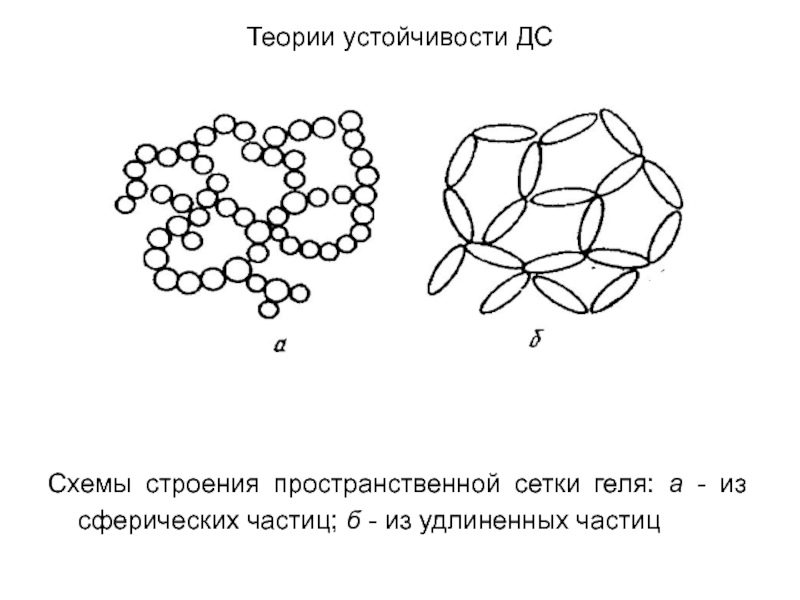
место дальнее взаимодействие двух частиц, при котором частицы не могут разойтись (их удерживают силы притяжения) и не могут приблизиться вплотную, так как этому препятствуют силы отталкивания. При таких условиях образуются структурированные системы - гели, в которых, однако, сохраняются прослойки среды между частицами. Образующиеся гели представляют собой периодические коллоидные структуры, имеющие квазикристаллическое строение.Слайд 21Теории устойчивости ДС
Схемы строения пространственной сетки геля: а - из
сферических частиц; б - из удлиненных частиц
Слайд 22Теории устойчивости ДС
Таким образом, из рассмотренных возможных случаев
взаимодействия частиц следует, что ДС агрегативно устойчива только при высоком
энергетическом барьере сил отталкивания. Поэтому все те факторы, которые снижают величину энергетического барьера ΔUб, неизбежно понижают агрегативную устойчивость системы.В тех случаях, когда велика роль адсорбционно-сольватного фактора устойчивости, проявляется приближенность теории ДЛФО, поскольку она не учитывает роли специфической адсорбции.
Слайд 23Теории устойчивости ДС
Факторы устойчивости дисперсных систем.
К термодинамическим факторам
относятся следующие:
электростатический - способствует созданию электростатических сил отталкивания, возрастающих при
увеличении потенциала поверхности частиц Δφ и особенно электрокинетического потенциала ζ.Слайд 24Теории устойчивости ДС
адсорбционно-сольватный - приводит к уменьшению межфазного натяжения и
снижению энергии Гиббса поверхности раздела;
энтропийный - является дополнительным к двум
первым факторам и действует в высокодисперсных системах, частицы ДФ которых участвуют в броуновском движении; способствует равномерному распределению частиц по объему системы.Слайд 25Теории устойчивости ДС
К кинетическим факторам устойчивости, снижающим скорость агрегации частиц
ДФ, относятся:
структурно-механический - связан с образованием на поверхности частиц защитных
слоев (пленок), обладающих упругостью и механической прочностью, стойких к разрушению;гидродинамический - снижает скорость агрегации вследствие изменения вязкости среды, плотности ДФ и ДСр.
Слайд 26Теории устойчивости ДС
В реальных системах устойчивость ДС обычно
обусловливается одновременным действием нескольких факторов.
При этом основную
роль играют два фактора агрегативной устойчивости: электростатический барьер, создаваемый силами отталкивания, и адсорбционно-сольватный барьер, окружающий частицу и механически препятствующий ее сближению с другими частицами.Слайд 27Теории устойчивости ДС
Рассмотрение действия сразу нескольких факторов устойчивости
привело к представлению о «расклинивающем давлении» (Дерягин).
Расклинивающее давление возникает при
сближении частиц, когда между ними остаются тонкие пленки ДСр. Его можно рассматривать как избыточное давление в тонкой пленке по сравнению с гидростатическим давлением в той фазе, из которой она образовалась, действующее со стороны прослойки на ограничивающие её поверхности и стремящееся раздвинуть их. Слайд 29Теории устойчивости ДС
Расклинивающее давление можно описать формулой П
= р – ро, где П – расклинивающее давление, р
и ро – давление в пленке и гидростатическое давление в окружающей пленку фазе.При уменьшении толщины пленки поверхностные слои, ограничивающие её, начинают перекрываться, вследствие чего возникает давление, обусловленное взаимодействием сближающихся фаз и межфазных слоев.
Слайд 30Теории устойчивости ДС
При рассмотрении действия расклинивающего давления учитываются как силы
отталкивания, так и силы притяжения, проявляющиеся между сближающимися поверхностями.
Силы притяжения
определяют отрицательную составляющую расклинивающего давления. Это силы притяжения между атомами и молекулами частиц, силы Ван-дер-Ваальса.Слайд 31Теории устойчивости ДС
Силы отталкивания определяют положительную составляющую расклинивающего давления, они
включают в себя:
а) силы электростатического отталкивания, возникающие при перекрывании
диффузных слоев частиц; б) структурную составляющую, обусловленную тем, что под влиянием заряженных поверхностей частиц фазы происходит изменение структуры воды в слоях, прилегающих к этим поверхностям. Структурированные поверхностные слои приобретают упругие свойства, препятствующие дальнейшему утоньшению пленки.
Слайд 32Теории устойчивости ДС
Вывод: устойчивость ДС обеспечивается наличием в них помимо
двух фаз еще и третьего компонента – электролита, ПАВ или
ВМВ. Все эти вещества называются стабилизаторами.В биологических системах стабилизаторами являются белки, полисахариды, соли желчных кислот и др. биологически активные вещества.