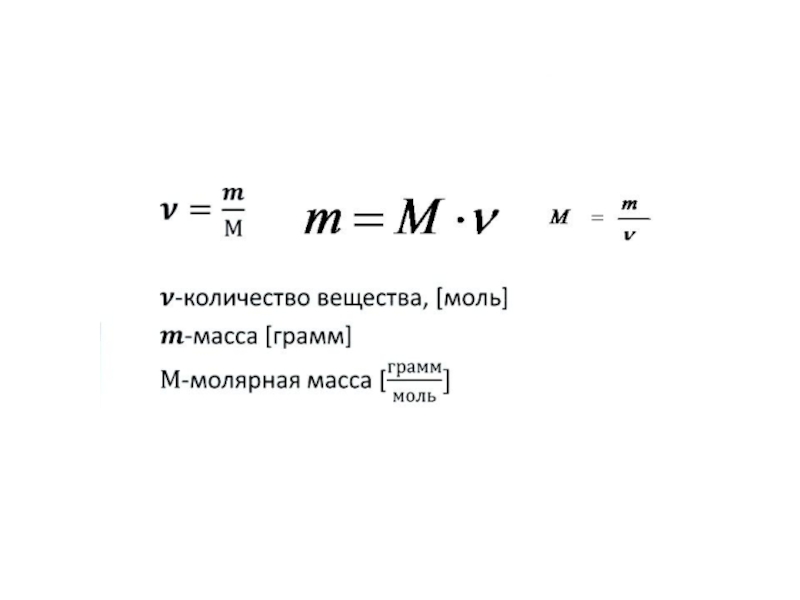Слайд 1Основные понятия и законы химии
Слайд 2Химия - наука о веществах, их свойствах, взаимных превращениях, и
процессах, их сопровождающих
Химия - наука о природе, об изменениях, происходящих
в природе
Химия - фундаментальная наука об одной из основных форм движения материи - химической
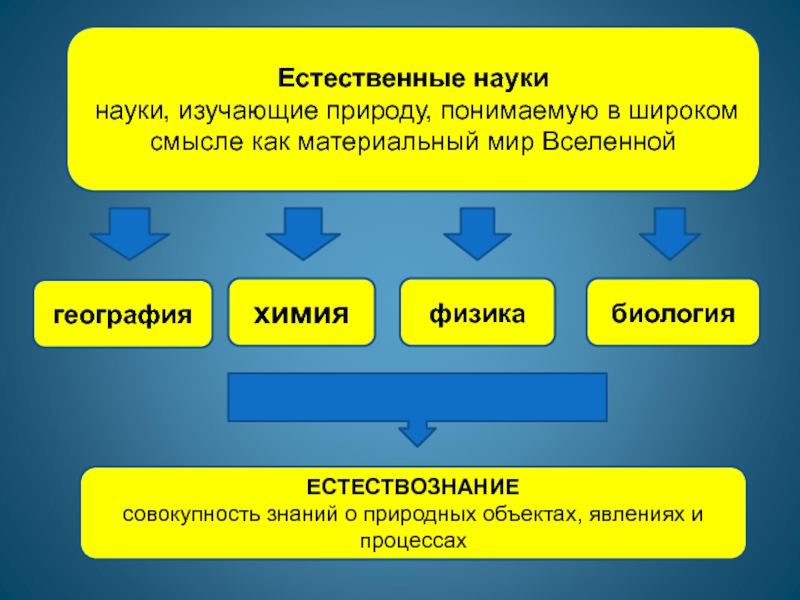
Слайд 3Естественные науки
науки, изучающие природу, понимаемую в широком смысле
как материальный мир Вселенной
физика
химия
география
биология
ЕСТЕСТВОЗНАНИЕ
совокупность знаний о природных объектах, явлениях
и процессах
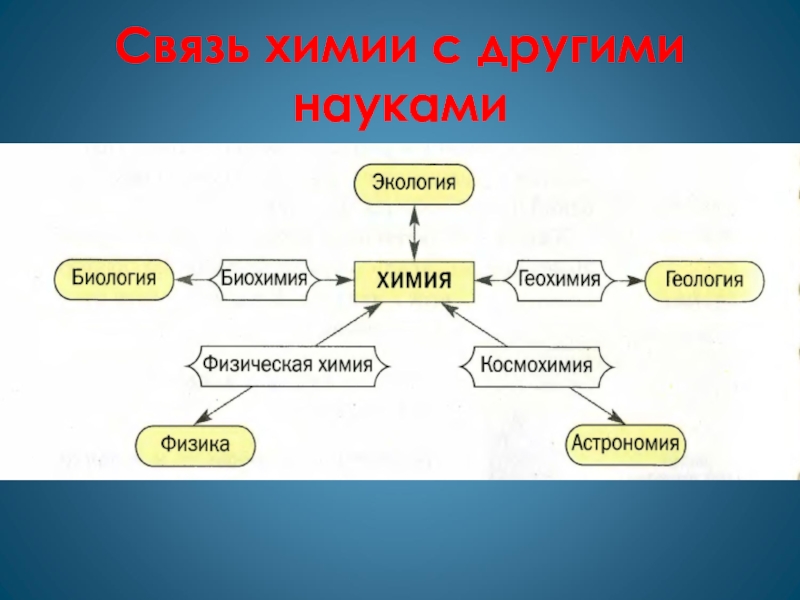
Слайд 4Связь химии с другими науками
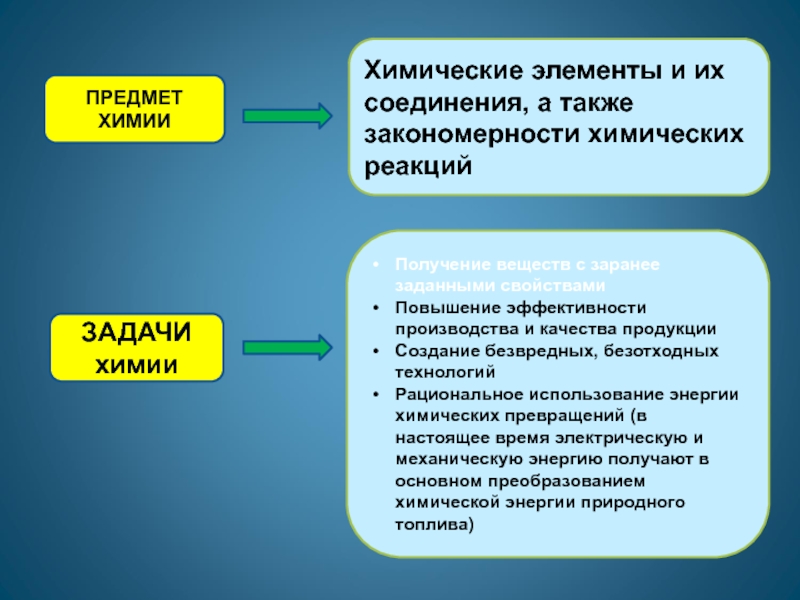
Слайд 5Химические элементы и их соединения, а также закономерности химических реакций
ПРЕДМЕТ
ХИМИИ
Получение веществ с заранее заданными свойствами
Повышение эффективности производства и качества
продукции
Создание безвредных, безотходных технологий
Рациональное использование энергии химических превращений (в настоящее время электрическую и механическую энергию получают в основном преобразованием химической энергии природного топлива)
ЗАДАЧИ химии
Слайд 6Вещество - то, из чего состоят физические тела.
Вещество состоит
из элементарных частиц (электронов, протонов, нейтронов и др.) и характеризуется
определенными физическими свойствами (температура плавления, температура кипения, вязкость, плотность, растворимость, диэлектрическая проницаемость, теплоёмкость, теплопроводность, электропроводность, абсорбция, цвет, концентрация, эмиссия, текучесть, индуктивность, радиоактивность).
Вещества можно различить по их агрегатному состоянию (твёрдые, жидкие, газообразные)
Слайд 7Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
Атом - наименьшая частица
химического элемента, сохраняющая все его химические свойства.
Химический элемент - вид атомов,
характеризующийся определенными зарядами ядер и строением электронных оболочек
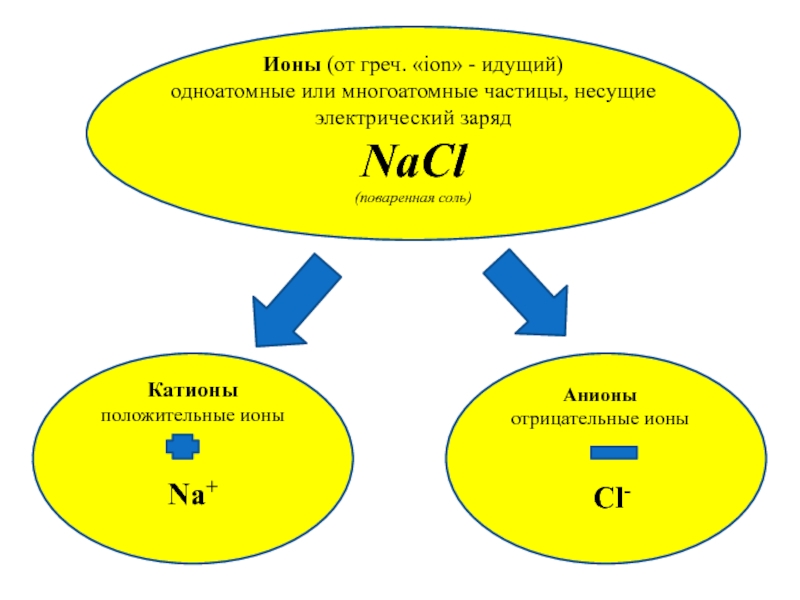
Слайд 8Ионы (от греч. «ion» - идущий)
одноатомные или многоатомные частицы,
несущие электрический заряд
NaCl
(поваренная соль)
Катионы
положительные ионы
Na+
Анионы
отрицательные
ионы
Cl-
Слайд 9Относительная атомная масса (Аг) - масса одного атома, выраженная в атомных
единицах массы (а.е.м.). Показывает, во сколько раз атом данного элемента
тяжелее атомной единицы массы (1,67 • 10-27кг).
Атомные массы каждого элемента содержатся в Периодической таблице химических элементов Д.И. Менделеева.
Относительная молекулярная масса (Мг) - масса одной молекулы вещества, выраженная в атомных единицах массы (а.е.м.). Показывает, во сколько раз молекула данного вещества тяжелее атомной единицы массы (1,67 • 10-27кг)
Слайд 10Валентность (от лат. «valentia» - сила) - способность атома присоединять или замещать определенное
число других атомов или атомных групп с образованием химической связи.
Обозначается римскими цифрами.
У металлов главных групп Периодической системы валентность равна номеру группы.
У неметаллов высшая валентность элемента равна номеру его группы в Периодической системе Д.И. Менделеева. Низшая валентность находится как разница между числом 8 и номером группы, в которой расположен данный элемент.
!Валентность водорода всегда принимают за 1.
!Кислород всегда проявляет в своих соединениях валентность 2.
!Валентность алюминия всегда равна 3
Слайд 11Степень окисления (с.о.) - условный заряд атома данного элемента в
соединении, вычисленный, исходя из предположения, что все атомы в молекуле
ионизированы, т.е. имеют заряд. Обозначается арабскими цифрами со знаком + или -.
У металлов IA группы Периодической таблицы Д.И. Менделеева степень окисления в соединениях равна +1: Na+1Cl−1, Li+12O−2.
У металлов IIA группы степень окисления всегда равна +2: Mg+2F−12, Ba+2O−2.
Степень окисления алюминия - +3: Al+32S−23.
У фтора степень окисления постоянная и равна -1: H+1F−1, K+1F−1.
Кислород почти всегда имеет степень окисления -2: Na+12O−2, C+4O2−2. Исключения - фторид кислорода и пероксиды: O+2F−12, H+12O−12.
В большинстве соединений степень окисления водорода +1, но в соединениях с металлами она равна -1: H+1Br−1, N−3H+13, Na+1H−1, Ca+2H−12.
У атомов остальных неметаллов максимальное значение степени окисления тоже равно номеру группы. Минимальное значение степени окисления можно определить, если от номера группы отнять 8.
!Степень окисления простого вещества равна нулю.
!Сумма всех степеней окисления в веществе равна нулю.
!В сложных веществах степень окисления атомов металла всегда положительная. Атомы неметаллов имеют как положительные, так и отрицательные степени окисления

Слайд 12Понятие валентности можно считать родственным такой характеристике, как степень окисления.
Тем не менее, обе эти характеристики не тождественны друг другу.
Так,
говоря о степени окисления, подразумевают, что атом в веществе ионной (что важно) природы имеет некий условный заряд. И если валентность - это нейтральная характеристика, то степень окисления может быть отрицательной, положительной или равной нулю.
Для атома одного и того же элемента, в зависимости от элементов, с которыми он образует химическое соединение, валентность и степень окисления могут совпадать (Н2О, СН4 и др.) и различаться (Н2О2, HNO3)
Слайд 13Важнейшей количественной единицей в химии является величина, называемая молем.
Моль -
количество вещества, содержащее столько молекул, атомов, ионов или других структурных
единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
В одном моле любого вещества содержится 6,02×1023 структурных единиц. Число 6,02×1023 называется числом Авогадро (NA).
Масса 1 моль вещества называется молярной массой (М) и выражается в г/моль.
Объём 1 моль вещества называется молярным объёмом (Vm) и выражается в м3/моль
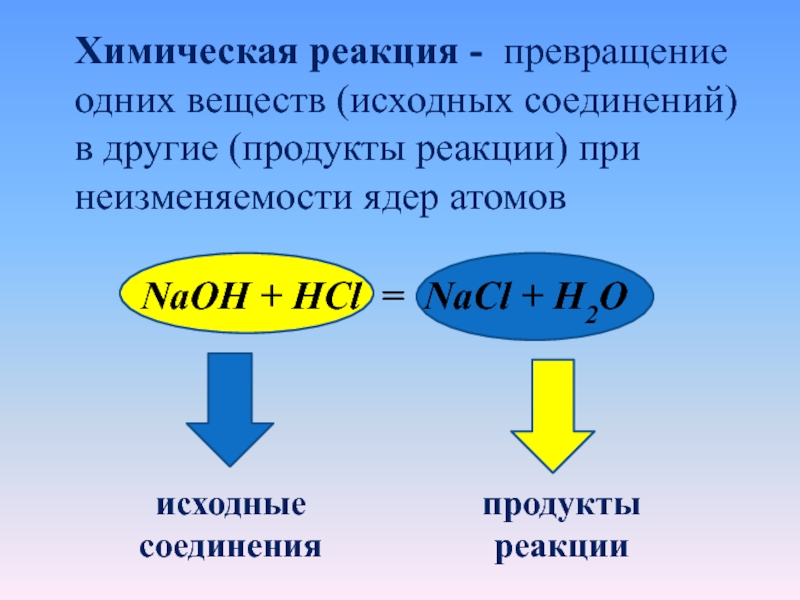
Слайд 15Химическая реакция - превращение одних веществ (исходных соединений) в другие
(продукты реакции) при неизменяемости ядер атомов
NaOH + HCl = NaCl
+ H2O
исходные соединения
продукты реакции
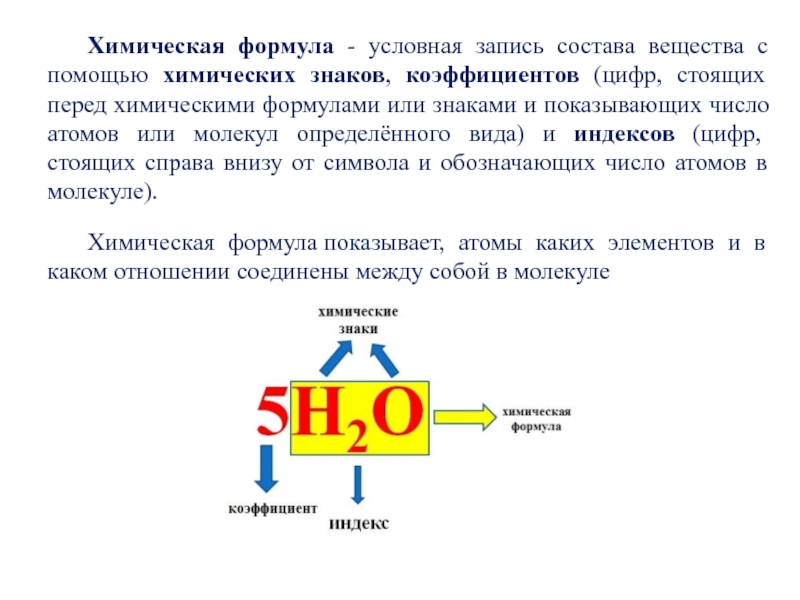
Слайд 16Химическая формула - условная запись состава вещества с помощью химических
знаков, коэффициентов (цифр, стоящих перед химическими формулами или знаками и
показывающих число атомов или молекул определённого вида) и индексов (цифр, стоящих справа внизу от символа и обозначающих число атомов в молекуле).
Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле
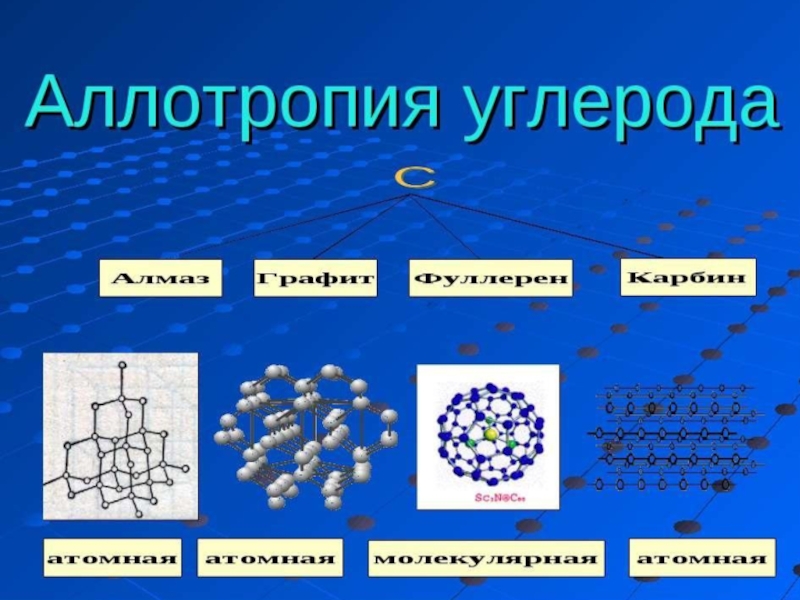
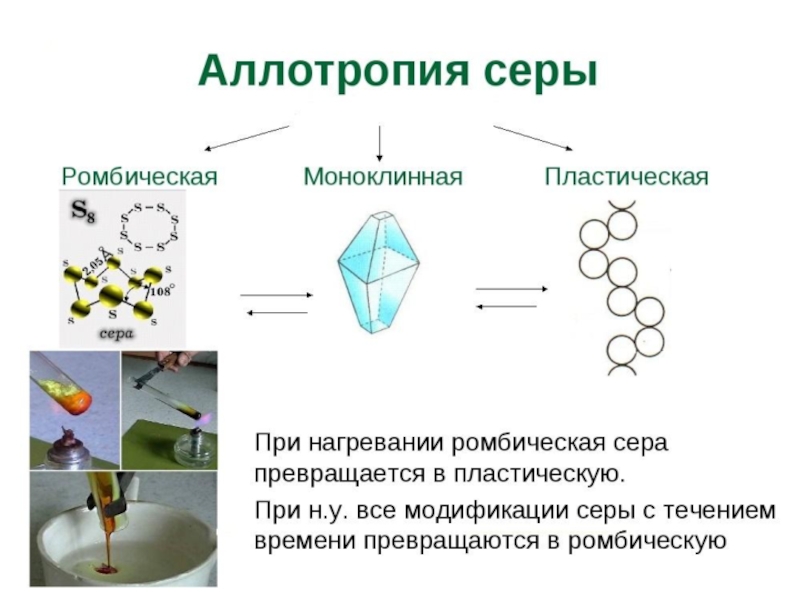
Слайд 17Аллотропия
(от др.греч. αλλος - «другой», τροπος - «поворот, свойство») - существование одного и того же химического элемента в
виде двух и более простых веществ, различных по строению и свойствам
- так называемых аллотропических модификаций или аллотропических форм.
Явление аллотропии обусловлено либо различным составом молекул простого вещества, либо способом размещения атомов или молекул в кристаллической решётке
Слайд 22
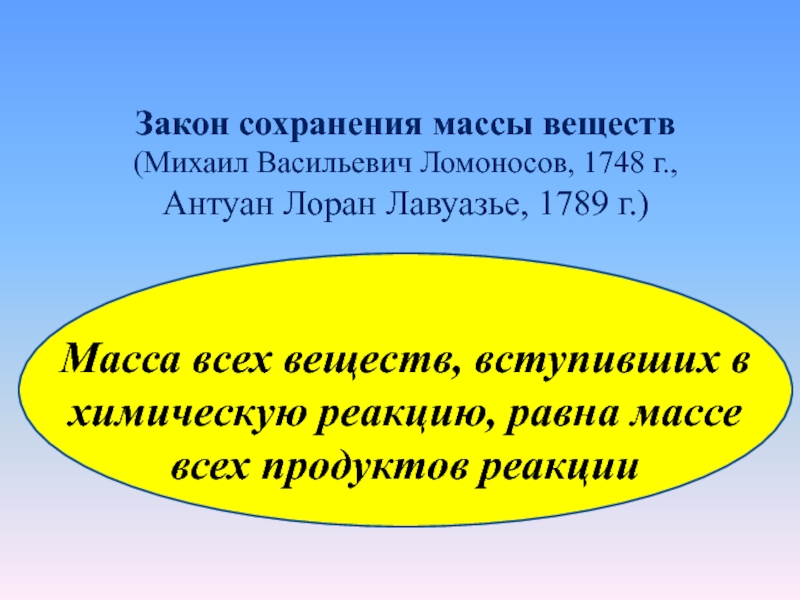
Закон сохранения массы веществ
(Михаил Васильевич Ломоносов, 1748 г.,
Антуан
Лоран Лавуазье, 1789 г.)
Масса всех веществ, вступивших в химическую
реакцию, равна массе всех продуктов реакции
Слайд 23
Закон постоянства состава
(Жозеф Луи Пруст,1808 г.)
Все индивидуальные химические вещества
имеют постоянный качественный и количественный состав и определенное химическое строение,
независимо от способа получения
Из закона постоянства состава следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных массовых соотношениях.
Например, CuS - сульфид меди. m(Cu) : m(S) = Ar(Cu) : Ar(S) = 64 : 32 = 2 : 1
Чтобы получить сульфид меди (CuS) необходимо смешать порошки меди и серы в массовых отношениях 2 : 1.
Если взятые количества исходных веществ не соответствуют их соотношению в химической формуле соединения, одно из них останется в избытке.
Например, если взять 3 г меди и 1 г серы, то после реакции останется 1 г меди, который не вступил в химическую реакцию.
Слайд 24
Закон Авогадро (1811 г.)
В равных объёмах различных газов при одинаковых
условиях (температура, давление и т.д.) содержится одинаковое число молекул
!Закон справедлив
только для газообразных веществ.
Следствия:
1. Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы.
2. При нормальных условиях (0°C = 273°К , 1 атм = 101,3 кПа) 1 моль любого газа занимает объем 22,4 л.