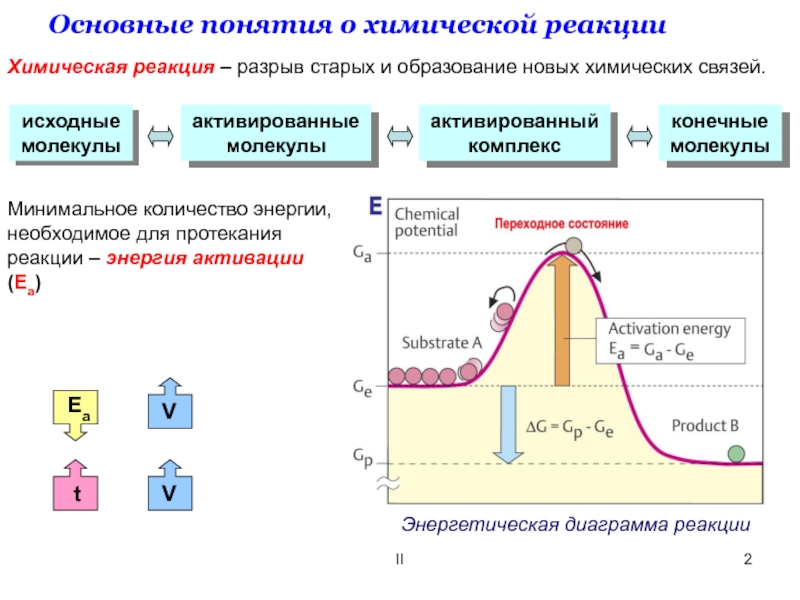
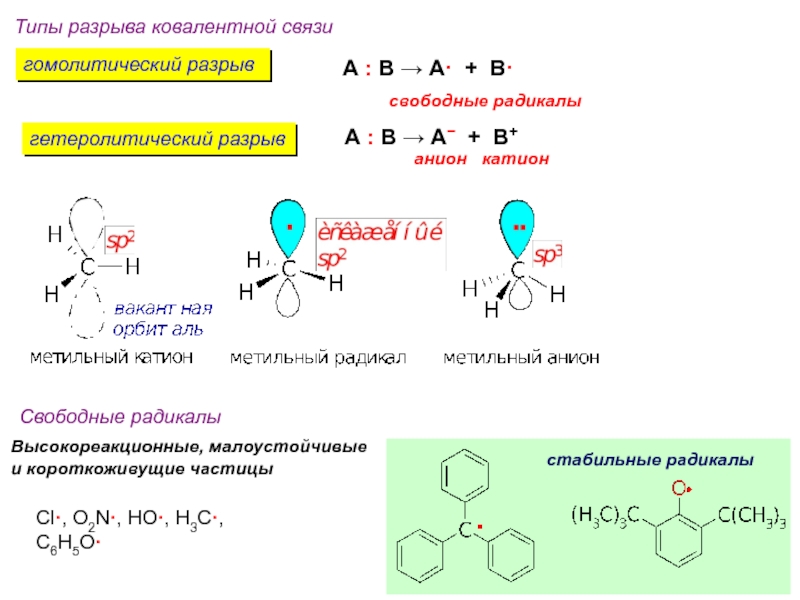
и образование новых химических связей.
исходные
молекулы
активированные
молекулы
активированный
комплекс
конечные
молекулы
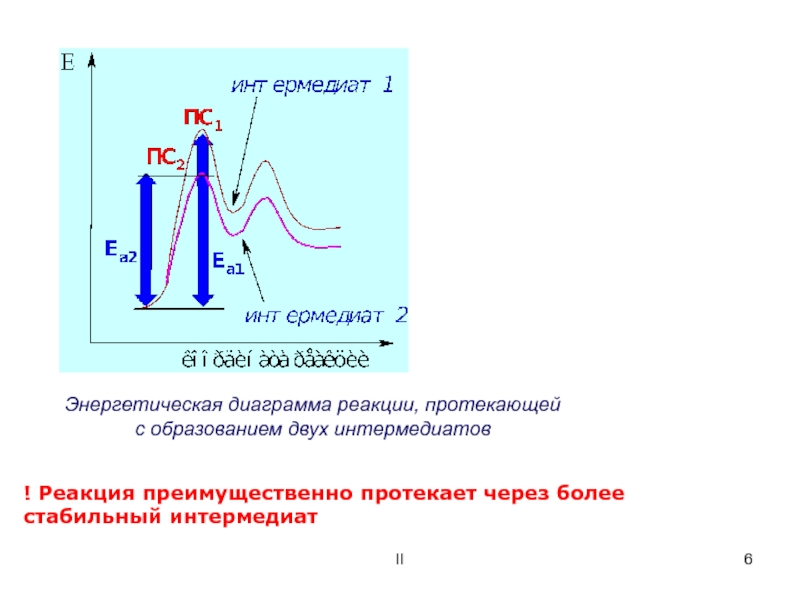
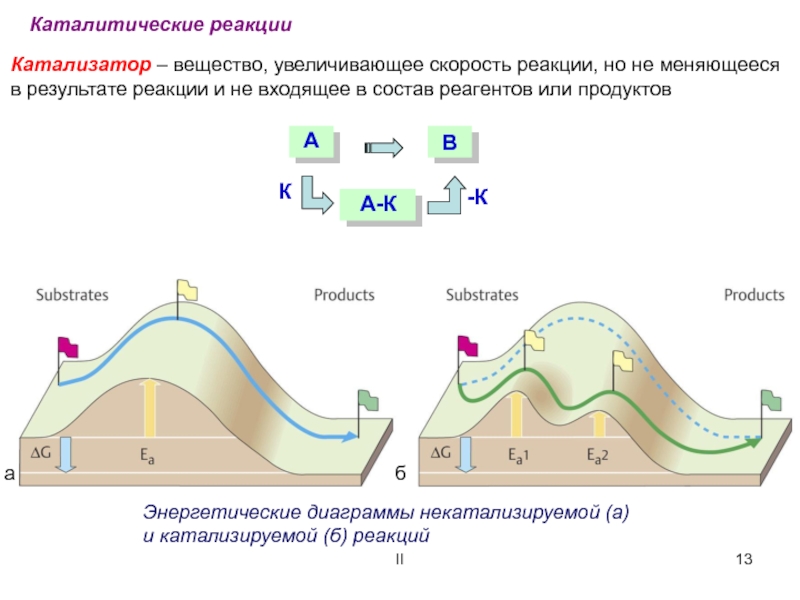
Минимальное количество энергии,
необходимое для протекания
реакции – энергия активации (Еа)
Ea
V
t
V
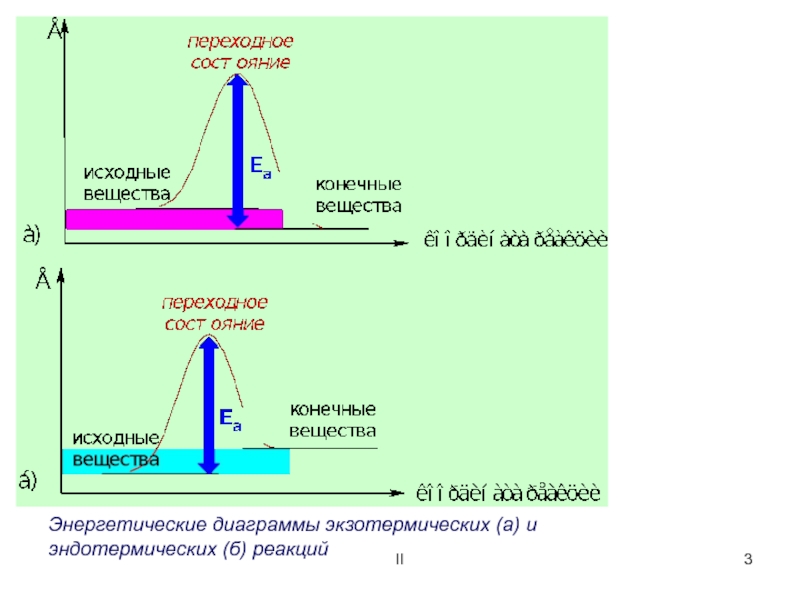
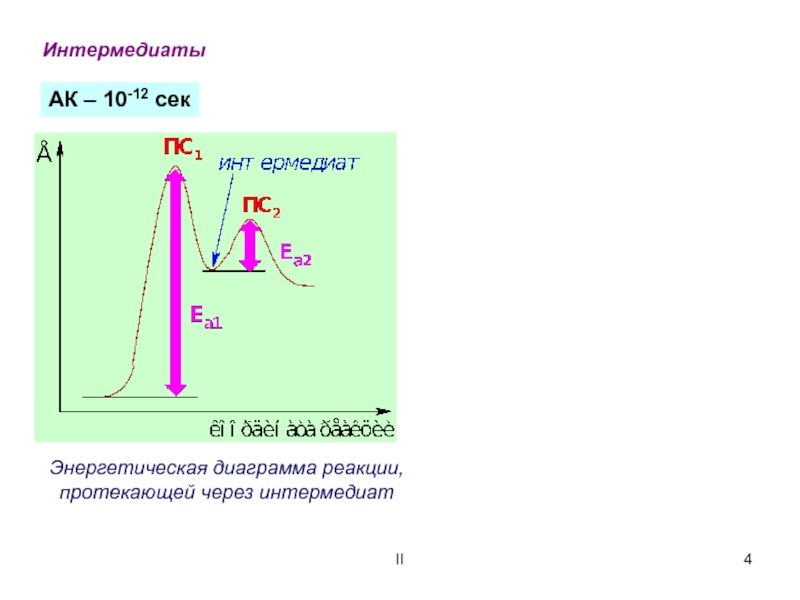
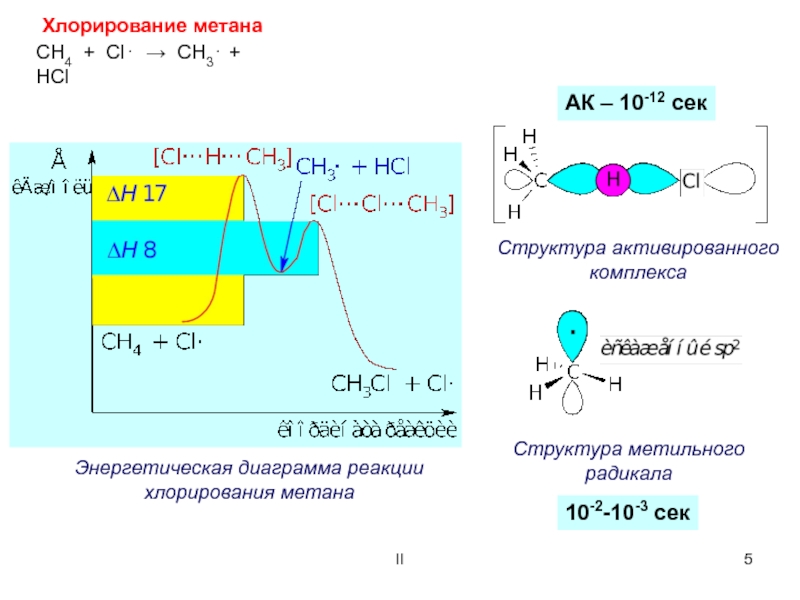
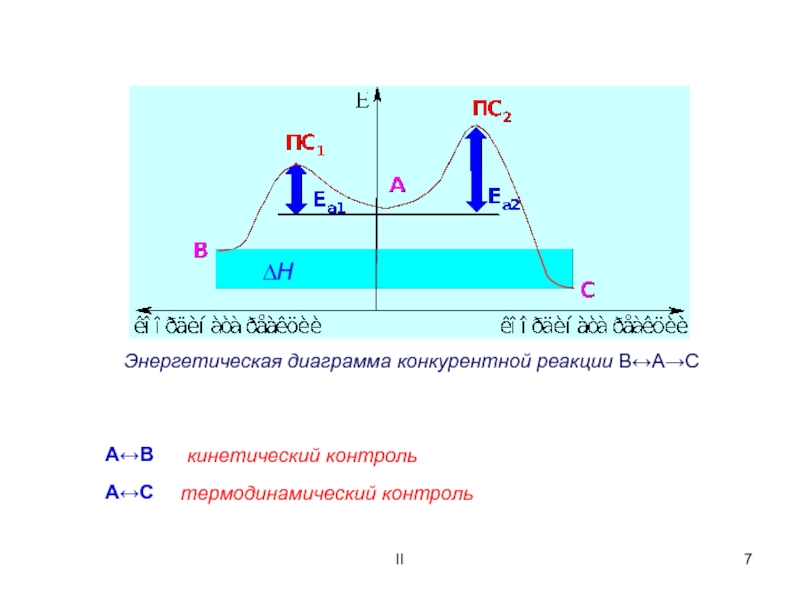
Энергетическая диаграмма реакции



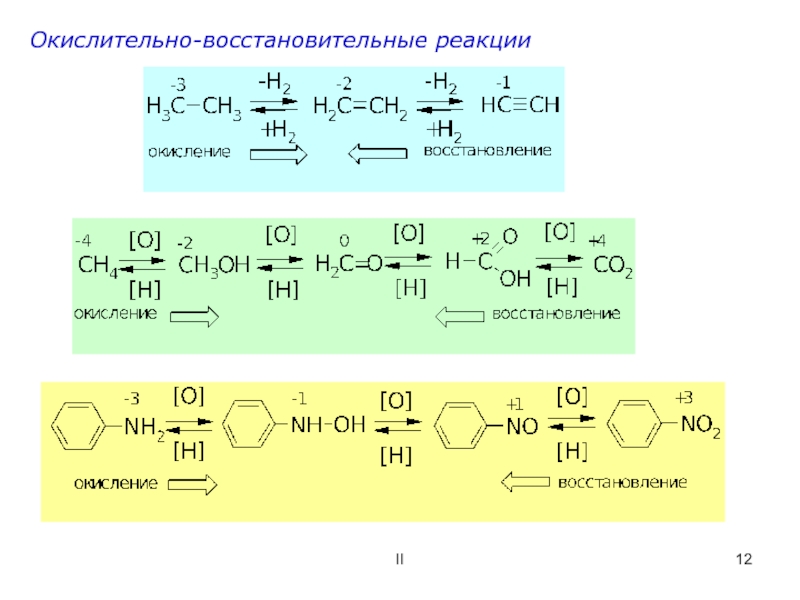
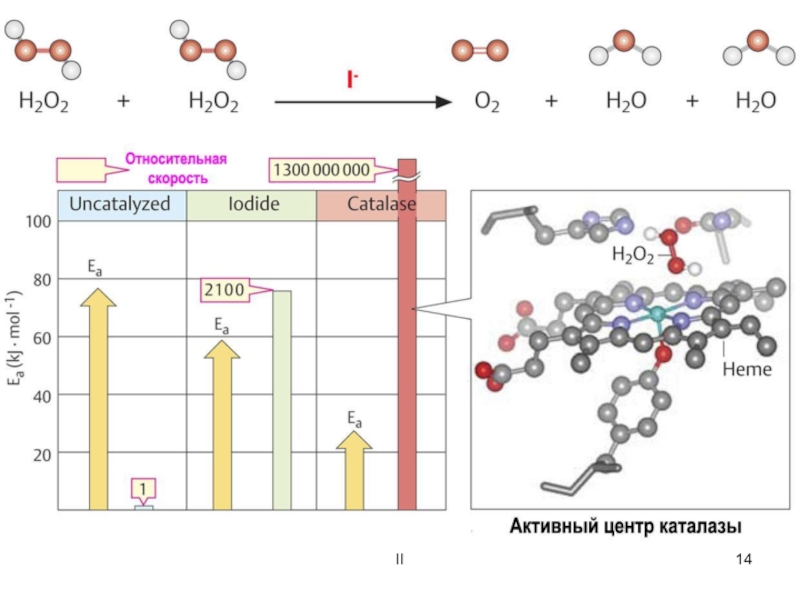
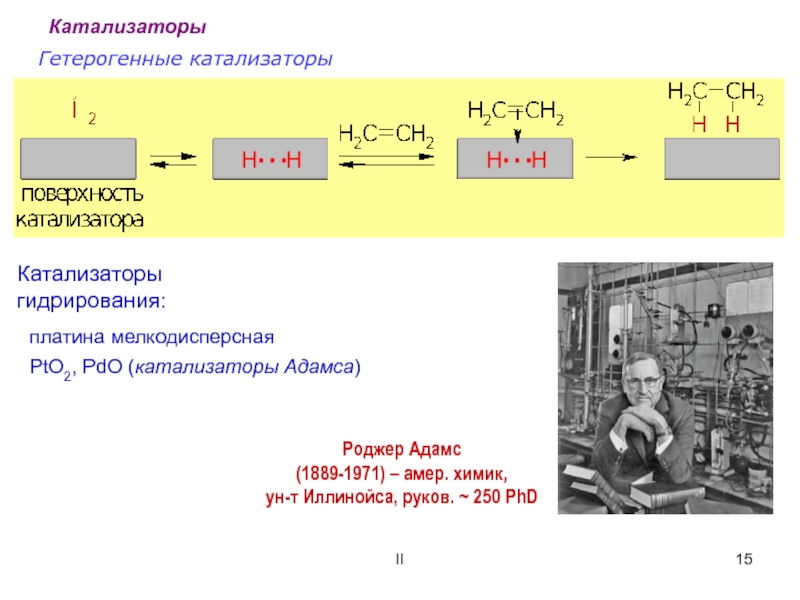

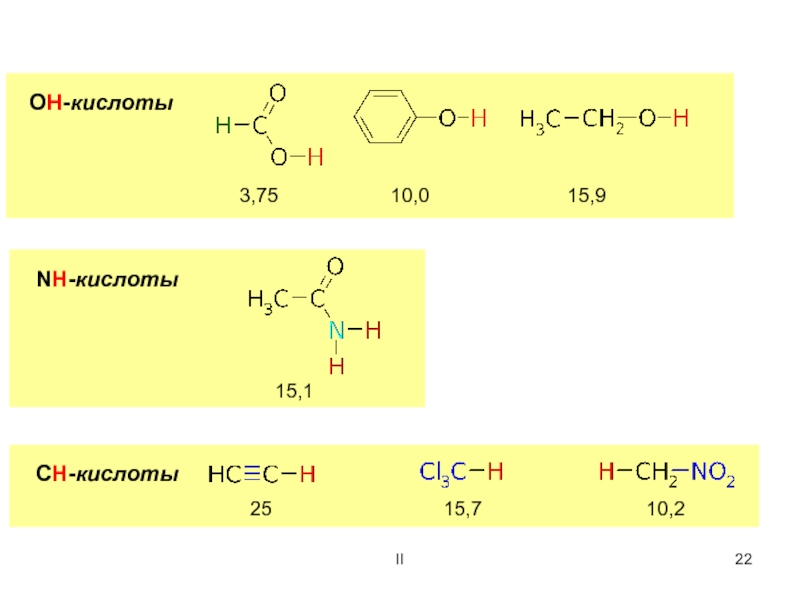
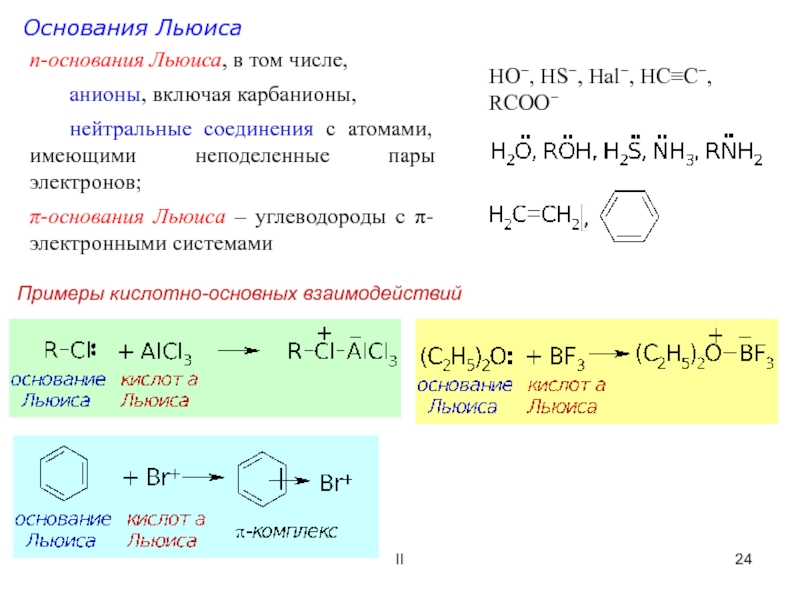
![ОСНОВНЫЕ ПОНЯТИЯ О
ХИМИЧЕСКОЙ РЕАКЦИИ IIГомогенные катализаторы [(C6H5)3P]3RhCl[(C6H5)3P]3Ru.HCl и др. Джефри Уилкинсон(1921-1996) – англ. химик1973, химия катализатор Уилкинсона IIГомогенные катализаторы [(C6H5)3P]3RhCl[(C6H5)3P]3Ru.HCl и др. Джефри Уилкинсон(1921-1996) – англ. химик1973, химия катализатор Уилкинсона](/img/thumbs/9082e6a5f0444fc88f0fc070e63c4207-800x.jpg)
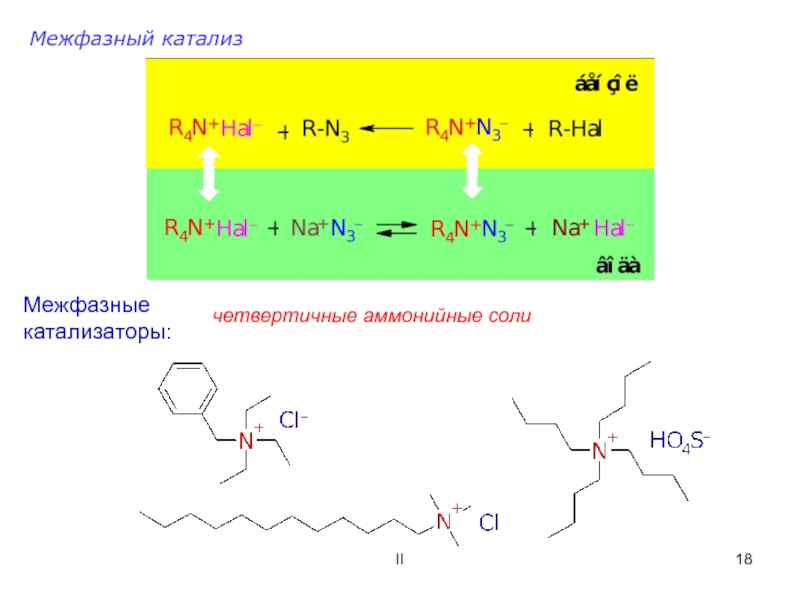
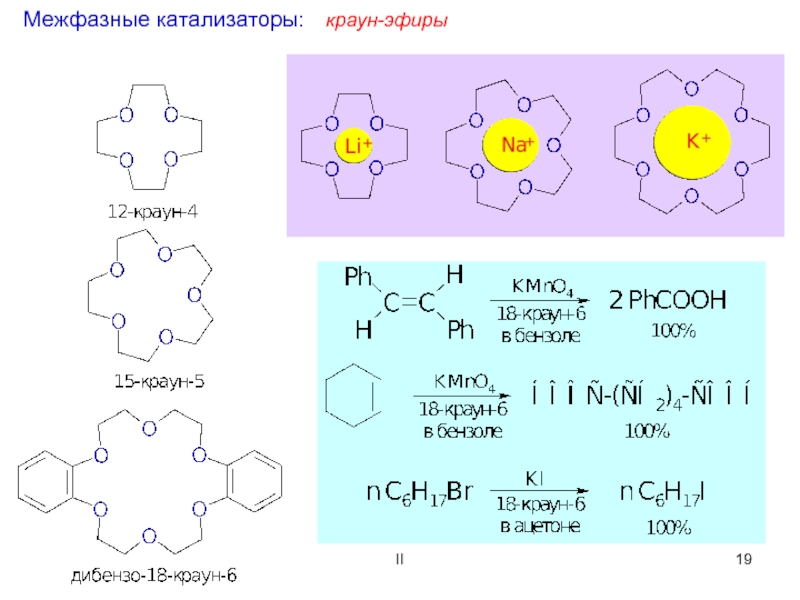

![ОСНОВНЫЕ ПОНЯТИЯ О
ХИМИЧЕСКОЙ РЕАКЦИИ IIA-H+:BA-B-H++кислотаоснованиесопряженнаякислотасопряженное основаниерастворы слабых электролитов A-H+Н2ОA-Н3О++Ка = Кр [Н2О] = рКа = IIA-H+:BA-B-H++кислотаоснованиесопряженнаякислотасопряженное основаниерастворы слабых электролитов A-H+Н2ОA-Н3О++Ка = Кр [Н2О] = рКа = -lg Ка рКb = 14 -](/img/thumbs/9dfaf8d327fb8bca3a0af5a54e4cb076-800x.jpg)