Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Структура и общие свойства ферментов
Содержание
- 1. Структура и общие свойства ферментов
- 2. Значение ферментовЛюбая реакция в организме катализируется ферментамиЛюбая
- 3. Доказательство белковой природы ферментовВсе выделенные ферменты являются
- 4. Структурная организация ферментаПростые ферменты - трипсин, химотрипсин
- 5. Структура ферментаПервичная структура (1о) - последовательность аминокислот
- 6. Активный центр ферментаАктивный центр - это несколько
- 7. Локализация ферментов в клеткеКомпартменты - места локализации
- 8. Изоферменты Изоферменты - множественные молекулярные формы данной особи,
- 9. Отличие ферментов от неорганических катализаторовВысокая молекулярная активность
- 10. Виды специфичностиАбсолютная специфичность - один фермент имеет
- 11. Стабильность. Ферменты действуют в мягких условиях (pH,
- 12. Энзимы в медицинеЭнзимопатология - изучает заболевания, связанные
- 13. Энзимодиагностика - определение активности фермента. Чтобы
- 14. Изоферменты ЛДГ органоспецифичны.ЛДГ1ЛДГ2ЛДГ3ЛДГ4ЛДГ5ЛДГ5 - характерен для ткани,
- 15. Креатинфосфокиназа (КФК)Изофермент BB - ткани мозга,
- 16. АСТ и АЛТАСТ - имеет двойную локализацию
- 17. Активность щелочной фосфатазы увеличивается при
- 18. Острый панкреатитУвеличена активность: - амилаза
- 19. Мультиферментные комплексы Мультиферментный комплекс -
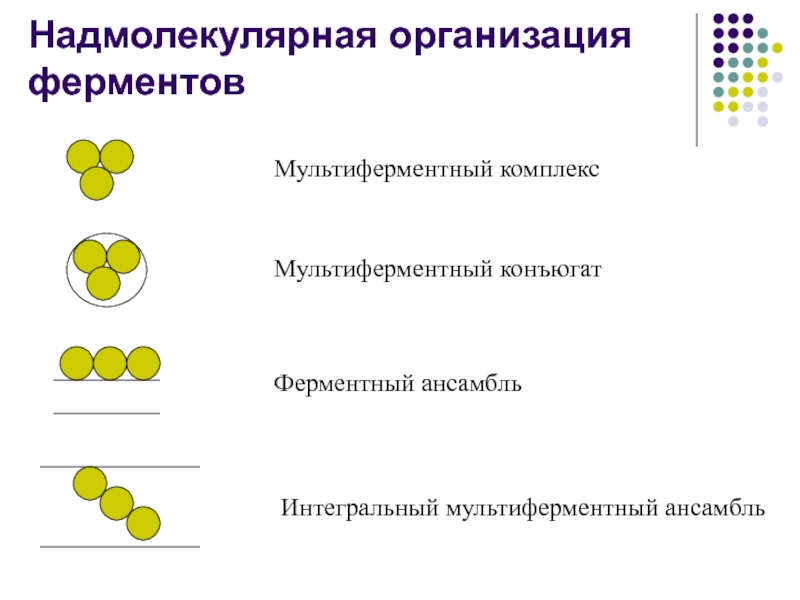
- 20. Надмолекулярная организация ферментовМультиферментный комплексМультиферментный конъюгатФерментный ансамбльИнтегральный мультиферментный ансамбль
- 21. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Значение ферментов
Любая реакция в организме катализируется ферментами
Любая живая клетка содержит
набор ферментов
патология ферментов)Слайд 3Доказательство белковой природы ферментов
Все выделенные ферменты являются белками
При гидролизе ферментов
образуются аминокислоты
Специфичность действия ферментов
Методы получения белков и ферментов одинаковы
Факторы вызывающие
денатурацию белка, вызывают инактивацию ферментовФермент – это биокатализаторы белковой природы
Слайд 4Структурная организация фермента
Простые ферменты - трипсин, химотрипсин и т.д.
Сложные ферменты
– содержат
белковую часть (апофермент)
небелковая часть (кофермент):
лактатдегидрогеназа (ЛДГ),
аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза
(АСТ)Ферменты:
Слайд 5Структура фермента
Первичная структура (1о) - последовательность аминокислот соединенных пептидной связью
Вторичная
структура (2о) - a-спираль
Третичная структура (3о) - глобула
Четвертичная структура
(4о) - олигомерыСлайд 6Активный центр фермента
Активный центр - это несколько аминокислотных остатков, которые
в ходе ферментативного катализа реагируют с субстратом.
В
активном центре различают:- контактный участок,
- каталитический участок.
Активный центр формируют 3-5 аминокислот.
Аминокислоты формирующие активный центр:
ГЛУ, АСП, ЛИЗ, АРГ, ГИС, СЕР, ТИР, ЦИС.
Слайд 7Локализация ферментов в клетке
Компартменты - места локализации ферментов в клетке.
Ядро - репликация/синтез ДНК, синтез и-РНК
(ДНК-зависимая РНК-полимераза,
РНК-зависимая ДНК-полимераза)Митохондрии - в них находится дыхательные центры, ферменты окислительного фосфорилирования, b-окисление жирных кислот, ферменты синтеза мочевины (ГлДГ - глутаматдегидрогеназа)
Лизосомы - ферменты гидролизы белков, липидов, нуклеиновых кислот и т.д. (кислая фосфатаза, кислая ДНК-нуклеаза, кислая РНКаза)
Цитоплазматическая мембрана - 5'-нуклеотидаза, Na+/K+-АТФаза
Цитоплазма - ферменты гликолиза, синтеза жирных кислот, синтеза мононуклеотидов
Слайд 8Изоферменты
Изоферменты - множественные молекулярные формы данной особи, катализирующие одну и
туже реакцию, но отличающиеся друг от друга по физическим и
химическим свойствам и разделяющиеся с помощью физико-химических методов.Методы разделения ферментов:
Электрофорез
Хроматографический метод
Гель-фильтрация
Слайд 9Отличие ферментов от неорганических катализаторов
Высокая молекулярная активность ферментов
Специфичность:
- абсолютная,
- относительная.Слайд 10Виды специфичности
Абсолютная специфичность - один фермент имеет один субстрат. Объясняет
теория Фишера («ключ-замок»).
Относительная специфичность - по отношению
к типу реакции (пример групповая специфичность). Объясняет теория Кошленда («рука-перчатка»)- групповая специфичность - пепсин, трипсин, химотрипсин.
Пепсин - гидролизирует пептидные связи, образованные аминогруппой ароматической аминокислоты и карбоксильной группой другой любой аминокислоты.
Химотрипсин - гидролизует пептидные связи, образованные карбоксильной группой ароматической и аминогруппой любой другой аминокислоты.
Трипсин - принимает участие карбоксильная группа лизина и аргинина.
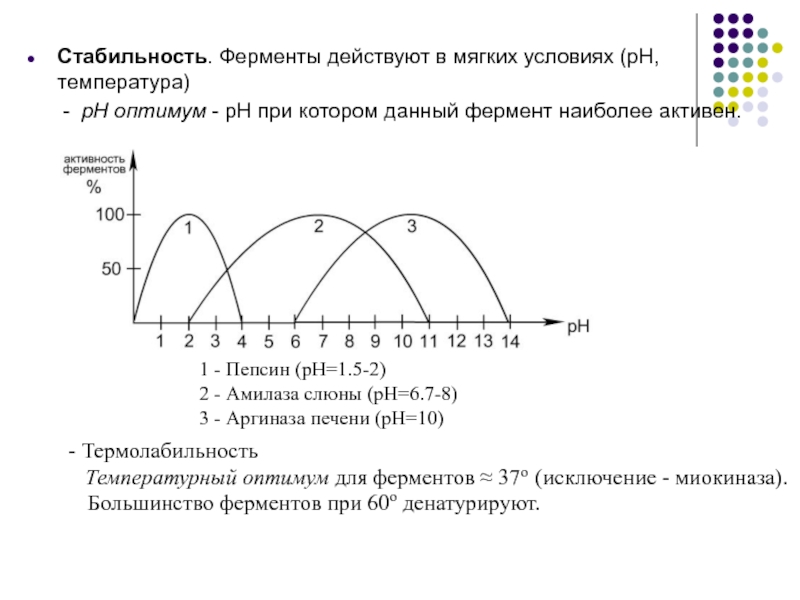
Слайд 11Стабильность. Ферменты действуют в мягких условиях (pH, температура)
- pH оптимум - pH при котором данный фермент наиболее
активен.- Термолабильность
Температурный оптимум для ферментов 37o (исключение - миокиназа).
Большинство ферментов при 60о денатурируют.
1 - Пепсин (pH=1.5-2)
2 - Амилаза слюны (pH=6.7-8)
3 - Аргиназа печени (pH=10)
Слайд 12Энзимы в медицине
Энзимопатология - изучает заболевания, связанные с нарушением действия
ферментов (энзимопатия).
Энзимопатии:
- наследственная (фенилпировиноградная олигофрения);
- алиментарная - недостаточное получение с пищей;- токсическая - передозировка лекарствами, действие вирусов;
- нарушение действия ферментов при определенных условиях.
Слайд 13 Энзимодиагностика - определение активности фермента.
Чтобы повысить эффективность диагностики
заболеваний надо изучать:
1. Активность нескольких
ферментов 2. Изоферментный спектр
3. Активность органоспецифических ферментов
Органоспецифические ферменты печени:
- аргиназа
- гистидаза
- урокониназа
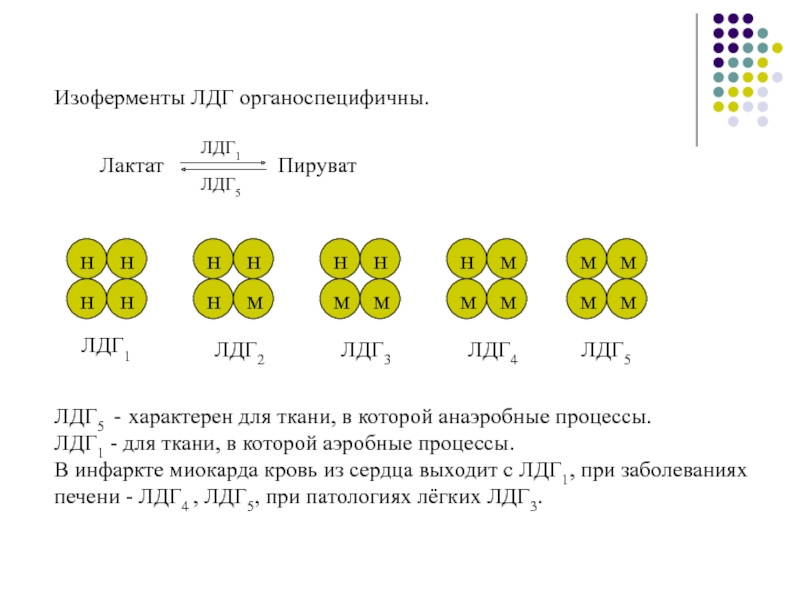
Слайд 14Изоферменты ЛДГ органоспецифичны.
ЛДГ1
ЛДГ2
ЛДГ3
ЛДГ4
ЛДГ5
ЛДГ5 - характерен для ткани, в которой анаэробные
процессы.
ЛДГ1 - для ткани, в которой аэробные процессы.
В инфаркте миокарда
кровь из сердца выходит с ЛДГ1, при заболеваниях печени - ЛДГ4 , ЛДГ5, при патологиях лёгких ЛДГ3.
Слайд 15Креатинфосфокиназа (КФК)
Изофермент BB - ткани мозга,
MM - скелетные мышцы,
MB - миокард.При инфаркте миокарда повышена активность MB-КФК.
Инфаркт миокарда - острое клиническое состояние, обусловленное
некрозом миокарда в результате нарушения кровоснабжения.
Для диагностики инфаркта миокарда используют:
ЛДГ1; MB-КФК; АСТ; миоглобин; тропонин.
Слайд 16АСТ и АЛТ
АСТ - имеет двойную локализацию (митохондрии и цитоплазма)
АЛТ
- локализуется только в цитоплазме. Активность АЛТ
увеличивается при заболеваниях
печени. Активность АСТ увеличивается при инфаркте миокарда
Коэффициент де Ритиса:
АСТ
АЛТ
= 1,33 + 0,42
При патологиях печени коэффициент де Ритиса < 1.
Слайд 17 Активность щелочной фосфатазы увеличивается при рахите,
механической желтухе
и патологии костной ткани.
Активность кислой фосфатазы увеличивается при
раке простаты.Активность амилазы увеличивается при патологии слюнных желез и
остром панкреатите.
Слайд 18Острый панкреатит
Увеличена активность:
- амилаза крови и
мочи,
- липаза,
-
фосфолипаза, - трипсин,
- химотрипсин.
Гепатит
Увеличена активность:
- АЛТ,
- АСТ,
- ЛДГ4,5,
- сорбитолдегидрогеназа.
Коэффициент де Ритиса <1
Слайд 19Мультиферментные комплексы
Мультиферментный комплекс - это комплекс, в
котором
принимают участие несколько ферментов, при этом продукт
предшествующей реакции
является субстратом следующей реакции.
Пример:
- дыхательная цепь;
- гликолиз;
- пируватдегидрогеназы;
- синтетаза жирных кислот.