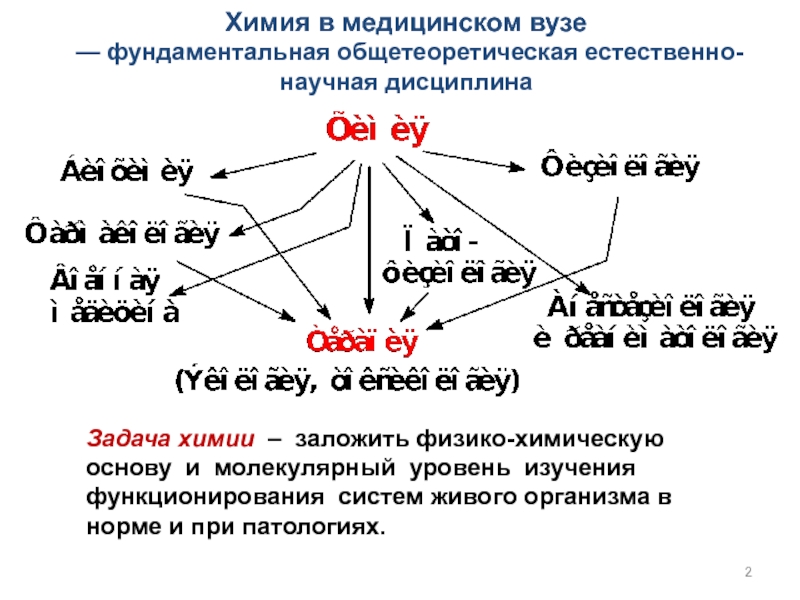
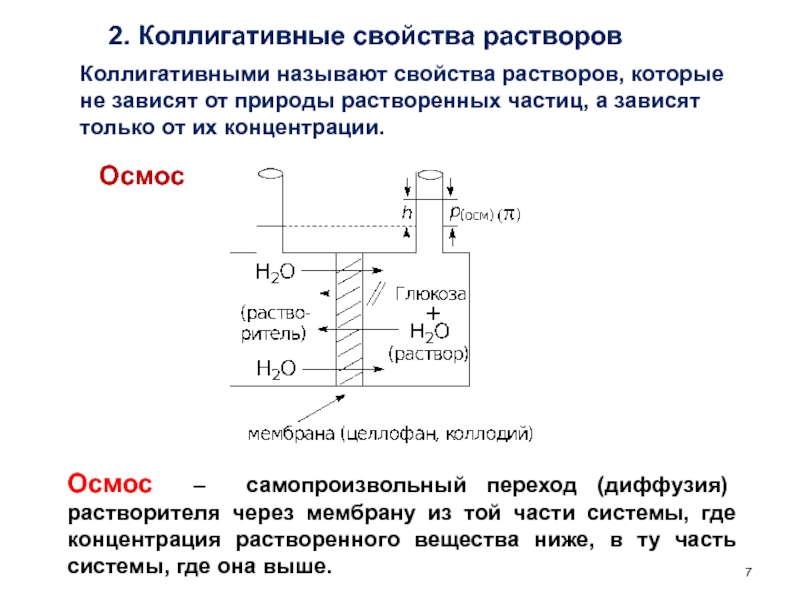
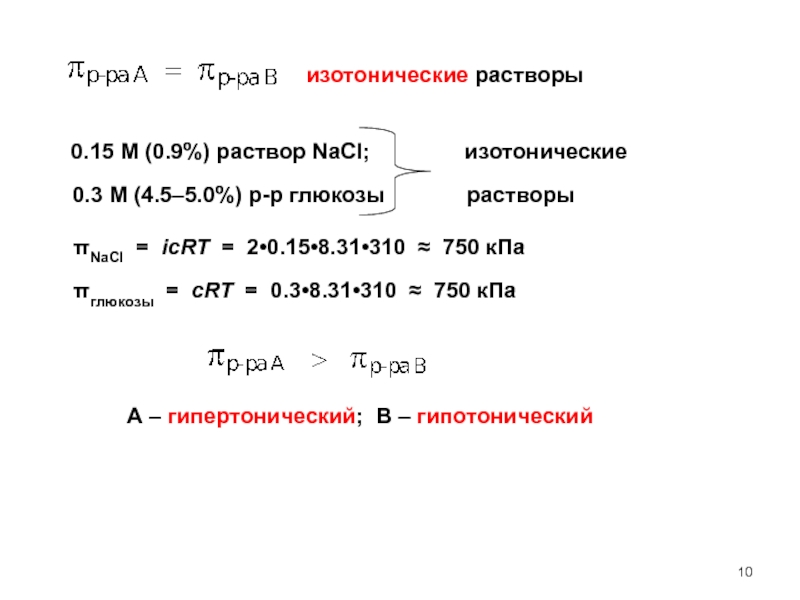
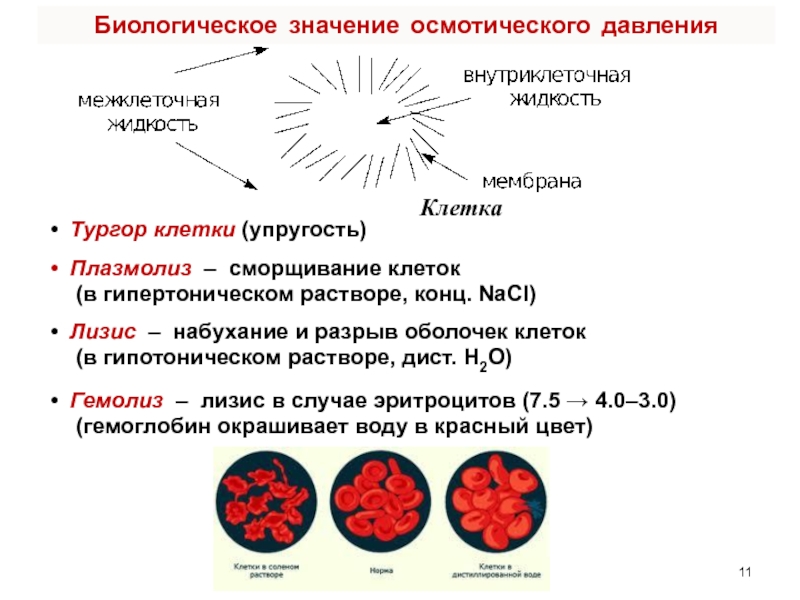
счет энергии другой (экзэргонической) реакции (ΔG < 0)
Макроэргические соединения —
вещества, ΔG0’гидролиза которых превышает ≈ -30 кДж/Моль. АТФ, креатинфорсфат, фосфоенолпируват и др. (ΔG0’ — изменение в стандартных биологических условиях)
Пример:
глюкоза + фосфат → глюкозо‑6‑фосфат + Н2О;ΔреакцииG'0 = +13,8 кДж
Реакция эндэргоническая, самопроизвольное протекание в стандартных условиях невозможно.
АТФ + H2O → АДФ + фосфат; ΔреакцииG'0 = –30,5 кДж.
Реакция экзэргоническая, самопроизвольное протекание возможно
Суммарная реакция:
глюкоза + АТФ → глюкозо‑6‑фосфат + АДФ
ΔреакцииG'0 = +13,8 + (–30,5) = - 16,7 кДж
Реакция экзэргоническая, самопроизвольное протекание возможно